Уран – химический элемент семейства актиноидов с атомным номером 92. Является важнейшим ядерным топливом. Его концентрация в земной коре составляет около 2 частей на миллион. К важным урановым минералам относятся окись урана (U3O8), уранинит (UO2), карнотит (уранил-ванадат калия), отенит (уранил-фосфат калия) и торбернит (водный фосфат меди и уранила). Эти и другие урановые руды являются источниками ядерного топлива и содержат во много раз больше энергии, чем все известные извлекаемые месторождения ископаемого топлива. 1 кг урана 92U дает столько же энергии, сколько 3 млн кг угля.
История открытия
Химический элемент уран – плотный, твердый металл серебристо-белого цвета. Он пластичный, ковкий и поддается полировке. В воздухе метал окисляется и в измельченном состоянии загорается. Относительно плохо проводит электричество. Электронная формула урана – 7s2 6d1 5f3.
Хотя элемент был обнаружен в 1789 г. немецким химиком Мартином Генрихом Клапротом, который назвал его в честь недавно открытой планеты Уран, сам металл был изолирован в 1841 г. французским химиком Эженом-Мельхиором Пелиго путем восстановления из тетрахлорида урана (UCl4) калием.
Радиоактивность
Создание периодической системы российским химиком Дмитрием Менделеевым в 1869 году сосредоточило внимание на уране как на самом тяжелом из известных элементов, которым он оставался до открытия нептуния в 1940 г. В 1896-м французский физик Анри Беккерель обнаружил в нем явление радиоактивности. Это свойство позже было найдено во многих других веществах. Теперь известно, что радиоактивный во всех его изотопах уран состоит из смеси 238U (99,27 %, период полураспада — 4 510 000 000 лет), 235U (0,72 %, период полураспада — 713 000 000 лет) и 234U (0,006 %, период полураспада — 247 000 лет). Это позволяет, например, определять возраст горных пород и минералов для изучения геологических процессов и возраста Земли. Для этого в них измеряется количество свинца, который является конечным продуктом радиоактивного распада урана. При этом 238U является исходным элементом, а 234U – один из продуктов. 235U порождает ряд распада актиния.
Открытие цепной реакции
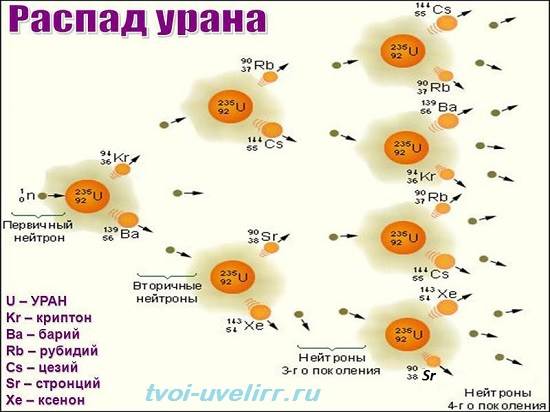
Химический элемент уран стал предметом широкого интереса и интенсивного изучения после того, как немецкие химики Отто Хан и Фриц Штрассман в конце 1938 г. при его бомбардировке медленными нейтронами обнаружили в нем ядерное деление. В начале 1939 г. американский физик итальянского происхождения Энрико Ферми предположил, что среди продуктов расщепления атома могут быть элементарные частицы, способные породить цепную реакцию. В 1939 г. американские физики Лео Сциллард и Герберт Андерсон, а также французский химик Фредерик Жолио-Кюри и их коллеги подтвердили это предсказание. Последующие исследования показали, что в среднем при делении атома высвобождается 2,5 нейтрона. Эти открытия привели к первой самоподдерживающейся цепной ядерной реакции (02.12.1942), первой атомной бомбе (16.07.1945), первому ее использованию в ходе военных действий (06.08.1945), первой атомной подводной лодке (1955) и первой полномасштабной атомной электростанции (1957).
Состояния окисления
Химический элемент уран, являясь сильным электроположительным металлом, реагирует с водой. Он растворяется в кислотах, но не в щелочах. Важными состояниями окисления являются +4 (как в оксиде UO2, тетрагалогенидах, таких как UCl4, и зеленом водном ионе U4+) и +6 (как в оксиде UO3, гексафториде UF6 и ионе уранила UO22+). В водном растворе уран наиболее устойчив в составе иона уранила, обладающего линейной структурой [О = U = О]2+. Элемент также имеет состояния +3 и +5, но они неустойчивы. Красный U3+ медленно окисляется в воде, которая не содержит кислорода. Цвет иона UO2+ неизвестен, поскольку он претерпевает диспропорционирование (UO2+ одновременно сводится к U4+ и окисляется до UO22+) даже в очень разбавленных растворах.
Ядерное топливо
При воздействии медленных нейтронов деление атома урана происходит в относительно редком изотопе 235U. Это единственный природный расщепляющийся материал, и он должен быть отделен от изотопа 238U. Вместе с тем после поглощения и отрицательного бета-распада уран-238 превращается в синтетический элемент плутоний, который расщепляется под действием медленных нейтронов. Поэтому природный уран можно использовать в реакторах-преобразователях и размножителях, в которых деление поддерживается редким 235U и одновременно с трансмутацией 238U производится плутоний. Из широко распространенного в природе изотопа тория-232 может быть синтезирован делящийся 233U для использования в качестве ядерного топлива. Уран также важен как первичный материал, из которого получают синтетические трансурановые элементы.
Другие применения урана
Соединения химического элемента ранее использовались в качестве красителей для керамики. Гексафторид (UF6) представляет собой твердое вещество с необычно высоким давлением паров (0,15 атм = 15 300 Па) при 25 °C. UF6 химически очень реактивный, но, несмотря на его коррозионную природу в парообразном состоянии, UF6 широко используется в газодиффузионных и газоцентрифужных методах получения обогащенного урана.
Металлоорганические соединения представляют собой интересную и важную группу соединений, в которых связи металл-углерод соединяют металл с органическими группами. Ураноцен является органоураническим соединением U(С8Н8)2, в котором атом урана зажат между двумя слоями органических колец, связанными с циклооктатетраеном C8H8. Его открытие в 1968 г. открыло новую область металлоорганической химии.
Обедненный природный уран применяется в качестве средства радиационной защиты, балласта, в бронебойных снарядах и танковой броне.
Переработка
Химический элемент, хотя и очень плотный (19,1 г/см3), является относительно слабым, невоспламеняющимся веществом. Действительно, металлические свойства урана, по-видимому, позиционируют его где-то между серебром и другими истинными металлами и неметаллами, поэтому его не используют в качестве конструкционного материала. Основная ценность урана заключается в радиоактивных свойствах его изотопов и их способности делиться. В природе почти весь (99,27 %) металл состоит из 238U. Остальную часть составляют 235U (0,72 %) и 234U (0,006 %). Из этих естественных изотопов только 235U непосредственно расщепляется нейтронным облучением. Однако при его поглощении 238U образует 239U, который в конечном итоге распадается на 239Pu – делящийся материал, имеющий большое значение для атомной энергетики и ядерного оружия. Другой делящийся изотоп, 233U, может образоваться нейтронным облучением 232Th.
Кристаллические формы
Характеристики урана обусловливают его реакцию с кислородом и азотом даже в нормальных условиях. При более высоких температурах он вступает в реакцию с широким спектром легирующих металлов, образуя интерметаллические соединения. Образование твердых растворов с другими металлами происходит редко из-за особых кристаллических структур, образованных атомами элемента. Между комнатной температурой и температурой плавления 1132 °C металлический уран существует в 3 кристаллических формах, известных как альфа (α), бета (β) и гамма (γ). Трансформация из α- в β-состояние происходит при 668 °C и от β до γ – при 775 °C. γ-уран имеет объемноцентрированную кубическую кристаллическую структуру, а β – тетрагональную. α-фаза состоит из слоев атомов в высокосимметричной орторомбической структуре. Эта анизотропная искаженная структура препятствует атомам легирующих металлов заменять атомы урана или занимать пространство между ними в кристаллической решетке. Обнаружено, что твердые растворы образуют только молибден и ниобий.
Руды
Земная кора содержит около 2 частей урана на миллион, что говорит о его широком распространении в природе. По оценкам, океаны содержат 4,5 × 109 т этого химического элемента. Уран является важной составляющей более чем 150 различных минералов и второстепенным компонентом еще 50. Первичные минералы, обнаруженные в магматических гидротермальных жилах и в пегматитах, включают уранинит и его разновидность настуран. В этих рудах элемент встречается в форме диоксида, который вследствие окисления может варьироваться от UO2 до UO2,67. Другой экономически значимой продукцией урановых рудников являются аутунит (гидратированный уранилфосфат кальция), тобернит (гидратированный уранилфосфат меди), коффинит (черный гидратированный силикат урана) и карнотит (гидратированный уранил-ванадат калия).
По оценкам, более 90 % известных недорогих запасов урана приходится на Австралию, Казахстан, Канаду, Россию, Южную Африку, Нигер, Намибию, Бразилию, КНР, Монголию и Узбекистан. Большие месторождения находятся в конгломератных скальных образованиях озера Эллиот, расположенного к северу от озера Гурон в Онтарио, Канада, и в южноафриканском золотом прииске Витватерсранде. Песчаные образования на плато Колорадо и в Вайомингском бассейне западной части США также содержатся значительные запасы урана.
Добыча
Урановые руды встречаются как в приповерхностных, так и глубоких (300–1200 м) отложениях. Под землей мощность пласта достигает 30 м. Как и в случае с рудами других металлов, добыча урана на поверхности производится крупным землеройным оборудованием, а разработка глубоких отложений – традиционными методами вертикальных и наклонных шахт. Мировое производство уранового концентрата в 2013 г. составило 70 тыс. т. Наиболее продуктивные урановые рудники расположены в Казахстане (32 % всей добычи), Канаде, Австралии, Нигере, Намибии, Узбекистане и России.
Урановые руды обычно включают лишь небольшое количество ураносодержащих минералов, и они не поддаются плавке прямыми пирометаллургическими методами. Вместо этого для извлечения и очистки урана должны использоваться гидрометаллургические процедуры. Повышение концентрации значительно снижает нагрузку на контуры обработки, но ни один из обычных способов обогащения, обычно используемых для переработки полезных ископаемых, например гравитационный, флотация, электростатический и даже ручная сортировка, неприменимы. За немногими исключениями эти методы приводят к значительной потере урана.
Обжиг
Гидрометаллургической обработке урановых руд часто предшествует высокотемпературная стадия кальцинирования. Обжиг обезвоживает глину, удаляет углеродистые материалы, окисляет соединения серы до безобидных сульфатов и окисляет любые другие восстановители, которые могут мешать последующей обработке.
Выщелачивание
Из обожженных руд уран извлекается как кислотными, так и щелочными водными растворами. Для успешного функционирования всех систем выщелачивания химический элемент должен либо первоначально присутствовать в более стабильной 6-валентной форме, либо окисляться до этого состояния в процессе обработки.
Кислотное выщелачивание обычно проводят путем перемешивания смеси руды и выщелачивателя в течение 4-48 ч при температуре окружающей среды. За исключением особых обстоятельств используется серная кислота. Ее подают в количествах, достаточных для получения конечного щелока при рН 1,5. Схемы выщелачивания серной кислоты обычно используют либо диоксид марганца, либо хлорат для окисления четырехвалентного U4+ до 6-валентного уранила (UO22+). Как правило, для окисления U4+ достаточно примерно 5 кг двуокиси марганца или 1,5 кг хлората натрия на тонну. В любом случае окисленный уран реагирует с серной кислотой с образованием уранилсульфатного комплексного аниона [UO2(SO4)3]4-.
Руда, содержащая значительное количество основных минералов, таких как кальцит или доломит, выщелачивается 0,5-1-молярным раствором карбоната натрия. Хотя были изучены и протестированы различные реагенты, основным окислителем урана является кислород. Обычно руда выщелачиваются на воздухе при атмосферном давлении и при температуре 75-80 °C в течение периода времени, который зависит от конкретного химического состава. Щелочь реагирует с ураном с образованием легкорастворимого комплексного иона [UO2(СО3)3]4-.
Перед дальнейшей обработкой растворы, образующиеся в результате кислотного или карбонатного выщелачивания, должны быть осветлены. Крупномасштабное разделение глин и других рудных шламов осуществляется за счет использования эффективных хлопьеобразующих агентов, в том числе полиакриламидов, гуаровой смолы и животного клея.
Экстракция
Сложные ионы [UO2(СО3)3]4- и [UO2(SO4)3]4- могут быть сорбированы из их соответствующих выщелачивающих растворов ионообменных смол. Эти специальные смолы, характеризующиеся кинетикой их сорбции и элюирования, размером частиц, стабильностью и гидравлическими свойствами, могут использоваться в различных технологиях обработки, например в неподвижном и подвижном слое, методом ионообменной смолы в пульпе корзинного и непрерывного типа. Обычно для элюирования сорбированного урана используют растворы хлорида натрия и аммиака или нитратов.
Уран можно выделить из кислых рудных щелоков путем экстракции растворителем. В промышленности используются алкилфосфорные кислоты, а также вторичные и третичные алкиламины. Как правило, экстракция растворителем предпочтительна по сравнению с ионообменными методами для кислотных фильтратов, содержащих более 1 г/л урана. Однако этот метод не применяется при карбонатном выщелачивании.
Затем уран очищают, растворяя в азотной кислоте с образованием уранилнитрата, экстрагируют, кристаллизуют и прокаливают с образованием трехокиси UO3. Восстановленный диоксид UO2 реагирует с фтористым водородом с образованием тетафторида UF4, из которого металлический уран восстанавливается магнием или кальцием при температуре 1300 °C.
Тетрафторид можно фторировать при температуре 350 °C до образования гексафторида UF6, используемого для отделения обогащенного урана-235 методом газовой диффузии, газового центрифугирования или жидкой термодиффузии.
Открытие планетарного масштаба. Так можно назвать обнаружение учеными Урана. Планета открыта в 1781-ом году.
Ее обнаружение стало поводом для наречения одного из элементов таблицы Менделеева. Уран металлический выделили из смоляной обманки в 1789-ом.
Шумиха вокруг новой планеты еще не улеглась, поэтому, идея о названии нового вещества лежала на поверхности.
В конце 18-го века еще не было понятия радиоактивности. Между тем, это основное свойство земного урана.
Ученые, работавшие с ним, облучались, сами того не зная. Кто был первопроходцем, и каковы другие свойства элемента, расскажем далее.
Свойства урана
Уран – элемент, открытый Мартином Клапротом. Он сплавил смоляную обманку с едким калием. Продукт сплавления был неполностью растворим.
Клапрот понял, что предполагаемых цинка, молибдена и вольфрама в составе минерала нет. Тогда, ученый растворил обманку в царской водке.
Из раствора выпали шестигранные кристаллы зеленого цвета. На них химик воздействовал желтой кровяной солью, то есть, гексацианоферратом калия.
Из раствора выпал бурый осадок. Этот окисел Клапрот восстановил льняным маслом, прокалил. Получился черный порошок.
Пришлось прокаливать уже его, смешав с бурым углем. В спекшейся массе обнаружились зерна нового металла.
Позже выяснилось, что это был не чистый уран, а его диоксид. Отдельно элемент получили лишь через 60 лет, в 1841-ом году. А еще через 55 Антуан Беккерель открыл явление радиоактивности.
Радиоактивность урана обусловлена способностью ядра элемента захватывать нейтроны и дробиться. При этом, выделяется внушительная энергия.
Она обусловлена кинетическими данными излучения и осколков. Есть возможность обеспечить непрерывное деление ядер.
Цепная реакция запускается при обогащении природного урана его 235-ым изотопом. Его не то, чтобы добавляют в металл.
Наоборот, из руды убирают малорадиоактивный и неэффективный 238-ой нуклид, а так же, 234-ый.
Их смесь именуют обедненной, а оставшийся уран называют обогащенным. Именно такой нужен промышленникам. Но, об этом поговорим в отдельной главе.
Уран излучает, как альфа-, так и бета- с гамма-лучами. Их обнаружили, увидев влияние соли металла на фотографическую пластину, обернутую черной бумагой.
Стало понятно, что новый элемент что-то излучает. Пока супруги Кюри исследовали, что именно, Мария получила дозу радиации, ставшей причиной развития у химика рака крови, от которого женщина умерла в 1934-ом году.
Бета-излучение способно разрушить не только человеческий организм, но и сам металл. Какой элемент образуется из урана? Ответ: — бревий.
Иначе его называют протактинием. Обнаружен в 1913-ом, как раз при изучении урана.
Последний превращается в бревий без сторонних воздействий и реактивов, лишь от бета-распада.
Внешне уран – химический элемент серебристо—белого цвета с металлическим блеском.
Так выглядят все актиноиды, к коим и относится 92-ое вещество. Начинается группа с 90-го номера, а заканчивается 103-им.
Стоя в начале списка, радиоактивный элемент уран, проявляет себя, как окислитель. Степени окисления могут быть 2-ой, 3-ей, 4-ой, 5-ой, 6-ой.
То есть, химически 92-ой металл активен. Если истереть уран в порошок, он самовоспламениться на воздухе.
В обычном виде вещество окислится при контакте с кислородом, покрывшись радужной пленкой.
Если довести температуру до 1000 градусов Цельсия, хим. элемент уран соединиться с азотом. Образуется нитрид металла. Это вещество желтого цвета.
Брось его в воду, — раствориться, как и чистый уран. Разъедают его и все кислоты. Из органических элемент вытесняет водород.
Выталкивает его уран, так же, из соляных растворов серебра, меди, олова, ртути, золота. Если такой раствор встряхнуть, частицы 92-го металла начнут светиться.
Урановые соли нестабильны, распадаются на свету, или в присутствии органики.
Индифферентен элемент, пожалуй, лишь к щелочам. С ними в реакцию металл не вступает.
Открытие урана – это обнаружение сверхтяжелого элемента. Его масса позволяет выделить металл, точнее, минералы с ним, из руды.
Достаточно раздробить ее и засыпать в воду. Урановые частицы осядут первыми. С этого начинается добыча металла. Подробности, в следующей главе.
Добыча урана
Получив тяжелый осадок, промышленники выщелачивают концентрат. Цель – перевести уран в раствор. Используют серную кислоту.
Исключение делают для смолки. Этот минерал в кислоте не растворим, поэтому, используют щелочи. Секрет трудностей в 4-валентном состоянии урана.
Не проходит кислотное выщелачивание и с доломитом, магнезитом. В этих минералах 92-ой металл тоже 4-валентный.
На такой воздействуют гидроксидом натрия, известным, как едкий натр. В остальных случаях хороша кислородная продувка. Не надо отдельно запасаться серной кислотой.
Достаточно нагреть руду с сульфидными минералами до 150-ти градусов и направить на нее кислородную струю. Это ведет к образованию в камнях кислоты, вымывающей уран.
Химический элемент и его применение связаны с чистыми формами металла. Дабы убрать примеси, используют сорбцию.
Ее проводят на ионообменных смолах. Подходит, так же, экстракция органическими растворителями.
Остается добавить в раствор щелочь, чтобы осадить уранаты аммония, растворить их в азотной кислоте и подвергнуть аффинажу.
Итогом станут оксиды 92-го элемента. Их нагревают до 800-от градусов и восстанавливают водородом.
Итоговый оксид переводят во фторид урана, из которого кальциетермическим восстановлением и получают чистый металл. Цепочка, как видно, не из простых. Зачем же так стараться?
Применение урана
92-ой металл – основное топливо ядерных реакторов. Обедненная смесь подходит для стационарных, а для силовых установок используют обогащенный элемент.
235-ый изотоп, так же, — основа ядерного оружия. Из 92-го металла можно получить и вторичное ядерное топливо.
Здесь стоит задаться вопросом, в какой элемент превращается уран. Из его 238-го изотопа получают плутоний, — еще одно радиоактивное, сверхтяжелое вещество.
У самого 238-го урана велик период полураспада, он длится 4,5 миллиардов лет. Столь длительное разрушение приводит к малой энергоемкости.
Если рассматривать применение соединений урана, пригождаются его оксиды. Их используют в стекольной промышленности.
Оксиды выступают красителями. Можно получить стекла от бледно-желтых до темно-зеленых. В ультрафиолетовых лучах материал флуоресцирует.
Это свойство используют не только в стеклах, но и урановых глазурях для фарфора. Оксидов урана в них от 0,3 до 6%.
В итоге, фон изделий безопасен, не превышает 30-ти микрон в час. Фото элементов урана, точнее, изделий с его участием, весьма красочны. Свечение стекол и посуды притягивает взоры.
Цена урана
За килограмм необогащенной окиси урана дают около 150-ти долларов. Пиковые значения наблюдались в 2007-ом.
Тогда стоимость достигала 300-от долларов за кило. Разработки урановых руд останутся рентабельными и при цене в 90-100 условных единиц.
Кто открыл элемент уран, не знал, каковы его запасы в земной коре. Теперь, они подсчитаны.
Крупные месторождения с рентабельной ценой добычи истощатся к 2030-му году.
Если не откроют новых залежей, или не найдут альтернативы металлу, его стоимость поползет вверх.
Ура́н (лат. Uranium), U (читается «уран»), радиоактивный химический элемент с атомным номером 92, атомная масса 238, 0289. Актиноид. Природный уран состоит из смеси трех изотопов: 238U, 99, 2739%, с периодом полураспада Т1/2 = 4, 51·109 лет, 235U, 0, 7024%, с периодом полураспада Т1/2 = 7, 13·108 лет, 234U, 0, 0057%, с периодом полураспада Т1/2 = 2, 45·105 лет. 238U (уран-I, UI) и 235U (актиноуран, АсU) являются родоначальниками радиоактивных рядов. Из 11 искусственно полученных радионуклидов с массовыми числами 227-240 долгоживущий 233U (Т1/2 = 1, 62·105лет), он получается при нейтронном облучении тория.
Конфигурация трех внешних электронных слоев 5s2p6d 10f3 6s2p 6d17 s2, уран относится к f-элементам. Расположен в IIIB группе в 7 периоде периодической системы элементов. В соединениях проявляет степени окисления +2, +3, +4, +5 и +6, валентности II, III, IV, V и VI.
Радиус нейтрального атома урана 0, 156 нм, радиус ионов: U3+ — 0, 1024 нм, U4+ — 0, 089 нм, U5+ — 0, 088 нм и U6+— 0, 083 нм. Энергии последовательной ионизации атома 6, 19, 11, 6, 19, 8, 36, 7 эВ. Электроотрицательность по Полингу 1, 22.
Уран был открыт в 1789 году немецким химиком М. Г. Клапротом при исследовании минерала «смоляной обманки». Назван им в честь планеты Уран, открытой У. Гершелем в 1781 году. В металлическом состоянии уран получен в 1841 году французским химиком Э. Пелиго при восстановлении UCl4металлическим калием. Радиоактивные свойства урана обнаружил в 1896 году француз А. Беккерель.
Первоначально урану приписывали атомную массу 116, но в 1871 году Д. И. Менделеев пришел к выводу, что ее надо удвоить. После открытия элементов с атомными номерами от 90 до 103 американский химик Г. Сиборг пришел к выводу, что эти элементы (актиноиды) правильнее располагать в периодической системе в одной клетке с элементом №89 актинием. Такое расположение связано с тем, что у актиноидов происходит достройка 5f-электоронного подуровня.
Уран — характерный элемент для гранитного слоя и осадочной оболочки земной коры. Содержание в земной коре 2, 5·10-4% по массе. В морской воде концентрация урана менее 10-9 г/л, всего в морской воде содержится от 109 до 1010 тонн урана. В свободном виде уран в земной коре не встречается. Известно около 100 минералов урана, важнейшие из них настуран U3O8, уранинит (U, Th)O2, урановая смоляная руда (содержит оксиды урана переменного состава) и тюямунит Ca[(UO2)2(VO4)2]·8H2O.
Уран получают из урановых руд, содержащих 0, 05-0, 5% U. Извлечение урана начинается с получения концентрата. Руды выщелачивают растворами серной, азотной кислот или щелочью. В полученном растворе всегда содержатся примеси других металлов. При отделении от них урана, используют различия в их окислительно-восстановительных свойствах. Окислительно-восстановительные процессы сочетают с процессами ионного обмена и экстракции.
Из полученного раствора уран извлекают в виде оксида или тетрафторида UF4, методом металлотермии:
UF4+ 2Mg = 2MgF2+ U
Образовавшийся уран содержит в незначительных количествах примеси бор, кадмий и некоторых других элементов, так называемых реакторных ядов. Поглощая образующиеся при работе ядерного реактора нейтроны, они делают уран непригодным для использования в качестве ядерного горючего.
Чтобы избавиться от примесей, металлический уран растворяют в азотной кислоте, получая уранилнитрат UO2(NO3)2. Уранилнитрат экстрагируют из водного раствора трибутилфосфатом. Продукт очистки из экстракта снова переводят в оксид урана или в тетрафторид, из которых вновь получают металл.
Часть урана получают регенерацией отработавшего в реакторе ядерного горючего. Все операции по регенерации урана проводят дистанционно.
Уран — серебристо-белый блестящий металл. Металлический уран существует в трех аллотропических модификациях. До 669 °C устойчива α-модификация с орторомбической решеткой, параметры а = 0, 2854нм, в = 0, 5869 нм и с = 0, 4956 нм, плотность 19, 12 кг/дм3. От 669 °C до 776 °C устойчива β-модификация с тетрагональной решеткой (параметры а = 1, 0758 нм, с = 0, 5656 нм). До температуры плавления 1135 °C устойчива γ-модификация с кубической объемно-центрированной решеткой (а = 0, 3525 нм). Температура кипения 4200 °C.
Химическая активность металлического урана высока. На воздухе он покрывается пленкой оксида. Порошкообразный уран пирофорен, при сгорании урана и термическом разложении многих его соединений на воздухе образуется оксид урана U3O8. Если этот оксид нагревать в атмосфере водорода при температуре выше 500°C, образуется диоксид урана UO2:
U3O8 + Н2 = 3UO2 + 2Н2О
Если уранилнитрат UO2(NO3)2 нагреть при 500°C, то, разлагаясь, он образует триоксид урана UO3. Кроме оксидов урана стехиометрического состава UO2, UO3 и U3О8, известен оксид урана состава U4O9 и несколько метастабильных оксидов и оксидов переменного состава.
При сплавлении оксидов урана с оксидами других металлов образуются уранаты: К2UO4 (уранат калия), СаUO4 (уранат кальция), Na2U2O7 (диуранат натрия).
Взаимодействуя с галогенами, уран дает галогениды урана. Среди них гексафторид UF6 представляет собой желтое кристаллическое вещество, легко сублимирующееся даже при слабом нагревании (40-60°C) и столь же легко гидролизующееся водой. Важнейшее практическое значение имеет гексафторид урана UF6. Получают его взаимодействием металлического урана, оксидов урана или UF4 с фтором или фторирующими агентами BrF3, СCl3F (фреон-11) или ССl2F2 (фреон-12):
U3O8+ 6CCl2F2 = UF4 + 3COCl2 + CCl4 + Cl2
UF4+ F2= UF6
или
U3O8+ 9F2 =3UF6+ 4O2
Известны фториды и хлориды, отвечающие степеням окисления урана +3, +4, +5 и +6. Получены бромиды урана UBr3, UBr4 и UBr5, а также иодиды урана UI3 и UI4. Синтезированы такие оксигалогениды урана, как UO2Cl2 UOCl2 и другие.
При взаимодействии урана с водородом образуется гидрид урана UH3, обладающий высокой химической активностью. При нагревании гидрид разлагается, образуя водород и порошкообразный уран. При спекании урана с бором возникают, в зависимости от молярного отношения реагентов и условий проведения процесса, бориды UB2, UB4 и UB12.
С углеродом уран образует три карбида UC, U2C3 и UC2.
Взаимодействием урана с кремнием получены силициды U3Si, U3Si2, USi, U3Si5, USi2 и U3Si2.
Получены нитриды урана (UN, UN2, U2N3) и фосфиды урана (UP, U3P4, UP2). С серой уран образует ряд сульфидов: U3S5, US, US2, US3 и U2S3.
Металлический уран растворяется в HCl и HNO3, медленно реагирует с H2SO4 и H3PO4. Возникают соли, содержащие катион уранила UO22+.
В водных растворах существуют соединения урана в степенях окисления от +3 до +6. Стандартный окислительный потенциал пары U(IV)/U(III) — 0, 52 B, пары U(V)/U(IV) 0, 38 B, пары U(VI)/U(V) 0, 17 B, пары U(VI)/U(IV) 0, 27. Ион U3+ в растворе неустойчив, ион U4+ стабилен в отсутствие воздуха. Катион UO2+ нестабилен и в растворе диспропорционирует на U4+и UO22+. Ионы U3+ имеют характерную красную окраску, ионы U4+ — зеленую, ионы UO22+ — желтую.
В растворах наиболее устойчивы соединения урана в степени окисления +6. Все соединения урана в растворах склонны к гидролизу и комплексообразованию, наиболее сильно — катионы U4+ и UO22+.
Атомная электростанция. Анимация
Металлический уран и его соединения используются в основном в качестве ядерного горючего в ядерных реакторах. Малообогащенная смесь изотопов урана применяется в стационарных реакторах атомных электростанций.
Продукт высокой степени обогащения — в ядерных реакторах, работающих на быстрых нейтронах. 235U является источником ядерной энергии в ядерном оружии. 238U служит источником вторичного ядерного горючего — плутония.
В микроколичествах (10-5-10-8 %) обнаруживается в тканях растений, животных и человека. В наибольшей степени накапливается некоторыми грибами и водорослями. Соединения урана всасываются в желудочно-кишечном тракте (около 1%), в легких — 50%. Основные депо в организме: селезенка, почки, скелет, печень, легкие и бронхо-легочные лимфатические узлы. Содержание в органах и тканях человека и животных не превышает 10-7 гг.
Уран и его соединения высокотоксичны. Особенно опасны аэрозоли урана и его соединений. Для аэрозолей растворимых в воде соединений урана ПДК в воздухе 0, 015 мг/м3, для нерастворимых форм урана ПДК 0, 075 мг/м3. При попадании в организм уран действует на все органы, являясь общеклеточным ядом. Молекулярный механизм действия урана связан с его способностью подавлять активность ферментов. В первую очередь поражаются почки (появляются белок и сахар в моче, олигурия). При хронической интоксикации возможны нарушения кроветворения и нервной системы.
- Химия урана / Под ред. Б. Н. Ласкорина и Б. Ф. Мясоедова. М., 1989.
- Химия урана. М., 1981.
- Химия актиноидов. М., 1991-1999. Т. 1-3.
- Константинов А. К. Урановый потенциал Чукотки. — М.: ФГУП ВНИИ минер. сырья им. Н.М. Федоровского, 2005.
- Кулиш Е. А. Геохимия, минералогия, генезис и классификация месторождений урана. — Киев, 2006.
- Горно-химическая технология добычи урана. — Москва: ГЕОС, 2001.
Молярная масса Урана
Порядковый номер – 92.
Строение атома показано на рис. 1. Металл d-семейства.

Рис. 1. Схема строения атома урана.
В обычных условиях уран представляет вещество серебристого цвета с глянцевой поверхностью. Тяжелый. Ковкий, гибкий и мягкий. Присущи свойства парамагнетиков. Для урана характерно наличие трех модификаций: α-уран (ромбическая система), β-уран (тетрагональная система) и γ-уран (кубическая система), каждая из которых существует в определенном температурном диапазоне.
Молярная масса урана равна 238,0289г/моль. Данное значение показывает отношение массы вещества (m) е число моль данного вещества (n), обозначается M и может быть рассчитано по формуле:
M = m / n.
Иными словами, молярная масса вещества – это масса 1 моль данного вещества, выраженная в г/моль или ккмоль.
Уран не может существовать в виде газа, только в форме твердого вещества, поэтому для нахождения значения его молярной массы нельзя использовать величину молярного объема или производить расчеты по формуле Менделеева-Клапейрона.
Уран и его характеристики
Содержание урана в земной коре оценивается в 3×10-4% (масс.), что соответствует общему количеству 1,3×1014 т металла.
Природные соединения урана многообразны; важнейшими минералами являются уранит (диоксид урана UO2), настуран (фаза переменного состава UO2,0-2,5) и карнотит (уранил-ванадат калия K2(UO2)2×(VO4)2×3H2O).
Уран представляет собой метал серебристого цвета с глянцевой поверхностью (рис. 1). Тяжелый. Ковкий, гибкий и мягкий.
Химический элемент уран: свойства, характеристика, формула. Добыча и применение урана
Присущи свойства парамагнетиков. Для урана характерно наличие трех модификаций: α-уран (ромбическая система), β-уран (тетрагональная система) и γ-уран (кубическая система), каждая из которых существует в определенном температурном диапазоне.

Рис. 1. Уран. Внешний вид.
Атомная и молекулярная масса урана
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии уран существует в виде одноатомных молекул U, значения его атомной и молекулярной масс совпадают.
Они равны 238,0289.
Изотопы урана
Известно, что в стабильных изотопов уран не имеет, однако природный уран состоит из смеси тех изотопов 238U (99,27%), 235U и 234U, которые являются радиоактивными.
Имеются нестабильные изотопы урана с массовыми числами от 217-ти до 242-х.
Ионы урана
На внешнем энергетическом уровне атома урана имеется три электрона, которые являются валентными:
1s22s22p63s23p63d104s24p64d104f145s25р 65d105f36s26р 66d17s2.
В результате химического взаимодействия уран отдает свои валентные электроны, т.е.
является их донором, и превращается в положительно заряженный ион:
U0 -3e → U3+.
Молекула и атом урана
В свободном состоянии уран существует в виде одноатомных молекул U. Приведем некоторые свойства, характеризующие атом и молекулу урана:
| Энергия ионизации атома, эВ | 7,11 |
| Относительная электроотрицательность | 1,38 |
| Радиус атома, нм | 0,138 |
Уран
Историческая справка
Распространение в природе
Физические свойства
Химические свойства
Получение
Применение
Уран в организме
Уран (лат. Uranium), U, радиоактивный химический элемент III группы периодической системы Менделеева, относится к семейству актиноидов; атомный номер 92, атомная масса 238,029; металл.
Природный Уран состоит из смеси трех изотопов: 238U — 99,2739% с периодом полураспада T½ = 4,51·109 лет, 235U — 0,7024% (T½ = 7,13·108 лет) и 234U — 0,0057% (T½ = 2,48·105 лет).
Из 11 искусственных радиоактивных изотопов с массовыми числами от 227 до 240 долгоживущий — 233U (T½ = 1 ,62·105 лет); он получается при нейтронном облучении тория.
238U и 235U являются родоначальниками двух радиоактивных рядов.
Историческая справка.
Уран (элемент)
Уран открыт в 1789 немецким химиком М. Г. Клапротом и назван им в честь планеты Уран, открытой В. Гершелем в 1781. В металлическом состоянии Уран получен в 1841 французским химиком Э. Пелиго при восстановлении UCl4 металлическим калием. Первоначально Уран приписывали атомную массу 120, и только в 1871 году Д. И. Менделеев пришел к выводу, что эту величину надо удвоить.
Длительное время уран представлял интерес только для узкого круга химиков и находил ограниченное применение для производства красок и стекла.
С открытием явления радиоактивности Урана в 1896 году и радия в 1898 году началась промышленного переработка урановых руд с целью извлечения и использования радия в научных исследованиях и медицине. С 1942 года, после открытия в 1939 году явления деления ядер, Уран стал основным ядерным топливом.
Распространение Урана в природе. Уран — характерный элемент для гранитного слоя и осадочной оболочки земной коры. Среднее содержание Урана в земной коре (кларк) 2,5·10-4% по массе, в кислых изверженных породах 3,5·10-4%, в глинах и сланцах 3,2·10-4%, в основных породах 5 ·10-5%, в ультраосновных породах мантии 3·10-7%. Уран энергично мигрирует в холодных и горячих, нейтральных и щелочных водах в форме простых и комплексных ионов, особенно в форме карбонатных комплексов.
Важную роль в геохимии Урана играют окислительно-восстановительные реакции, поскольку соединения Урана, как правило, хорошо растворимы в водах с окислительной средой и плохо растворимы в водах с восстановительной средой (например, сероводородных).
Известно около 100 минералов Урана; промышленное значение имеют 12 из них. В ходе геологической истории содержание Урана в земной коре уменьшилось за счет радиоактивного распада; с этим процессом связано накопление в земной коре атомов Рb, He.
Радиоактивный распад Урана играет важную роль в энергетике земной коры, являясь существенным источником глубинного тепла.
Физические свойства Урана
Уран по цвету похож на сталь, легко поддается обработке. Имеет три аллотропических модификации — α, β и γ с температурами фазовых превращений: α → β 668,8 °С, β → γ 772,2 °С; α-форма имеет ромбическую решетку (а = 2,8538Å, b = 5.8662Å, с = 4.9557Å), β-форма — тетрагональную решетку (при 720 °С а = 10,759Å, b = 5,656Å), γ-форма — объемноцентрированную кубическую решетку (при 850 °С а = 3,538Å).
Плотность Урана в α-форме (25 °С) 19,05 г/см3; tпл 1132 °С; tкип 3818 °С; теплопроводность (100-200 °С), 28,05 вт/(м·К) [0,067 кал/(см·сек·°С)], (200-400 °С) 29,72 вт/(м·К) [0,071 кал/(см·сек·°С)]; удельная теплоемкость (25 °С) 27,67 кдж/(кг·К) [6,612 кал/(г·°С)]; удельное электросопротивление при комнатной температуре около 3·10-7 ом·см, при 600 °С 5,5·10-7ом·см; обладает сверхпроводимостью при 0,68 К; слабый парамагнетик, удельная магнитная восприимчивость при комнатной температуре 1,72·10-6.
Механические свойства Урана зависят от его чистоты, от режимов механической и термической обработки. Среднее значение модуля упругости для литого Уран 20,5·10-2 Мн/м2 [20,9·10-3кгс/мм2]; предел прочности при растяжении при комнатной температуре 372-470 Мн/м2 [38-48 кгс/мм2]; прочность повышается после закалки из β- и γ-фаз; средняя твердость по Бринеллю 19,6-21,6·102 Мн/м2 [200-220 кгс/мм2].
Облучение потоком нейтронов (которое имеет место в ядерном реакторе) изменяет физико-механические свойства Урана: развивается ползучесть и повышается хрупкость, наблюдается деформация изделий, что заставляет использовать Уран в ядерных реакторах в виде различных урановых сплавов.
Уран — радиоактивный элемент. Ядра 235U и 233U делятся спонтанно, а также при захвате как медленных (тепловых), так и быстрых нейтронов с эффективным сечением деления 508·10-24 см2 (508 барн) и 533·10-24 см2 (533 барн) соответственно.
Ядра 238U делятся при захвате только быстрых нейтронов с энергией не менее 1 Мэв; при захвате медленных нейтронов 238U превращается в 239Рu, ядерные свойства которого близки к 235U. Критическая масса Урана (93,5% 235U) в водных растворах составляет менее 1 кг, для открытого шара — около 50 кг, для шара с отражателем — 15-23 кг; критическая масса 233U- примерно 1/3 критической массы 235U.
Химические свойства Урана. Конфигурация внешней электронной оболочки атома Урана 7s26dl5f3. Уран относится к реакционноспособным металлам, в соединениях проявляет степени окисления +3, +4, + 5, +6, иногда +2; наиболее устойчивы соединения U (IV) и U (VI).
На воздухе медленно окисляется с образованием на поверхности пленки оксида (IV), которая не предохраняет металл от дальнейшего окисления. В порошкообразном состоянии Уран пирофорен и горит ярким пламенем. С кислородом образует оксид (IV) UO2, оксид (VI) UО3 и большое число промежуточных оксидов, важнейший из которых U3O8.
Эти промежуточные оксиды по свойствам близки к UO2 и UO3. При высоких температуpax UO2 имеет широкую область гомогенности от UO1, 60 до UO2,27. С фтором при 500-600 °С образует тетрафторид UF4 (зеленые игольчатые кристаллы, малорастворимые в воде и кислотах) и гексафторид UF6 (белое кристаллическое вещество, возгоняющееся без плавления при 56,4 °С); с серой — ряд соединений, из которых наибольшее значение имеет US (ядерное горючее).
При взаимодействии Урана с водородом при 220 °С получается гидрид UH3; с азотом при температуре от 450 до 700 °С и атмосферном давлении — нитрид U4N7, при более высоком давлении азота и той же температуре можно получить UN, U2N3 и UN2; с углеродом при 750-800 °С — монокарбид UC, дикарбид UC2, а также U2С3; с металлами образует сплавы различных типов.
Уран медленно реагирует с кипящей водой с образованием UO2 н Н2, с водяным паром — в интервале температур 150-250 °С; растворяется в соляной и азотной кислотах, слабо — в концентрированной плавиковой кислоте.
Для U (VI) характерно образование иона уранила UO22+; соли уранила окрашены в желтый цвет и хорошо растворимы в воде и минеральных кислотах; соли U (IV) окрашены в зеленый цвет и менее растворимы; ион уранила чрезвычайно способен к комплексообразованию в водных растворах как с неорганических, так и с органических веществами; наиболее важны для технологии карбонатные, сульфатные, фторидные, фосфатные и других комплексы.
Известно большое число уранатов (солей не выделенной в чистом виде урановой кислоты), состав которых меняется в зависимости от условий получения; все уранаты имеют низкую растворимость в воде.
Уран и его соединения радиационно и химически токсичны. Предельно допустимая доза (ПДД) при профессиональном облучении 5 бэр в год.
Получение Урана
Уран получают из урановых руд, содержащих 0,05-0,5% U. Руды практически не обогащаются, за исключением ограниченного способа радиометрической сортировки, основанной на γ-излучении радия, всегда сопутствующего урану. В основном руды выщелачивают растворами серной, иногда азотной кислот или растворами соды с переводом Урана в кислый раствор в виде UО2SO4 или комплексных анионов [UO2(SO4)3]4-, а в содовый раствор — в виде [UО2(СО3)3]4-.
Для извлечения и концентрирования Урана из растворов и пульп, а также для очистки от примесей применяют сорбцию на ионообменных смолах и экстракцию органических растворителями (трибутилфосфат, алкилфосфорные кислоты, амины). Далее из растворов добавлением щелочи осаждают уранаты аммония или натрия или гидрооксид U(OH)4.
Для получения соединений высокой степени чистоты технические продукты растворяют в азотной кислоте и подвергают аффинажным операциям очистки, конечными продуктами которых являются UO3 или U3О8; эти оксиды при 650-800 °С восстанавливаются водородом или диссоциированным аммиаком до UO2 с последующим переводом его в UF4 обработкой газообразным фтористым водородом при 500-600 °С.
UF4 может быть получен также при осаждении кристаллогидрата UF4·nН2О плавиковой кислотой из растворов с последующим обезвоживанием продукта при 450 °С в токе водорода. В промышленности основные способом получения Уран из UF4 является его кальциетермическим или магниетермическим восстановление с выходом Урана в виде слитков массой до 1,5 т. Слитки рафинируются в вакуумных печах.
Очень важным процессом в технологии Урана является обогащение его изотопом 235U выше естественного содержания в рудах или выделение этого изотопа в чистом виде, поскольку именно 235U — основные ядерное горючее; осуществляется это методами газовой термодиффузии, центробежными и другими методами, основанными на различии масс 238U и 235U; в процессах разделения Уран используется в виде летучего гексафторида UF6.
При получении Урана высокой степени обогащения или изотопов учитываются их критические массы; наиболее удобный способ в этом случае — восстановление оксидов Урана кальцием; образующийся при этом шлак СаО легко отделяется от Урана растворением в кислотах. Для получения порошкообразного Урана, оксида (IV), карбидов, нитридов и других тугоплавких соединений применяются методы порошковой металлургии.
Применение Урана
Металлический Уран или его соединения используются в основном в качестве ядерного горючего в ядерных реакторах. Природная или малообогащенная смесь изотопов Урана применяется в стационарных реакторах атомных электростанций, продукт высокой степени обогащения — в ядерных силовых установках или в реакторах, работающих на быстрых нейтронах.
235U является источником ядерной энергии в ядерном оружии. 238U служит источником вторичного ядерного горючего — плутония.
Уран в организме. В микроколичествах (10-5-10-8%) обнаруживается в тканях растений, животных и человека. В золе растений (при содержании Уран в почве около 10-4%) его концентрация составляет 1,5·10-5%. В наибольшей степени Уран накапливается некоторыми грибами и водорослями (последние активно участвуют в биогенной миграции Урана по цепи вода — водные растения — рыба — человек).
В организм животных и человека Уран поступает с пищей и водой в желудочно-кишечный тракт, с воздухом в дыхательные пути, а также через кожные покровы и слизистые оболочки. Соединения Уран всасываются в желудочно-кишечном тракте — около 1% от поступающего количества растворимых соединений и не более 0,1% труднорастворимых; в легких всасываются соответственно 50% и 20%.
Распределяется Уран в организме неравномерно. Основное депо (места отложения и накопления) — селезенка, почки, скелет, печень и, при вдыхании труднорастворимых соединений, — легкие и бронхолегочные лимфатические узлы. В крови Уран (в виде карбонатов и комплексов с белками) длительно не циркулирует. Содержание Уран в органах и тканях животных и человека не превышает 10-7 г/г.
Так, кровь крупного рогатого скота содержит 1·10-8 г/мл, печень 8·10-8 г/г, мышцы 4·10-11 г/г, селезенка 9·108-8 г/г. Содержание Урана в органах человека составляет: в печени 6·10-9 г/г, в легких 6·10-9-9·10-9г/г, в селезенке 4,7·10-7г/г, в крови 4-10-10 г/мл, в почках 5,3·10-9 (корковый слой) и 1,3·10-8 г/г (мозговой слой), в костях 1·10-9 г/г, в костном мозге 1 -Ю-8 г/г, в волосах 1,3·10-7 г/г.
Уран, содержащийся в костной ткани, обусловливает ее постоянное облучение (период полувыведения Урана из скелета около 300 суток).
Наименьшие концентрации Урана — в головном мозге и сердце (10-10 г/г). Суточное поступление Урана с пищей и жидкостями — 1,9·10-6 г, с воздухом — 7·10-9 г. Суточное выведение Уран из организма человека составляет: с мочой 0,5·10-7- 5·10-7г, с калом — 1,4·10-6-1,8·10-6 г, с волосами — 2·10-8 г.
По данным Международной комиссии по радиационной защите, среднее содержание Урана в организме человека 9·10-5 г. Эта величина для различных районов может варьировать. Полагают, что Уран необходим для нормальной жизнедеятельности животных и растений.
Токсическое действие Уран обусловлено его химические свойствами и зависит от растворимости: более токсичны уранил и других растворимые соединения Урана.
Отравления Ураном и его соединениями возможны на предприятиях по добыче и переработке уранового сырья и других промышленного объектах, где он используется в технологическом процессе. При попадании в организм Уран действует на все органы и ткани, являясь общеклеточным ядом. Признаки отравления обусловлены преимущественным поражением почек (появление белка и сахара в моче, последующая олигурия); поражаются также печень и желудочно-кишечный тракт.
Различают острые и хронические отравления; последние характеризуются постепенным развитием и меньшей выраженностью симптомов. При хронической интоксикации возможны нарушения кроветворения, нервной системы и др. Полагают, что молекулярный механизм действия Урана связан с его способностью подавлять активность ферментов.
| Уран | |
|---|---|
| Атомный номер | 92 |
| Внешний вид простого вещества |  |
| Свойства атома | |
| Атомная масса (молярная масса) | 238,0289 а. е. м. (г/моль) |
| Радиус атома | 138 пм |
| Энергия ионизации (первый электрон) | 686,4(7,11) кДж/моль (эВ) |
| Электронная конфигурация | [Rn] 5f3 6d1 7s2 |
| Химические свойства | |
| Ковалентный радиус | 142 пм |
| Радиус иона | (+6e) 80 (+4e) 97 пм |
| Электроотрицательность (по Полингу) | 1,38 |
| Электродный потенциал | U←U4+ -1,38В U←U3+ -1,66В U←U2+ -0,1В |
| Степени окисления | 6, 5, 4, 3 |
| Термодинамические свойства простого вещества | |
| Плотность | 19,05 г/см³ |
| Молярная теплоёмкость | 27,67[1]Дж/(K·моль) |
| Теплопроводность | 27,5 Вт/(м·K) |
| Температура плавления | 1405,5 K |
| Теплота плавления | 12,6 кДж/моль |
| Температура кипения | 4018 K |
| Теплота испарения | 417 кДж/моль |
| Молярный объём | 12,5 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Параметры решётки | 2,850 Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
| U | 92 |
| 238,0289 | |
| 5f36d17s2 | |
| Уран | |
Уран (старое название Ураний) — химический элемент с атомным номером 92 в периодической системе, атомная масса 238,029; обозначается символом U (Uranium), относится к семейству актиноидов.
История
Ещё в древнейшие времена (I век до нашей эры) природная окись урана использовалась для изготовления жёлтой глазури для керамики. Исследования урана развивались, подобно порождаемой им цепной реакции. Вначале сведения о его свойствах, как и первые импульсы цепной реакции, поступали с большими перерывами, от случая к случаю. Первая важная дата в истории урана — 1789 год, когда немецкий натурфилософ и химик Мартин Генрих Клапрот восстановил извлечённую из саксонской смоляной руды золотисто-жёлтую «землю» до чёрного металлоподобного вещества. В честь самой далёкой из известных тогда планет (открытой Гершелем восемью годами раньше) Клапрот, считая новое вещество элементом, назвал его ураном.
Пятьдесят лет уран Клапрота числился металлом. Только в 1841 г. Эжен Мелькиор Пелиго — французский химик (1811—1890)] доказал, что, несмотря на характерный металлический блеск, уран Клапрота не элемент, а окисел UO2. В 1840 г. Пелиго удалось получить настоящий уран — тяжёлый металл серо-стального цвета и определить его атомный вес. Следующий важный шаг в изучении урана сделал в 1874 г. Д. И. Менделеев. Опираясь на разработанную им периодическую систему, он поместил уран в самой дальней клетке своей таблицы. Прежде атомный вес урана считали равным 120. Великий химик удвоил это значение. Через 12 лет предвидение Менделеева было подтверждено опытами немецкого химика Циммермана.
Изучение урана началось с 1896: французский химик Антуан Анри Беккерель случайно открыл Лучи Беккереля, которые позже Мария Кюри переименовала в радиоактивность. В это же время французскому химику Анри Муассану удалось разработать способ получения чистого металлического урана. В 1899 г. Резерфорд обнаружил, что излучение урановых препаратов неоднородно, что есть два вида излучения — альфа- и бета-лучи. Они несут различный электрический заряд; далеко не одинаковы их пробег в веществе и ионизирующая способность. Чуть позже, в мае 1900 г., Поль Вийар открыл третий вид излучения — гамма-лучи.
Эрнест Резерфорд провёл в 1907 г. первые опыты по определению возраста минералов при изучения радиоактивных урана и тория на основе созданной им совместно с Фредериком Содди (Soddy, Frederick, 1877—1956; Нобелевская премия по химии, 1921) теории радиоактивности. В 1913 г. Ф. Содди ввёл понятие об изотопах (от греч. ισος — «равный», «одинаковый», и τόπος — «место»), а в 1920 г.предсказал, что изотопы можно использовать для определения геологического возраста горных пород. В 1928 г. Ниггот реализовал, а в 1939 г. A.O.К.Нир (Nier,Alfred Otto Carl,1911 — 1994) создал первые уравнения для расчёта возраста и применил масс-спектрометр для разделения изотопов.
В 1939 Фредерик Жолио-Кюри и немецкие физики Отто Фриш и Лиза Мейтнер открыли неизвестное явление, происходящем с ядром урана при облучении его нейтронами. Происходило взрывное разрушения этого ядра с образованием новых элементов намного более лёгких, чем уран. Это разрушение носило взрывообразный характер, осколки продуктов разлетались в разные стороны с громадными скоростями. Таким образом было открыто явление, названное ядерной реакцией.
В 1939—1940 гг. Ю. Б. Харитон и Я. Б. Зельдович впервые теоретически показали, что при небольшом обогащении природного урана ураном-235 можно создать условия для непрерывного деления атомных ядер, то есть придать процессу цепной характер.
Нахождение в природе
Уранинитовая руда
Уран широко распространён в природе. Кларк урана составляет 1·10-3% (вес.). Количество урана в слое литосферы толщиной 20 км оценивается в 1,3·1014 т.
Основная масса урана находится в кислых породах с высоким содержанием кремния. Значительная масса урана сконцентрирована в осадочных породах, особенно обогащённых органикой. В больших количествах как примесь уран присутствует в ториевых и редкоземельных минералах (ортит, сфен CaTiO3[SiO4], монацит (La,Ce}PO4, циркон ZrSiO4, ксенотим YPO4 и др.). Важнейшими урановыми рудами являются настуран (урановая смолка), уранинит и карнотит. Основными минералами — спутниками урана являются молибденит MoS2, галенит PbS, кварц SiO2, кальцит CaCO3, гидромусковит и др.
| Минерал | Основной состав минерала | Содержание урана, % |
|---|---|---|
| Уранинит | UO2, UO3 + ThO2, CeO2 | 65-74 |
| Карнотит | K2(UO2)2(VO4)2·2H2O | ~50 |
| Казолит | PbO2·UO3·SiO2·H2O | ~40 |
| Самарскит | (Y, Er, Ce, U, Ca, Fe, Pb, Th)·(Nb, Ta, Ti, Sn)2O6 | 3.15-14 |
| Браннерит | (U, Ca, Fe, Y, Th)3Ti5O15 | 40 |
| Тюямунит | CaO·2UO3·V2O5·nH2O | 50-60 |
| Цейнерит | Cu(UO2)2(AsO4)2·nH2O | 50-53 |
| Отенит | Ca(UO2)2(PO4)2·nH2O | ~50 |
| Шрекингерит | Ca3NaUO2(CO3)3SO4(OH)·9H2O | 25 |
| Уранофан | CaO·UO2·2SiO2·6H2O | ~57 |
| Фергюсонит | (Y, Ce)(Fe, U)(Nb, Ta)O4 | 0.2-8 |
| Торбернит | Cu(UO2)2(PO4)2·nH2O | ~50 |
| Коффинит | U(SiO4)1-x(OH)4x | ~50 |
Основными формами нахождений урана в природе являются уранинит, настуран (урановая смолка) и урановые черни. Они отличаются только формами нахождения; имеется возрастная зависимость: уранинит присутствует преимущественно в древних (докембрийских породах), настуран — вулканогенный и гидротермальный — преимущественно в палеозойских и более молодых высоко- и среднетемпературных образованиях; урановые черни — в основном в молодых — кайнозойских и моложе образованиях — преимущественно в низкотемпературных осадочных породах.
Содержание урана в земной коре составляет 0,003 %, он встречается в поверхностном слое земли в виде четырех видов отложений. Во-первых, это жилы уранинита, или урановой смолки (диоксид урана UO2), очень богатые ураном, но редко встречающиеся. Им сопутствуют отложения радия, так как радий является прямым продуктом изотопного распада урана. Такие жилы встречаются в Заире, Канаде (Большое Медвежье озеро), Чехии и Франции. Вторым источником урана являются конгломераты ториевой и урановой руды совместно с рудами других важных минералов. Конгломераты обычно содержат достаточные для извлечения количества золота и серебра, а сопутствующими элементами становятся уран и торий. Большие месторождения этих руд находятся в Канаде, ЮАР, России и Австралии. Третьим источником урана являются осадочные породы и песчаники, богатые минералом карнотитом (уранил-ванадат калия), который содержит, кроме урана, значительное количество ванадия и других элементов. Такие руды встречаются в западных штатах США. Железоурановые сланцы и фосфатные руды составляют четвертый источник отложений. Богатые отложения обнаружены в глинистых сланцах Швеции. Некоторые фосфатные руды Марокко и США содержат значительные количества урана, а фосфатные залежи в Анголе и Центральноафриканской Республике еще более богаты ураном. Большинство лигнитов и некоторые угли обычно содержат примеси урана. Богатые ураном отложения лигнитов обнаружены в Северной и Южной Дакоте (США) и битумных углях Испании и Чехии
Изотопы урана
Природный уран состоит из смеси трёх изотопов: 238U — 99,2739 % (период полураспада T1/2 = 4,468×109 лет), 235U — 0,7024 % (T1/2 = 7,038×108 лет) и 234U — 0,0057 % (T1/2 = 2,455×105 лет). Последний изотоп является не первичным, а радиогенным, он входит в состав радиоактивного ряда 238U.
Радиоактивность природного урана обусловлена в основном изотопами 238U и 234U, в равновесии их удельные активности равны. Удельная активность изотопа 235U в природном уране в 21 раз меньше активности 238U.
Известно 11 искусственных радиоактивных изотопов урана с массовыми числами от 227 до 240. Наиболее долгоживущий из них — 233U (T1/2 = 1,62×105лет) получается при облучении тория нейтронами и способен к спонтанному делению тепловыми нейтронами.
Изотопы урана 238U и 235U являются родоначальниками двух радиоактивных рядов. Конечными элементами этих рядов являются изотопы свинца 206Pb и 207Pb.
В природных условиях распространены в основном изотопы 234U: 235U : 238U = 0,0054 : 0,711 : 99,283. Половина радиоактивности природного урана обусловлена изотопом 234U. Изотоп 234U образуется за счёт распада 238U. Для двух последних в отличие от других пар изотопов и независимо от высокой миграционной способности урана характерно географическое постоянство отношения 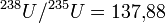
Получение
Самая первая стадия уранового производства — концентрирование. Породу дробят и смешивают с водой. Тяжёлые компоненты взвеси осаждаются быстрее. Если порода содержит первичные минералы урана, то они осаждаются быстро: это тяжёлые минералы. Вторичные минералы урана легче, в этом случае раньше оседает тяжёлая пустая порода. (Впрочем, далеко не всегда она действительно пустая; в ней могут быть многие полезные элементы, в том числе и уран).
Следующая стадия — выщелачивание концентратов, перевод урана в раствор. Применяют кислотное и щелочное выщелачивание. Первое — дешевле, поскольку для извлечения урана используют серную кислоту. Но если в исходном сырье, как, например, в урановой смолке, уран находится в четырёхвалентном состоянии, то этот способ неприменим: четырёхвалентный уран в серной кислоте практически не растворяется. В этом случае нужно либо прибегнуть к щелочному выщелачиванию, либо предварительно окислять уран до шестивалентного состояния.
Не применяют кислотное выщелачивание и в тех случаях, если урановый концентрат содержит доломит или магнезит, реагирующие с серной кислотой. В этих случаях пользуются едким натром (гидроксидом натрия).
Проблему выщелачивания урана из руд решает кислородная продувка. В нагретую до 150 °C смесь урановой руды с сульфидными минералами подают поток кислорода. При этом из сернистых минералов образуется серная кислота, которая и вымывает уран.
На следующем этапе из полученного раствора нужно избирательно выделить уран. Современные методы — экстракция и ионный обмен — позволяют решить эту проблему.
Раствор содержит не только уран, но и другие катионы. Некоторые из них в определённых условиях ведут себя так же, как уран: экстрагируются теми же органическими растворителями, оседают на тех же ионообменных смолах, выпадают в осадок при тех же условиях. Поэтому для селективного выделения урана приходится использовать многие окислительно-восстановительные реакции, чтобы на каждой стадии избавляться от того или иного нежелательного попутчика. На современных ионообменных смолах уран выделяется весьма селективно.
Методы ионного обмена и экстракции хороши ещё и тем, что позволяют достаточно полно извлекать уран из бедных растворов (содержание урана — десятые доли грамма на литр).
После этих операций уран переводят в твёрдое состояние — в один из оксидов или в тетрафторид UF4. Но этот уран ещё надо очистить от примесей с большим сечением захвата тепловых нейтронов — бора, кадмия, гафния. Их содержание в конечном продукте не должно превышать стотысячных и миллионных долей процента. Для удаления этих примесей технически чистое соединение урана растворяют в азотной кислоте. При этом образуется уранилнитрат UO2(NO3)2, который при экстракции трибутил-фосфатом и некоторыми другими веществами дополнительно очищается до нужных кондиций. Затем это вещество кристаллизуют (или осаждают пероксид UO4·2H2O) и начинают осторожно прокаливать. В результате этой операции образуется трёхокись урана UO3, которую восстанавливают водородом до UO2.
На диоксид урана UO2 при температуре от 430 до 600 °C воздействуют сухим фтористым водородом для получения тетрафторида UF4. Из этого соединения восстанавливают металлический уран с помощью кальция или магния.
Физические свойства
Уран — очень тяжёлый, серебристо-белый глянцеватый металл. В чистом виде он немного мягче стали, ковкий, гибкий, обладает небольшими парамагнитными свойствами. Уран имеет три аллотропные формы: альфа (призматическая, стабильна до 667,7 °C), бета (четырёхугольная, стабильна от 667,7 °C до 774,8 °C), гамма (с объёмно центрированной кубической структурой, существующей от 774,8 °C до точки плавления).
Радиоактивные свойства некоторых изотопов урана (выделены природные изотопы):
| Массовое число | Период полураспада | Тип распада |
|---|---|---|
| 234 | 2,45·105 лет | α |
| 235 | 7,13·108 лет | α |
| 236 | 2,39·107 лет | α |
| 237 | 6,75 сут. | β— |
| 238 | 4,49·109 лет | α |
| 239 | 23,54 мин. | β— |
| 240 | 14 час. | β— |
Химические свойства
Уран может проявлять степени окисления от +III до +VI. Соединения урана(III) образуют неустойчивые растворы красного цвета и являются сильными восстановителями:
4UCl3 + 2H2O → 3UCl4 + UO2 + H2↑
Соединения урана(IV) являются наиболее устойчивыми и образуют водные растворы зелёного цвета.
Соединения урана(V) неустойчивы и легко диспропорционируют в водном растворе:
2UO2Cl → UO2Cl2 + UO2
Химически уран очень активный металл. Быстро окисляясь на воздухе, он покрывается радужной пленкой оксида. Мелкий порошок урана самовоспламеняется на воздухе, он зажигается при температуре 150—175 °C, образуя U3O8. При 1000 °C уран соединяется с азотом, образуя желтый нитрид урана. Вода способна разъедать металл, медленно при низкой температуре, и быстро при высокой, а также при мелком измельчении порошка урана. Уран растворяется в соляной, азотной и других кислотах, образуя четырёхвалентные соли, зато не взаимодействует с щелочами. Уран вытесняет водород из неорганических кислот и солевых растворов таких металлов, как ртуть, серебро, медь, олово, платина и золото. При сильном встряхивании металлические частицы урана начинают светиться. Уран имеет четыре степени окисления — III—VI. Шестивалентные соединения включают в себя триокись урана (окись уранила) UO3 и уранилхлорид урана UO2Cl2. Тетрахлорид урана UCl4 и диоксид урана UO2 — примеры четырёхвалентного урана. Вещества, содержащие четырёхвалентный уран, обычно нестабильны и обращаются в шестивалентные при длительном пребывании на воздухе. Ураниловые соли, такие как уранилхлорид, распадаются в присутствии яркого света или органики.
Применение
Ядерное топливо
Наибольшее применение имеет изотоп урана 235U, в котором возможна самоподдерживающаяся цепная ядерная реакция. Поэтому этот изотоп используется как топливо в ядерных реакторах, а также в ядерном оружии. Выделение изотопа U235 из природного урана — сложная технологическая проблема, (см. разделение изотопов).
Изотоп U238 способен делиться под влиянием бомбардировки высокоэнергетическими нейтронами, эту его особенность используют для увеличения мощности термоядерного оружия (используются нейтроны, порождённые термоядерной реакцией).
В результате захвата нейтрона с последующим β-распадом 238U может превращаться в 239Pu, который затем используется как ядерное топливо.
Уран-233, искусственно получаемый в реакторах из тория (торий-232 захватывает нейтрон и превращается в торий-233, который распадается в протактиний-233 и затем в уран-233), может в будущем стать распространённым ядерным топливом для атомных электростанций (уже сейчас существуют реакторы, использующие этот нуклид в качестве топлива, например KAMINI в Индии) и производства атомных бомб (критическая масса около 16 кг).
Уран-233 также является наиболее перспективным топливом для газофазных ядерных ракетных двигателей.
Геология
Основная отрасль использования урана — определение возраста минералов и горных пород с целью выяснения последовательности протекания геологических процессов. Этим занимаются Геохронология и Теоретическая геохронология. Существенное значение имеет также решение задачи о смешении и источниках вещества.
В основе решения задачи лежат уравнения радиоактивного распада, описываемых уравнениями.
где 238Uo, 235Uo — современные концентрации изотопов урана; 
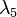
Весьма важным является их комбинация:
-
-
.
-
Здесь
В связи с тем, что горные породы содержат различные концентрации урана, они обладают различной радиоактивностью. Это свойство используется при выделении горных пород геофизическими методами. Наиболее широко этот метод применяется в нефтяной геологии при геофизических исследованиях скважин, в этот комплекс входит, в частности, γ — каротаж или нейтронный гамма-каротаж, гамма-гамма-каротаж и т. д. С их помощью происходт выделение коллекторов и флюидоупоров.
Другие сферы применения
Небольшая добавка урана придаёт красивую жёлто-зелёную флуоресценцию стеклу (Урановое стекло).
Уранат натрия Na2U2O7 использовался как жёлтый пигмент в живописи.
Соединения урана применялись как краски для живописи по фарфору и для керамических глазурей и эмалей (окрашивают в цвета: жёлтый, бурый, зелёный и чёрный, в зависимости от степени окисления).
Некоторые соединения урана светочувствительны.
В начале XX века уранилнитрат широко применялся для усиления негативов и окрашивания (тонирования) позитивов (фотографических отпечатков) в бурый цвет.
Карбид урана-235 в сплаве с карбидом ниобия и карбидом циркония применяется в качестве топлива для ядерных реактивных двигателей (рабочее тело — водород + гексан).
Сплавы железа и обеднённого урана (уран-238) применяются как мощные магнитострикционные материалы.
Обеднённый уран
-
Обеднённый уран
После извлечения 235U и 234U из природного урана, оставшийся материал (уран-238) носит название «обеднённый уран», так как он обеднён 235-м изотопом. По некоторым данным, в США хранится около 560 000 тонн обеднённого гексафторида урана (UF6).
Обеднённый уран в два раза менее радиоактивен, чем природный уран, в основном за счёт удаления из него 234U. Из-за того, что основное использование урана — производство энергии, обеднённый уран — малополезный продукт с низкой экономической ценностью.
В основном его использование связано с большой плотностью урана и относительно низкой его стоимостью. Обеднённый уран используется для радиационной защиты (как это ни странно) и как балластная масса в аэрокосмических применениях, таких как рулевые поверхности летательных аппаратов. В каждом самолёте «Боинг-747» содержится 1500 кг обеднённого урана для этих целей. Ещё этот материал применяется в высокоскоростных роторах гироскопов, больших маховиках, как балласт в космических спускаемых аппаратах и гоночных яхтах, при бурении нефтяных скважин.
Сердечники бронебойных снарядов
Наконечник (вкладыш) снаряда калибра 30 мм (пушки GAU-8 самолёта A-10) диаметром около 20 мм из обеднённого урана.
Самое известное применение обеднённого урана — в качестве сердечников для бронебойных снарядов. При сплавлении с 2 % Mo или 0,75 % Ti и термической обработке (быстрая закалка разогретого до 850 °C металла в воде или масле, дальнейшее выдерживание при 450 °C 5 часов) металлический уран становится твёрже и прочнее стали (прочность на разрыв больше 1600 МПа, при том, что у чистого урана она равна 450 МПа). В сочетании с большой плотностью, это делает закалённую урановую болванку чрезвычайно эффективным средством для пробивания брони, аналогичным по эффективности более дорогому вольфраму. Тяжёлый урановый наконечник также изменяет распределение масс в снаряде, улучшая его аэродинамическую устойчивость.
Подобные сплавы типа «Стабилла» применяются в стреловидных оперенных снарядах танковых и противотанковых артиллерийских орудий.
Процесс разрушения брони сопровождается измельчением в пыль урановой болванки и воспламенением её на воздухе с другой стороны брони (см. Пирофорность). Около 300 тонн обеднённого урана остались на поле боя во время операции «Буря в Пустыне» (по большей части это остатки снарядов 30-мм пушки GAU-8 штурмовых самолётов A-10, каждый снаряд содержит 272 г уранового сплава).
Такие снаряды были использованы войсками НАТО в боевых действиях на территории Югославии. После их применения обсуждалась экологическая проблема радиационного загрязнения территории страны.
Впервые уран в качестве сердечника для снарядов был применен в Третьем рейхе.
Обеднённый уран используется в современной танковой броне, например, танка M-1 «Абрамс».
Физиологическое действие
В микроколичествах (10−5—10−8 %) обнаруживается в тканях растений, животных и человека. В наибольшей степени накапливается некоторыми грибами и водорослями. Соединения урана всасываются в желудочно-кишечном тракте (около 1 %), в легких — 50 %. Основные депо в организме: селезёнка, почки, скелет, печень, лёгкие и бронхо-лёгочные лимфатические узлы. Содержание в органах и тканях человека и животных не превышает 10−7г.
Уран и его соединения токсичны. Особенно опасны аэрозоли урана и его соединений. Для аэрозолей растворимых в воде соединений урана ПДК в воздухе 0,015 мг/м³, для нерастворимых форм урана ПДК 0,075 мг/м³. При попадании в организм уран действует на все органы, являясь общеклеточным ядом. Молекулярный механизм действия урана связан с его способностью подавлять активность ферментов. В первую очередь поражаются почки (появляются белок и сахар в моче, олигурия). При хронической интоксикации возможны нарушения кроветворения и нервной системы.
Разведанные запасы урана в мире
Добыча урана в мире
10 стран, ответственных за 94 % мировой добычи урана
Согласно «Красной книге по урану», выпущенной ОЭСР, в 2005 добыто 41 250 тонн урана (в 2003 — 35 492 тонны). Согласно данным ОЭСР, в мире функционирует 440 реакторов коммерческого назначения, которые потребляют в год 67 тыс. тонн урана. Это означает, что его производство обеспечивает лишь 60 % объёма его потребления (остальное извлекается из старых ядерных боеголовок).
Добыча по странам в тоннах по содержанию U на 2005—2006 гг.
| Страна | 2005 год |
| Канада | 11 410 |
| Австралия | 9044 |
| Казахстан | 4020 |
| Россия | 3570 |
| США | 1249 |
| Украина | 920 |
| Китай | 920 |
Добыча по компаниям в 2006 г.:
Cameco — 8,1 тыс. тонн
Rio Tinto — 7 тыс. тонн
AREVA — 5 тыс. тонн
Казатомпром — 3,8 тыс.тонн
ОАО ТВЭЛ — 3,5 тыс. тонн
BHP Billiton — 3 тыс. тонн
Навоийский ГМК — 2,1 тыс. тонн (Узбекистан, Навои)
Uranium One — 1 тыс. тонн
Heathgate — 0,8 тыс. тонн
Denison Mines — 0,5 тыс. тонн
Добыча в России
В СССР основными уранорудными регионами были Украина (месторождение Желтореченское, Первомайское и др.), Казахстан (Северный — Балкашинское рудное поле и др.; Южный — Кызылсайское рудное поле и др.; Восточный; все они принадлежат преимущественно вулканогенно -гидротермальному типу); Забайкалье (Антей, Стрельцовское и др.); Средняя Азия, в основном Узбекистан с оруденениями в чёрных сланцах с центром в г. Учкудук. Имеется масса мелких рудопроявлений и проявлений. В России основным урановорудным регионом осталось Забайкалье. На месторождении в Читинской области (около города Краснокаменск) добывается около 93 % российского урана. Добычу осуществляет шахтным способом «Приаргунское производственное горно-химическое объединение» (ППГХО), входящее в состав ОАО «Атомредметзолото» (Урановый холдинг).
Остальные 7 % получают методом подземного выщелачивания ЗАО «Далур» (Курганская область) и ОАО «Хиагда» (Бурятия).
Полученные руды и урановый концентрат перерабатываются на Чепецком механическом заводе.
Добыча в Казахстане
В Казахстане сосредоточена примерно пятая часть мировых запасов урана (21% и 2 место в мире). Общие ресурсы урана порядка 1,5 млн. тонн, из них около 1,1 млн. тонн можно добывать методом подземного выщелачивания.
В 2009 году Казахстан вышел на первое место в мире по добыче урана.
Добыча на Украине
Основное предприятие — Восточный горно-обогатительный комбинат в городе Жёлтые Воды.
Стоимость
Несмотря на бытующие легенды о десятках тысяч долларов за килограммовые или даже грамовые количества урана, реальная его цена на рынке не очень высока — необогащённая окись урана U3O8 стоит меньше 100 американских долларов за килограмм. Связано это с тем, что для запуска атомного реактора на необогащённом уране нужны десятки или даже сотни тонн топлива, а для изготовления ядерного оружия следует обогатить большое количество урана для получения пригодных для создания бомбы концентраций















 .
.

