Углерод
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических
веществ в природе.
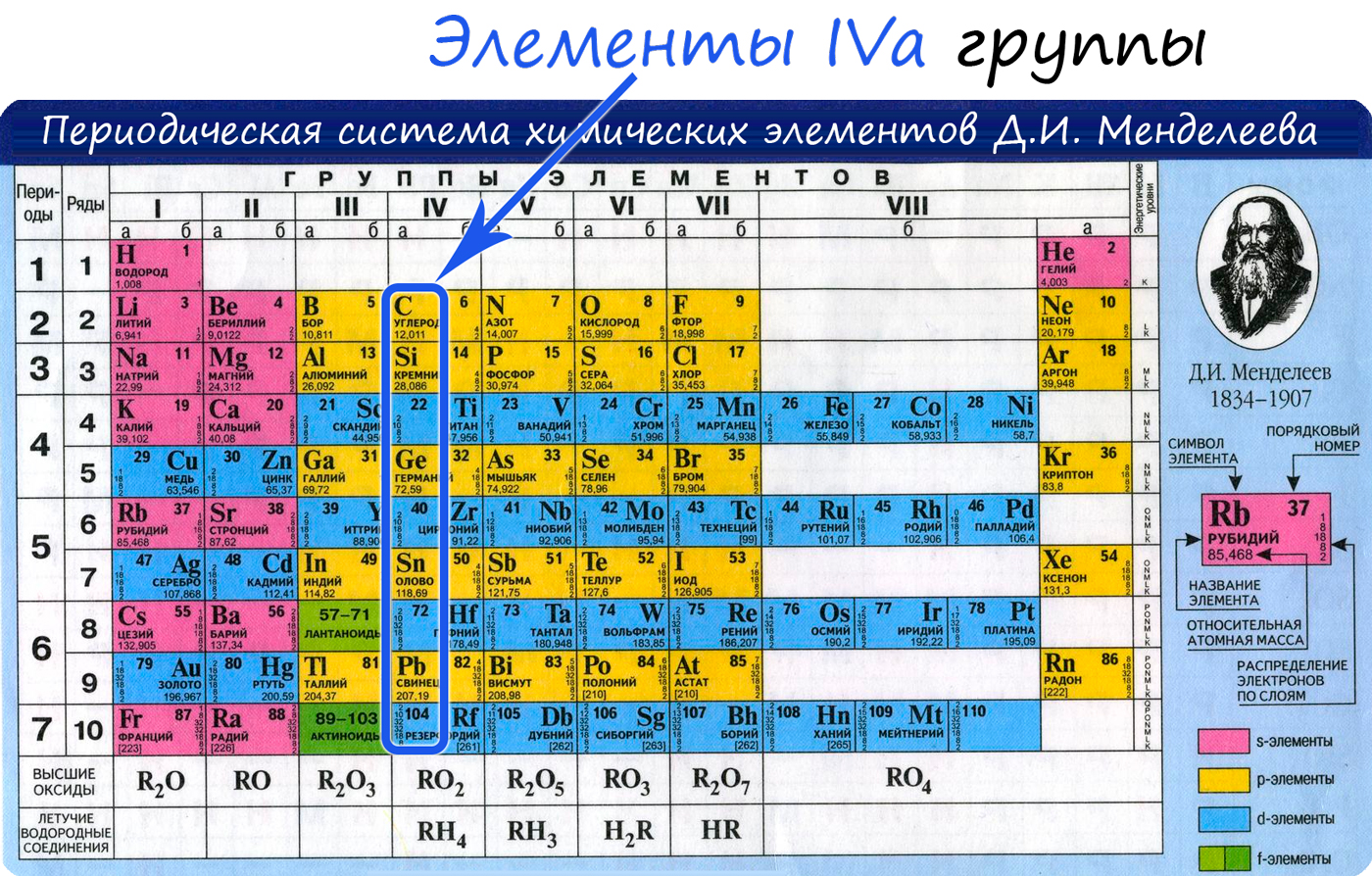
Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит
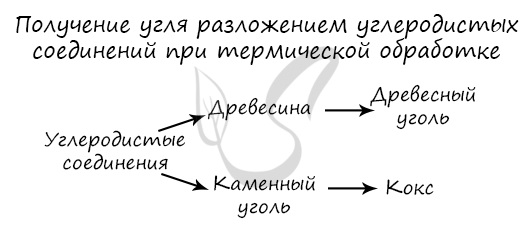
Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений:
древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Восстановительные свойства
- Реакция с водой
- Реакции с кислотами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
C + H2 → (t) CH4 (метан)
2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
С + F2 → (t) CF4
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные
степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их
оксидов:
Fe2O3 + C → Fe + CO2
ZnO + C → Zn + CO
FeO + C → Fe + CO
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
CO2 + C → CO
Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑
В реакциях с кислотами углерод проявляет себя как восстановитель:
C + HNO3(конц.) → (t) CO2 + NO2 + H2O
C + HNO3 → CO2 + NO + H2O
C + H2SO4(конц.) → CO2 + SO2 + H2O
Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется
при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода
и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
Получение
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
CO2 + C → (t) CO
C + H2O → (t) CO + H2
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
HCOOH → (H2SO4) CO + H2O
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
CO + O2 → CO2
Fe2O3 + CO → Fe + CO2
FeO + CO → Fe + CO2
Образование карбонилов — чрезвычайно токсичных веществ.
Fe + CO → (t) Fe(CO)5
Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ,
без запаха.
Получение
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
CaCO3 → (t) CaO + CO2↑
C6H12O6 → C2H5OH + CO2↑
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
CaCO3 + HCl → CaCl2 + H2O + CO2↑
Углекислый газ образуется при горении органических веществ:
C3H8 + O2 → CO2 + H2O
Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
CO2 + H2O ⇄ H2CO3
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания),
кислые — гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
Na2O + CO2 → Na2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Химические свойства
- Качественная реакция
- Средние и кислые соли
- Нагревание солей угольной кислоты
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного
газа без запаха.
MgCO3 + HCl → MgCl2 + CO2↑ + H2O
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что
при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа —
помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)
Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу
H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
LiHCO3 + LiOH → Li2CO3 + H2O
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
MgCO3 → (t) MgO + CO2
KHCO3 → (t) K2CO3 + CO2↑ + H2O
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.

Углерод – это 15-й наиболее распространенный элемент в земной коре, и четвертый наиболее распространенный элемент во Вселенной по массе после водорода, гелия и кислорода. Обилие углерода, уникальное разнообразие его органических соединений и его необычная способность образовывать полимеры при температурах, обычно встречающихся на Земле, позволяют этому элементу служить общим элементом для всех известных форм жизни. Это второй наиболее распространенный элемент в человеческом теле по массе (около 18,5%) после кислорода. 2)
Атомы углерода могут связываться по-разному, называясь при этом аллотропами углерода. Наиболее известными аллотропами являются графит, алмаз и аморфный углерод. Физические свойства углерода широко варьируются в зависимости от аллотропной формы. Например, графит непрозрачен и черный, а алмаз – очень прозрачный. Графит достаточно мягкий, чтобы образовывать полосу на бумаге (отсюда и его название, от греческого глагола «γράφειν», что означает «писать»), в то время как алмаз является самым твердым известным в природе материалом. Графит является хорошим электрическим проводником, а алмаз имеет низкую электропроводность. В обычных условиях, алмаз, углеродные нанотрубки и графен имеют самую высокую теплопроводность среди всех известных материалов. Все углеродные аллотропы являются твердыми веществами в нормальных условиях, причем графит является наиболее термодинамически стабильной формой. Они химически устойчивы и требуют высокой температуры, чтобы реагировать даже с кислородом.
Наиболее распространенное состояние окисления углерода в неорганических соединениях составляет +4, и +2 – в карбоксильных комплексах монооксида углерода и переходного металла. Крупнейшими источниками неорганического углерода являются известняки, доломиты и двуокись углерода, но значительные количества происходят из органических отложений угля, торфа, нефти и метанатных клатратов. Углерод образует огромное количество соединений, больше, чем любой другой элемент, с почти десятимиллионным количеством соединений, описанных до настоящего времени, и, тем не менее, это число является лишь частью числа теоретически возможных соединений в стандартных условиях. По этой причине, углерод часто упоминается как «царь элементов» 3).
Характеристики
Аллотропы углерода включают графит, одно из самых мягких из известных веществ, и алмаз, самое твердое природное вещество. Углерод легко связывается с другими малыми атомами, включая другие атомы углерода, и способен образовывать многочисленные устойчивые ковалентные связи с подходящими многовалентными атомами. Известно, что углерод образует почти десять миллионов различных соединений, подавляющее большинство всех химических соединений. Углерод также имеет самую высокую точку сублимации среди всех элементов. При атмосферном давлении, он не имеет температуры плавления, так как его тройная точка составляет 10,8 ± 0,2 МПа и 4600 ± 300 К (~ 4330 ° С или 7 820 ° F), поэтому он возгоняется при температуре около 3900 К. 4) Графит гораздо более реактивный, чем алмаз, в стандартных условиях, несмотря на то, что он более термодинамически стабилен, поскольку его делокализованная система pi гораздо более уязвима для атаки. Например, графит может быть окислен горячей концентрированной азотной кислотой в стандартных условиях до меллитовой кислоты C6 (CO2H) 6, которая сохраняет гексагональные единицы графита при разрушении большей структуры.
Углерод возгоняется в углеродистой дуге, температура которой составляет около 5800 К (5 530 ° С, 9 980 ° F). Таким образом, независимо от его аллотропной формы, углерод остается твердым при более высоких температурах, чем самые высокие температуры плавления, такие как вольфрам или рений. Хотя термодинамически углерод склонен к окислению, он более устойчив к окислению, чем такие элементы, как железо и медь, которые являются более слабыми восстановителями при комнатной температуре.
Углерод – шестой элемент с электронной конфигурацией основного состояния 1s22s22p2, из которых четыре внешних электрона являются валентными электронами. Его первые четыре энергии ионизации 1086,5, 2352,6, 4620,5 и 6222,7 кДж / моль, намного выше, чем у более тяжелых элементов группы 14. Электроотрицательность углерода составляет 2,5, что значительно выше, чем у более тяжелых элементов 14 группы (1,8-1,9), но близка к большинству соседних неметаллов, а также к некоторым переходным металлам второго и третьего ряда. Ковалентные радиусы углерода обычно принимаются как 77,2 пм (C-C), 66,7 пм (C = C) и 60,3 пм (C≡C), хотя они могут варьироваться в зависимости от координационного числа и от того, с чем связан углерод. В общем случае, ковалентный радиус уменьшается при уменьшении координационного числа и увеличении порядка связей.
Углеродные соединения составляют основу всех известных форм жизни на Земле, а углерод-азотный цикл обеспечивает некоторую энергию, выделяемую Солнцем и другими звездами. Хотя углерод образует необычайное разнообразие соединений, большинство форм углерода сравнительно не реагируют в нормальных условиях. При стандартных температурах и давлении, углерод выдерживает все, кроме самых сильных окислителей. Он не реагирует с серной кислотой, соляной кислотой, хлором или щелочами. При повышенных температурах, углерод реагирует с кислородом с образованием оксидов углерода и убирает кислород из оксидов металлов, оставляя элементный металл. Эта экзотермическая реакция используется в черной металлургии для плавки железа и контроля содержания углерода в стали:
-
Fe3О4 + 4 C (s) → 3 Fe (s) + 4 CO (g)
с серой с образованием дисульфида углерода и с паром в реакции уголь-газ:
-
C (s) + H2O (g) → CO (g) + H2 (g)
Углерод сочетается с некоторыми металлами при высоких температурах с образованием металлических карбидов, таких как цементит из карбида железа в стали и карбид вольфрама, широко используемый в качестве абразива и для изготовления жестких наконечников для режущих инструментов.
Система аллотропов углерода охватывает ряд экстремумов:
-
Графит – один из самых мягких материалов. Синтетический нанокристаллический алмаз является самым твердым материалом. 5)
-
Графит – очень хорошая смазка. Алмаз – конечный абразив.
-
Графит – проводник электричества. Алмаз – отличный электрический изолятор и имеет самое высокое электрическое поле пробоя среди любого известного материала.
Некоторые виды графита используются для теплоизоляции (например, противопожарные преграды и теплозащитные экраны), но некоторые другие формы являются хорошими тепловыми проводниками. Алмаз – самый известный природный теплопроводник.
Графит непрозрачен. Алмаз очень прозрачный.
Графит кристаллизуется в гексагональной системе 6). Алмаз кристаллизуется в кубической системе.
Аморфный углерод полностью изотропный. Углеродные нанотрубки являются одними из самых известных анизотропных материалов.
Аллотропы углерода
Атомный углерод является очень недолговечным видом, и поэтому углерод стабилизируется в различных многоатомных структурах с различными молекулярными конфигурациями, называемыми аллотропами. Три относительно известных аллотропа углерода – аморфный углерод, графит и алмаз. Ранее считавшиеся экзотическими, фуллерены в настоящее время обычно синтезируются и используются в исследованиях; они включают бакиболы, 7) углеродные нанотрубки, углеродные наноточки и нановолокна. Также было обнаружено несколько других экзотических аллотропов, таких как лонсалетит, стеклоуглерод, 
По состоянию на 2009 год, графен считается наиболее сильным материалом среди всех, когда-либо протестированных. 9) Процесс отделения его от графита потребует некоторого дальнейшего технологического развития, прежде чем он станет экономичным для промышленных процессов. В случае успеха, графен можно будет использовать при строительстве космических лифтов. Он также может быть использован для безопасного хранения водорода для использования в двигателях на основе водорода в автомобилях.
Аморфная форма представляет собой набор атомов углерода в некристаллическом, нерегулярном, стекловидном состоянии, а не содержащихся в кристаллической макроструктуре. Она присутствует в виде порошка и является основным компонентом таких веществ, как древесный уголь, ламповая копоть (сажа) и активированный уголь. При нормальных давлениях, углерод имеет форму графита, в котором каждый атом тригонально связан тремя другими атомами в плоскости, состоящей из сплавленных гексагональных колец, как и в ароматических углеводородах 10). Полученная сеть является двухмерной, и полученные плоские листы складываются и свободно связываются через слабые силы Ван-дер-Ваальса. Это дает графиту его мягкость и свойства расщепления (листы легко проскальзывают друг за другом). Из-за делокализации одного из внешних электронов каждого атома с образованием π-облака, графит проводит электричество, но только в плоскости каждого ковалентно связанного листа. Это приводит к более низкой удельной электропроводности для углерода, чем для большинства металлов.
Делокализация также объясняет энергетическую стабильность графита над алмазом при комнатной температуре.
При очень высоких давлениях, углерод образует более компактный аллотроп, алмаз, имеющий почти вдвое большую плотность, чем графит. Здесь каждый атом тетраэдрически соединен с четырьмя другими, образуя трехмерную сеть сморщенных шестичленных колец атомов. Алмаз имеет ту же кубическую структуру, что кремний и германий, и из-за прочности углерод-углеродных связей он является самым твердым природным веществом, что измеряется по сопротивлению царапинам. Вопреки распространенному мнению, что «алмазы вечны», они термодинамически нестабильны в нормальных условиях и превращаются в графит. Из-за высокого энергетического барьера активации, переход в форму графита настолько медленный при нормальной температуре, что он незаметен. При некоторых условиях, углерод кристаллизуется как лонсалейт, гексагональная кристаллическая решетка со всеми ковалентно связанными атомами и свойствами, аналогичными свойствам алмаза. Фуллерены представляют собой синтетическое кристаллическое образование с графитоподобной структурой, но вместо шестиугольников фуллерены состоят из пятиугольников (или даже семиугольников) атомов углерода. Отсутствующие (или дополнительные) атомы деформируют листы в сферы, эллипсы или цилиндры. Свойства фуллеренов (разделенных на бакиболы, бакитубы и нанобады) еще не полностью проанализированы и представляют собой интенсивную область исследований наноматериалов. Названия «фуллерен» и «бакибол» связаны с именем Ричарда Бакминстера Фуллера, популяризатора геодезических куполов, которые напоминают структуру фуллеренов. Бакиболы представляют собой довольно крупные молекулы, образованные полностью из углеродных связей тригонально, образуя сфероиды (наиболее известным и простейшим является баксинистерфеллерен C60 с формой футбольного мяча). Углеродные нанотрубки структурно подобны бакиболам, за исключением того, что каждый атом связан тригонально в изогнутом листе, который образует полый цилиндр. 11) Нанобады впервые были представлены в 2007 году и представляют собой гибридные материалы (бакиболы ковалентно связаны с внешней стенкой нанотрубки), которые сочетают свойства обоих в одной структуре. Из других обнаруженных аллотропов, углеродная нанопена является ферромагнитным аллотропом, обнаруженным в 1997 году. Она состоит из кластерной сборки атомов углерода с низкой плотностью, натянутых вместе в рыхлую трехмерную сеть, в которой атомы тригонально связаны в шести- и семичленных кольцах. Она относится к числу самых легких твердых веществ с плотностью около 2 кг / м3. Аналогичным образом, стеклообразный углерод содержит высокую долю закрытой пористости, но, в отличие от обычного графита, графитовые слои не сложены в виде страниц в книге, но имеют более случайное расположение. Линейный ацетиленовый углерод имеет химическую структуру — (C ::: C) n-. Углерод в этой модификации является линейным с орбитальной гибридизацией sp и является полимером с чередующимися одиночными и тройными связями. Этот карбин представляет значительный интерес для нанотехнологий, поскольку его модуль Юнга в сорок раз больше, чем у самого твердого материала – алмаза. В 2015 году команда из Университета Северной Каролины объявила о разработке еще одного аллотропа, который они назвали Q-углерод, созданный высокоэнергетическим лазерным импульсом низкой длительности на аморфной углеродной пыли. Сообщается, что Q-углерод проявляет ферромагнетизм, флуоресценцию и имеет твердость, превосходящую алмазы.
Распространенность
Углерод является четвертым по распространенности химическим элементом во Вселенной по массе после водорода, гелия и кислорода. Углерод изобилует в Солнце, звездах, кометах и атмосферах большинства планет. Некоторые метеориты содержат микроскопические алмазы, которые были сформированы, когда солнечная система все еще была протопланетным диском. Микроскопические алмазы также могут образовываться при интенсивном давлении и высокой температуре в местах воздействия метеорита. В 2014 году, НАСА объявила об обновленной базе данных для отслеживания полициклических ароматических углеводородов (ПАУ) во Вселенной. Более 20% углерода во Вселенной могут быть связаны с ПАУ, комплексными соединениями углерода и водорода без кислорода 12). Эти соединения фигурируют в мировой гипотезе ПАУ, где они, предположительно, играют роль в абиогенезе и формировании жизни. Похоже, что ПАУ были сформированы «через пару миллиардов лет» после Большого взрыва, широко распространены во вселенной и связаны с новыми звездами и экзопланетами. По оценкам, твердая оболочка земли, в целом, содержит 730 чнм углерода, при этом 2000 чнм содержатся в сердцевине и 120 чнм – в комбинированной мантии и коре 13). Поскольку масса земли составляет 5,9 72 × 1024 кг, это будет означать 4360 миллионов гигатонн углерода. Это намного больше, чем количество углерода в океанах или атмосфере (ниже). В сочетании с кислородом в углекислом газе, углерод находится в атмосфере Земли (приблизительно 810 гигатонн углерода) и растворяется во всех водоемах (приблизительно 36000 гигатонн углерода). В биосфере присутствует около 1900 гигатонн углерода. Углеводороды (такие как уголь, нефть и природный газ) также содержат углерод. Угольные «резервы» (а не «ресурсы») составляют около 900 гигатонн с, возможно, 18 000 Гт ресурсов. Запасы нефти составляют около 150 гигатонн. Доказанные источники природного газа составляют около 175 1012 кубических метров (содержащих около 105 гигатонн углерода), однако в исследованиях оценивается еще 900 1012 кубических метров «нетрадиционных» месторождений, таких как сланцевый газ, что составляет около 540 гигатонн углерода. Углерод также был обнаружен в гидратах метана в полярных регионах и под морями. По разным оценкам, количество этого углерода составляет 500, 2500 Гт, или 3000 Гт 14). В прошлом, количество углеводородов было больше. Согласно одному источнику, в период с 1751 по 2008 годы около 347 гигатонн углерода было выброшено в атмосферу в виде углекислого газа в атмосферу от сжигания ископаемого топлива. Другой источник добавляет количество, добавленное в атмосферу в период с 1750 года до 879 Гт, а общее количество в атмосфере, море и земле (например, торфяные болота) составляет почти 2000 Гт 15). Углерод является составной частью (12% по массе) очень больших масс карбонатных пород (известняк, доломит, мрамор и т. д.). Уголь содержит очень большое количество углерода (антрацит содержит 92-98% углерода) и является крупнейшим коммерческим источником минерального углерода, на который приходится 4000 гигатонн или 80% ископаемого топлива. Что касается индивидуальных аллотропов углерода, графит содержится в больших количествах в Соединенных Штатах (в основном, в Нью-Йорке и Техасе), в России, Мексике, Гренландии и Индии.
Природные алмазы встречаются в горном кимберлите, содержащемся в древних вулканических «шеях» или «трубах». Большинство алмазных месторождений находится в Африке, особенно в Южной Африке, Намибии, Ботсване, Республике Конго и Сьерра-Леоне. Алмазные месторождения также обнаружены в Арканзасе, Канаде, Российской Арктике, Бразилии, а также в Северной и Западной Австралии. Теперь бриллианты также извлекают со дна океана у мыса Доброй Надежды. Алмазы встречаются естественным образом, но сейчас производится около 30% всех промышленных алмазов, используемых в США. Углерод-14 образуется в верхних слоях тропосферы и стратосферы на высотах 9-15 км в реакции, которая осаждается космическими лучами. 16) Производятся тепловые нейтроны, которые сталкиваются с ядрами азота-14, образуя углерод-14 и протон. Таким образом, 1,2 × 1010% атмосферного углекислого газа содержит углерод-14. [23] Астероиды, богатые углеродом, относительно преобладают во внешних частях пояса астероидов в нашей солнечной системе. Эти астероиды еще не были напрямую исследованы учеными. Астероиды могут использоваться в гипотетической угледобыче на основе космического пространства, что может быть возможно в будущем, но в настоящее время технологически невозможно.
Изотопы углерода
Изотопы углерода представляют собой атомные ядра, которые содержат шесть протонов плюс ряд нейтронов (от 2 до 16). У углерода есть два устойчивых, встречающихся в природе, изотопа. Изотоп углерод-12 (12С) образует 98,93% углерода на Земле, а углерод-13 (13С) образует оставшиеся 1,07%. Концентрация 12С еще больше увеличивается в биологических материалах, потому что биохимические реакции дискриминируют 13С. В 1961 году, Международный союз чистой и прикладной химии (ИЮПАК) принял изотопный углерод-12 в качестве основы для атомных весов. 17) Идентификация углерода в экспериментах с ядерным магнитным резонансом (ЯМР) проводится с изотопом 13С. Углерод-14 (14С) представляет собой природный радиоизотоп, созданный в верхней атмосфере (нижняя стратосфера и верхняя тропосфера) путем взаимодействия азота с космическими лучами. Он находится в следовых количествах на Земле в количестве до 1 части на триллион (0,0000000001%), в основном, в атмосфере и поверхностных отложениях, в частности, торфе и других органических материалах. Этот изотоп распадается в ходе β-эмиссии 0,158 МэВ. Из-за относительно короткого периода полураспада, 5730 лет, 14С практически отсутствует в древних скалах. В атмосфере и в живых организмах, количество 14С почти постоянное, но снижается в организмах после смерти.
Этот принцип используется в радиоуглеродном датировании, изобретенном в 1949 году, которое широко использовалось для определения возраста углеродистых материалов с возрастом до 40000 лет 18). Существует 15 известных изотопов углерода и наименьший срок жизни из них имеет 8C, который распадается за счет эмиссии протонов и альфа-распада и имеет период полураспада 1,98739 × 10-21 с. Экзотический 19C демонстрирует ядерный ореол, что означает, что его радиус значительно больше, чем можно было бы ожидать, если бы ядро было сферой постоянной плотности. 19)
Образование в звездах
Формирование атомного ядра углерода требует почти одновременного тройного столкновения альфа-частиц (ядер гелия) внутри ядра гигантской или сверхгигантской звезды, что известно как тройной альфа-процесс, поскольку продукты дальнейших реакций ядерного синтеза гелия с водородом или другим ядром гелия производят литий-5 и бериллий-8 соответственно, оба из которых очень неустойчивы и почти мгновенно затухают обратно в более мелкие ядра 20). Это происходит в условиях температур более 100 мегакальвин и концентрации гелия, что недопустимо в условиях быстрого расширения и охлаждения ранней Вселенной, и поэтому во время Большого взрыва не было создано значительных количеств углерода. Согласно современной теории физической космологии, углерод образуется внутри звезд в горизонтальной ветви путем столкновения и трансформации трех ядер гелия. Когда эти звезды умирают как сверхновая, углерод рассеивается в космос в виде пыли. Эта пыль становится составным материалом для образования звездных систем второго или третьего поколения с аккрецированными планетами. Солнечная система – одна из таких звездных систем с обилием углерода, позволяющая существование жизни, как мы ее знаем. Цикл CNO является дополнительным механизмом слияния, который управляет звездами, где углерод работает как катализатор. Ротационные переходы различных изотопических форм монооксида углерода (например, 12CO, 13CO и 18CO) обнаруживаются в субмиллиметровом диапазоне длин волн и используются при изучении новообразующихся звезд в молекулярных облаках 21).
Углеродный цикл
В земных условиях, конверсия одного элемента в другой – явление очень редкое. Поэтому количество углерода на Земле эффективно постоянное. Таким образом, в процессах, которые используют углерод, он должен получаться откуда-то и утилизироваться в другом месте. Пути углерода в окружающей среде образуют углеродный цикл. Например, фотосинтетические установки извлекают углекислый газ из атмосферы (или морской воды) и строят его в биомассу, как в цикле Кальвина, процессе фиксации углерода. Некоторая часть этой биомассы съедается животными, в то время как некоторая часть углерода выдыхается животными в виде двуокиси углерода. Цикл углерода значительно сложнее, чем этот короткий цикл; например, некоторое количество двуокиси углерода растворяется в океанах; если бактерии не поглощают его, мертвое растительное или животное вещество может стать нефтью или углем, которое выделяет углерод при сжигании. 22)
Соединения углерода
Углерод может образовывать очень длинные цепи взаимосвязанных углерод-углеродных связей, свойство, которое называется образованием цепочек. Углерод-углеродные связи устойчивы. Благодаря катанации (образованию цепочек), углерод образует бесчисленное количество соединений. Оценка уникальных соединений показывает, что большее количество из них содержат углерод. 23) Аналогичное утверждение может быть сделано для водорода, потому что большинство органических соединений также содержат водород. Простейшая форма органической молекулы представляет собой углеводород – большое семейство органических молекул, которые состоят из атомов водорода, связанных с цепочкой атомов углерода. Длина цепи, боковые цепи и функциональные группы влияют на свойства органических молекул. Углерод встречается во всех формах известной органической жизни и является основой органической химии. При объединении с водородом, углерод образует различные углеводороды, которые важны для промышленности как хладагенты, смазочные материалы, растворители, как химическое сырье для производства пластмасс и нефтепродуктов, а также как ископаемое топливо. В сочетании с кислородом и водородом, углерод может образовывать множество групп важных биологических соединений, включая сахара, лигнаны, хитины, спирты, жиры и ароматические сложные эфиры, каротиноиды и терпены. С азотом, углерод образует алкалоиды, а с добавлением серы также образует антибиотики, аминокислоты и резиновые изделия. С добавлением фосфора к этим другим элементам, он образует ДНК и РНК, носители химического кода жизни и аденозинтрифосфат (АТФ), самую важную молекулу переноса энергии во всех живых клетках.
Неорганические соединения
Обычно углеродсодержащие соединения, которые связаны с минералами или которые не содержат водорода или фтора, обрабатываются отдельно от классических органических соединений; это определение не является строгим. Среди них простые оксиды углерода. Наиболее известным оксидом является двуокись углерода (CO2). Когда-то это вещество было главной составляющей палеоатмосферы, но сегодня является второстепенным компонентом атмосферы Земли 24). При растворении в воде, это вещество образует углекислоту (H2CO3), но, как и большинство соединений с несколькими односвязными кислородами на одном углероде, оно неустойчиво. Однако, через это промежуточное вещество образуются резонансные стабилизированные карбонатные ионы. Некоторыми важными минералами являются карбонаты, особенно кальциты. Углерод дисульфид (CS2) аналогичен. Другим распространенным оксидом является окись углерода (СО). Она образуется при неполном сгорании и является бесцветным газом без запаха. Каждая молекула содержит тройную связь и является довольно полярной, что приводит к тому, что она постоянно связывается с молекулами гемоглобина, вытесняя кислород, который имеет более низкую аффинность связывания. 25) Цианид (CN-) имеет сходную структуру, но ведет себя подобно ионам галогенида (псевдогалоген). Например, он может образовывать молекулу нитрида цианогена (CN) 2), аналогичную диатомовым галогенидам. Другими необычными оксидами являются субоксид углерода (C3O2), неустойчивый монооксид углерода (C2O), 26) триоксид углерода (CO3), циклопентанпептон (C5O5), циклогексангексон (C6O6) и меллитовый ангидрид (C12O9). С реактивными металлами, такими как вольфрам, углерод образует либо карбиды (C4-), либо ацетилиды (C2-2) с образованием сплавов с высокими температурами плавления. Эти анионы также связаны с метаном и ацетиленом, оба из которых являются очень слабыми кислотами. При электроотрицательности 2,5, углерод предпочитает образовывать ковалентные связи. Несколько карбидов представляют собой ковалентные решетки, такие как карборунд (SiC), который напоминает алмаз. Тем не менее, даже самые полярные и солеобразные карбиды не являются полностью ионными соединениями 27).
Металлоорганические соединения
Органометаллические соединения, по определению, содержат, по меньшей мере, одну связь углерод-металл. Существует широкий спектр таких соединений; основные классы включают простые соединения алкил-металл (например, тетраэтилэлид), η2-алкеновые соединения (например, соль Zeise) и η3-аллильные соединения (например, димер хлорида аллилпалладия); металлоцены, содержащие циклопентадиенильные лиганды (например, ферроцен); и карбеновые комплексы переходных металлов. Существует много карбонилов металлов (например, тетракарбонилникель); некоторые работники считают, что лиганд монооксида углерода является чисто неорганическим, а не металлоорганическим, соединением. В то время как считается, что углерод исключительно образует четыре связи, сообщается об интересном соединении, содержащем октаэдрический гексакоординированный атом углерода. Катион этого соединения представляет собой [Ph3PAu) 6C] 2+. Это явление объясняется аурофильностью золотых лигандов. В 2016 году было подтверждено, что гексаметилбензол содержит атом углерода с шестью связями, а с не обычными четырьмя. 28)
История и этимология
Английское название углерода (carbon) происходит от латинского carbo, обозначающего «уголь» и «древесный уголь» 29), отсюда же и французское слово charbon, что означает «древесный уголь». На немецком, голландском и датском языках названия углерода – Kohlenstoff, koolstof и kulstof соответственно, все в буквальном смысле означают угольную субстанцию. Углерод был обнаружен в доисторических временах и был известен в формах сажи и древесного угля в самых ранних человеческих цивилизациях. Алмазы были известны, вероятно, уже в 2500 г. до н.э. в Китае, а углерод в виде древесного угля был изготовлен в римские времена путем той же химии, что и сегодня, путем нагрева древесины в пирамиде, покрытой глиной, чтобы исключить воздух.
В 1722 году Рене Антуан Ферхо де Реамур продемонстрировал, что железо превращается в сталь через поглощение какого-либо вещества, которое теперь известно как углерод. В 1772 году Антуан Лавуазье показал, что алмазы являются формой углерода; когда он сжигал образцы древесного угля и алмаза и обнаружил, что ни один из них не производил никакой воды, и что оба вещества выпускали равное количество углекислого газа на грамм. В 1779 году Карл Вильгельм Шееле показал, что графит, который считался формой свинца, вместо этого был идентичен древесному углю, но с небольшой примесью железа и что он давал «воздушную кислоту» (что является диоксидом углерода) при окислении азотной кислотой. 30)
В 1786 году французские ученые Клод Луи Бертолле, Гаспард Мондж и К. А. Вандермонд подтвердили, что графит, в основном, был углеродом, при окислении его в кислороде почти так же, как Лавуазье делал с алмазом.
Некоторое количество железа снова оставалось, что, по мнению французских ученых, было необходимо для структуры графита. В своей публикации они предложили название carbone (латинское слово carbonum) для элемента в графите, который выделялся как газ при сжигании графита. Затем Антуан Лавуазье перечислил углерод как элемент в своем учебнике 1789 года. Новый аллотроп углерода, фуллерен, который был обнаружен в 1985 году, включает наноструктурные формы, такие как баккиболы и нанотрубки. Их первооткрыватели – Роберт Керл, Гарольд Крото и Ричард Смолли – получили Нобелевскую премию по химии в 1996 году. 31) Возникший в результате возобновленный интерес к новым формам приводит к открытию дополнительных экзотических аллотропов, включая стеклообразный углерод, и осознанию того, что «аморфный углерод» не является строго аморфным.
Производство
Графит
Коммерчески жизнеспособные природные отложения графита встречаются во многих частях мира, но наиболее экономически важные источники находятся в Китае, Индии, Бразилии и Северной Корее. Графитовые отложения имеют метаморфическое происхождение, обнаруженное в сочетании с кварцем, слюдой и полевыми шпатами в сланцах, гнейсах и метаморфизованных песчаниках и известняках в виде линз или жил, иногда толщиной в несколько метров или более. Запасы графита в Борроудейл, Камберленд, Англия, были вначале достаточного размера и чистоты, поэтому до 19-го века карандаши делались просто путем распиливания блоков из натурального графита на полоски перед обклеиванием полос в древесине. Сегодня меньшие отложения графита получают путем измельчения родительской породы и плавания более легкого графита на воде. 32) Существует три типа натурального графита – аморфный, чешуйчатый или кристаллический.
Аморфный графит имеет самое низкое качество и является наиболее распространенным. В отличие от науки, в промышленности «аморфный» относится к очень маленькому размеру кристалла, а не к полному отсутствию кристаллической структуры. Слово «аморфный» используется для обозначения продуктов с низким количеством графита и является самым дешевым графитом. Крупные месторождения аморфного графита находятся в Китае, Европе, Мексике и США. Плоский графит реже встречается и имеет более высокое качество, чем аморфный; он выглядит как отдельные пластины, которые кристаллизуются в метаморфических породах. Цена гранулированного графита может в четыре раза превышать цену аморфного. Чешуйчатый графит хорошего качества может быть переработан в расширяемый графит для многих применений, таких как антипирены.
Первичные месторождения графита находятся в Австрии, Бразилии, Канаде, Китае, Германии и на Мадагаскаре. Жидкий или кусковой графит – самый редкий, самый ценный и высококачественный тип природного графита. Он находится в жилах вдоль интрузивных контактов в твердых кусках, и коммерчески добывается только в Шри-Ланке. Согласно USGS, мировое производство природного графита в 2010 году составило 1,1 миллиона тонн, при этом в Китае было добыто 800 000 тонн, в Индии – 130 000 т, в Бразилии – 76 000 т, в Северной Корее – 30 000 т и в Канаде – 25 000 т. Никакого природного графита не было добыто в Соединенных Штатах, но в 2009 году было добыто 118 000 т синтетического графита с оценочной стоимостью 998 млн. долл. США.
Алмаз
Поставки алмазов контролируются ограниченным числом бизнесов, а также высоко концентрируются в небольшом количестве мест по всему миру. Только очень небольшая доля алмазной руды состоит из реальных алмазов. Руда измельчается, во время чего необходимо принять меры для предотвращения разрушения крупных алмазов в этом процессе, а затем частицы сортируются по плотности. Сегодня алмазы добывают во фракции богатой алмазами с помощью рентгеновской флуоресценции, после чего последние шаги сортировки выполняются вручную. До распространения использования рентгеновских лучей, разделение проводилось с помощью смазочных лент; известно, что алмазы были обнаружены только в аллювиальных отложениях на юге Индии. Известно, что алмазы более склонны прилипать к массе, чем другие минералы в руде. Индия была лидером в производстве алмазов с момента их открытия примерно в IX веке до нашей эры до середины 18 века нашей эры, но коммерческий потенциал этих источников был исчерпан к концу 18 века, и к тому времени Индия была затомлена Бразилией, где первые алмазы были найдены в 1725 году. 33)
Алмазное производство первичных месторождений (кимберлитов и лампроитов) началось только в 1870-х годах, после открытия алмазных месторождений в Южной Африке.
Производство алмазов увеличивалось с течением времени, и с этой даты было накоплено всего 4,5 млрд каратов. Около 20% от этого количества было добыто только за последние 5 лет, и в течение последних десяти лет начали производство 9 новых месторождений, и еще 4 ждут скорого открытия.
Большинство из этих месторождений находятся в Канаде, Зимбабве, Анголе и одно – в России. 34) В Соединенных Штатах, алмазы были обнаружены в Арканзасе, Колорадо и Монтане. 35) В 2004 году поразительное открытие микроскопического алмаза в Соединенных Штатах привело к выпуску в январе 2008 года массового отбора проб кимберлитовых труб в отдаленной части Монтаны. Сегодня большинство коммерчески жизнеспособных алмазных месторождений находятся в России, Ботсване, Австралии и Демократической Республике Конго. В 2005 году, Россия произвела почти одну пятую мирового запаса алмазов, по сообщению Британской Геологической Службы. В Австралии самая богатая диамантированная труба достигла пиковых уровней производства в 42 метрических тонны (41 тонна, 46 коротких тонн) в год в 1990-х годах.
Существуют также коммерческие месторождения, активные добычи которых осуществляются на Северо-Западных территориях Канады, Сибири (в основном, на территории Якутии, например, в Трубе «Мир» и в Удачной трубе), в Бразилии, а также в Северной и Западной Австралии.
Применения
Углерод необходим для всех известных живых систем. Без него невозможно существование жизни, такой, как мы ее знаем. Основное экономическое использование углерода, кроме продуктов питания и древесины, относится к углеводородам, в первую очередь, к ископаемому топливу метановому газу и сырой нефти. Сырая нефть перерабатывается нефтеперерабатывающими заводами для производства бензина, керосина и других продуктов. Целлюлоза представляет собой природный углеродсодержащий полимер, производимый растениями в виде дерева, хлопка, льна и конопли. Целлюлоза используется, в основном, для поддержания структуры растений. Коммерчески ценные углеродные полимеры животного происхождения включают шерсть, кашемир и шелк. Пластмассы изготавливают из синтетических углеродных полимеров, часто с атомами кислорода и азота, включенными через регулярные интервалы в основную полимерную цепь. Сырье для многих из этих синтетических веществ поступает из сырой нефти. Использование углерода и его соединений чрезвычайно разнообразно. Углерод может образовывать сплавы с железом, наиболее распространенным из которых является углеродистая сталь. Графит сочетается с глинами, образуя «свинец», используемый в карандашах, используемых для письма и рисования. Он также используется в качестве смазки и пигмента в качестве формовочного материала при производстве стекла, в электродах для сухих батарей и гальванизации и гальванопластики, в щетках для электродвигателей и в качестве замедлителя нейтронов в ядерных реакторах. Уголь используется как материал для изготовления произведений искусства, в качестве гриля для барбекю, для выплавки железа и имеет множество других применений. Древесина, уголь и нефть используются в качестве топлива для производства энергии и для отопления. Алмазы высокого качества используются в производстве ювелирных изделий, а промышленные алмазы используются для сверления, резки и полировки инструментов для обработки металлов и камня. Пластмассы изготавливаются из ископаемых углеводородов, а углеродное волокно, изготовленное путем пиролиза синтетических полиэфирных волокон, используется для армирования пластмасс с образованием передовых, легких композиционных материалов. Углеродное волокно изготавливается путем пиролиза экструдированных и растянутых нитей полиакрилонитрила (PAN) и других органических веществ. Кристаллическая структура и механические свойства волокна зависят от типа исходного материала и последующей обработки. Углеродные волокна, изготовленные из PAN, имеют структуру, напоминающую узкие нити графита, но термическая обработка может переупорядочить структуру в непрерывный лист. В результате, волокна имеют более высокую удельную прочность на растяжение, чем сталь. 36) Углеродная сажа используется в качестве черного пигмента в печатных красках, масляной краске и акварелях художников, углеродной бумаге, автомобильной отделке, чернилах и лазерных принтерах. Углеродная сажа также используется в качестве наполнителя в резиновых изделиях, таких как шины и в пластмассовых соединениях. Активированный уголь используется в качестве абсорбента и адсорбента в фильтровальных материалах в таких разнообразных применениях, как противогазы, очистка воды и кухонные вытяжки, а также в медицине для поглощения токсинов, ядов или газов из пищеварительной системы. Углерод используется при химическом восстановлении при высоких температурах. Кокс используется для восстановления железной руды в железе (плавка). Затвердевание стали достигается за счет нагрева готовых стальных компонентов в углеродном порошке. Карбиды кремния, вольфрама, бора и титана входят в число самых твердых материалов и используются в качестве абразивов для резки и шлифования. Углеродные соединения составляют большую часть материалов, используемых в одежде, таких как натуральный и синтетический текстиль и кожа, а также почти все внутренние поверхности в среде, отличной от стекла, камня и металла.
Бриллианты
Алмазная промышленность подразделяется на две категории, одна из которых – алмазы высокого качества (драгоценные камни), а другая – алмазы промышленного класса. Хотя существует большая торговля обоими типами алмазов, оба рынка действуют совершенно по-разному.
В отличие от драгоценных металлов, таких как золото или платина, бриллианты драгоценных камней не торгуются как товар: в продаже алмазов имеется существенная надбавка, и рынок перепродажи алмазов не очень активен.
Промышленные алмазы ценятся, в основном, за их твердость и теплопроводность, при этом геммологические качества ясности и цвета, в основном, неактуальны. Около 80% добытых алмазов (равно примерно 100 млн каратов или 20 тонн в год) непригодны для использования, и используются в промышленности (алмазный лом). Синтетические алмазы, изобретенные в 1950-х годах, почти сразу нашли промышленные применения; Ежегодно производится 3 млрд каратов (600 тонн) синтетических алмазов. 37)
Доминирующим промышленным использованием алмаза является резка, сверление, шлифовка и полировка. Большинство этих применений не требуют больших алмазов; на самом деле, большинство алмазов драгоценного качества, за исключением алмазов небольшого размера, могут использоваться в промышленности. Алмазы вставляются в наконечники сверл или пильные диски или измельчаются в порошок для использования в шлифовании и полировке. Специализированные применения включают использование в лабораториях в качестве хранилища для экспериментов высокого давления, высокопроизводительных подшипников и ограниченное использование в специализированных окнах. Благодаря достижениям в области производства синтетических алмазов, новые применения становятся практически осуществимыми. Большое внимание уделяется возможному использованию алмаза в качестве полупроводника, подходящего для микрочипов, и из-за его исключительной теплопроводности в качестве радиатора в электронике. 38)
Меры предосторожности
Чистый углерод обладает чрезвычайно низкой токсичностью для людей и может обрабатываться без риска для здоровья и даже безопасно поступать в организм в виде графита или древесного угля. Он устойчив к растворению или химическому воздействию даже в кислом содержимом пищеварительного тракта. Следовательно, как только он проникает в ткани организма, он, вероятно, останется там неопределенно долго. Углеродная сажа была, вероятно, одним из первых пигментов, которые можно было использовать для татуировки, и на Этци — ледяной мумии человека эпохи халколита, были обнаружены углеродные татуировки, которые сохранились в течение его жизни и в течение 5200 лет после его смерти. Вдыхание угольной пыли или сажи в больших количествах может быть опасным, раздражать легкие и вызывать застойное заболевание легких, пневмокониоз работников угольной промышленности. Алмазная пыль, используемая в качестве абразива, может нанести вред при попадании внутрь или вдыхании. Микрочастицы углерода образуются в выхлопных газах дизельных двигателей и могут накапливаться в легких 39). В этих примерах, вред может быть вызван загрязняющими веществами (например, органическими химическими веществами, тяжелыми металлами), а не самим углеродом.
Углерод обычно имеет низкую токсичность для жизни на Земле; но углеродные наночастицы смертельно опасны для дрозофилы.
Углерод может энергично и ярко гореть в присутствии воздуха при высоких температурах. Большие скопления угля, которые оставались инертными в течение сотен миллионов лет в отсутствие кислорода, могут спонтанно сжигаться при воздействии воздуха в угольных отходах, судовых грузовых трюмах и угольных бункерах 40) и хранилищах.
В ядерных приложениях, где графит используется как замедлитель нейтронов, может произойти накопление энергии Вигнера, сопровождаемое внезапным, спонтанным высвобождением углерода. Нагревание до, по крайней мере, 250°C, может безопасно высвобождать энергию, хотя при аварии в Уиндскейле процедура пошла не так, в результате чего сгорели другие реакторные материалы.
Большое разнообразие углеродных соединений включает такие летальные яды, как тетродотоксин, лектин рицин из семян растения касторового масла Ricinus communis, цианид (CN-) и монооксид углерода; и такие основные части жизни, как глюкоза и белок.
:Tags
Список использованной литературы:
1)
«Carbon – Naturally occurring isotopes». WebElements Periodic Table. Retrieved 2008-10-09
2)
«Biological Abundance of Elements». The Internet Encyclopedia of Science. Retrieved 2008-10-09.
3)
Deming, Anna (2010). «King of the elements?». Nanotechnology. 21. doi:10.1088/0957-4484/21/30/300201. Retrieved 15 November 2016.
4)
Zazula, J. M. (1997). «On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam» (PDF). CERN. Retrieved 2009-06-06.
5)
Irifune, Tetsuo; Kurio, Ayako; Sakamoto, Shizue; Inoue, Toru; Sumiya, Hitoshi (2003). «Materials: Ultrahard polycrystalline diamond from graphite». Nature. 421 (6923): 599–600. Bibcode:2003Natur.421..599I. PMID 12571587. doi:10.1038/421599b
6)
Delhaes, P. (2001). Graphite and Precursors. CRC Press. ISBN 90-5699-228-7
7)
Ebbesen, T. W., ed. (1997). Carbon nanotubes—preparation and properties. Boca Raton, Florida: CRC Press. ISBN 0-8493-9602-6.

Harris, PJF (2004). «Fullerene-related structure of commercial glassy carbons» (PDF). Philosophical Magazine. 84 (29): 3159–3167. Bibcode:2004PMag…84.3159H. doi:10.1080/14786430410001720363
9)
Lee, C.; Wei, X.; Kysar, J. W.; Hone, J. (2008). «Measurement of the Elastic Properties and Intrinsic Strength of Monolayer Graphene». Science. 321 (5887): 385–8. Bibcode:2008Sci…321..385L. PMID 18635798. doi:10.1126/science.1157996. Lay summary
10)
Jenkins, Edgar (1973). The polymorphism of elements and compounds. Taylor & Francis. p. 30. ISBN 0-423-87500-0. Retrieved 2011-05-01
11)
Schewe, Phil & Stein, Ben (March 26, 2004). «Carbon Nanofoam is the World's First Pure Carbon Magnet». Physics News Update. 678 (1).
12)
«Online Database Tracks Organic Nano-Particles Across the Universe». Sci Tech Daily. February 24, 2014. Retrieved 2015-03-10.
13)
William F McDonough The composition of the Earth in Earthquake Thermodynamics and Phase Transformation in the Earth's Interior. 2000. ISBN 978-0126851854.
14)
«Ice on fire: The next fossil fuel» by Fred Pearce, New Scientist, 27 June 2009, pp. 30-33.
15)
Rachel Gross (Sep 21, 2013). «Deep, and dank mysterious». New Scientist: 40–43.
16)
«Carbon-14 formation». Retrieved 13 October 2014.
17)
«Official SI Unit definitions». Retrieved 2007-12-21.
18)
Libby, W. F. (1952). Radiocarbon dating. Chicago University Press and references therein.
19)
Watson, A. (1999). «Beaming Into the Dark Corners of the Nuclear Kitchen». Science. 286 (5437): 28–31. doi:10.1126/science.286.5437.28
20)
Audi, G.; Bersillon, O.; Blachot, J.; Wapstra, A. H. (1997). «The Nubase evaluation of nuclear and decay properties» (PDF). Nuclear Physics A. 624: 1–124. Bibcode:1997NuPhA.624….1A. doi:10.1016/S0375-9474(97)00482-X
21)
Pikelʹner, Solomon Borisovich (1977). Star formation. Springer. pp. 38–. ISBN 978-90-277-0796-3. Retrieved 2011-06-06
22)
Smith, T. M.; Cramer, W. P.; Dixon, R. K.; Leemans, R.; Neilson, R. P.; Solomon, A. M. (1993). «The global terrestrial carbon cycle». Water, Air, & Soil Pollution. 70: 19–37. doi:10.1007/BF01104986
23)
Burrows, A.; Holman, J.; Parsons, A.; Pilling, G.; Price, G. (2017). Chemistry3: Introducing Inorganic, Organic and Physical Chemistry. Oxford University Press. p. 70. ISBN 978-0-19-873380-5. Retrieved 2017-05-07
24)
Levine, Joel S.; Augustsson, Tommy R.; Natarajan, Murali (1982). «The prebiological paleoatmosphere: stability and composition». Origins of Life and Evolution of Biospheres. 12 (3): 245–259. Bibcode:1982OrLi…12..245L. doi:10.1007/BF00926894
25)
Gorman, D.; Drewry, A.; Huang, Y. L.; Sames, C. (2003). «The clinical toxicology of carbon monoxide». Toxicology. 187 (1): 25–38. PMID 12679050. doi:10.1016/S0300-483X(03)00005-2
26)
Anderson D. J.; Rosenfeld, R. N. (1991). «Photodissociation of Carbon Suboxide». Journal of Chemical Physics. 94 (12): 7852–7867. Bibcode:1991JChPh..94.7857A. doi:10.1063/1.460121
27)
Greenwood and Earnshaw, pp. 297–301
28)
Ritter, Stephen K. «Six bonds to carbon: Confirmed». Chemical & Engineering News
29)
Shorter Oxford English Dictionary, Oxford University Press
30)
Senese, Fred. «Who discovered carbon?». Frostburg State University. Retrieved 2007-11-24.
31)
«The Nobel Prize in Chemistry 1996 «for their discovery of fullerenes»». Retrieved 2007-12-21.
32)
USGS Minerals Yearbook: Graphite, 2009 and Graphite: Mineral Commodity Summaries 2011
33)
Hershey, J. W. (1940). The Book Of Diamonds: Their Curious Lore, Properties, Tests And Synthetic Manufacture. Kessinger Pub Co. p. 28. ISBN 1-4179-7715-9.
34)
Janse, A. J. A. (2007). «Global Rough Diamond Production Since 1870». Gems and Gemology. GIA. XLIII (Summer 2007): 98–119. doi:10.5741/GEMS.43.2.98
35)
«Microscopic diamond found in Montana». The Montana Standard. 2004-10-17. Archived from the original on 2005-01-21. Retrieved 2008-10-10.
36)
Cantwell, W. J.; Morton, J. (1991). «The impact resistance of composite materials – a review». Composites. 22 (5): 347–62. doi:10.1016/0010-4361(91)90549-V
37)
«Industrial Diamonds Statistics and Information». United States Geological Survey. Retrieved 2009-05-05.
38)
Sakamoto, M.; Endriz, J. G.; Scifres, D. R. (1992). «120 W CW output power from monolithic AlGaAs (800 nm) laser diode array mounted on diamond heatsink». Electronics Letters. 28 (2): 197–199. doi:10.1049/el:19920123
39)
Dorfer, Leopold; Moser, M.; Spindler, K.; Bahr, F.; Egarter-Vigl, E.; Dohr, G. (1998). «5200-year old acupuncture in Central Europe?». Science. 282 (5387): 242–243. Bibcode:1998Sci…282..239D. PMID 9841386. doi:10.1126/science.282.5387.239f
40)
McSherry, Patrick. «Coal bunker Fire». www.spanamwar.com. Retrieved 2016-04-06.
Характеристика углерода. Свойства простых веществ и соединений

Физические свойства: углерод образует множество аллотропных модификаций: алмаз – одно из самых твердых веществ, графит, уголь, сажа.
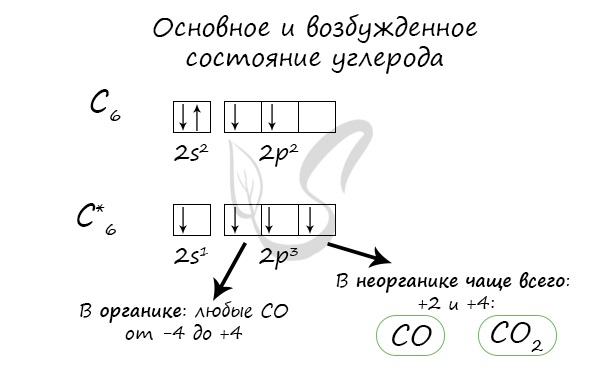
Атом углерода имеет 6 электронов: 1s22s22p2. Последние два электрона располагаются на отдельных р-орбиталях и являются неспаренными. В принципе, эта пара могла бы занимать одну орбиталь, но в таком случае сильно возрастает межэлектронное отталкивание. По этой причине один из них занимает 2рх, а другой, либо 2ру, либо 2рz-орбитали.

Это явление, как известно, называют sp3-гибридизацией, а возникающие функции – sp3-гибридными. Образование четырех sp3-cвязeй обеспечивает атому углерода более устойчивое состояние, чем три р—р- и одна s—s-связи. Помимо sp3-гибридизации у атома углерода наблюдается также sp2— и sp-гибридизация. В первом случае возникает взаимное наложение s- и двух р-орбиталей. Образуются три равнозначные sp2— гибридных орбитали, расположенные в одной плоскости под углом 120° друг к другу. Третья орбиталь р неизменна и направлена перпендикулярно плоскости sp2.
При sp-гибридизации происходит наложение орбиталей s и р. Между двумя образующимися равноценными гибридными орбиталями возникает угол 180°, при этом две р-орбитали у каждого из атомов остаются неизменными.
Аллотрорпия углерода. Алмаз и графит
В кристалле графита атомы углерода расположены в параллельных плоскостях, занимая в них вершины правильных шестиугольников. Каждый из атомов углерода связан с тремя соседними sp2-гибридными связями. Между параллельными плоскостями связь осуществляется за счет ван-дер-ваальсовых сил. Свободные р-орбитали каждого из атомов направлены перпендикулярно плоскостям ковалентных связей. Их перекрыванием объясняется дополнительная π-связь между атомами углерода. Таким образом, от валентного состояния, в котором находятся атомы углерода в веществе, зависят свойства этого вещества.
Химические свойства углерода
Наиболее характерные степени окисления: +4, +2.
При низких температурах углерод инертен, но при нагревании его активность возрастает.
Углерод как восстановитель:
— с кислородом
C0 + O2 –t°= CO2 углекислый газ
при недостатке кислорода — неполное сгорание:
2C0 + O2 –t°= 2C+2O угарный газ
— со фтором
С + 2F2 = CF4
— с водяным паром
C0 + H2O –1200°= С+2O + H2 водяной газ
— с оксидами металлов. Таким образом выплавляют металл из руды.
C0 + 2CuO –t°= 2Cu + C+4O2
— с кислотами – окислителями:
C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
— с серой образует сероуглерод:
С + 2S2 = СS2.
Углерод как окислитель:
— с некоторыми металлами образует карбиды
4Al + 3C0 = Al4C3
Ca + 2C0 = CaC2-4
— с водородом — метан (а также огромное количество органических соединений)
C0 + 2H2 = CH4
— с кремнием, образует карборунд (при 2000 °C в электропечи):
Si + C = SiC.
Нахождение углерода в природе
Ссвободный углерод встречается в виде алмаза и графита. В виде соединений углерод находится в составе минералов: мела, мрамора, известняка – СаСО3, доломита – MgCO3*CaCO3; гидрокарбонатов – Mg(НCO3)2 и Са(НCO3)2, СО2 входит в состав воздуха; углерод является главной составной частью природных органических соединений – газа, нефти, каменного угля, торфа, входит в состав органических веществ, белков, жиров, углеводов, аминокислот, входящих в состав живых организмов.
Неорганические соединения углерода
Ни ионы С4+ , ни С4- ‑ ни при каких обычных химических процессах не образуются: в соединениях углерода имеются ковалентные связи различной полярности.
Оксид углерода (II) СО
Угарный газ; бесцветный, без запаха, малорастворим в воде, растворим в органических растворителях, ядовит, t°кип = -192°C; t пл. = -205°C.
Получение
1) В промышленности (в газогенераторах):
C + O2 = CO2
CO2 + C = 2CO
2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH = H2O + CO
H2C2O4 = CO + CO2 + H2O
Химические свойства
При обычных условиях CO инертен; при нагревании – восстановитель; несолеобразующий оксид.
1) с кислородом
2C+2O + O2 = 2C+4O2
2) с оксидами металлов
C+2O + CuO = Сu + C+4O2
3) с хлором (на свету)
CO + Cl2 –hn= COCl2(фосген)
4) реагирует с расплавами щелочей (под давлением)
CO + NaOH = HCOONa (формиат натрия)
5) с переходными металлами образует карбонилы
Ni + 4CO –t°= Ni(CO)4
Fe + 5CO –t°= Fe(CO)5
Оксид углерода (IV) СO2
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение.
Получение
- Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка:
CaCO3 –t°= CaO + CO2
- Действием сильных кислот на карбонаты и гидрокарбонаты:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
NaHCO3 + HCl = NaCl + H2O + CO2
Химические свойства СO2
Кислотный оксид: реагирует с основными оксидами и основаниями, образуя соли угольной кислоты
Na2O + CO2 = Na2CO3
2NaOH + CO2 = Na2CO3 + H2O
NaOH + CO2 = NaHCO3
При повышенной температуре может проявлять окислительные свойства
С+4O2 + 2Mg –t°= 2Mg+2O + C0
Качественная реакция
Помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3¯(белый осадок) + H2O
Оно исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + H2O + CO2 = Сa(HCO3)2
Угольная кислота и её соли
H2CO3 — Кислота слабая, существует только в водном растворе:
CO2 + H2O ↔ H2CO3
Двухосновная:
H2CO3 ↔ H+ + HCO3— Кислые соли — бикарбонаты, гидрокарбонаты
HCO3— ↔ H+ + CO32- Cредние соли — карбонаты
Характерны все свойства кислот.
Карбонаты и гидрокарбонаты могут превращаться друг в друга:
2NaHCO3 –t°= Na2CO3 + H2O + CO2
Na2CO3 + H2O + CO2 = 2NaHCO3
Карбонаты металлов (кроме щелочных металлов) при нагревании декарбоксилируются с образованием оксида:
CuCO3 –t°= CuO + CO2
Качественная реакция — «вскипание» при действии сильной кислоты:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
CO32- + 2H+ = H2O + CO2
Карбиды
Карбид кальция:
CaO + 3 C = CaC2 + CO
CaC2 + 2 H2O = Ca(OH)2 + C2H2 .
Ацетилен выделяется при реакции с водой карбидов цинка, кадмия, лантана и церия:
2 LaC2 + 6 H2O = 2La(OH)3 + 2 C2H2 + H2.
Be2C и Al4C3 разлагаются водой с образованием метана:
Al4C3 + 12 H2O = 4 Al(OH)3 = 3 CH4.
В технике применяют карбиды титана TiC, вольфрама W2C (твердые сплавы), кремния SiC (карборунд – в качестве абразива и материала для нагревателей).
Цианиды
получают при нагревании соды в атмосфере аммиака и угарного газа:
Na2CO3 + 2 NH3 + 3 CO = 2 NaCN + 2 H2O + H2 + 2 CO2
Синильная кислота HCN – важный продукт химической промышленности, широко применяется в органическом синтезе. Ее мировое производство достигает 200 тыс. т в год. Электронное строение цианид-аниона аналогично оксиду углерода (II), такие частицы называют изоэлектронными:
C=O: [:C=N:]–
Цианиды (0,1-0,2%-ный водный раствор) применяют при добыче золота:
2 Au + 4 KCN + H2O + 0,5 O2 = 2 K[Au(CN)2] + 2 KOH.
При кипячении растворов цианидов с серой или сплавлении твердых веществ образуются роданиды:
KCN + S = KSCN.
При нагревании цианидов малоактивных металлов получается дициан: Hg(CN)2 = Hg + (CN)2. Растворы цианидов окисляются до цианатов:
2 KCN + O2 = 2 KOCN.
Циановая кислота существует в двух формах:
H-N=C=O; H-O-C=N:
В 1828 г. Фридрих Вёлер (1800-1882) получил из цианата аммония мочевину: NH4OCN = CO(NH2)2 при упаривании водного раствора.
Это событие обычно рассматривается как победа синтетической химии над «виталистической теорией».
Существует изомер циановой кислоты – гремучая кислота
H-O-N=C.
Ее соли (гремучая ртуть Hg(ONC)2) используются в ударных воспламенителях.
Синтез мочевины (карбамида):
CO2 + 2 NH3 = CO(NH2)2 + H2O. При 1300С и 100 атм.
Мочевина является амидом угольной кислоты, существует и ее «азотный аналог» – гуанидин.
Карбонаты
Важнейшие неорганические соединения углерода – соли угольной кислоты (карбонаты). H2CO3 – слабая кислота (К1 =1,3·10-4; К2 =5·10-11). Карбонатный буфер поддерживает углекислотное равновесие в атмосфере. Мировой океан обладает огромной буферной емкостью, потому что он является открытой системой. Основная буферная реакция – равновесие при диссоциации угольной кислоты:
H2CO3 ↔ H+ + HCO3— .
При понижении кислотности происходит дополнительное поглощение углекислого газа из атмосферы с образованием кислоты:
CO2 + H2O ↔ H2CO3 .
При повышении кислотности происходит растворение карбонатных пород (раковины, меловые и известняковые отложения в океане); этим компенсируется убыль гидрокарбонатных ионов:
H+ + CO32-↔ HCO3—
CaCO3(тв.) ↔ Ca2+ + CO32-
Твердые карбонаты переходят в растворимые гидрокарбонаты. Именно этот процесс химического растворения избыточного углекислого газа противодействует «парниковому эффекту» – глобальному потеплению из-за поглощения углекислым газом теплового излучения Земли. Примерно треть мирового производства соды (карбонат натрия Na2CO3) используется в производстве стекла.
Содержание:
- Углерод и его соединения
- Химические свойства углерода
- Оксиды углерода
Соединения углерода весьма распространены: все живые организмы, каменный уголь, торф, нефть и др. содержат углерод. Углерод входит в состав многих неорганических веществ (известняк, мел, мрамор и др). ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА. Углерод — малоактивен, на холоде реагирует только со фтором; химическая активность проявляется при высоких температурах.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Углерод и его соединения
Охарактеризуйте углерод по его месту в Периодической системе. Назовите соединения углерода и валентность углерода в этих соединениях.
Углерод в виде угля, копоти, сажи известен человечеству с незапамятных времен. Элементарная природа углерода была установлена А. Лавуазье в конце 1780-х годов. Свое название элемент получил в 1824 г., в переводе с латинского оно означает «уголь».
Положение в периодической системе. Углерод – элемент 2-го периода главной подгруппы IV группы (IVА), атомный номер 6, относительная атомная масса 12, в ядре атома содержится 6 протонов и 6 нейтронов 
Строение атома. Электронная конфигурация атома углерода: 
Валентные электроны (II, IV) размещены по орбиталям:
При возбуждении один электрон переходит с 2s-подуровня на 2p-подуровень. Поэтому в основном состоянии атом углерода двухвалентен (CО), а в возбужденном состоянии – четырехвалентен
Нахождение в природе. Углерод входит в состав всех живых организмов. В свободном состоянии углерод встречается в виде алмаза, графита и карбина (аллотропные видоизменения, рис. 69). Природные соединения углерода – доломит 


В свободном виде углерод не токсичен, а вот многие его соединения обладают значительной токсичностью.
Аллотропные видоизменения углерода характеризуются различным строением кристаллических решеток. Этим и объясняется резкое различие их физических свойств.
Физические свойства. Алмаз – самое твердое природное соединение на Земле. Это прозрачное, бесцветное, кристаллическое вещество, имеет тетраэдрическое строение, не электропроводен.
Графит – мягкий, непрозрачный, серого цвета, маслянистый и блестящий (рис. 68). Графит при температуре 2000оС и низком давлении превращается в карбин.
В последние годы открыли еще одну форму – фуллерен. У него структура‚ как у футбольного мяча.
К этим разновидностям можно прибавить аморфный углерод, простейшим представителем которого является древесный уголь. При сухой перегонке древесины образуется древесный уголь, у которого сильно выражена способность к адсорбции (поглощение на поверхности) газов, паров и растворенных веществ.
Получение. Сажа – аморфный углерод, продукт неполного сгорания углеводорода. Кокс – твердое искусственное топливо, продукт термической обработки каменного угля.
Запомни! Площадь поверхности активированного угля массой 1 г составляет 800 м2, поэтому он обладает повышенной адсорбционной способностью. Адсорбент — это вещество, способное поглощать на своей поверхности газы и жидкости. Таблетки активированного угля применяют для подготовки желудочно-кишечного тракта к рентгеновскому обследованию и УЗИ; для очистки спирта. Активированный уголь не поглощает угарный газ (СО).
Аллотропные видоизменения углерода.
Химические свойства углерода
Углерод может вступать в реакцию со многими простыми и сложными веществами (схема 9).
Далее приводятся некоторые уравнения реакций с простыми веществами:
1) а) при неполном сгорании углерода:
б) при полном сгорании углерода в избытке кислорода:
2) углерод при освещении соединяется с хлором:
3) с металлами образуются карбиды:
4) с серой образуется сероуглерод:
Сероуглерод применяется для получения вискозного волокна и как растворитель;
5) с водородом образуется метан:
Метан – газообразное топливо (основа природного газа).
Углерод также взаимодействует со сложными веществами:
1) с водой образуется водяной газ, который является ценным топливом.
Именно поэтому уголь смачивают водой, когда топят печь.
2) Углерод с углекислым газом образует оксид углерода (II).
3) С оксидами железа (этот процесс происходит в доменной печи). Углерод выделяет железо в свободном состоянии:
Применение. Алмаз используют для резки стекла, изготовления наконечников буровых установок. Из ограненного алмаза делают великолепные
Графит применяют для изготовления электродов, а также грифелей карандашей. Кокс (С) получают при сухой перегонке (нагревание без доступа воздуха). Используется в производстве металлов как восстановитель. Адсорбционная способность активированного угля находит применение в медицине, а также в противогазах (рис. 69).
Фуллерены – это наночастицы, имеющие очень ценные особенности.
Каждая молекула содержит 60 атомов углерода, упорядоченных в виде пяти и шестиугольников и позволяет изготавливать кристаллы, которые применяются в электронике, в компьютерах.
Практическая работа №6
Физические и химические свойства углерода
Цель: Знать условия образования диоксида и монооксида углерода при сжигании углерода.
Ход работы
Опыт 1. изучение древесного угля
1. В коническую колбу налейте водный раствор какой-нибудь краски.
2. Всыпьте в раствор 0,3–0,5 г мелко истолченного древесного угля, взболтайте содержимое в течение 2–3 минут.
3. Отфильтруйте, наблюдайте исчезновение окраски.
Опыт 2. Восстановительные свойства угля.
1. Примерно одинаковые по массе порции оксида меди (II) и измельченного древесного угля перемешать на листе бумаги.
2. Смесь пересыпьте в сухую пробирку, укрепите горизонтально в штативе.
3. Закройте пробирку пробкой с газоотводной трубкой, изогнутой под прямым углом.
4. Конец трубки опустите в раствор известковой воды.
5. Пробирку сильно нагрейте до прекращения выделения газа.
6. Дайте пробирке остыть, отметьте цвет содержимого.
Вопросы и задания
1. Как изменился цвет раствора красителя? Дайте объяснения.
2. Напишите уравнения реакций опыта №2.
3. Каким химическим свойством обладает углерод?
Оксиды углерода
Какие оксиды углерода вы знаете? К каким оксидам они относятся? Какой из оксидов углерода (II, IV) тяжелее воздуха?
Углерод образует два оксида: угарный газ СО и углекислый газ 
Оксид углерода (II) – угарный газ СО.
Впервые он был получен французским химиком Жаком де Лассаном в 1776 году при нагревании оксида цинка с углем.
Нахождение в природе. В естественных условиях, на поверхности Земли, СО образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, например, при лесных и степных пожарах.
В атмосфере СО является продуктом ряда реакций с участием метана и других углеводородов. Основным антропогенным источником СО служат выхлопные газы двигателей внутреннего сгорания.
Получение:
Физические свойства. Оксид углерода (II) – бесцветный, плохо растворимый в воде ядовитый газ, чуть легче воздуха 
Химические свойства. Угарный газ СО – несолеобразующий оксид. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами. При нагревании он восстанавливает металлы из их оксидов:
Оксид углерода (II) на воздухе горит голубоватым пламенем:
Оксид углерода (IV) – углекислый газ 
Оксид углерода не поддерживает горения. Он используется при огнетушении. Выделяется при дыхании животных и человека. Из-за того что углекислый газ тяжелее воздуха, он накапливается в подвалах, шахтах, колодцах. Углекислый газ легко переходит в жидкое (при давлении 50 атм.), а затем в твердое состояние («сухой лед»). Углекислый газ, растворенный
в воде, придает воде кислый привкус (рис. 71).
Графическая формула: O = C = OКонцентрация углекислого газа в атмосфере Земли
составляет 0,039%. При большой концентрации оксида углерода (IV) люди и животные задыхаются. При его концентрации до 3% у человека наблюдается учащенное дыхание, более 10% – потеря сознания и даже смерть.
Повышение концентрации углекислого газа в атмосфере вызывает «парниковый эффект», что приводит к повышению температуры и таянию ледников. Концентрация углекислого газа в атмосфере растет из-за автомобильного транспорта, количество которого увеличивается из года в год.
Получение:
1) при сгорании углерода:
2) при разложении карбонатов:
3) из карбонатов под действием сильных кислот (рис. 73):
Это лабораторный способ получения
4) при разложении основных солей:
5) при горении органических веществ:
Химические свойства. 


1) с основными оксидами образует соли:
2) с растворимыми основаниями образуются соль и вода:
Гидроксид кальция (известковая вода) является реагентом на углекислый газ (выделяется белый осадок). Помутнение известковой воды – качественная реакция на 
3) при избытке углекислого газа карбонат превращается в растворимую кислую соль:
4) с водой образуется слабая, неустойчивая угольная кислота:
Применение. Углекислый газ 
Угарный, углекислый газы; ПДК угарного газа, метан, физические и химические свойства оксидов углерода, качественная реакция на
Практическая работа №7
Получение углекислого газа и изучение его свойств
Цель: получить углекислый газ, доказать его наличие и изучить свойства.
Ход работы
1. В пробирку с газоотводной трубкой положите кусочки мрамора и налейте раствор соляной кислоты, наблюдайте выделение газа (рис. 73).
2. Наполните два сухих стакана углекислым газом. Каким способом его можно собирать? Наполненность проверьте горящей лучиной и затем закройте стеклянными пластинками.
3. В сухой стакан бросьте кусочек ваты, смоченной спиртом, и подожгите его горящей лучинкой.
4. Затем возьмите стакан с углекислым газом и осторожно перелейте в стакан, где горит вата? Что происходит?
5. В стакан, наполненный углекислым газом, поместите подожженную магниевую ленту, держа ее шипцами. Наблюдайте за горением магния.
6. Продукты реакции залейте разбавленным раствором соляной кислоты. Что остается на дне стакана?
Вопросы и задания
1. Напишите все уравнения реакций, определите типы реакций.
2. К каким оксидам относится углекислый газ?
3. Можно ли собирать углекислый газ методом вытеснения воды? Ответ мотивируйте.
4. Углекислый газ тяжелее или легче воздуха? На каких этапах работы вы это наблюдали?
ДЕЛЛЕМ ВЫВОДЫ
- 1. Углерод встречается в четырех аллотропных видоизменениях (алмаз, графит, карбин). Фуллерен — это искусственная модификация углерода, не существующая в природе.
- 2. В соединениях углерод проявляет валентность II, IV (СН4, СО, со2).
- 3. СО — угарный (ядовитый) газ, несолеобразующий оксид. СО., -кислотный оксид.
- 4. Углекислому газу соответствует угольная кислота Н„СО3. Она непрочная, разлагается. Соли этой кислоты называются карбонатами.
- 5. Активированный уголь — хороший адсорбент.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
УГЛЕРОД, С (а. carbon; н. Kohlenstoff; ф. carbone; и. carbono), — химический элемент IV группы периодической системы Менделеева, атомный номер 6, атомная масса 12,041. Природный углерод состоит из смеси 2 стабильных изотопов: 12С (98,892%) и 13С (1,108%). Известно также 6 радиоактивных изотопов углерода, из которых наиболее важным является изотоп 14С с периодом полураспада 5,73•103 лет (этот изотоп в небольших количествах постоянно образуется в верхних слоях атмосферы в результате облучения ядер 14N нейтронами космического излучения).
Углерод известен с глубокой древности. Древесный уголь использовался для восстановления металлов из руд, а алмаз — как драгоценный камень. Признание углерода в качестве химического элемента связано с именем французского химика А. Лавуазье (1789).
Модификации и свойства углерода
Известны 4 кристаллические модификации углерода: графит, алмаз, карбин и лонсдейлит, сильно различающиеся по своим свойствам. Карбин — искусственно полученная разновидность углерода, представляющая собой мелкокристаллический порошок чёрного цвета, кристаллическая структура которого характеризуется наличием длинных цепочек атомов углерода, расположенных параллельно друг другу. Плотность 3230-3300 кг/м3, теплоёмкость 11,52 Дж/моль•К. Лонсдейлит обнаружен в метеоритах и получен искусственно; его структура и физические свойства окончательно не установлены. Для углерода характерно также состояние с неупорядоченной структурой — т.н. аморфный углерод (сажа, кокс, древесный уголь). Физические свойства «аморфного» углерода в сильной степени зависят от дисперсности частиц и от наличия примесей.
Химические свойства углерода
В соединениях углерод имеет степени окисления +4 (наиболее распространённая), +2 и +3. При обычных условиях углерод химически инертен, при высоких температурах соединяется со многими элементами, проявляя сильные восстановительные свойства. Химическая активность углерода убывает в ряду «аморфный» углерод, графит, алмаз; взаимодействие с кислородом воздуха у этих разновидностей углерода происходит соответственно при температурах 300-500°С, 600-700°С и 850-1000°С с образованием диоксида (CO2) и монооксида (CO) углерода. Диоксид растворяется в воде с образованием угольной кислоты. Все формы углерода устойчивы к щелочам и кислотам. С галогенами углерод практически не взаимодействует (кроме графита, который с F2 выше 900°С реагирует), поэтому его галогениды получают косвенным путём. Среди азотсодержащих соединений важное практическое значение имеют цианистый водород HCN (синильная кислота) и его многочисленные производные. При температурах выше 1000°С углерод взаимодействует со многими металлами, образуя карбиды. Все формы углерода нерастворимы в обычных неорганических и органических растворителях.
Важнейшее свойство углерода — способность его атомов образовывать прочные химические связи между собой, а также между собой и другими элементами. Способность углерода образовывать 4 равнозначные валентные связи с другими атомами углерода позволяет строить углеродные скелеты разных типов (линейные, разветвлённые, циклические); именно этими свойствами и объясняется исключительная роль углерода в строении всех органических соединений и, в частности, всех живых организмов.
Углерод в природе
Среднее содержание углерода в земной коре 2,3•10 % (по массе); при этом основная масса углерода концентрируется в осадочных горных породах (1%), тогда как в других горных породах существенно более низкие и примерно одинаковые (1-3•10%) концентрации этого элемента. Углерод накапливается в верхней части земной коры, где его присутствие связано в основном с живым веществом (18%), древесиной (50%), каменным углём (80%), нефтью (85%), антрацитом (96%), а также с доломитами и известняками. Известно свыше 100 минералов углерода, из которых наиболее распространены карбонаты кальция, магния и железа (кальцит CaCO3, доломит (Ca, Mg)CO3 и сидерит FeCO3). С накоплением углерода в земной коре часто связано и накопление других элементов, сорбируемых органическим веществом и осаждающихся после его захоронения на дне водоёмов в виде нерастворимых соединений. Большие количества диоксида CO2 выделяются в атмосферу из недр Земли при вулканической деятельности и при сжигании органических топлив. Из атмосферы CO2 усваивается растениями в процессе фотосинтеза и растворяется в морской воде, слагая тем самым важнейшие звенья общего круговорота углерода на Земле. Важную роль играет углерод и в космосе; на Солнце углерод занимает 4-е место по распространённости после водорода, гелия и кислорода, участвуя в ядерных процессах.
Применение и использование
Важнейшее народно-хозяйственное значение углерода определяется тем, что около 90% всех первичных источников энергии, потребляемой человеком, приходится на органическое топливо. Наблюдается тенденция использовать нефть и газ не как топливо, а как сырьё для разнообразных химических производств. Меньшую, но тем не менее весьма существенную роль в народном хозяйстве играет углерод, добываемый в виде карбонатов (металлургия, строительство, химические производства), алмазов (ювелирные украшения, техника) и графита (ядерная техника, жаропрочные тигли, карандаши, некоторые виды смазок и т.д.). По удельной активности изотопа 14С в остатках биогенного происхождения определяют их возраст (радиоуглеродный метод датирования). 14С широко используется в качестве радиоактивного индикатора. Важное значение имеет наиболее распространённый изотоп 12С — одна двенадцатая часть массы атома этого изотопа принята за единицу атомной массы химических элементов.