Предисловие.
Горение – экзотермическая реакция, являющаяся сложным физико-химическим
процессом с образованием продуктов сгорания из исходных веществ.
Жил-был звездочёт, сидел на высоком пригорке по ночам и
считал звёзды. Они появлялись каждую ночь с заходом Солнца и исчезали на
рассвете. Тяжело звездочёту было расставаться с ними на целый день. И вот
однажды зашёл он в свою мастерскую, и стал искать способ продлить разнообразное
свечение. В его обсерватории было
множество книг, но ему было некогда их прочесть, потому что он всё время следил
за небом. Бродил он по своей библиотеке с утра и до самого вечера. И вот на
третий день исканий, наткнулся он на замечательную книжку «Неорганическая химия».
Звездочёт задумался, стоит ли её прочесть. В конце концов, отчаявшись найти
решение, он открыл её на странице «Щелочные металлы». Удивился звездочёт, узнав
что это самые активные из всех металлов, они легко вступают в реакцию с водой,
быстро-быстро вращаясь на её поверхности и булькая. Тогда решил он поэкспериментировать.
Когда в очередной раз на его пригорок опустилась ночь, а небо как назло
заволокло тучами, звездочёт стал поджигать маленькие кусочки металлов. Первый загорелся
неприглядным, грязно-красным цветом. Это был очень мягкий, серебристо-белого
цвета металл, но не так спокоен в воде как серебро. Когда звездочёт поджёг
второй метал, от неожиданности от отпрыгнул на несколько метров. Металл горел
ярким жёлтым пламенем. Третий металл больше всего понравился звездочёту, потому
что цвет его пламени был похож на
распускающийся цветок фиалки.
Закончив экспериментировать звездочёт больше не смотрел на
звёзды, а читал книги изучая из чего они состоят.
Конец)
P.S. Все металлы во Вселенной образуются на последней стадии термоядерного синтеза звезд, при которой сами звёзды постепенно умирают. Самым последним синтезируется железо, спустя мгновение происходит взрыв сверхновой звезды. (это так, на заметку)
Предисловие.
Горение – экзотермическая реакция, являющаяся сложным физико-химическимпроцессом с образованием продуктов сгорания из исходных веществ.
Жил-был звездочёт, сидел на высоком пригорке по ночам исчитал звёзды. Они появлялись каждую ночь с заходом Солнца и исчезали нарассвете. Тяжело звездочёту было расставаться с ними на целый день. И вотоднажды зашёл он в свою мастерскую, и стал искать способ продлить разнообразноесвечение. В его обсерватории быломножество книг, но ему было некогда их прочесть, потому что он всё время следилза небом. Бродил он по своей библиотеке с утра и до самого вечера. И вот натретий день исканий, наткнулся он на замечательную книжку «Неорганическая химия».Звездочёт задумался, стоит ли её прочесть. В конце концов, отчаявшись найтирешение, он открыл её на странице «Щелочные металлы». Удивился звездочёт, узнавчто это самые активные из всех металлов, они легко вступают в реакцию с водой,быстро-быстро вращаясь на её поверхности и булькая. Тогда решил он поэкспериментировать.Когда в очередной раз на его пригорок опустилась ночь, а небо как назлозаволокло тучами, звездочёт стал поджигать маленькие кусочки металлов. Первый загорелсянеприглядным, грязно-красным цветом. Это был очень мягкий, серебристо-белогоцвета металл, но не так спокоен в воде как серебро. Когда звездочёт поджёгвторой метал, от неожиданности от отпрыгнул на несколько метров. Металл горелярким жёлтым пламенем. Третий металл больше всего понравился звездочёту, потомучто цвет его пламени был похож нараспускающийся цветок фиалки.
Закончив экспериментировать звездочёт больше не смотрел назвёзды, а читал книги изучая из чего они состоят.
Конец)
P.S. Все металлы во Вселенной образуются на последней стадии термоядерного синтеза звезд, при которой сами звёзды постепенно умирают. Самым последним синтезируется железо, спустя мгновение происходит взрыв сверхновой звезды. (это так, на заметку)
Предисловие. горение – экзотермическая реакция, являющаяся сложным – процессом с образованием продуктов сгорания из исходных веществ. жил-был звездочёт, сидел на высоком пригорке по ночам и считал звёзды. они появлялись каждую ночь с заходом солнца и исчезали на рассвете. тяжело звездочёту было расставаться с ними на целый день. и вот однажды зашёл он в свою мастерскую, и стал искать способ продлить разнообразное свечение. в его обсерватории было множество книг, но ему было некогда их прочесть, потому что он всё время следил за небом. бродил он по своей библиотеке с утра и до самого вечера. и вот на третий день исканий, наткнулся он на замечательную книжку «неорганическая ». звездочёт задумался, стоит ли её прочесть. в конце концов, отчаявшись найти решение, он открыл её на странице «щелочные металлы». удивился звездочёт, узнав что это самые активные из всех металлов, они легко вступают в реакцию с водой, быстро-быстро вращаясь на её поверхности и булькая. тогда решил он поэкспериментировать. когда в очередной раз на его пригорок опустилась ночь, а небо как назло заволокло тучами, звездочёт стал поджигать маленькие кусочки металлов. первый загорелся неприглядным, грязно-красным цветом. это был мягкий, серебристо-белого цвета металл, но не так спокоен в воде как серебро. когда звездочёт поджёг второй метал, от неожиданности от отпрыгнул на несколько метров. металл горел ярким жёлтым пламенем. третий металл больше всего понравился звездочёту, потому что цвет его пламени был похож на распускающийся цветок фиалки. закончив экспериментировать звездочёт больше не смотрел на звёзды, а читал книги изучая из чего они состоят. конец)p.s. все металлы во вселенной образуются на последней стадии термоядерного синтеза звезд, при которой сами звёзды постепенно умирают. самым последним синтезируется железо, спустя мгновение происходит взрыв сверхновой звезды. (это так, на заметку)
Предисловие. Горение – экзотермическая реакция, являющаяся сложным физико-химическимпроцессом с образованием продуктов сгорания из исходных веществ. Жил-был звездочет, сидел на высоком пригорке по ночам исчитал звезды. Они появлялись каждую ночь с заходом Солнца и исчезали нарассвете. Тяжело звездочету было расставаться с ними на целый день. И вотоднажды зашел он в свою мастерскую, и стал искать способ продлить разнообразноесвечение. В его обсерватории быломножество книг, но ему было некогда их прочесть, потому что он все время следилза небом. Бродил он по своей библиотеке с утра и до самого вечера. И вот натретий день исканий, наткнулся он на замечательную книжку «Неорганическая химия» . Звездочет задумался, стоит ли ее прочесть. В конце концов, отчаявшись найтирешение, он открыл ее на странице «Щелочные металлы». Удивился звездочет, узнавчто это самые активные из всех металлов, они легко вступают в реакцию с водой, быстро-быстро вращаясь на ее поверхности и булькая. Тогда решил он поэкспериментировать. Когда в очередной раз на его пригорок опустилась ночь, а небо как назлозаволокло тучами, звездочет стал поджигать маленькие кусочки металлов. Первый загорелсянеприглядным, грязно-красным цветом. Это был очень мягкий, серебристо-белогоцвета металл, но не так спокоен в воде как серебро. Когда звездочет поджегвторой метал, от неожиданности от отпрыгнул на несколько метров. Металл горелярким желтым пламенем. Третий металл больше всего понравился звездочету, потомучто цвет его пламени был похож нараспускающийся цветок фиалки. Закончив экспериментировать звездочет больше не смотрел назвезды, а читал книги изучая из чего они состоят. Конец) P.S. Все металлы во Вселенной образуются на последней стадии термоядерного синтеза звезд, при которой сами звезды постепенно умирают. Самым последним синтезируется железо, спустя мгновение происходит взрыв сверхновой звезды. (это так, на заметку)
Химия в жизни человека
Значение химии в жизни человека трудно переоценить. Приведём фундаментальные области, в которых химия оказывает своё созидательное воздействие на жизнь людей.
1. Возникновение и развитие жизни человека не возможно без химии. Именно химические процессы, многие тайны которых учёные ещё не раскрыли, ответственны за тот гигантский переход от неживой материи к простейшим одноклеточным, и далее к вершине современного эволюционного процесса — человеку.
2. Большинство материальных потребностей, возникающих в жизни человека, обслуживается природной химией или получает удовлетворение в результате использования в производстве химических процессов.
3. Даже возвышенные и гуманистические устремления людей в своей основе опираются на химию человеческого организма, и, в частности, сильно зависят от химических процессов в мозге человека.
Конечно же, всё богатство и разнообразие жизни нельзя свести только к химии. Но наряду с физикой и психологией, химия как наука, представляет собой определяющий фактор развития человеческой цивилизации.
Химия жизни
Насколько сейчас известно, наша планета образовалась приблизительно 4.6 миллиарда лет назад, а простейшие ферментирующие одноклеточные формы жизни существуют 3.5 миллиарда лет. Уже 3.1 миллиарда лет они могли бы использовать фотосинтез, но геологические данные об окислительном состоянии осадочных отложений железа указывают, что атмосфера Земли приобрела окислительный характер лишь 1.8-1.4 миллиарда лет назад. Многоклеточные формы жизни, которые, по-видимому, зависели от изобилия энергии, возможного только при дыхании кислородом, появились На Земле приблизительно от миллиарда до 700 миллионов лет назад, и именно в то время наметился путь дальнейшей эволюции высших организмов. Наиболее революционным шагом, после зарождения самой жизни, было использование внеземного источника энергии, Солнца. В конечном итоге, именно это превратило жалкие ростки жизни, которые использовали случайно встречающиеся природные молекулы с большой свободной энергией, в огромную силу, способную преобразовать поверхность планеты и даже выйти за её пределы.
В настоящее время учёные придерживаются точки зрения, что зарождение жизни на Земле происходило в восстановительной атмосфере, которая состояла из аммиака, метана, воды и диоксида углерода, но не содержала свободного кислорода.
Первые живые организмы получали энергию, разлагая молекулы небиологического происхождения с большой свободной энергией на меньшие молекулы без их окисления. Предполагается, что на ранней стадии существования Земли она имела восстановительную атмосферу, состоящую из таких газов как водород, метан, вода, аммиак и сероводород, но содержащую очень мало свободного кислорода или вообще его не имевшего. Свободный кислород разрушал бы органические соединения быстрее, чем они могли синтезироваться в результате естественно протекающих процессов (под воздействием электрического разряда, ультрафиолетового излучения, теплоты или естественной радиоактивности). В этих восстановительных условиях органические молекулы, которые образовались небиологическими способами, не могли разрушаться в результате окисления, как это происходит в наше время, а продолжали накапливаться в течении тысячелетий, до тех пор, пока, наконец, не появились компактные локализованные образования из химических веществ, которые можно уже считать живыми организмами.
Появившиеся живые организмы могли поддерживать существование за счёт разрушения естественно образующихся органических соединений, поглощая их энергию. Но если бы это был единственный источник энергии, то жизнь на нашей планете была бы крайне ограниченной. К счастью, около 3 миллиардов лет назад появились важные соединения металлов с порфиринами, и это открыло путь к использованию совершенно нового источника энергии – солнечного света. Первым шагом, который поднял жизнь на Земле над ролью простого потребителя органических соединений, было включение в неё процессов координационной химии.
По-видимому, перестройка явилась побочным следствием появления нового способа запасания энергии – фотосинтеза*, – который давал его обладателям огромное преимущество над простыми ферментативными поглотителями энергии. Организмы, в которых развилось это новое свойство, могли использовать энергию солнечного света для синтеза своих собственных энергоёмких молекул и уже не зависеть от того, что находится среди их окружения. Они стали предшественниками всех зелёных растений.
Сегодня все живые организмы можно подразделить на две категории: те, которые способны изготовлять свою собственную пищу при помощи солнечного света, и те, которые не имеют такой возможности. Скорее всего, и родственные ей бактерии сегодня являются живыми ископаемыми, потомками тех древних способных к ферментации анаэробов, которые отступили в редкие анаэробные области мира, когда атмосфера в целом накопила большие количества свободного кислорода и приобрела окислительный характер. Поскольку организмы второй категории существуют за счёт поедаемых ими организмов первой категории, накопление энергии посредством фотосинтеза является источником движущей силы для всего живущего на Земле.
Общая реакция фотосинтеза в зелёных растениях обратна реакции сгорания глюкозы и проходит с поглощением значительного количества энергии.
6 CO2 + 6 H2 O –> C6 H12 O6 + 6 O2
Вода расщепляется на элементы, что создаёт источник атомов водорода для восстановления углекислого газа в глюкозу, а нежелательный газообразный кислород выделяется в атмосферу. Энергия, необходимая для осуществления этого в высшей степени несамопроизвольного процесса, обеспечивается солнечным светом. В наиболее древних формах бактериального фотосинтеза в качестве источника восстановительного водорода использовалась не вода, а сероводород, органические вещества или сам газообразный водород, но лёгкая доступность воды сделала этот источник наиболее удобным, и в настоящее время он используется всеми водорослями и зелёными растениями. Простейшими организмами, в которых осуществляется фотосинтез с высвобождением кислорода, являются сине-зелёные водоросли. Их правильнее обозначать современным названием цианобактерии, поскольку это, в самом деле бактерии, научившиеся добывать собственную пищу из углекислого газа, воды и солнечного света.
К сожалению, фотосинтез приводит к высвобождению опасного побочного продукта, кислорода. Кислород был не только бесполезен для ранних организмов, он конкурировал с ними, окисляя естественно образующиеся органические соединения прежде, чем они могли быть окислены в процессе метаболизма этими организмами. Кислород представлял собой гораздо более эффективный «пожиратель» энергоёмких соединений, чем живая материя. Ещё хуже было то, что слой озона, который постепенно образовывался из кислорода в верхней части атмосферы, преграждал доступ ультрафиолетовому излучению Солнца и ещё более замедлял естественный синтез органических соединений. Со всех современных точек зрения, появление свободного кислорода в атмосфере представляло собой угрозу для жизни.
Но, как часто случается, жизнь сумела обойти это препятствие и даже обратила его в преимущество. Отходами жизнедеятельности первичных простейших организмов были такие соединения, как молочная кислота и этанол. Эти вещества намного менее энергоёмки по сравнению с сахарами, но они способны высвобождать большое количество энергии, если полностью окисляются до СО2 и Н2 О. В результате эволюции возникли живые организмы, способные «фиксировать» опасный кислород в виде Н2 О и СО2, а взамен получать энергию сгорания того, что прежде было их отходами. Преимущества сжигания пищи с помощью кислорода оказались столь велики, что подавляющее большинство форм жизни – растения и животные – пользуются в настоящее время кислородным дыханием.
Когда появились новые источники энергии, возникла новая проблема, связанная уже не с получением пищи или кислорода, а с транспортировкой кислорода в надлежащее место организма. Малые организмы могли обходиться простой диффузией газов через содержащиеся в них жидкости, но этого недостаточно для многоклеточных существ. Так перед эволюцией возникла очередная преграда.
Выход из тупика в третий раз оказался возможен благодаря процессам координационной химии. Появились такие молекулы, состоящие из железа, порфирина и белка, в которых железо могло связывать молекулу кислорода, не окисляясь при этом. Кислород просто переносится в различные участки организма, чтобы высвободиться при надлежащих условиях – кислотности и недостатке кислорода. Одна из таких молекул, гемоглобин, переносит О2 в крови, а другая, миоглобин, получает и запасает (хранит) кислород в мышечных тканях до тех пор, пока он не понадобится в химических процессах. В результате появления миоглобина и гемоглобина были сняты ограничения на размеры живых организмов. Это привело к появлению разнообразных многоклеточных, и, в конечном итоге, человека.
* Фотосинтез – это процесс преобразования энергии света в энергию химической связи получающихся веществ.
** Метаболизм – расщепление богатых энергией веществ и извлечение их энергии.
Химия как зеркало жизни человека.
Оглянитесь вокруг, и Вы увидите, что жизнь современного человека невозможна без химии. Мы используем химию при производстве пищевых продуктов. Мы передвигаемся на автомобилях, металл, резина и пластик которых сделаны с использованием химических процессов. Мы используем духи, туалетную воду, мыло и дезодоранты, производство которых немыслимо без химии. Есть даже мнение, что самое возвышенное чувство человека, любовь, это набор определённых химических реакций в организме.
Такой подход к рассмотрению роли химии в жизни человека, является, на мой взгляд, упрощённым, и я предлагаю Вам его углубить и расширить, перейдя в совершенно новую плоскость оценки химии и её влияния на человеческое общество.
Относительно недавно человек понял, что сознательное подражание природе в технике может дать великолепный результат. Скопировав крыло птицы, мы создали самолёт. Рассмотрев способ передвижения червя, получили гусеницы трактора. Внимательнее приглядевшись к движениям кожи дельфинов и акул, смогли значительно увеличить скорость торпеды, при её движении в воде. Таких примеров можно привести ещё много, а ещё больше их станет, если мы чаще будем применять этот подход.
А что же химия? Неужели она, являясь на самом деле более «тонкой» и глубокой наукой, по сравнению с механикой макрообъектов, не даст нам никаких намёков и подсказок, рассмотрев которые, человек сделал бы очередной шаг в своём развитии. Оказывается, такие подсказки есть, просто их никто ещё не пытался найти и использовать. И оказалось, что эти подсказки касаются более высокой области, чем даваемые механикой.
Мир людей богат и разнообразен, но всё же поведение каждого человека в отдельности, и устойчивых человеческих групп или общностей, можно свести к определённому набору качеств. И здесь мы можем провести аналогию между атомом и человеком. Действительно, хотя количество различных атомов и ограничено, они могут располагаться в молекулах совершенно различными способами и на самом деле взаимодействовать по-разному, в зависимости от того, с чем приходится вступать в реакцию. Таков и человек.
Теперь дадим сравнение свойств атома (с точки зрения химии) и человека ( с точки зрения человеческих взаимоотношений).
Самыми активными являются атомы щелочных металлов. Их отталкивающая защита из электронов мала и слаба, но зато они могут взаимодействовать практически со всеми химическими элементами. Человек такого типа, тоже может прекрасно общаться и уживаться с другими людьми. Но он потеряет при этом свою индивидуальность. Ведь и щелочные металлы не встречаются в чистом виде в природе, а находятся только в виде соединений.
С другой стороны инертные газа создают вокруг себя непреодолимый барьер из восьми электронов, и надо создать особые условия, чтобы заставить их вступить в реакцию. Так и люди. Отгораживаясь от всего мира, человек или общество, теряет способность к изменениям и к развитию, потому что взаимодействие – это взаимное действие. В его процессе изменяются обе стороны.
И наконец, идеал мира химических элементов – углерод. В этом элементе гармонично сочетаются защищённость (4 электрона) и открытость (4 вакансии). Причём распределение электронов может достаточно легко изменяться, не требуя больших энергетических затрат. Углерод способен образовать двойные и тройные связи, взаимодействуя с себе подобными.
В поисках идеала человека мы должны использовать эту информацию. Проявляя в своём поведении разумный компромисс между отстаиванием своих интересов (защита) и учётом мнения оппонента, изменяя слегка свои подходы к решению проблем, как атом углерода в процессе реакций изменяет расположение своих электронов и вакансий, мы продвинемся в деле получения результатов значительно дальше, чем, если бы сохраняли свою позицию неизменной.
С учётом того, что такой подход может быть применён большим количеством людей, то они, как одинаковые атомы углерода, смогут образовать прочные (двойные и тройные) связи. Тоже самое можно сказать и в отношении человеческих общностей (небольших групп, общественных объединений и целых государств).
Развивая эту мысль можно предположить, что наиболее перспективным путём развития человечества является направление, при котором в обществе будет существовать большое разнообразие взглядов и мнений, будет разрешено законом значительное количество способов действия, но большинство людей будет обладать универсальностью, способностью понимать других людей и взаимодействовать с ними, схожей с универсальность атома углерода. При таких условиях жизнь общества будет гармоничной и стабильной.
Пример водорода, в этом вопросе также очень показателен. Сократите сферу своего влияния (или уменьшите область своих запросов) и Вы, подобно атому водорода, сможете взаимодействовать и объединяться со значительно большим числом людей (элементов).
Итак, резюмируя всё выше сказанное, отметим, что химия в жизни человека может стать путеводной звездой для гармоничного развития всего человеческого общества.
Прикладные вопросы влияния химии на развитие жизни человека.
В предыдущей главе мы осветили философский подход к оценке химии в жизни человека. Это был, так сказать общий взгляд. Здесь же мы рассмотрим роль химии и её влияние на жизнь человека с позиций стратегии.
Если принять за главную цель существования человеческой цивилизации её гармоничное и всестороннее развитие, особенно в интеллектуальных вопросах, то встаёт вопрос, что на этом пути может сделать химия. Изучая поведение людей и особенно влияние на их поведение того, чем они питаются, можно сделать однозначное заключение. В натуральной здоровой пище содержатся вещества, которые могут не только повысить физическую отдачу организма, но и стимулировать его мозговую деятельность. Поэтому, применяя такую пищу в нужное время в нужных количествах, мы могли бы ускорить развитие человеческой цивилизации, не затрачивая на это больше ресурсов, чем сейчас. Такой подход является новой социальной инновацией, а, следовательно, роль химии в жизни человека возрастёт еще больше.
Необходимо провести крупномасштабные научные исследования в этой области и применить их результаты в повседневной жизни. Ведь даже такое социальное зло, как алкоголизм можно победить, грамотно используя «пищевой вопрос» в отношении страдающих этим недугом людей.
Скажу даже больше. Применение такого подхода в вопросах питания, находящихся в заключении людей, однозначно способно снизить уровень рецидива преступлений.
Этот же метод можно применить и к планированию рождаемости.
Конечно, в каждой из предложенных областей, мы не должны посягать на свободу выбора человека. Но учитывая, что — мы то, что мы едим – применение вышеупомянутых стратегий является вполне обоснованной альтернативой современным способам.
А теперь о самой, на мой взгляд, решающей старатегии, которую необходимо внедрить. Эта страница является частью сайта посвящённого общей теории взаимодействий, новой альтернативной теории. Химические процессы, да и само строение атомов, в этой теории показаны простым человеческим языком и с применением анимации, сравните это взгляды с теми, которые Вы встречали в учебниках. И сделайте совй выбор. Возможно, он будет не в пользу общей теории взаимодействий, но одно можно сказать точно. Химия предстанет перед Вами как интересная, без разрывов и несоответствий во взглядах, без необоснованных постулатов, наука, в которой нет границ для творчества. Вы можете используя общую теорию взаимодействий понять многие, очень туманно объяснённые вопросы. Причём описания, сделанные мною Вам даже не придётся запоминать, они сами зафиксируются в вашей памяти, потому что просты и непротиворечивы. Правда сдавать на экзамене Вам придётся нечто другое.
Министерство связи Российской Федерации
Санкт-Петербургский Государственный Университет Телекоммуникаций
им. проф. Бонч-Бруевича
Кафедра химии
Реферат
Предмет: Химия
Тема: Щелочные металлы
Составители: студенты гр. Р-73 Смирнов Игорь Васильев Валерий
Самим
Санкт-Петербург
1999г.
Что такое металлы
В периодической системе металлы преобладают. По многим свойствам металлы очень отличаются друг от друга: литий вдвое легче воды, а осмий тяжелее ее в 22,5 раза. Цезий или галлий можно легко расплавить в ладони, а вольфраму для плавления нужна температура лишь вдвое меньше, чем температура поверхности Солнца; литий, натрий или калий можно резать ножом, а чистый хром не всякий резец возьмет… Различна и химическая активность металлов – от почти полной химической инертности золота или платины до неукротимой реакционной способности калия или натрия.
Но, несмотря на все свое разнообразие, эти элементы образуют единую семью, потому что все они относительно легко расстаются со своими наружными электронами и превращаются в положительные ионы.
Элемент легко отдает электроны, если их на внешнем энергетическом уровне мало (поэтому элементы первых трех групп, не считая бора, – металлы) или если радиус атома так велик, что ядро не в состоянии прочно удерживать наружные электроны (поэтому висмут, атом которого имеет на внешнем энергетическом уровне пять электронов, все-таки относят к металлам).
Проследив, как изменяются свойства у элементов III периода, мы увидим, что с увеличением числа электронов во внешнем энергетическом уровне элементы постепенно переходят от активного металла натрия к активному неметаллу хлору. IV период тоже начинается активным металлом калием. В конце этого периода перед инертным газом криптоном также стоит активный неметалл бром. Следовательно, и в этом периоде должен происходить такой же переход.
Почему же этот переход такой медленный? Дело в том, что у элементов IV периода от скандия до цинка «достраивается» не внешний энергетический уровень, а предыдущий. И лишь после цинка (начиная с галлия) число электронов на внешнем энергетическом уровне увеличивается, так что у германия здесь четыре электрона. Он – «пограничный» элемент, за которым следуют неметаллы.
Поскольку у элементов от скандия до никеля на внешнем энергетическом уровне не больше двух электронов, то они металлы. Каждый большой период включает в себя подобный ряд, состоящий только из металлов.
У этих рядов четные номера, а из большинства расположенных в них металлов состоят побочные подгруппы периодической системы.
Получение и химические свойства
Впервые металлы I группы (Na и K) были получены английским химиком Х. Дэви в 1807г. электролизом щелочей, откуда и возникло их групповое название – щелочные металлы .
В чистом виде элементы I группы – легкие, мягкие, блестящие металлы, быстро тускнеющие на воздухе из-за окисления кислородом и реакции с водой. Их основные свойства представлены в виде таблицы 1-1 в приложении I.
Литий
Литий Li – s -элемент 1s2 2s1. У лития, имеющего только один валентный электрон и большой атомный радиус, энергия ионизации значительно меньше, чем у бериллия (5,39эв против 9,32эв у Be). Это типичный металлический элемент, щелочной металл. Однако от остальных щелочных металлов литий отличает небольшой размер атома и иона; литий по свойствам напоминает также магний.
Для лития наиболее характерно образование ионной связи. Поэтому координационное число Li в соединениях в отличие от остальных элементов второго периода больше 4. Вместе с тем вследствие небольшого размера ион лития характеризуется высокой энергией сольватации, а в литийорганических соединениях литий образует ковалентную связь.
Литий достаточно широко распространен в земной коре (0,002ат.%). Природный литий состоит из двух стабильных изотопов: 6 Li (7,3%) и 7 Li (92,7%). Искусственно получены радиоактивные изотопы. Наибольшую ценность имеют минералы сподумен LiAl(SiO3 )2, амблигонит LiAl(PO4 )F и лепидолит Li2 Al2 (SiO3 )3 (F, OH)2 .
Литий – единственный элемент, реагирующий при обычных условиях с азотом. Поскольку при контакте с воздухом одновременно протекают реакции с кислородом и влагой, лития, как и другие щелочные металлы, можно хранить только без доступа воздуха.
При горении лития на воздухе одновременно образуются и оксид, и нитрид:
2Li (кр) + 1/2O2 (г) = Li2 O (кр), DH° = -598кДж;
3Li (кр) + 1/2N2 (г) = Li3 N (кр), DH° = -164кДж.
При небольшом нагревании литий реагирует с водородом, углеродом, фосфором и другими элементами, образуя многочисленные бинарные соединения, в кристаллах которых он присутствует в виде однозарядного криптона.
При реакциях с органическими галогенами образуются литийорганические соединения.
C2 H5 Cl + 2Li = C2 H5 Li + LiCl.
Это чрезвычайно реакционно-способные вещества, загорающиеся при контакте с влажным воздухом. Их хорошая растворимость в неполярных растворителях указывает на ковалентный характер связи лития с органическим радикалом. Часто эти соединения образуют полимеры, в которых координационное число лития достигает четырех.
Литий используется в специальных легких сплавах, литийорганические производные широко применяются при синтезе различных классов органических соединений.
Простое вещество литий
В виде простого вещества литий – мягкий серебристо-белый металл (т. пл. 179.°C, т. кип. 1370°C). Из металлов он самый легкий (пл. 0,534 г/см3 ).
Литий высоко химически активен. С кислородом и азотом взаимодействует уже при обычных условиях, поэтому на воздухе тотчас окисляется, образуя темно-серый налет продуктов взаимодействия (Li2 O, Li3 N). При температуре выше 200°C загорается. В атмосфере фтора и хлора, а так же в парах брома и йода самовоспламеняется при обычных условиях. При нагревании непосредственно соединяется с серой, углем, водородом и другими неметаллами. Будучи накален, горит в CO2 .
С металлами литий образует интерметаллические соединения. С магнием, алюминием, цинком и с некоторыми другими металлами, кроме того, образует ограниченные твердые растворы. Заметно отличается атомным радиусом от остальных щелочных металлов, дает с ними эвтектические смеси.
Литий придает сплавам ряд ценных физико-химических свойств. Например, у сплавов алюминия с содержанием до одного процента лития повышается механическая прочность и коррозионная стойкость, введение двух процентов лития в техническую медь значительно увеличивает ее электропроводность и т.д.
Литий по химической активности уступает некоторым металлам, хотя значение его стандартного электродного потенциала наиболее отрицательное (E ° 298 = -3,01 в ). Это обусловлено большой энергией гидратации иона Li+, что обеспечивает смещение равновесия
Li(т) — Li+ (p) + e-
в сторону ионизации металла в значительно большей степени, чем это имеет место у остальных щелочных металлов. Для слабо сольватирующих растворителей (например, в расплавах солей) значение его электродного потенциала соответствует его меньшей химической активности в ряду щелочных металлов.
Литий энергично разлагает воду, выделяя из нее водород; еще легче взаимодействует с кислотами.
Литий получают электролизом расплава эвтектической смеси LiCl – KCl. Его хранят под слоем вазелина или парафина в запаянных сосудах.
Важнейшей областью применения лития, как источника трития является атомная энергия. Литий, кроме того, используется в качестве теплоносителя в атомных реакторах.
Натрий
Атомный и ионный радиус натрия Na (1s2 2s2 2p6 3s1 ) значительно больше, чем лития, и признаки металлического элемента у натрия выражены сильнее. В этом отношении он уступает лишь элемента подгруппы калия.
Натрий – один из наиболее распространенных элементов на Земле (2,0 ат. %). Он обнаружен в атмосфере Солнца и в межзвездном пространстве.
Важнейшие минералы натрия: NaCl (каменная соль, галит ), Na2 SO4 ?10H2 O (мирабилит, глауберова соль ), Na3 AlF6 (криолит ), Na2 B4 O7 ?10H2 O (бура ) и др. В сочетании с другими элементами он входит в состав многих природных силикатов и алюмосиликатов. Огромное количество солей натрия находится в гидросфере. Абсолютное содержание натрия в морской воде около 1,5?1016m .
Соединения натрия содержатся в растительных и животных организмах, в последнем случае главным образом в виде NaCl. В крови человека ионы Na+ составляют 0,32%, в костях 0,6%, в мышечной ткани 0,6 – 1,5%.
Натрий – наиболее употребительный их щелочных металлов. Его получают в больших количествах электролизом расплава NaCl с добавками CaCl2, KCl и другими для понижения температуры плавления.
Это мягкий металл, легко реагирующий с водой, окисляющийся кислородом и другими элементами-окислителями – галогенами, халькогенами т.д. Хранят натрий в запаянных сосудах, а небольшое количество – под слоем керосина.
Применяется натрий в металлотермии и как активный восстановитель в органическом синтезе. Так же его используют в газоразрядных лампах и химических источниках тока.
Натрий является одним из важных элементов, входящих в состав живых организмов, в частности массовая доля ионов Na+ в плазме крови составляет около 0,3%.
Тяжелые щелочные металлы – калий, рубидий и цезий – еще более реакционноспособны, чем натрий. Все они со вспышкой реагируют с неметаллическими элементами, разлагают воду и многие другие вещества. Хранят их как и натрий, в запаянных сосудах.
Подобно натрию калий является биогенным элементом, особенно существенным в физиологии растений, которые получают его из почвы. При интенсивной агротехнике естественный круговорот калия нарушается и его необходимо вводить в почву в виде калийных удобрений.
Из тяжелых щелочных металлов техническое применение находит только цезий, который благодаря малому потенциалу ионизации используется для создания фоточувствительных слоев в вакуумных фотоэлементах.
Простое вещество натрий
В виде простого вещества натрий – легкий (пл. 0,97 г/см3 ), мягкий серебристо-белый металл со сравнительно невысокими температурами плавления (98°C) и кипения (883°C).
По химическим свойствам это активнейший металл. На воздухе тотчас окисляется, образуя рыхлые продукты окисления. При обычной температуре самовоспламеняется в атмосфере фтора и хлора. При небольшом подогревании энергично взаимодействует с жидким бромом, серой, йодом, водородом и др.
С многими металлами натрий образует интерметаллические соединения. Например, с оловом он дает ряд соединений: NaSn6, NaSn4, NaSn3, NaSn2, NaSn, Na2 Sn, Na3 Sn и др. С некоторыми металлами дает твердые растворы. Эвтектический сплав 24% Na и 76% K представляет собой жидкость (температура кристаллизации –12,6°C).
Натрий используется в металлотермии. Металлический натрий и его жидкий сплав с калием используется в органическом синтезе. Как восстановитель часто применяется амальгама натрия. Натрий используется также в качестве теплоносителя в ядерных энергетических установках, в клапанах авиационных двигателей, в химических производствах, где требуется равномерный обогрев в пределах 450 – 650°C.
Натрий получают электролизом расплавленного NaCl и реже NaOH. При производстве натрия из NaCl (т. пл. 800°C) температуру плавления электролита снижают (до 575 – 585°C) добавкой KCl, CaCl2, NaF или других солей. Натрий хранят в запаянных сосудах или под керосином.
Элементы подгруппы калия
Калий K, Рубидий Rb, цезий Cs и франций Fr – полные электронные аналоги. Хотя у атомов щелочных металлов число валентных электронов одинаково, свойства элементов подгруппы калия отличаются от свойств натрия и, особенно, лития. Это обусловлено заметным различием величины радиусов их атомов и ионов. Кроме того, у лития в предвнешнем квантовом слое 2 электрона, а у элементов подгруппы калия – 8. В таблице 1-2 приложения I приведены сведения о литии, натрии и элементах подгруппы калия.
Элементы подгруппы калия – наиболее типичные металлические элементы – катионогены. При этом с повышением порядкового номера этот признак у элементов усиливается. Для них наиболее характерны соединения с преимущественно ионным типом связи. Вследствие незначительного поляризирующего действия ионов (малый заряд, устойчивость электронной структуры, большие размеры), комплексообразование для K+, Rb+, Cs+, Fr+ нехарактерно; даже кристаллогидраты для них почти неизвестны.
Наиболее важными минералами калия являются: сильвин KCl, сильвинит NaCl?KCl, карналлит KCl?MgCl2 ?6H2 O, каинит KCl?MgSO4 ?3H2 O.
Рубидий и цезий содержатся в минералах калия. Франций радиоактивен, стабильных изотопов не имеет. Он открыт в 1939г. в продуктах радиоактивного распада урана (4?10-28г. на 1 грамм природного урана). Его получают искусственно. Наиболее долгоживущий изотоп 212 Fr (T1/2 = 20 мин ) образуется при облучении урана протонами:
238 U (p, 6p 21n )212 Fr
Вследствие малого периода полураспада изотопов сколько-нибудь заметных количеств франция накопить не удается, поэтому его свойства изучены недостаточно.
Простые вещества подгруппы калия
В виде простых веществ калий и его аналоги – блестящие серебристо-белые (за исключением золотисто-желтого цезия) металлы с объемно-центрированной кристаллической решеткой (как Li и Na). Основные физические константы этих элементов приведены в таблице 1-3 приложения I.
Как видно из приведенных данных, плотность K, Rb и Cs невелика, температуры плавления и кипения невысокие. Эти металлы очень мягки и легко режутся ножом. Существенно, что от лития к натрию и далее к калию значения большинства констант меняются довольно резко.
Калий и его аналоги – исключительно реакционноспособные металлы. На воздухе калий тотчас окисляется, образуя рыхлые продукты взаимодействия; цезий и рубидий самовоспламеняются. В атмосфере фтора и хлора эти металлы самовоспламеняются при обычных условиях. Взаимодействие их с жидким бромом сопровождается сильным взрывом. При нагревании они легко взаимодействуют с серой, водородом и др. металлами. С металлами они образуют большей частью интерметаллические соединения.
Калий и его аналоги располагаются в самом начале ряда напряжений. Взаимодействие калия с водой сопровождается самовоспламенением выделяющегося водорода, а взаимодействие рубидия и цезия – даже взрывом.
Рассматриваемые металлы при нагревании и освещении сравнительно легко теряют электроны. Эта способность делает их ценными материалами для изготовления фотоэлементов.
В технике калий получают натрийтермическим методом из расплавленного гидроксида или хлорида, рубидий и цезий – методами металлотермии и термическим разложением соединений. Калий и его аналоги хранят в запаянных сосудах. Калий, кроме того, можно сохранять в керосине.
Соединения с водородом
Щелочные металлы непосредственно взаимодействуют с водородом, образуя гидриды MH. Наиболее характерна эта реакция для лития:
2Li + H2 = 2LiH
В отличие от соединений с p -элементами, в которых водород находится в положительной степени окисления, в гидридах щелочных металлов он присутствует в степени окисления –1, образуя гидридный анион H. В отсутствие воды гидрид лития не реагирует с кислородом и галогенами, но вода немедленно его разлагает:
LiH + H2 O = LiOH + H2
В этой реакции протон выступает в роли окислителя, а гидридный анион – восстановителя:
H+ + H- = H2
Гидриды остальных щелочных металлов менее устойчивы и более реакционноспособны. Их свойства определяются свойствами гидридного аниона, т.е. они являются сильными восстановителями.
Соединения с кислородом
Несмотря на то, что щелочные металлы во всех своих соединениях находятся в единственной степени окисления +1, каждый из них образует несколько бинарных соединений с кислородом. Кроме нормальных оксидов существуют пероксиды, супероксиды и озониды щелочных металлов.
Образование таких соединений обусловлено в большей мере свойствами кислорода, чем свойствам щелочных металлов.
Особенности элементов первой группы в образовании соединений с кислородом заключаются в том, что относительно большие однозарядные ионы обладают малым поляризующим действием и не дестабилизируют молекулярные ионы кислорода. При горении в кислороде получаются оксид лития, пероксид натрия и супероксиды остальных металлов:
2Li + 1/2O2 = Li2 O 2Na + O2 = Na2 O2 K + O2 = KO2
Пероксид лития может быть получен косвенным путем.
Оксиды получают из продуктов сгорания, нагревая их с соответствующим металлом:
Na2 O2 + 2Na = 2Na2 O2 KO2 + 3K = 2K2 O
При взаимодействии калия, рубидия и цезия с озоном образуются озониды:
K + O2 = KO3
Большинство соединений с кислородом окрашено. Оксиды лития и натрия бесцветны, но уже Na2 O2 имеет светло-желтую окраску, KO2 – оранжевого, RbO2 – темно-коричневого цвета.
Естественно, что нормальные оксиды щелочных металлов практически не проявляют ни окислительных, ни восстановительных свойств, тогда как остальные соединения являются сильными окислителями. Большая часть органических веществ (эфир, уксусная кислота, древесные опилки, хлопок) реагируют с Na2 O2 или KO2 со вспышкой или со взрывом.
Пероксид натрия получают в промышленности в больших количествах путем сжигания металлического натрия в токе воздуха. При взаимодействии его с водой идет реакция гидролиза:
O22- + H2 O = OH- + HO2-
Водные растворы пероксида натрия – достаточно сильные окислители и широко используются для отбеливания органических средств – древесной массы, тканей, меха.
Смесь пероксида натрия с супероксида калия применяется в изолирующих дыхательных аппаратах, так как в этом случае число молей выделившегося кислорода может быть равно числу молей поглощенного CO2 :
Na2 O2 + CO2 = Na2 CO3 + 1/2O2
2KO2 + CO2 = K2 CO3 + 3/2O2
При соотношении Na2 O2: KO2 = 1: 2 поглощение CO2 происходит без изменения общего давления.
Гидроксиды
Все бинарные соединения элементов I группы с кислородом реагируют с водой, образуя гидроксиды. Например:
Li2 O + H2 O = 2LiOH, Na2 O2 + 2H2 O = 2NaOH + H2 O,
2KO2 + 2H2 O = 2KOH + H2 O2 + O2
Гидроксиды щелочных металлов, называемые щелочами, в воде хорошо растворимы и практически полностью диссоциированы:
NaOH ( кр) = Na+ (p-p) + OH- (p-p)
В чистом виде это твердые бесцветные вещества, плавящиеся без разложения при @ 300 – 500 °C. Только гидроксид лития при нагревании выше Тпл = 445 °C теряет воду:
2LiOH = Li2 O + H2 O
Твердые гидроксиды и их концентрированные растворы сильно гигроскопичны, они жадно поглощают влагу и используются для осушения газов, не обладающих кислотными свойствами, в частности аммиака. Уже при обычных условиях твердые щелочи легко реагируют с «кислотами» газами – CO2, SO2, NO2, галогенами, галогено- и халькогеноводородами. Поэтому щелочи широко используются для поглощения таких газов и очистки от них кислорода, водорода, азота.
В силу этих причин как твердые щелочи, так и их растворы следует хранить в плотно закрытой посуде.
Наибольшее применение находит NaOH – едкий натр, который в громадных количествах получают в промышленности электролизом раствора хлорида натрия. Он широко применяется при производстве целлюлозы, искусственного шелка, при рафинировании жидких растительных масел и нефти, в мыловаренной промышленности, при синтезе красителей и в других химических производствах.
Растворы щелочных металлов
При обсуждении свойств типичных металлов – галогенов, серы, фосфора – неоднократно упоминалась их способность растворяться в некоторых растворителях, из которых затем они могут быть выведены в неизменном виде. Такими растворителями для неметаллов являются малополярные вещества вроде CS2, CCl4 или бензола. По мере перехода от молекулярных кристаллов к атомным и металлическим способность растворяться без химических реакций постепенно уменьшается, и простые вещества элементов IV и III группы переходят в раствор только в результате химического превращения.
В случае щелочных металлов связи в металлических кристаллах, осуществляемые единственным валентным электроном, настолько слабы, что появляется возможность их разрушения в результате молекулярных, а не химических, в полном смысле этого слова, взаимодействий.
Так, в отсутствие следов железа все щелочные металлы достаточно хорошо растворимы в жидком аммиаке. При этом образуются голубые или синие растворы, из которых металлы могут быть выведены в неизменном виде после испарения аммиака. Подобным же образом натрий и другие металлы могут быть растворены в некоторых органических растворителях – аминах и эфирах. Все эти растворы обладают хорошей электропроводимостью, что говорит о ионной природе растворенных частиц. Различными методами доказано, что во всех случаях имеет место равновесие:
M (кр) — M (p-p) — M+ (p-p) + e- (p-p)
Как катион металла, так и электрон сильно сольватируются молекулами растворителя; например, в аммиаке образуются ионы Na(NH3 )4+, и это приводит к общему выигрышу энергии при растворении.
Очевидно, что сольватированные электроны в заметных количествах не могут существовать в растворах, содержащих протоны, так как непременно должна идти реакция
H+ (p-p) + e- (p-p) = 1/2H2
или, иначе, обмен электроном между атомом металла и протоном:
M (кр) + H+ (p-p) = M+ (p-p) + 1/2H2
В водных растворах этот процесс количественно характеризуется стандартным восстановительным потенциалом. Для щелочных металлов E ° k практически одинаковы и равны –2,9В. Такие большие отрицательные значения E ° говорят о том, что ни при каких условиях щелочные металлы не могут существовать с водой и любыми водными растворами, а значит, не могут быть восстановлены из водного раствора.
Действительно, все щелочные металлы энергично, во многих случаях со взрывом, реагируют с водой и растворами кислот. Со щелочными растворами, в которых концентрация протонов мала, реакции идут более спокойно. Натрий, брошенный на поверхность воды, немедленно плавится за счет теплоты реакции, а иногда поджигает выделяющийся водород:
Na (кр) + H2 O (ж) = NaOH (p-p) + 1/2H2
Калий всегда реагирует с водой со вспышкой или со взрывом.
Соли щелочных металлов
Во всех своих соединениях щелочные металлы существуют в виде однозарядных катионов. Это относиться как к бинарным соединениям – галогенидам, халькогенидам, нитридам, карбидам, так и к солям со сложными многоатомными анионами.
Электростатические взаимодействия в ионных кристаллических решетках, содержащих однозарядные катионы, не очень велики, и энергии гидратации ионов оказываются вполне соизмеримы с ними. Поэтому, за редкими исключениями, соли щелочных металлов хорошо растворяются в воде. Хуже других растворимы фториды, карбонат и фосфат лития и перхлораты калия, рубидия и цезия.
При сильном нагревании солей, особенно при внесении их в пламя горящего водорода или бытового газа, происходит ряд процессов приводящих к появлению характерной окраски пламени.
Соли щелочных металлов находят самое широкое применение как в лабораторной практике, так и в различных областях промышленности и медицины.
Особенно широко используются карбонат и гидрокарбонат натрия, известные под общим названием сода. В технике и в быту различают кристаллическую соду Na2 CO3 ?10H2 O, кальцинированную соду – безводный карбонат Na2 CO3 и питьевую соду – NaHCO3. Кроме того, следует упомянуть, что термин каустическая сода или каустик используется в технике для обозначения NaOH.
Основные потребители соды – стекольное, мыловаренное, бумажное, текстильное производство. Сода служит исходным продуктом для получения других солей натрия. Питьевая сода широко применяется в медицине. В лабораторной практике сода используется для нейтрализации кислот при несчастных случаях.
Приложение I
Таблица 1-1. Физико-химические свойства щелочных металлов
Величина
Li
Na
K
Rb
Cs
Энергия ионизации атомов I1,
Эв (кДж/моль)
5,4
(520)
5,1
(492)
4,3
(415)
4,2
(405)
3,9
(386)
Сродство атомов к электрону,
Эв (кДж/моль)
0,6
(57)
0,3
(29)
0,5
(48)
0,4
(39)
0,4
(39)
Электроотрицательность
1,0
1,0
0,9
0.9
0,9
Орбитальный радиус атома, нм
0,159
0,171
0,216
0,229
0,252
Энтальпия атомизации, кДж/моль
159
107
89
81
77
Температура плавления, °C
180
98
64
39
29
Температура кипения, °C
1340
886
761
690
672
Таблица 1-2. Основные сведения о щелочных металлах
Величина
3 Li
11 Na
19 Ka
37 Rb
55 Cs
87 Fr
Атомный вес
6,94
22,99
39,1
85,47
132,9
[223]
Валентные электроны
(2) 2s1
(8) 3s1
(8) 4s1
(8) 5s1
(8) 6s1
(8) 7s1
Металлический радиус
Атома, А
1,55
1,89
2,36
2,48
2,68
2,80
Радиус иона Э+, А
0,68
0,98
1,33
1,49
1,65
1,75
Энергия ионизации, Эв
Э° ® Э+
5,39
5,14
4,43
4,176
3,89
3,98
Содержание в земной
коре, ат. %
0,02
2,0
1,1
4?10-3
9?10-5
?
Природные изотопы
7Li
92,7%
23Na
100%
39Ka
93,1%
85Rb
72,15%
183Cs
100%
?
Таблица 1-3. Основные физические константы щелочных металлов
Величина
Li
Na
K
Rb
Cs
Плотность, г/см3
0,53
0,97
0,85
1,5
1,9
Твердость (алмаз 10)
0,6
0,4
0,5
0,3
0,2
S°298, дж/г-ат?град
28,1
51,2
64,2
76,2
84,3
Теплоемкость (H2 O 1)
0,83
0,29
0,17
0,08
0,05
Теплопроводность
11
21
14
8
5
DH°возг.298, кДж/г-ат
159,3
92,0
90,4
82,1
78,2
Т. пл., °C
179
98
63
39
29
Т. кип., °C
1350
900
776
680
666
Список использованной литературы
1. Н. С. Ахметов «Неорганическая химия», Москва изд. Высшая школа 1975г.
2. В. В. Пасынков «Материалы электронной техники», Москва изд. Высшая школа 1980г.
3. Ю. В. Ходаков, В. Л. Василевский «Металлы», Москва изд. Просвещение 1966г.
4. А. В. Суворов, А. Б. Никольский «Общая химия», Санкт-Петербург изд. Химия 1995г.
5. С. И. Венецкий «Рассказы о металлах», Москва изд. Металлургия 1986г.
Добавлено: 17 сентября 2021 в 18:40
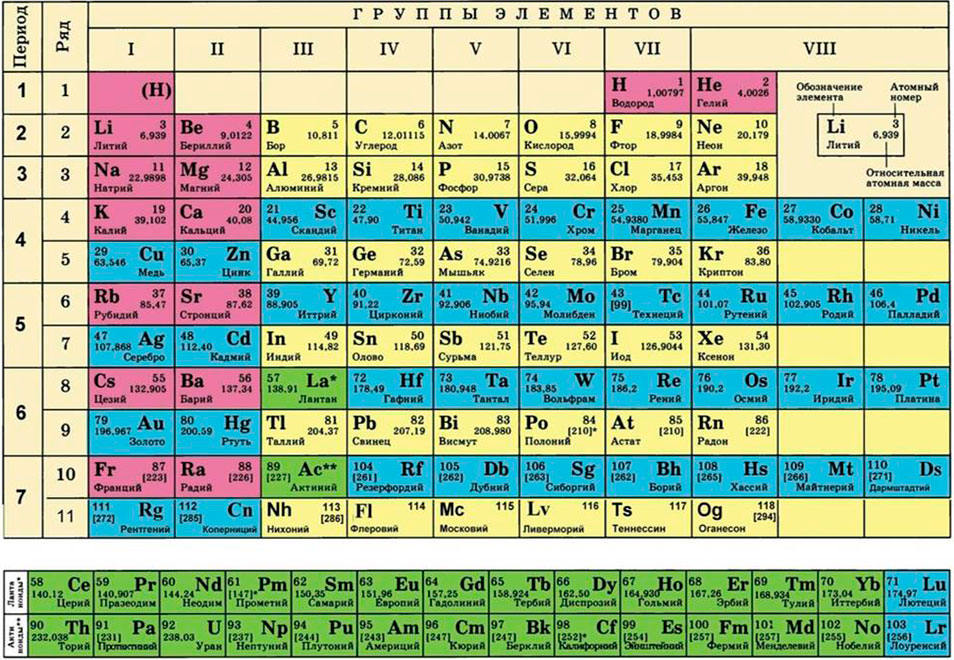
Таблица Менделеева — форма записи, которая в удобной форме объединяет обнаруженные человеком химические элементы (в том числе и вновь открываемые и официально признанные международным сообществом). Это азбука химии, которая дает представление о свойствах и разнообразии «простейших веществ».
Таблица или Периодическая система химических элементов — то, что должен уметь «читать» современный выпускник школы. Именно с нее начинается погружение в предмет на уроках или курсах химии для школьников.
Почему таблица Менделеева так важна
В 1869 году Дмитрий Менделеев работал над вторым томом своего учебника. Первый том был сдан «в печать», но над вторым пришлось призадуматься, ведь ученый не знал, как лучше классифицировать химические элементы. Впрочем, проблема позже превратилась в колоссальное открытие, которое прославило фамилию Менделеева не только в химической науке.
Все школьники помнят, что автор увидел свою таблицу во сне, а многие думают, что на этом заслуга химика и оканчивается.
В реальности все оказалось совсем не так, ведь за первым вариантом таблицы стоит колоссальный умственный труд по систематизации свойств элементов. Плоды этого труда были представлены в докладе Русскому химическому обществу, где прозвучал основной принцип организации таблицы: периодический, отражающий общность свойств сгруппированных в ней элементов.
Естественно, до Менделеева многие химики пытались упорядочить химические элементы (или то, что они считали таковыми) в поисках определенной закономерности. Менделеев понял, что физические и химические свойства элементов связаны с их атомной массой «периодическим» способом, и расположил их так, что группы элементов с аналогичными свойствами попадали в вертикальные столбцы в его таблице.
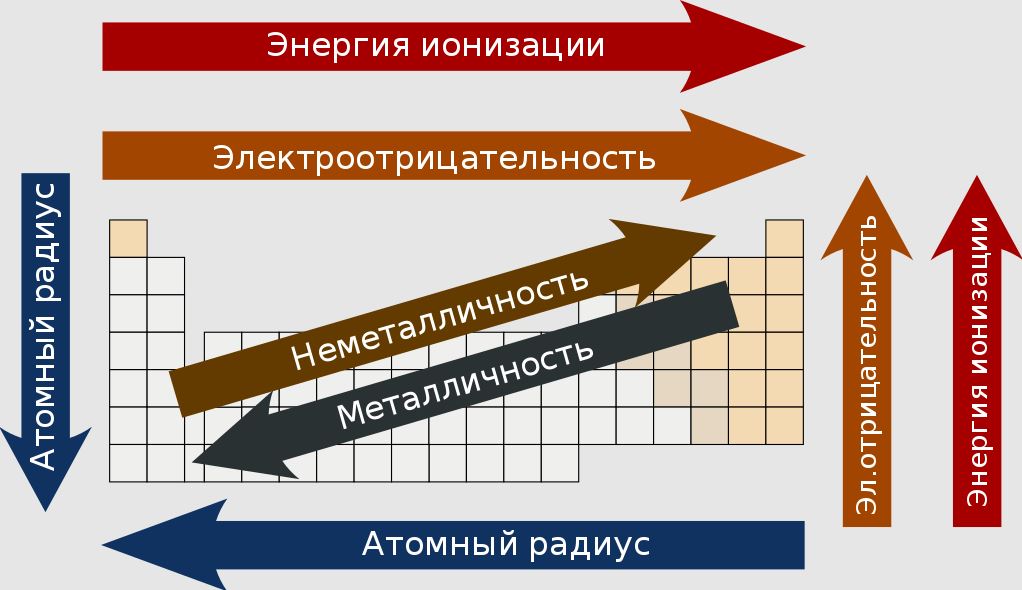
Таблица Менделеева: значение и структура
Предложенная автором система также не стала однозначным ответом, но она содержала признаки научного закона. При работе над таблицей Менделеев в определенных местах оставил пробелы, так как не нашел подходящего кандидата на конкретную позицию. Вместе с тем химику в голову пришла еще одна блестящая идея: он понял, что нужный элемент просто не открыли.
На основании своего подхода он смог определить атомную массу недостающих элементов и, таким образом, предсказать их свойства. Например, он предсказал свойства галлия, который был открыт в 1875 году. Позже были обнаружены два других предсказанных элемента, что еще раз подтвердило адекватность таблицы Менделеева. Когда ученые обнаружили недостающие части паззла с предсказанными Менделеевым характеристиками, периодическая система стала не просто таблицей, а инструментом для изучения химии.
Характеристики таблицы Менделеева
Ни первая попытка ученого построить периодическую систему, ни его самая популярная таблица 1870 года не очень похожа на таблицу Менделеева, которая сегодня висит на стене большинства кабинетов химии или появляется на обложках учебников. Существует около тысячи различных ее версий. Современные таблицы расширены за пределы первоначальных 63 элементов. Большинство текущих вариантов содержит 108 или 109 элементов.
Таблица Менделеева: значение и структура
В таблице химические элементы располагаются в порядке возрастания атомного номера. Они сгруппированы в столбцы (группы) и строки (периоды), что отражает их особенности:
- в группах представлены элементы со сходными химическими свойствами, что обусловлено электронными конфигурациями на их валентных оболочках. К примеру, в 1-й группе собраны щелочные металлы от лития до франция, у которых на внешней оболочке имеется один электрон. Его очень легко «оторвать» от атома, поэтому щелочные металлы являются сильными восстановителями. С ростом порядкового номера элемента в группах растут металлические и восстановительные свойстваа, увеличивается атомный радиус, снижается электроотрицательность;
- в периодах элементы расположены по мере возрастания их атомных или порядковых номеров. При этом, как правили, слева направо уменьшаются металлические свойства и атомные радиусы, растут окислительные свойства и электроотрицательность.

Таблица Менделеева: значение и структура
Существует три вида таблицы:
- короткая — с лантаноидами и актиноидами, вынесенными в отдельный блок, и группировкой периодов, начиная с четвертого. Эта форма записи отменена ИЮПАК (международной организацией химиков), но широко используется в школьных учебниках, поскольку более наглядна с точки зрения анализа химических свойств. В ней ;
- длинная — с лантаноидами и актиноидами, вынесенными в отдельный блок;
- сверхдлинная — в этом варианте каждый период занимает свою строку.
Каждая клеточка в таблице Менделеева содержит важную информацию:
- символ химического элемента в соответствии с международной классификацией, например, N — азот, Fe — железо (феррум) и т.д. Всего в таблице насчитывается 118 элементов. Из символы используются для обозначения элементов при записи химических реакций, формул веществ и в других случаях;
- атомный номер — число протонов, которое возрастает от первого элемента (водорода) к последующим. Количество электронов у каждого элемента может изменяться, а число протонов остается неизменным, определяя его основные свойства;
- относительная атомная масса — величина, которая показывает, во сколько раз масса атома конкретного элемента больше массы атома водорода — самого легкого элемента. Такой подход позволяет отойти от привычных граммов и килограммов, которые в масштабах атома неприменимы.
Анализ каждого элемента в таблице Менделеева и всего массива данных позволяет узнать многое о каждом из них и «предсказать», как будут вести себя вещества, составленные из них. Недаром на ОГЭ по химии разрешается пользоваться Периодической системой, ведь это умение также многое говорит о квалификации участника государственного экзамена.
Занимайтесь на курсах подготовки к ЕГЭ и ОГЭ (ГИА) в паре TwoStu и получите максимум баллов на ЕГЭ и ОГЭ!
Тест по
теме «Щелочные металлы и их соединения».
Вариант
1
Часть А (задание с
выбором ответа)
А1. Элементы
основной подгруппы 1 группы имеют названия
- Щелочные металлы
- Щелочноземельные металлы
- Галогены
- Переходные металлы.
А 2. Укажите
верное суждение: А) Щелочные металлы – это серебристо-белые мягкие вещества; Б)
Щелочные металлы — это легкие и легкоплавкие металлы.
- верно только А
- Верно только Б
- Верны оба суждения
- Оба суждения неверны.
А 3.Самый активный
щелочной металл
- Na
- K
- Li
- Cs
А4. Наиболее
легкоплавкий металл
1.
Rb
2.
Cs
3.
Li
4.
Na
А 5. Определите
вещество Х в схеме получения оксида натрия Na + X =Na2O
- O2
- NaH
- NaOH
- Na2O2
Часть В (задание с
кратким ответом)
В1 Расположите
щелочные металлы в порядке усиления восстановительной способности 1)Rb 2)Cs 3) Li 4)K 5)Na Ответ дайте в виде последовательности цифр.
В2. Расположите
щелочные металлы в порядке уменьшения скорости взаимодействия с водой 1)К,
2)Na 3)Сs 4)Rb
5)Li. Ответ дайте в виде последовательности цифр
В3. Установите
соответствие между формулой соединения и его названием. Ответ дайте в виде
последовательности цифр, соответствующих буквам по алфавиту.
ФОРМУЛА
СОЕДИНЕНИЯ НАЗВАНИЕ СОЕДИНЕНИЯ:
А) NaOH
1.Поташ
Б) Na2CO3*10 H2O
2. Поваренная соль
В) KOH
3.Каустик
Г) K2CO3
4. Кристаллическая сода
Д) NaCL
5. Едкое кали
В4. Установите
соответствие между свойствами ионов металла и формулой этого
соединения. Ответ дайте в виде последовательности цифр, соответствующим буквам
по алфавите.
СВОЙСТВА
ИОНА ФОРМУЛА ИОНА
А) главный внеклеточный ион,
1) Na+
содержится в крови и лимфе
Б) Основной внутриклеточный ион 2)
К+
В) Окрашивает пламя в желтый цвет
Г)Поддерживает работу сердечной мышцы
Д) окрашивает пламя в розово-фиолетовый цвет
Тест по
теме «Щелочные металлы и их соединения».
Вариант
2
Часть А (задание с выбором ответа)
А1. Элементы
основной подгруппы 1 группы имеют названия
- Галогены
- Щелочноземельные металлы
- Щелочные металлы
- Переходные металлы.
А 2. Укажите
верное суждение: А) Щелочные металлы с характерным блеском на свежесрезанной
поверхности; Б) Щелочные металлы – активно взаимодействуют со всеми
неметаллами.
- верно только А
- Верно только Б
- Верны оба суждения
- Оба суждения неверны.
А 3.Самый активный
щелочной металл
- K
- Na
- Fr
- Cs
А4. Обладает
наибольшей плотностью
- Rb
- Cs
- Li
- Na
А 5. Определите
вещество Х в схеме получения пероксида натрия:Na + X =Na2O2
- O2
- NaH
- NaOH
- Na2O2
Часть В (задание с
кратким ответом)
В1 Расположите
щелочные металлы в порядке ослабления металлических свойств : 1)Rb 2)Cs 3) Li 4)K 5)Na. Ответ дайте в виде последовательности цифр.
В2. Расположите
щелочные металлы в порядке увеличения скорости взаимодействия с водой
1)К, 2)Na 3)Сs 4)Rb 5)Li.
Ответ дайте в виде последовательности цифр
В3. Установите
соответствие между формулой соединения и его названием. Ответ дайте в виде
последовательности цифр, соответствующих буквам по алфавиту.
ФОРМУЛА СОЕДИНЕНИЯ НАЗВАНИЕ
СОЕДИНЕНИЯ:
А) NaOH
1.Глауберовая соль
Б) Na2CO3*10 H2O 2. Поваренная соль
В) KOH
3.Каустик
Г) K2SO4*10H2O 4.
Кристаллическая сода
Д) NaCI
5. Едкое кали
В4. Установите
соответствие между формулой соли и ее применением. Ответ дайте в виде
последовательности цифр, соответствующим буквам по алфавиту
ФОРМУЛА СОЕДИНЕНИЯ
ПРИМЕНЕНИЕ
А) K2CO3 1)для
производства мыла и волокон
Б) NaOH
2)для приготовления тугоплавкого стекла
В) Na2CO3*10 H2O 3)для производства стекла, бумаги, мыла
Г) NaCL
4)слабительное средство
Д) K2SO4*10H2O 5)приправа к пище
Ответы к тестам
«Щелочные металлы и их соединения».9 класс
Вариант 1.
Вариант 2
А1
-1 А1-3
А2-4
А2 –4
А3-4
А3- 3
А4-2
А4.-2
А5-4
А5.-1
В1- 3, 5, 4, 1, 2 В1.-2,1,4,5,3
В2. – 4, 3, 1, 2, 5 В2.-
5, 2, 1, 4, 3
В3. –А-3, Б-4, В-5,
Г-1, Д-2 В3.-А-1,Б-4, В-5, Г-1, Д-2
В4. А-1, Б-2, В-1, Г-2, Д-2
В4.В-5 А-2, Б-1, В-3, Г-5, Д -4 (вариант -2)


