Презентация на тему Презентация по химии на тему Угольная кислота и её соли, предмет презентации: Химия. Этот материал в формате pptx (PowerPoint) содержит 18 слайдов, для просмотра воспользуйтесь проигрывателем. Презентацию на заданную тему можно скачать внизу страницы, поделившись ссылкой в социальных сетях! Презентации взяты из открытого доступа или загружены их авторами, администрация сайта не отвечает за достоверность информации в них, все права принадлежат авторам презентаций и могут быть удалены по их требованию.
Слайды и текст этой презентации

Эпиграф урока:
«…У школьного мела,
у стен дворца и у стен пирамиды
один источник, одна основа….»
Урок химии в 9 классе.
Учитель химии МБОУ «Кубанская школа» Мамутова З.Б.

Ж.Верн «Таинственный остров»
Уголь – ценнейшее из полезных ископаемых, – ответил инженер, — и природа как будто решила доказать это, создав алмаз, ибо он, в сущности, не что иное, как кристаллический углерод.
Какие аллотропные модификации углерода, кроме алмаза вам известны?
Б) озон
К) графит
А) карбин
Р) фуллерен
По страницам литературных произведений …

Русская народная сказка «Мороз Иванович»
Между тем Рукодельница воротится, воду процедит, в кувшины нальет, да еще какая затейница: коли вода нечиста, так свернет лист бумаги, положит в нее угольков да песку крупного насыплет, вставит ту бумагу в кувшин да нальет в нее воды, а вода-то, знай проходит сквозь песок да сквозь уголья и капает в кувшин чистая, словно хрустальная.
Какие методы очистки использует Рукодельница?
Б) фильтрование
А) дистилляция
О) адсорбция
М) кристаллизация

А.К.Дойл «Случай с переводчиком»
«Угарный газ! – вскричал Холмс.- Подождите немного. Сейчас он уйдет. Заглянув в дверь, мы увидели, что комнату освещает только тусклое синее пламя, мерцающее в маленькой медной жаровне посредине… В раскрытую дверь тянуло страшным ядовитым чадом, от которого мы задыхались и кашляли.»
Почему Холмс и его спутники не могли по описанным признакам определить присутствие угарного газа в помещении:
Н) угарный газ не имеет запаха
Г) угарный газ имеет приятный запах
А) при отравлении угарным газом человек не кашляет

В.Короткевич «Черный замок Ольшанский»
Вы слышали об эффекте «собачьей пещеры» в Италии? Есть там такая пещера-яма. Человек войдет и ходит, а собака или кролик погибают через несколько минут.
— Почему?
— Из вулканической трещины выделяется углекислый газ…
Почему в «собачьей пещере» человек остается живым, а собаки и другие мелкие животные гибнут?
Т) СО2 тяжелее воздуха и скапливается внизу
А) СО2 безопасен для человека, но вреден для животных
Ж) человек входит в пещеру в противогазе

Г. Хаггард «Клеопатра»
«… она вынула из уха одну из 3-х огромных жемчужин и опустила жемчужину в ……. ? Наступило молчание, потрясённые гости, замерев, наблюдали, как несравненная жемчужина медленно растворяется, Вот от неё не осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая, и выпила всё до последней капли».
В чём же растворила жемчужину Клеопатра?
Е) винном уксусе
Ы) уксусной кислоте
Э) воде
КАРБОНАТЫ

Цель:
ознакомиться со свойствами угольной кислоты, ее солей и отдельных представителей этих солей;
повторить соли средние и кислые на примере карбонатов и гидрокарбонатов,
показать их взаимосвязь на примере перехода карбонатов в гидрокарбонаты;
показать практическое значение карбонатов в жизни человека и в природе
научить распознавать карбонат-ионы в соединении.
Полученные знания и умения вам пригодятся в практической деятельности и повседневной жизни для:
безопасного обращения с веществами и материалами
критической оценки информации о веществах, используемых в быту.
Тема урока: «Угольная кислота и её соли.
Круговорот углерода».

Глава первая “Открываем тайну”
Угольная кислота
H2CO3
Каким самым простым способом можно получить угольную кислоту?
СО2 + Н2О= Н2СО3
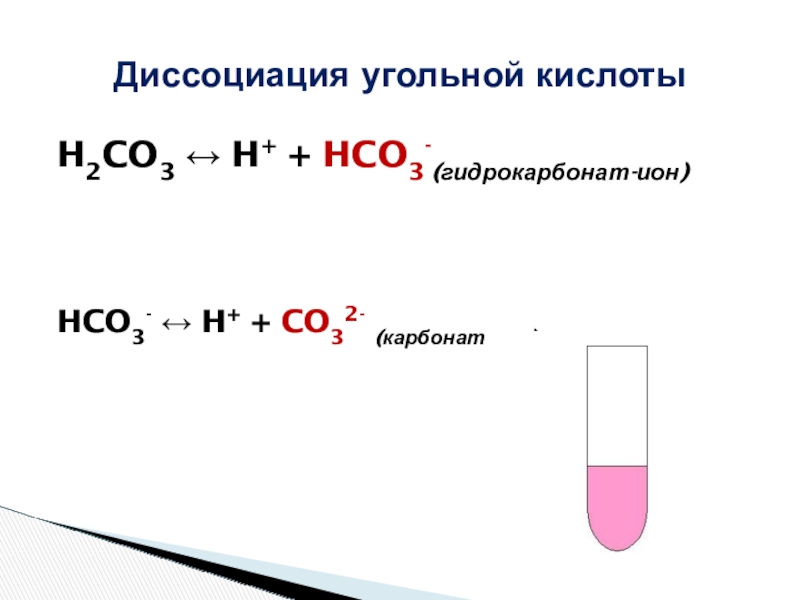
H2CO3 ↔ H+ + HCO3-(гидрокарбонат-ион)
HCO3- ↔ H+ + CO32- (карбонат-ион)
Диссоциация угольной кислоты

Глава вторая
“Соли угольной кислоты”
средние –карбонаты
кислые –гидрокарбонаты
CaCO3
NaHCO3 –
питьевая сода
мел
мрамор
известняк
K2CO3-поташ

Установите соответствие:
Вывод: Все карбонаты – твёрдые кристаллические вещества. Гидрокарбонаты растворимы в воде. Карбонаты не растворимы, кроме солей K+, Na+, NH4+ .

физминутка для глаз

Глава третья “Химические превращения”
Общие свойства солей:
1) с растворимыми солями
Na2CO3 + CaCl2 =
2) Разложение гидрокарбонатов при нагревании
NaHCO3 t˚C →
3) Разложение нерастворимых карбонатов при нагревании
CaCO3 t˚C →
4) Взаимопревращения карбонатов и гидрокарбонатов (Видеоопыт)
Са(ОН)2 + СО2 →
Са(НСО3)2 t→

Лабораторный опыт № 7 Качественная реакция на карбонат – ион
СaCO3
Глава четвертая “Качественная реакция”.
HCl
→
Составьте уравнения реакций в ионном виде.
По сокращенному ионному уравнению сделайте вывод: какие вещества
являются качественными реактивами на СO32- и HCO3- ?
ТБ
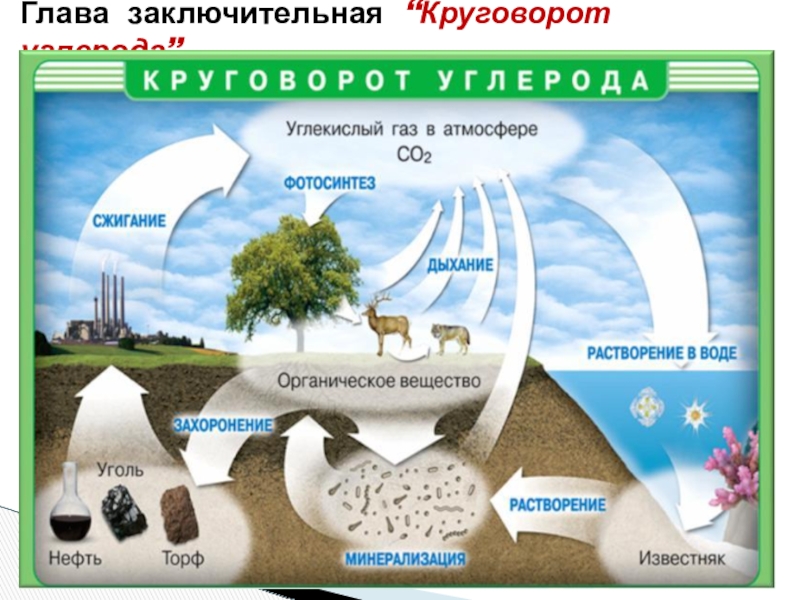
Глава заключительная “Круговорот углерода”

Обобщение
1. Осуществите превращения по схеме:
Ca → CaC 2→ Ca ( OH )2→ CaCO 3→ CO 2→ C
2) CO2 → H2CO3 → Na2CO3 → CO2
3) CaCO3 → CO2 → NaHCO3 → Na2CO3
2. Решите задачу
Какой объём углекислого газа выделится при обжиге карбоната кальция массой 200 г

§35, 36.
1 группа — № 2 стр. 128;
2 группа — №5,6 стр. 129
Домашнее исследование:
Выясните:
Почему нельзя пить много газированной воды?
Домашнее задание
Презентация на тему Презентация Химическая сказка о кислороде, из раздела: Химия. Эта презентация содержит 16 слайда(ов). Информативные слайды и изображения помогут Вам заинтересовать аудиторию. Скачать презентацию на данную тему можно внизу страницы, поделившись ссылкой с помощью социальных кнопок. Также можно добавить наш сайт презентаций в закладки! Презентации взяты из открытого доступа или загружены их авторами, администрация сайта не отвечает за достоверность информации в них. Все права принадлежат авторам презентаций.
Слайды и текст этой презентации
Открыть в PDF

ХИМИЧЕСКАЯ
сказка о Кислороде

Автор проекта:
ученица 8а класса
МОУ «Средняя общеобразовательная школа №20»
Касилина Татьяна
Технический оператор проекта:
ученик 9а класса
МОУ «Средняя
общеобразовательная школа №20»
Рой Дмитрий
Руководитель проекта: учитель химии высшей квалификационной категории
МОУ «Средняя общеобразовательная школа №20» Мартынова В.А.

В химическом царстве жили-были: Водород, Кислород, Бор, Сера, Магний, Азот, Аргон, Хлор и многие другие. Жили весело, не тужили…

К
В
F
Br
Ba
Cr
Cu
Fe
Zn
Na
Si
Mg
Al
Нельзя сказать, что у всех них был добрый, ровный, покладистый характер. Кто-то с кем-то дружил, а иной стремился избежать этой дружбы.
О
Н

И иногда между ними происходили встречи: приятные и не очень.

В квартире №8 в шестом подъезде, на втором этаже, жил самый распространенный авторитетный элемент – дядюшка Кислород.
На первый взгляд, он себя ничем не проявлял. Он часто заходил в гости к своим соседям – тетушке Сере и дядюшке Азоту, и крайне редко захаживал к господину Фтору.

Кислород очень любил общаться, правда, после общения с ним элементы сильно изменялись. Он превращал всех в оксиды.

Встретятся два закадычных друга Кислород и Азот — вот и веселятся «на всю катушку».
А к Сере заглянет, то, не дай бог, у неё уже в гостях госпожа Вода! Тогда разъедающих последствий от кислоты не избежать.

Посещения г.Фтора заканчивались одним и тем же. Фтор всегда настаивал на своем и оказывался прав.

Особенно уважали и любили Кислород Щелочные металлы. Хоть и были не богаты электронами, но всегда встречали Кислород приветливо и радушно.

Был у дядюшки родной братец Озон. Он постоянно проживал в хвойном лесу и любил экстремальные ситуации. На прогулку выходил только во время грозы. Озон был активнее брата, поэтому часто ввязывался в разные истории.

Дядюшка Кислород являлся почетным членом общества «Воздух», основателем которого был господин Лавуазье

Люди уважали дядюшку Кислорода за то, что он был трудолюбив и никогда не отказывался от любого дела, будь то производство веществ или фотосинтез, дыхание или горение.

И, наконец, старый добрый дядюшка Кислород
и не менее уважаемый
дядюшка Водород
подарили людям волшебную жидкость Акву, которая является основой всей жизни.

«Кислород – это вещество, вокруг которого вращается земная химия»
Берцелиус

СПАСИБО ЗА ВНИМАНИЕ!
Цель:
Оборудование:
Просмотр содержимого документа
«Химия 10 класс Практическая работа №2. «Получение этилена и опыты с ним»»
Практическая работа 2.
«Получение этилена и опыты с ним»
Цель:
закрепить знания учащихся по теме «Алканы. Алкены», научить получать этилен и проводить с ним опыты;
совершенствовать умение получать газообразные вещества в простейших приборах, соблюдая правила техники безопасности;
воспитывать чувство ответственности, коллективизма.
Оборудование:
на столах учащихся: лабораторный штатив с лапкой, спиртовка, спички, пробирки в штативе, газоотводная трубка, песок, бромная вода, раствор перманганата калия, этиловый спирт, концентрированная серная кислота.
Ход урока
1. Инструктаж по технике безопасности под роспись.
Затем вместе разбираем ход практической работы по пунктам, останавливаюсь
подробно на предельной осторожности при проведении практической работы.
2. Учащиеся начинают оформлять практическую работу в тетрадях для
практических работ: записывают число, тему, цель, оборудование.
3. Затем выполняют практическую работу. Выданную пробирку с уже готовой
смесью этилового спирта (2 – 3 мл), концентрированной серной кислоты
(6 – 9 мл) и прокаленного песка закрывают газоотводной трубкой, укрепляют
в лабораторном штативе и начинают осторожно нагревать, начиная с прогрева
всей пробирки.
а) C 2 H 5 OH → H 2 C = CH 2 + H 2 O
этиловый спирт этилен
Конец газоотводной трубки опускают в пробирку, в которую налито 2-3 мл
бромной воды. Через некоторое время выделяющийся газ обесцвечивает
бромную воду. Это значит, что произошла химическая реакция, и образовалось
новое вещество:
б) H 2 C = CH 2 + Br 2 → CH 2 Br – CH 2 Br
этилен 1,2 – дибромэтан
4. После того, как обесцветилась бромная вода, в другую пробирку налить 2-3 мл
разбавленного раствора перманганата калия, подкисленного серной кислотой,
и также пропустить через него образующийся газ. Через некоторое время
окраска исчезает, раствор становится прозрачным, значит также здесь
произошла химическая реакция и образовалось новое вещество:
H 2 C = CH 2 + [O] + H 2 O → CH 2 – CH 2
этилен ׀ ׀
этиленгликоль
5. После проделанных опытов вынуть газоотводную трубку из пробирки и
выделяющийся газ поджечь, он горит светящимся пламенем. Этилен, как и все
углеводороды горит с образованием углекислого газа и воды:
C 2 H 4 +3O 2 → 2CO 2 + 2H 2 O
6. После окончания работы на рабочем столе навести порядок и приступить к
оформлению работы в тетради: описать весь ход работы, зарисовать
рисунок 19 на стр. 56, по ходу работы написать уравнения соответствующих
реакций, в конце работы сделать вывод, при этом ответить на все вопросы для
самостоятельных выводов, в конце урока тетради сдаются на проверку.
учени 10 класса
_____________________________
Лабораторные опыты
Лабораторный опыт №1
Дата
_________
Определение элементарного состава органических соединений
Цель:
научиться определять элементарный состав органических веществ.
Оборудование и реактивы:
химический стакан, парафиновая свеча, лучинка, известковая вода.
Ход работы
Что делали
Что наблюдали
Вывод
Вывод
Лабораторный опыт №2
Дата
_________
Изготовление моделей молекул углеводородов.
Цель:
научиться собирать модели простейших углеводородов.
Оборудование и реактивы:
пластилин 2 –х цветов, спички.
Содержание и порядок выполнения опыта
см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.174.
Ход работы:
Рисунок
Описание строения
Модель молекулы метана
Модель молекулы бутана
Модель молекулы изобутана
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 3
Дата
_________
Обнаружение непредельных соединений в жидких нефтепродуктах.
Цель:
научиться обнаруживать непредельные соединения в жидких нефтепродуктах.
Оборудование и реактивы:
жидкие нефтепродукты, раствор йода, раствор перманганата калия.
Содержание и порядок выполнения опыта
Ход работы
п/п
Реагенты для распознавания веществ
Наблюдения
Выводы
Раствор перманганата калия
Раствор йода
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 4
Дата
_________
Получение и свойства ацетилена.
Цель:
изучить лабораторный способ получения ацетилена, выяснить его свойства.
Оборудование и реактивы:
пробирки, пробка с газоотводной трубкой, штатив, вода, карбид кальция, раствор перманганата калия.
Содержание и порядок выполнения опыта
см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.175.
Ход работы
Что делали
Что наблюдали
Вывод
Запишите уравнения проведенных реакций:
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 5
Дата
_________
Ознакомление с коллекцией «Нефть и продукты ее переработки».
Цель:
ознакомление с коллекцией «Нефть и продукты ее переработки».
Оборудование и реактивы:
коллекция «Нефть и продукты ее переработки».
Содержание и порядок выполнения опыта
см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.175- 176.
Ход работы
№ п/п
Образец
Цвет
Формула
Процессы, лежащие в основе производства
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 6
Дата
_________
Свойства этилового спирта.
Цель:
изучить свойства этилового спирта.
Оборудование и реактивы:
этиловый спирт, дистиллированная вода, подсолнечное масло, медная проволока, пробирки, спиртовка, фильтровальная бумага.
Содержание и порядок выполнения опыта
см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.176.
Ход работы
Что делали
Что наблюдали
Вывод
Запишите уравнения проведенных реакций:
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 7
Дата
_________
Свойства глицерина.
Цель:
изучить свойства глицерина.
Оборудование и реактивы:
дистиллированная вода, глицерин, раствор щелочи (NaOH
II
)), пробирки.
Содержание и порядок выполнения опыта
см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.174.
Ход работы
Что делали
Что наблюдали
Вывод
Запишите уравнения проведенных реакций:
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 8
Дата
_________
Свойства формальдегида.
Цель:
изучить свойства формальдегида.
Оборудование и реактивы:
аммиачный раствор оксида серебра, формалин, раствор щелочи (NaOH
), раствор медного купороса (сульфат меди (II
)), пробирки, стакан с горячей водой.
Содержание и порядок выполнения опыта
Ход работы
Что делали
Что наблюдали
Вывод
Запишите уравнения проведенных реакций:
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 9
Дата
_________
Свойства уксусной кислоты.
Цель:
изучить свойства уксусной кислоты.
Оборудование и реактивы:
раствор уксусной кислоты, раствор лакмуса, раствор щелочи (NaOH
), цинк (гранулы), оксид меди (II
), мел или сода, пробирки.
Содержание и порядок выполнения опыта
см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.177.
Ход работы
Что делали
Что наблюдали
Вывод
Запишите уравнения проведенных реакций:
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 10
Дата
_________
Свойства жиров.
Цель:
изучить свойства жиров.
Оборудование и реактивы:
дистиллированная вода, спирт, бензин, подсолнечное масло, пробирки, фильтровальная бумага,
Содержание и порядок выполнения опыта
см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.177 — 178.
Ход работы
Что делали
Что наблюдали
Вывод
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 11
Дата
_________
Сравнение свойств растворов мыла и стирального порошка.
Цель:
сравнить свойства растворов мыла и стирального порошка.
Оборудование и реактивы:
раствор мыла, раствор стирального порошка, раствор фенолфталеина, жесткая вода (раствор хлорида кальция), пробирки.
Содержание и порядок выполнения опыта
Ход работы
Что делали
Что наблюдали
Вывод
В каком случае приходится прибавлять больше раствора для образования устойчивой пены? ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Какой препарат не утрачивает своей моющей способности в жесткой воде? Почему? ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 12
Дата
_________
Свойства глюкозы.
Цель:
изучить свойства глюкозы.
Оборудование и реактивы:
раствор глюкозы, раствор медного купороса (сульфат меди (II
)), раствор щелочи (NaOH
), аммиачный раствор оксида серебра, пробирки, спиртовка.
Содержание и порядок выполнения опыта
см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.178.
Ход работы
Что делали
Что наблюдали
Вывод
Запишите уравнения проведенных реакций: ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 13
Дата
_________
Свойства крахмала.
Цель:
изучить свойства крахмала.
Оборудование и реактивы:
порошок крахмала, вода, стакан с горячей водой, спиртовой раствор йода, пробирки, спиртовка.
Содержание и порядок выполнения опыта
Ход работы
Что делали
Что наблюдали
Вывод
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 14
Дата
_________
Свойства белков.
Цель:
изучить свойства белков.
Оборудование и реактивы:
раствор белка, раствор щелочи (NaOH
), раствор медного купороса (сульфат меди (II
)), раствор азотной кислоты, раствор нашатырного спирта, шерстяные нитки, вода, пробирки, спиртовка.
Содержание и порядок выполнения опыта
см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.179.
Ход работы
Что делали
Что наблюдали
Вывод
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 15
Дата
_________
Ознакомление с образцами пластмасс и каучуков.
Цель:
ознакомление с образцами пластмасс и каучуков.
Оборудование и реактивы:
образцы пластмасс, волокон, каучуков.
Содержание и порядок выполнения опыта
см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.179.
Ход работы
Группы веществ
Образец
Реакция получения
полимеризации
поликонденсации
Природные
Искусственные
Синтетические
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Практические работы
Практическая работа №1
Дата
__________
Идентификация органических веществ.
Цель
:…………………………………………………………………………………………..……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Содержание и порядок выполнения опыта
см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.180 -181.
Задание 1.
Вариант № ____
Оборудование и реактивы:
………………………………………………………………………………….
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Ход работы:
Что делали
Что наблюдали
Вывод
Запишите уравнения проведенных реакций: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Задание 2.
Оборудование и реактивы:
раствор глюкозы, …………………………………………………………….
…………………………………………………………………………………………………………………
Ход работы:
Что делали
Что наблюдали
Вывод
Задание 3.
Оборудование и реактивы:
раствор глицерина, формальдегида, глюкозы, ……………………………
…………………………………………………………………………………………………………………
Ход работы:
Что делали
Что наблюдали
Вывод
Задание 4.
Оборудование и реактивы:
картофель, белый хлеб, спелое яблоко, ……………………………………..
…………………………………………………………………………………………………………………
Ход работы:
Что делали
Что наблюдали
Вывод
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Отметка ___________
Практическая работа № 2
Дата
__________
Распознавание пластмасс и волокон.
Цель
:…………………………………………………………………………………………..……………………………………………………………………………………………………………………………………………………………………………………………………
Содержание и порядок выполнения опыта
см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.181 — 182.
Задание 1.
Оборудование и реактивы:
полиэтилен, поливинилхлорид.
Ход работы:
Формула
Описание
Полиэтилен
Поливинилхлорид
Задание 2.
Оборудование и реактивы:
хлопок, шерсть, ацетатное волокно, капрон, ………………………………………………………………………………………………………………..
Ход работы:
Формула
Описание
Хлопок
Шерсть
Ацетатное волокно
Капрон
Вывод
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Отметка ___________
Использованная литература:
О.С.Габриелян «Химия.10 кл.» базовый уровень, Москва.: Дрофа, 2012
Перечень лабораторных работ по «Химии»
Лабораторная №1: 2 части. «Основные классы
химических соединений, кислоты, основания, соли»
Лабораторная №2:2 части. «Неметаллы и их соединения»
Лабораторная №3: 3 части. «Металлы»
Лабораторная №4:2 части. «Моделирование молекул углеводородов.»
Лабораторная №5: « Спирты, фенолы»
Лабораторная №6: «Альдегиды, кетоны, карбоновые кислоты»
Лабораторная № 7: «Сложные эфиры и жиры»
Лабораторная № 8: «Углеводы»
Лабораторная №9: «Азотсодержащие соединения »
- ОСНОВНЫЕ КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ КИСЛОТЫ, ОСНОВАНИЯ, СОЛИ
Лабораторная работа № 1
ЦЕЛЬ РАБОТЫ:
Изучить свойства кислот, оснований, солей.
ОБОРУДОВАНИЕ:
Штатив, пробирки, спиртовка.
Металлы:
натрий, кальций, цинк, железо, индикаторы м/о ф/ф, лакмус.
Кислоты:
соляная, серная,
основание:
гидроксид натрия, дистиллированная вода, держалки, бюретки на 25 мл, воронки, вода, CuO
,
CuSO
4
,
раствор Na
2
CO
3
, AL(NO
3
)
3
, NaCI, ZnCI
2
.
Выполнение работы.
Опыт 1: общие свойства кислот, оснований.
Налить в три пробирки понемногу дистиллированной воды и прибавить раствор лакмуса, отметить цвет лакмуса в воде. В одну из пробирок с раствором лакмуса прибавить кислоту, а в другую щелочь. Наблюдать изменения окраски. Проделать тоже самое, взяв вместо лакмуса фенолфталеин и метилоранж.
Опыт 2: свойства кислот и оснований.
В пробирку налить 1 мл кислоты и опустить кусочек цинка. Что наблюдается
Написать уравнение реакции.
Опыт 3: реакция нейтрализации между кислотой и гидроксидом
Натрия.
В пробирку налить 1 мл раствора NаОН и добавить каплю фенолфталеина. Что произошло
В эту пробирку осторожно влить раствор кислоты до исчезновения окраски.
Написать уравнение реакции. Сделать вывод.
Опыт 4: получение оснований (демонстрация).
Кусочек металлического натрия или кальция опустить в выпарительную чашку. Что происходит
Как доказать, что образовалось основание
Записать уравнение реакций. Использовать индикатор для доказательства.
Опыт 5: общие свойства солей, гидролиз солей, получение солей.
Получение солей. Проделать опыты:
- Взаимодействие оксида меди с серной кислотой (при t)
- Взаимодействие кислоты с основанием, кислоты с солью.
- Взаимодействие цинка с раствором сульфата меди.
Сделать вывод.
Напишите уравнения реакций
Опыт 6. Гидролиз солей
Выполнение работы.
Налить в пробирку раствора соли (Na
2
CO
3
, Al(NO
3
)
3
,NaCl, ZnCl
2
и т. д.) и испытать его на лакмус или фенолфталеин, или метилоранж. Наблюдения занести в таблицу.
| Формула соли | Среда раствора | Чем образована соль | ||
| нейтральная | кислая | щелочная | ||
| Na | ||||
| Al(NO | ||||
| NaCl | ||||
| ZnCl |
Сделать вывод о реакции гидролиза среды
и записать уравнения реакций гидролиза солей в молекулярной и ионной форме.
Контрольные вопросы.
- Дать определения: кислота, соль, основание.
- Определить степени окисления элементов в соединениях:
Мg(NO
3
)
2
, Na
3
PO
4
, Н
2
СО
3
, К
2
Cr
2
O
7
, Н
2
CO
3
.
- Осуществите превращения:
- FeCl
3
Fe(OH)
3
Fe
2
O
3
Fe
2
(SO
4
)
3
Fe(ОН)
3
. - Сl
2
HCl
ZnCl
2
Zn(OH)
2
Na
2
ZnО
2
.
- Запишите уравнения реакций гидролиза солей в молекулярном и ионном виде, определите реакцию среды:
Na
2
S, Na
3
PO
4
, CuCl
2
, КCl
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Тема: Неметаллы и их соединения.
Лабораторная работа № 2
ЦЕЛЬ РАБОТЫ:
Изучить способ получения оксида углерода (4), его свойства, пронаблюдать изменения свойств на примере галогенов.
ОБОРУДОВАНИЕ:
Аппарат Киппа, Штатив с пробирками, химические стаканы, спиртовка, мрамор, известковая вода, лакмус, соляная кислота, раствор NaOH, спички, спирт, вата, лучинки, вода, метилоранж, газоотводная трубка, пробка, фарфоровая чашка. Соли МgCO
3
, ВаСО
3
, Na
2
СО
3
, разбавленная НСl, хлорная вода, фуксин или индиго. Раствор Кj и КВr
2
Выполнение работы.
Опыт 1: получение и свойства углекислого газа.
В собранный прибор для получения газа поместить 2 – 3 кусочка мрамора или мела и через воронку прилить разбавленную соляную кислоту (1:4). Выделяющимся углекислым газом наполнить последовательно три стакана и закрыть их картоном. О наполнении можно судить по затуханию горячей лучинки, поднесенной к отверстию стакана. Стаканы с углекислым газом сохраняем для следующих опытов. Записать уравнение реакции получения углекислого газа.
Опыт 2: свойства углекислого газа.
В стакан бросить маленький кусочек ваты, смоченной спиртом и поджечь его горящей лучинкой. Затем осторожно перелить в него (как воду) углекислый газ из одного наполненного в предыдущем опыте стакане. Горение спирта прекращается.
Сделать вывод.
Опыт 3: растворимость углекислого газа в воде.
В пробирку прилить синего лакмуса или метилоранжа и через раствор пропустить углекислый газ. Что вы наблюдаете
Напишите уравнение реакции.
Сделать вывод.
Опыт 4: свойства известковой воды.
Налить в пробирку на одну четверть ее объема известковой воды и пропустить через раствор углекислый газ. Наблюдать образование белого осадка. Напишите уравнение реакции.
Опыт 5:взаимодействие углекислого газа с гидроксидом натрия.
Пробирку наполнить углекислым газом, пробкой и опрокинуть в фарфоровую чашку с разбавленным раствором гидроксида натрия. Под жидкостью открыть пробку. Жидкость входит в пробирку. Записать наблюдения. Записать уравнение реакции между гидроксидом натрия и углекислым газом.
Опыт 6: действие кислот на соли угольной кислоты.
Насыпать в одну пробирку немного МgСО
3
в другую ВаСО
3
или Na
2
СО
3
и в пробирку прилить разбавленную соляную кислоту. Наблюдать растворение солей и выделение газов, написать уравнение в молекулярном и ионном виде.
Тема:
Свойства соединений серы.
Цель:
Определить качественную реакцию на ионы
1.
и его соли
2. Свойства иона
3. Составить полное, ионное и сокращенное уравнение
4. Определить степень окисления и составить ОВР.
ОБОРУДОВАНИЕ:
1. практикум
2. таблицы
3. набор химической посуды и реагентов.
ХОД РАБОТЫ.
Опыт №1.
Качественная работа на ион
А) К 1мл раствора серной кислоты прилили 2-3 капли раствора соли Наблюдение: выпал белый кристаллический осадок
H
2
SO
4
+ BaCL
2
= BaSO
4
+ 2HCl
Вывод:
Б) К 1 мл раствора соли
Na
2
SO
4
прилили 2-3 капли раствора соли
BaCl
2
Наблюдение
Na
2
SO
4
+
BaCl
2
= BaSO
4
+ 2NaCl
Вывод:
Опыт №2 Восстановительные свойства соединений сернистой кислоты и ее соли.
А) К 1мл раствора соли KMnO
4
прилили 5-6 капель раствора H
2
SO
4
и 0,5 мл раствора Na
2
SO
3
Наблюдения:
KMnO
4
+ H
2
SO
4
+ Na
2
SO
3
= MnSO
4
+ Na
2
SO
4
+ K
2
SO
4
+ H
2
O
Mn
+7
+ 5e = Mn
+2
10
S
+4
– 2e = S
+6
10
Б) К 1 мл раствора соли KMnO
4
прилили 2-3 капли раствора KOH и 0,5 мл раствора соли Na
2
SO
3
Наблюдение: малиновый раствор стал изумрудного цвета, а затем стал бурым.
KMnO
4
+ KOH + Na
2
SO
3
= K
2
MnO
4
+ Na
2
SO
4
+ KOH
Mn
+7
+ 1e = Mn
+6
2
S
+ 4
– 2e = S
+6
2
Вывод:
Выполнить задание:
1.
Записать уравнение качественной реакции:
1.1
на ион
1.2
на ион
2.
Записать уравнение диссоциации кислот: серной, сернистой, сероводородной.
Контрольные вопросы
МЕТАЛЛЫ.
Лабораторная работа № 3
ЦЕЛЬ РАБОТЫ:
Изучить свойства металлов и их соединений.
ОБОРУДОВАНИЕ:
Штатив, пробирки, спиртовка, держалки, раствор СuSO
4
, гвоздики, известковая вода, стеклянные трубочки, спирт, вата.
Выполнение работы.
Опыт 1: вытеснение металлов из растворов солей другими
Металлами.
Налить 2 – 3 мл. в пробирки раствора сернокислой меди и опустить гвоздик (Fe). Наблюдать что происходит
Написать уравнение реакции в молекулярном и ионом виде.
Опыт 2: превращение карбонатов кальция в гидрокарбонат и
Гидрокарбоната в карбонат.
Налить четверть пробирки известковой воды и пропустить через раствор углекислый газ. Наблюдать что происходит
Продолжить пропускать углекислый газ до получения прозрачного раствора. Раствор сохранить для дальнейшего использования.
2. Разлить полученный прозрачный раствор в две пробирки. Одну пробирку с раствором нагреть до кипения, а в другую прилить известковой воды. Наблюдать что происходит. Записать наблюдения. Написать уравнение реакций по схеме:
Са(ОН)
2
+ СО
2
СаСО
3
+ СО
2
+Н
2
О
Са(НСО
3
)
2
CаСО
3
+ Са(ОН)
2
СаСО
3
Опыт 3: взаимодействие щелочных металлов с водой. (Демонстрация)
Налить воды в фарфоровую чашку (или кристаллизатор) и опустить кусочек металлического натрия, затем повторить с кальцием. Что наблюдается
Проверить раствор индикатором – фенолфталеином. Записать уравнение реакции.
Сделать вывод об активности щелочных и щелочно-земелных металлов
.
ОБОРУДОВАНИЕ:
Штатив, пробирки, фарфоровая чашка, металлы, натрий, кальций, фенолфталеин, раствор соли МnSO
4
, серная и соляная кислота, соль алюминия Na
2
СО
3
, вода, индикатор – лакмус.
Опыт 4: получение гидроксида марганца (2) исследования его
Свойств.
К раствору соли MnSO
4
, прилить NaОН. Полученный осадок вместе с раствором разлить в две пробирки. В одну из них прилить раствор серной или соляной кислоты, а другую оставить на воздухе. Записать наблюдения. Написать в молекулярной и иной формах уравнения реакций, происходящих между: солью марганца и серной кислотой. Солью марганца и NaОН, Мn(ОН), водой и кислородом воздуха, с образованием Мn(ОН).
Опыт 4 (1): гидролиз солей алюминия.
К раствору соли алюминия в пробирку прилить углекислого натрия. Наблюдать выпадение белого аморфного осадка и выделение пузырьков углекислого газа.
Аl
2
(SO)
3
или Аl(NO
3
)
3
использовать в реакции:
Аl
2
(SO
4
)
3
+ 3Na
2
CO
3
= Al
2
(CO
3
)
3
+ 3Na
2
SO
4
2Al + 3CO
3
2-
+ 6HOH = 2Al(OH)
3
+ 3 СO
2
+ 3Н
2
О
Написать уравнение реакций:
А) взаимодействие Аl
2
(CO
3
)
3
c водой.
Б) взаимодействие соли алюминия с углекислым натрием.
Объединить первое и второе уравнение реакций в одно итоговое молекулярной и ионной форме.
Сделайте вывод –
прошел ли полный гидролиз
Опыт 4 (2): испытание раствора солей алюминия индикаторов.
Исследуйте растворы: сульфата алюминия или хлорида алюминия или нитрата алюминия на лакмус.
Сделайте вывод.
Напишите уравнение реакции гидролиза.
СВОЙСТВА СОЕДИНЕНИЙ ЖЕЛЕЗА.
ОБОРУДОВАНИЕ:
Штатив с пробирками, растворы солей FeSO
4
, FeCl
3
, гидроксид натрия, соляная и серная кислота, раствор КМnО
4
, хлорная вода, раствор NH
4
CNS раствор К
3
(Fe(CN)
6
).
Опыт 5:
В пробирку на одну четверть ее объема прилить раствор FeSO
4
. И прилить столько же раствора гидроксида натрия или калия. Что наблюдается?
Опыт 6:
К полученному в предыдущем опыте Fe(ОН)
2
прилить соляной кислоты до растворения осадка. Что наблюдаете?
Опыт 7:
В пробирку на одну четверть ее объема налить раствор хлорида железа III и прилить столько же раствора гидроксида натрия. Что наблюдается?
Опыт 8:
К полученному в предыдущем опыте (7) прилить раствор серной кислоты до растворения осадка. Написать реакции в молекулярном и ионном виде, назвать получившиеся вещества и указать, какое из них находится в оксиде.
Опыт 9: окисление сернокислого железа перманганатом калия.
Налить в пробирку 1 –2 мл. раствора марганцовокислого калия, немного разбавленной серной кислоты и раствор FeSO
4
(можно бросить несколько кристалликов вместо раствора.
Записать наблюдения и написать уравнения реакций).
Опыт 10:
В пробирку налейте около 2 мл. раствора хлорного железа (2) и прилейте столько же хлорной кислоты. Как изменился цвет раствора? Объясните явление. Напишите уравнение реакции. Что окислилось, что восстановилось?
Опыт 11: взаимодействие солей железа (3) с родонитом аммония и
Солей железа (2) с красной кровяной солью К
3
Fe(CN
6
).
К раствору хлорного железа добавить раствор родонита аммония NH
4
CNS. Как изменился цвет? Напишите уравнение в молекулярном и ионном виде.
Опыт 11 (2):
К раствору хлорида железа (2) или FeSO
4
добавить красной кровяной соли соли К
2
Fe(CN)
6
. Что наблюдается? Напишите уравнение в молекулярном и ионном виде.
ОБОРУДОВАНИЕ:
Штатив, пробирки, спиртовки, растворы: соли хрома (3) гидрата окиси натрия, серной, соляной кислоты, раствор К
2
Сr
2
O
7
Na
2
SO
4
, серной кислоты, раствор К
2
CrО
4
.
Опыт 12: свойства соединений хрома.
В пробирку с раствором соли хрома Сr(NО
3
)
3
прибавить по каплям раствор NaОН до образования осадка. Полученный осадок разлить в две пробирки. В одну из них прилить раствор серной кислоты или соляной, а в другую NaОН. Что наблюдается?
Напишите уравнения следующих реакций:
- Сr(NO
3
)
3
c NaOH - Cr(OH)
3
с серной кислотой
- Сr(ОН)
3
с избытком NaОН
Опыт 13: окислительные свойства дихроматов.
К раствору К
2
cr
2
O
7
прибавить раствор серной кислоты, а затем раствор сернисто-кислого натрия (Na
2
SО
3
). Наблюдать изменение окраски. Написать уравнение окислительно – восстановительной реакции.
Опыт 14: перевод хроматов в дихроматы и обработка.
К раствору
К
2
СrO
4
прибавить раствор серной кислоты. Наблюдать изменение окраски. К полученному раствору прибавить гидроксид натрия или калия. Наблюдать изменения окраски. Записать наблюдения и уравнения реакций.
ОРГАНИЧЕСКАЯ ХИМИЯ
МОДЕЛИРОВАНИЕ МОЛЕКУЛ УГЛЕВОДОРОДОВ.
Лабораторная № 4
ЦЕЛЬ РАБОТЫ:
Использование знаний видов химической связи (ковалентной полярной и неполярной) для моделирования молекул углеводородов:
Алканов, Алкенов, Алкинов, Аренов
ОБОРУДОВАНИЕ:
Фломастеры, цветные карандаши, линейки.
Работа складывается из индивидуальных заданий по моделированию молекул углеводородов.
Задание 1.
Изучить модели молекул метана, этилена, ацетилена, бензола.
Задание 2.
Зарисовать модели молекул – метана, этана, пропана, бутана, пентана, гексана, октана, декана, этилена, ацетилена, бензола.
Смоделировать молекулы углеводородов – электронные, структурные формулы.
Записать химические реакции:
- Горение метана, этилена, ацетилена.
- Взаимодействие метана с хлором (по стадиям)
- Реакции гидрирования пропилена и этина
- Реакция полимеризация этилена.
- Реакцию Вюрца (взаимодействие галогенпроизводных алканов с натрием).
ЦЕЛЬ РАБОТЫ:
Изучить способ получения этилена и его свойства, а также ознакомиться отношением каучука и резины к органическим растворителем.
ОБОРУДОВАНИЕ:
Штативы, пробирки, газовые трубки, держалки, штатив металлический, смесь этилового спирта с концентрированной серной кислотой, песок или кусочки пензы, растворы (бледно-розовой марганцовки), бромной воды (светло желтый раствор), спиртовки, стакан с водой, лучинка.
Приготовить каучук и резину в растворе бензола или бензина.
Выполнение работы
Опыт 1: получение и свойства этилена.
Собрать прибор: налить в пробирку « а » 10 – 20 мл заранее приготовленной смеси этилового (винного) спирта к концентрированной серной кислотой, для равномерного кипения для равномерного кипения прибавить в смесь 0,5 речного песка (прокаленного) или кусочек пемзы, закрыть пробирку пробкой с газоотводной трубкой и укрепить в зажиме штатива, стакан наполнить водой и опустить в него пробирки (две), заполненные водой.
Опустить конец газоотводной трубки в стакан с водой так, чтобы последняя почти касалась дна стакана. Начать нагревать смесь в пробирке « а » и когда весь воздух из нее будет вытеснен, заполнить выделяющимся газом две пробирки. Смесь при этом чернеет. Когда пробирки заполнятся газом, вынуть из стакана газоотводную трубку. Пробирки с газом из воды не вынимать.
Опыт 2: горение этилена.
Пробирку с газом под водой закрыть пальцем, вынуть из стакана, перевернуть отверстием кверху и внести в нее горячую лучинку. Вторую пробирку с газом поджечь. Составьте уравнение реакции.
Опыт 3: взаимодействие этилена с раствором марганцовокислым
Калием и бромной водой.
Газоотводную трубку с газом пропустить через растворы КМnО
4
и бромной водой. Наблюдать за исчезновением окраски раствора. Записать наблюдения. Напишите уравнения реакций:
А) Получение этилена.
Б) Горение этилена.
В) Присоединение брома к этилену в молекулярной и структурной форме.
Опыт 4: ознакомление со свойствами каучука.
а) В одну пробирку поместить кусочек сырого (не вулканизированного)
Каучука, в другую – резины (обрезки от пробок). Прилить бензина –
Наблюдать что произошло? (готовит заранее лаборант) за несколько суток.
б) В пробирку с раствором каучука в бензоле или бензине прилить раствор
Брома.
Что наблюдаете?
Дать ответы:
Контрольные вопросы
- Что называется гомологическим рядом?
- Какие химические свойства наиболее характерны для алканов, алкенов?
- Написать структурную форму 2,2,4 – триметилпентан?
4. Назовите виды изомерии.
5. Дайте определение реакции полимеризации, приведите пример.
6. Какая реакция называется качественной?
Приведите пример качественной реакции на алкены
Лабораторная работа № 5
Тема 10
«Спирты. Фенолы»
ЦЕЛЬ РАБОТЫ:
Знакомиться с растворением глицерина, качественной реакцией на глицерин и свойства фенола.
ОБОРУДОВАНИЕ:
Штатив с пробирками, спиртовка, глицерин, вода раствор СuSO
4
, раствор NaОН, фенол, Н
2
SO
4
или НСl, бромная вода.
ХОД РАБОТЫ:
Опыт 1: растворение глицерина в воде и его взаимодействие с
Гидратом окиси меди.
- К 1мл. воды 2 – 3 капли глицерина. Взболтать. Обратить внимание на растворимость.
- К разбавленному раствору СuSO
4
прилить небольшой избыток NaОН. Слить избыток жидкости с Сu(OH)
2
, оставшуюся часть взболтать в 2 – 3 мл. воды и добавить ее к полученную ранее раствору в воде.
Сделать вывод
и записать реакцию через структурную формулу между
глицерином и Сu(ОН)
2
.
Опыт 2: свойства фенола.
- Несколько кристалликов фенола взболтать в пробирке с водой (во избежании ожогов не закрывать пробирку пальцами).
- К полученной мутной жидкости прибавить раствор щелочи – NаОН до исчезновения мути.
- К полученному прозрачному раствору прилить Н
2
SО
4
или НСl до помутнения.
- К 1мл. раствора фенола добавить по каплям бромную воду, сначала образуется муть, при потряхивании исчезает: при дальнейшем прибавлении бромной воды (3 – 4мл.) выдеяет обильный белый осадок – трибромфенол.
Сделать выводы
и записать в молекулярной и структурной форме
реакции:
А) фенола с NаОН.
Б) фенолята натрия с Н
2
SO
4
.
В) фенола с бромом (бромной воды).
Контрольные вопросы.
- Почему глицерин называется многоатомным спиртом?
- Каким реактивом можно обнаружить многоатомные спирты?
- Как можно из глицерина и азотной кислоты получить нитроглицерин?
- Можно ли считать гликолят меди комплексным соединением? Почему раствор фенола С
6
Н
5
ОН называется карболовой кислотой?
6. Запишите структурные формулы этиленгликоля, этанола, фенола.
7. Запишите качественную реакцию на фенол.
Лабораторная работа № 6
«Альдегиды, кетоны, карбоновые кислоты.»
ЦЕЛЬ РАБОТЫ:
Ознакомиться с химическими свойствами альдегидов и свойствами уксусной кислоты.
ОБОРУДОВАНИЕ:
Штатив с пробирками, спиртовки, аммиачный раствор окиси серебра, растворы сернокислой меди и NаОН, формалин, СН
3
СООН, соль СН
3
СООNа, газоотводные трубки, Н
2
SO
4
(концентрированной), стружки, порошок Мg, лакмус синий, стакан воды, держалки.
ХОД РАБОТЫ:
Опыт 1: окисление альдегида – реакция «серебряного зеркала»
- В чистую пробирку (вымытую щелочью, затем хромовой смесью и водой) налить четверть ее объема аммиачного раствора окиси серебра, прибавить 5 – 10 капель формалина. Взболтать и осторожно нагреть смесь, вращая пробирку вокруг пламени горелки (лучше держать пробирку в стакане с кипящей водой).
- Окисление гидроксидом меди.
К нескольким каплям раствора сернокислой меди прилить раствор едкого натрия – NаОН. Взболтать. К полученной жидкости с осадком гидроксид меди, прибавить 5 – 10 капель формалина и смесь нагреть. Наблюдать за изменением окраски.
Сделать выводы.
Написать уравнение реакции:
а)метаналя (структурную формулу) с аммиачным раствором оксида серебра.
Почему эту реакцию называют « реакцией серебряного зеркала»
б) метаналя с гидроксидом меди (2).
Опыт 2: получение и свойства уксусной кислоты.
- Насыпать в пробирку 3 – 5г. уксуснокислого натрия, прибавить немного концентрированной серной кислоты, так, чтобы смочить соль. Пробирку закрыть газоотводной трубкой, свободный конец которой опустить в пустую пробирку, находящуюся в холодной воде. Нагревать смесь до тех пор, пока в пробирке соберется СН
3
СООН.
- Полученную кислоту разделить на две части, разбавить водой и опустить синий лакмус.
- Вторую часть пробирки с кислотой соединить с магнием, поджечь газ.
Сделать выводы.
Записать реакции:
- Получение СН
3
СООН
- Реакцию диссоциации СН
3
ООН.
- Взаимодействие СН
3
СООН с Мg в молекулярном и ионном виде.
- Запишите реакцию этерификации между этанолом и муравьиной кислотой.
Контрольные вопросы
- Что такое альдегиды?
- Какие вещества образуются при окислении альдегидов?
- Какой альдегид можно получить путем окисления этанола?
- Способы получения карбоновых кислот?
- Что такое формалин?
- Напишите химические свойства карбоновых кислот на примере этановой (уксусной) кислоты.
Лабораторная работа № 7.
Тема 12:
«Сложные эфиры. Жиры»
ЦЕЛЬ РАБОТЫ:
Ознакомиться со свойствами жиров, омылением, сравнительных свойств мыла и синтетических моющих средств (с.м.с.)
ОБОРУДОВАНИЕ:
Штативы с пробирками, вода, уксусная кислота (концентрированная), органические растворители – бензин, ацетон и др. эфиры, растворительный жир и др. жиры. Мыло – твердое и (смс) любые. Спиртовки, фенол – фталин, СаСl
2
Н
2
SO
4
, HCl, бромная вода, фарфоровые чашечки, тринежки, NaОН, спирт, стеклянные палочки, стаканы и цилиндр.
ХОД РАБОТЫ:
Опыт 1: свойства жиров.
В пробирку налить: воды, бензина, эфира, ацетона и др. жидкости, добавить кусочек жира или несколько капель растительного жира, все тщательно взболтать, наблюдать в какой пробирке растворился жир.
Опыт 2: свойства мыла.
Мелко настругать мыло и растворить в воде, нагревая воду. Мыльный раствор разлить в пробирки. В одну прилить 2 – 3 капли фенолфталина, в другую равный объем серной или соляной кислоты, в третью столько же раствора хлористого кальция. Наблюдать что происходит и записать реакции в молекулярном и ионном виде.
Опыт 3: доказательства непредельного характера жиров.
В одну пробирку налить2 мл. подсолнечного масла, во вторую поместить кусочек твердого жира (нагреть). К содержимому всех пробирок добавьте немного бромной воды. Что наблюдается?
Опыт 4: омыление жиров.
В фарфоровую чашечку поместить 3г. жиров, маргарина, или сливочного масла и прилейте 7 – 8 мл. раствора, содержащего в массовых долях 0,2 NаОН. Для ускорения реакции добавить 1 – 2 мл. этанола. Смесь кипятить 15 мин., помешивая стеклянной палочкой и добавляя воду до исходного уровня. Проверить омыление так: если при охлаждении на поверхности воды не всплывают капельки жира (омыление прошло).
Опыт 5: сравнительные свойства мыла и синтетических моющих
средств.
Приготовить в 3 колбах по 50 мл. разбавленных растворов: мыла, порошка.
Влейте по 2-3 мл. приготовленных растворов в пробирки, добавьте несколько капель растворов фенолфталеина. Наблюдайте появление малиновой окраски.
Опыт 6: синтез этилового эфира уксусной кислоты.
В пробирку налейте 1-2 мл. концентрированной уксусной кислоты и столько же этанола, добавьте 0,5 мл. концентрированной серной кислоты. Смесь этих веществ перемешивайте в течении 4-5 минут. Осторожно нагрейте, не доводя до кипения. Затем содержимое пробирки охладите и вылейте в другую пробирку с водой.
Контрольные вопросы
- Что такое омыление и для каких целей используется процесс омыления жиров?
- Почему раствор мыла имеет щелочную реакцию?
- Что называется реакцией этерификации?
- О чем свидетельствует осветление бромной воды?
- Составьте уравнения реакции между:
- метиловым спиртом и уксусной кислотой
- пропиловым спиртом и масляной кислотой
Назовите полученные соединения.
Лабораторная работа № 8
Тема 13
«Углеводы»
ЦЕЛЬ РАБОТЫ:
Изучить свойства углеводов на примере глюкозы, сахарозы, крахмала.
ОБОРУДОВАНИЕ:
Пробирки, спиртовки, растворы: глюкозы, сахарозы, крахмала, йода, сульфата меди, щелочи, гидроксида кальция, аммиачный раствор оксида серебра, серной кислоты, углекислый газ, картофель, хлеб.
ХОД РАБОТЫ:
Опыт 1: Взаимодействие глюкозы с гидроксидом меди (2) и
аммиачным раствором оксида серебра.
- К 2-3 мл. раствора глюкозы добавить 1 мл. NаОН и 2-3 капли раствора СuSО
4
.Встряхнуть пробирку до получения жидкости окрашенной в синий цвет. Осторожно нагревать — наблюдать переход синей окраски раствора в зеленую, затем желто – красного, или коричневого осадка.
- В чистую пробирку налить четверть ее объема аммиачного раствора серебра, прилить 5 – 10 капель раствора глюкозы. Взболтать и осторожно нагреть над пламенем горелки или в водяной бане.
Что наблюдается?
Записать реакции
- Структурную формулу глюкозы.
- Взаимодействие СuSО
4
с гидроксидом натрия NaОН.
- Глюкозы (формулу писать структурную) с гидроксидом меди (2).
- Глюкозы с аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Опыт 2: взаимодействие сахарозы с гидроксидом кальция
(Са(ОН)
2
).
1г. сахарозы растворить в 5 – 6 мл. воды. Добавить по каплям взмученное известковое молоко (Са(ОН)
2
). Что наблюдаете? Добавляйте Са(ОН)
2
до образования белого осадка. Затем профильтровать и фильтрат разделить на две пробирки:
а) через одну часть фильтрата пропустить углекислый газ, вторую часть фильтрата нагреть до образования белого осадка трехкальцевого сахарата.
С
12
Н
22
О
11
3СаО
2Н
2
О
Опыт 3: приготовление крахмального клейстера: йодная проба.
Гидролиз крахмала.
Насыпать в пробирку 0,5г. крахмала, прилить четверть пробирки холодной воды и хорошо взболтать. В стакан жидкость с крахмалом и прокипятить, и дать смеси остыть.
В пробирку с оставшимся крахмальным клейстером прибавить йодной воды. Что наблюдается?
Сделать срез картофеля и капнуть йодной воды, что наблюдаете?
Налить в пробирку небольшое количество крахмального клейстера и прибавить к нему 1мл. раствора серной кислоты, 2 – 3 минуты прокипятить. Охладить раствор и затем добавить несколько капель йодной воды, синяя окраска не должна появляться.
Записать наблюдения
Сделать выводы
и написать реакции гидролиза крахмала с образованием глюкозы.
Контрольные вопросы
- Строение молекулы глюкозы?
- Чем отличается фруктоза от глюкозы?
- Какие углеводы образуются при гидролизе сахарозы?
- Какими качественными реактивами можно обнаружить: глюкозу, сахарозу, крахмал?
- Какие продукты образуются при спиртовом брожении глюкозы?
- Почему крахмал с серной кислотой после кипячения не дает синей окраски с йодной водой?
Лабораторная работа № 9.
Тема 14
«Азотосодержащие органические соединения»
ЦЕЛЬ РАБОТЫ:
Изучить свойства белков, и провести исследования свойств термопластичных полимеров (полиэтилена, полистирола) и др. веществ.
ОБОРУДОВАНИЕ:
Штатив с пробирками, раствор белка, растворы СuSО
4
, НNO
3
, спиртовки, щелочи – NaОН, КОН, капроновая смола, стеклянные палочки, мука.
Полиэтилен, полистирол, ацетон, держалки, рыболовная леска, картон, стеклянная палочка, синий лакмус, раствор КмnО
4
, поливинилхлорид.
ХОД РАБОТЫ:
Опыт 1: свойства белков: свертывание, цветные реакции.
- Налить в пробирку (четверть объема) раствора яичного белка и нагреть. Что наблюдаете?
- Налить в пробирку (четверть объема) яичного белка и прибавить несколько капель концентрированной кислоты азотной, нагреть. Охладить смесь и прибавить к ней раствор аммиака до изменения окраски. Что наблюдается?
- Налить белка (четверть пробирки), прибавить такое же количество равтвора едкого натрия – NаОН и 2 – 3 капли раствора медного купороса – СuSО
4
. Нагреть. Что наблюдается?
- Насыпать в пробирку около 0,5г. пшеничной муки, прибавить 3 – 5 капли азотной кислоты (конц.) – НNО
3
. Нагреть. Охладить и прилить раствор аммиака. Что наблюдается? Какие признаки указывают на присутствие белка в муке?
Примечание:
эти способы помогут обнаружить белок в молоке, мясе, твороге, шерсти.
Исследование свойств термопластичных полимеров (полиэтилен, полистирол).
- Термопластичность.
- Горючесть.
- Отношение к раствору кислот, щелочей, окислителей.
ХОД РАБОТЫ:
- Полиэтилен.
- Полистирол.
- Обратить внимание: на внешний вид этих полимеров.
- Горение (внести в пламя спиртовки).
- Отношение полимеров к кислотам, к ацетону.
- Получение нитей из капроновой смолы.
В пробирку поместить кусочек изделия из капрона (рыболовная леска) и осторожно нагреть. Вязкую жидкость, вытянуть в тонкую нить стеклянной палочкой.
Примечание:
во избежание загрязнения пробирок, можно проделать опыт на капроне с помощью щипцов.
Обнаружение хлора в поливинилхлориде.
Проверить:
не горючесть, устойчивость к действию химических реагентов, легко окрашивается? Из пластмассы изготовляют клеенки, плащи, портфели, искусственную кожу для обуви и др. используют для изоляции проводов и кабелей. Кусочки пластмассы несильно нагреть в пробирке или фарфоровой чашке. Проверить проходит ли размягчение? При горении распространяется запах – какой?
В газообразные продукты внести влажную синею лакмусовую бумагу, а затем стеклянную палочку, смоченную раствором аммиака. Если поместить кусочки полихлорвинила в пробирки с растворами кислот, щелочи. Что наблюдается?
Сделать вывод
по исследованию свойств полимеров
.
Контрольные вопросы.
- Дать характеристику полимерам: полиэтилену, полистиролу, полихлорвинилу?
- Записать их формулы, физические свойства и применение в промышленности, в быту.
Лабораторная работа № 10.
Тема
«Амфотерные свойства и гидролиз солей.»
ЦЕЛЬ РАБОТЫ:
Ознакомиться с реакциями гидролиза и свойствами амфотерных соединений
ОБОРУДОВАНИЕ:
Штатив с пробирками, растворы Na
2
СО
3
, NaSO
3
, Al(NO
3
)
3
, NaCL, FeCl
3
, NaNO
3
, ZnCl
2
Al
2
(SO
4
)
3
, Pb(NO
3
)
2
, HCl, НNO
3
, дистил. вода, индикаторы: фенолфталеин, метилоранж, лакмус, NaОН.
ХОД РАБОТЫ:
Опыт 1: испытание растворов солей индикатором. Полный
гидролиз солей.
- Налить в пробирку немного какой – либо соли и испытать его действие на лакмус, нанося каплю раствора на красную и синею бумагу стеклянной палочкой. Наблюдения занести в таблицу.
Написать уравнения реакций гидролиза солей, раствора которых имели кислую или щелочную реакции. Уравнения реакций записать в молекулярной и ионной форме.
- К раствору соли алюминия в пробирке прилить раствор углекислого натрия.
Наблюдать выпадение белого аморфного осадка и выделение пузырьков
углекислого газа. Написать уравнение реакции:
Взаимодействие соли алюминия с углекислым газом.
Взаимодействие углекислой соли алюминия с водой.
Объединить первое и второе уравнение реакций в одно итоговое уравнение.
Написать эти же уравнения в ионной форме.
Опыт 2: получение гидроокиси цинка и испытание ее амфотерных
свойств.
Налить половину пробирки раствора какой – нибудь соли цинка и прибавить несколько капель гидрата натрия или гидрата окиси калия до образования белого осадка. Разлить полученный раствор вместе с осадком в две пробирки. В одну прилить щелочи, а в другую – кислоты до растворения осадка. Записать наблюдения и реакции.
Опыт 3: получение гидроокиси алюминия и испытание ее
амфотерных свойств.
Налить половину пробирки раствора сернокислого алюминия и прибавить несколько капель до образования белого осадка. Разлить полученный раствор вместе с осадком в две пробирки. В одну из них прилить щелочи, а в другую соляной или серной кислоты до растворения осадка. Записать наблюдения и реакции.
Опыт 4: свойства соединений свинца.
Налить четверть пробирки раствор азотнокислого свинца и приливать к нему по каплям раствор гидрата окиси натрия до выпадения белого осадка. Полученный раствор вместе с осадком разлить в две пробирки. В одну из пробирок прилить разбавленной азотной кислоты, а в другую – избыток гидрата окиси натрия до растворения осадка.
Контрольные вопросы.
- Что называется реакциями гидролиза?
- Почему при гидролизе карбоната натрия на выделяется угольная кислота?
- Составьте сокращенные ионные формы – гидролиза солей: К
2
S, Fe
2
SO
3
, CuSO
4
, К
3
РО
4
?
- Написать уравнения реакций Zn(ОН)
2
с щелочью и кислотой. Аl(ОН)
3
с щелочью и кислотой?
Практическая работа №1.
Практическая работа № 2.
Практическая работа №1.
«Идентификация органических соединений»
Цель:
Ход работы:
В вашем распоряжении имеется спиртовка и набор реактивов:
1) водный раствор NаОН;
2) Н
2
SO
4
разбавленная;
3) водный раствор Nа
2
С0
3
;
4) водный раствор КМn0
4
;
5) бромная вода;
6) водный раствор СuSO
4
;
7) аммиачный раствор оксида серебра;

В двух пробирках содержатся следующие вещества:
1. а) глюкоза;
2. а) уксусная кислота;
3. а) глюкоза;
б) глицерин;
С помощью минимального числа реагентов (указанных в начале работы) определите содержимое в каждой паре пробирок. Напишите уравнения соответствующих реакций.
Работу оформите по следующему образцу:
1. Распознавание глюкозы и сахарозы
2. Распознавание уксусной кислоты и этилового спирта
3. Распознавание глюкозы и глицерина
Сделайте общий вывод
Характеристика некоторых органических веществ
| 1.Метан | Бесцветный газ без запаха, химическая формула — CH . Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно меркаптаны) со специфическим «запахом газа». |
| 2.Этилен | Бесцветный горючий газ со слабым запахом. Частично растворим в воде. Наркотик. Формула С Н 4 . |
| 3.Ацетилен | Ненасыщенный , C 2 H 2 , бесцветный , малорастворим в , легче
. При сжатии разлагается со взрывом, хранят в баллонах, заполненных , пропитанным , в котором ацетилен растворяется под давлением в больших количествах. . |
| 4.Метанол | Бесцветная ядовитая жидкость с запахом, напоминающим запах этилового спирта, но более слабым, с воздухом образует взрывоопасные смеси, смешивается в любых соотношениях с водой и большинством органических растворителей. Горит синеватым пламенем 3 -OH |
| 5.Бензол | 6 6 , с своеобразным резким . Входит в состав , широко применяется в , , , красителей.
.
С воздухом образует взрывоопасные смеси, хорошо смешивается с эфирами, бензином и другими органическими растворителями. |
| 6. Этанол | Одноатомный спирт с CH 3 -CH 2 -OH, летучая, горючая, бесцветная прозрачная жидкость. |
| 7. Метаналь (формальдегид) | Бесцветный газ с резким , хорошо растворимый в воде, спиртах и полярных растворителях, токсичен. |
| 8. Этаналь | Бесцветная жидкость с резким запахом, хорошо растворяется в , , . Формула: CH 3 -CHO.
Ацетальдегид токсичен при действии на кожу, и, возможно, канцероген. Он также является загрязнителем воздуха при горении, курении, в автомобильных выхлопах. |
| 9.Муравьиная кислота | Бесцветная жидкость. Растворима в
,
,
. Смешивается с ,
,
. При контакте с кожей 100 %-ная жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Формула: HCOOH |
| 10. Уксусная кислота | Органическое вещество с формулой CH COOH, бесцветная с характерным резким и кислым
.
. Неограниченно растворима в . Смешивается со многими ; в уксусной кислоте хорошо растворимы органические соединения и газы. Слабая, предельная одноосно вная
. Производные уксусной кислоты носят название « |
| 11. Бензойная кислота | C 6 H 5 СООН — простейшая одноосновная ароматического ряда. Бесцветные кристаллы, плохо растворимые в воде, хорошо — в и
. Бензойная кислота является, подобно большинству других , слабой кислотой. |
| 12. Этиленгликоль | Простейший представитель HO-CH 2 -CH 2 -OH, прозрачная бесцветная жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов внутрь организма человека может привести к необратимым изменениям в организме и к летальному исходу |
| 13. Глицерин | Химическое соединение с формулой HOCH -CH(OH)-CH 2 OH; б есцветная, вязкая, гигроскопичная жидкость, неограниченно растворимая в воде. Сладкий на вкус, отчего и получил своё название (гликос — сладкий). Хорошо растворяет многие вещества. |
| 14. Глюкоза | Бесцветное кристаллическое вещество сладкого вкуса, растворимое в воде и органических растворителях. Глюкозу используют при интоксикации, вводят внутривенно, так как она является универсальным антитоксическим средством. С Н 12 О 6 . |
| 15. Сахароза | C 12 H 22 O 11. Бесцветные кристаллы. При застывании расплавленной сахарозы образуется аморфная прозрачная масса — . Сахароза является весьма распространённым в природе дисахаридом, она встречается во многих , и
.
|
| 16. Крахмал | ( 6 10 5 ) n . Безвкусный, аморфный порошок , нерастворимый в холодной воде. Под микроскопом видно, что это зернистый порошок; при сжатии порошка крахмала в руке он издаёт характерный «скрип», вызванный трением частиц. В горячей воде набухает (растворяется), образуя ; с раствором образует соединение-включение, которое имеет синюю окраску. В воде, при добавлении кислот (разбавленная H SO 4 и др.) как
, постепенно .
При действии или нагревании с кислотами подвергается гидролизу. |
| 17. Анилин | Соединение с формулой 6 5 2 , простейший ароматический . Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного тяжелее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. |
| 18. Аминокислоты | Бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом. |
Практическая работа №2.
«Распознавание пластмасс и волокон»
Цель:
распознать органические вещества с помощью качественных реакций.
С правилами ТБ ознакомлен(-а). Роспись.
Оборудование и реактивы:
образцы пластмасс и волокон под номерами, спиртовка, спички, стеклянные палочки, тигельные щипцы, асбестовые сетки.
Ход работы:
1. Распознавание пластмасс
В разных пакетах под номерами имеются образцы пластмасс. Пользуясь при веденными ниже данными, определите, под каким номером какая пластмасса находится.
Полиэтилен
. Полупрозрачный, эластичный, жирный на ощупь материал. При нагревании размягчается, из расплава можно вытянуть нити. Горит сине ватым пламенем, распространяя запах расплавленного парафина, продолжает гореть вне пламени.
Поливинилхлорид
. Эластичный или жесткий материал, при нагревании быстро размягчается, разлагается с выделением хлороводорода. Горит коптящим пламенем, вне пламени не горит.
Полистирол
. Может быть прозрачным и непрозрачным, часто хрупок. При нагревании размягчается, из расплава легко вытянуть нити. Горит коптящим пламенем, распространяя запах стирола, продолжает гореть вне пламени.
Полиметилметакрилат
. Обычно прозрачен, может иметь различную окраску. При нагревании размягчается, нити не вытягиваются. Горит желтоватым пла менем с синей каймой и характерным потрескиванием, распространяя эфирный запах.
Фенолформальдегидная пластмасса.
Темных тонов (от коричневого до чер ного). При нагревании разлагается. Загорается с трудом, распространяя запах фенола, вне пламени постепенно гаснет.
2. Распознавание волокон
В разных пакетах под номерами содержатся образцы волокон. Пользуясь приведенными ниже данными, определите, под каким номером какое волокно находится.
Хлопок
. Горит быстро, распространяя запах жженой бумаги, после сгорания остается серый пепел.
Шерсть, натуральный шелк.
Горит медленно, с запахом жженых перьев, после сгорания образуется черный шарик, при растирании превращающийся в порошок.
Ацетатное волокно.
Горит быстро, образуя нехрупкий, спекшийся шарик темно-бурого цвета. В отличие от других волокон растворяется в ацетоне.
Капрон
. При нагревании размягчается, затем плавится, из расплава можно вытянуть нити. Горит, распространяя неприятный запах.
Лавсан
. При нагревании плавится, из расплава можно вытянуть нити. Горит коптящим пламенем с образованием темного блестящего шарика.
Оформление работы:
Цвет, внешний вид.
Горит или нет. Характер горения. Запах.
Вывод
1. Распознавание пластмасс
2. Распознавание волокон
Общий вывод:
на какие группы делятся пластмассы? волокна?
10 класс
Лабораторные опыты
Тема лабораторного опыта
Инструкция
Л.о. №1.
Изготовление моделей молекул углеводородов
Модель молекулы метана.
Соберите модель молекулы метана, используя для этого заводской набор моделей атомов. Если он в школе отсутствует, соберите ее из пластилиновых шариков. Для этого из пластилина светлых тонов изготовьте четыре небольших шарика, а из пластилина темных тонов — один шарик, который примерно в два раза больше предыдущих. В качестве стержней можно использовать спички. Учтите, что в молекуле метана угол между химическими связями С-Н составляет 109°, т. е. молекула имеет тетраэдрическое строение (см. рис. 11 на с. 25).
Модели молекул бутана и изобутана.
Соберите модель молекулы н-бутана, используя для этого заводской набор моделей атомов или пластилин. Аналогично соберите модель молекулы изобутана. Учтите, что в бутане атомы углерода расположены по отношению друг к другу под углом 109°, т. е. углеродная цепь должна иметь зигзагообразное строение. В молекуле изобутана все связи центрального атома углерода направлены к вершинам правильного тетраэдра. Сравните строение этих углеводородов.
Л.о. №2.
Обнаружение непредельных соединений в жидких нефтепродуктах
Выданные вещества разделите на две части и исследуйте их отношение к растворам иода и перманганата калия. Наблюдайте за изменением окраски растворов. Внесите наблюдения в таблицу и сделайте выводы.
| Л.о. №3. | В пробирку налейте около 1 мл воды и поместите в нее кусочек карбида кальция величиной со спичечную головку. Быстро закройте пробирку пробкой с газоотводной трубкой и выделяющийся газ пропустите в другую пробирку с раствором перманганата калия. Что наблюдаете? О чем свидетельствует изменение окраски раствора? Запишите уравнения проведенных реакций. |
| Л.о. №4. |
|
| Л.о. №5. |
|
| Л.о. №6. |
|
| Л.о. №7. |
|
| Л.о. №8. |
3. Практически докажите, что в состав выданного вам растительного жира входят остатки непредельных кислот. Объясните свои действия. |
| Л.о. №9. |
|
| Л.о. №10. |
|

Это вещество являлось разменной монетой
в торговых отношениях
в средние века.

Бесцветное негигроскопичное кристаллическое вещество, растворимое в воде и плавящееся при 801° С.

Сказка: «Хан решил выяснить
у своих трех дочерей, насколько они его любят.
Ответы двух первых дочерей его устроили, а третья дочь ответила: «Я тебя люблю так, как это вещество любит мясо».
Хан разгневался и прогнал дочь…»

Каменная соль галит

Кристаллическая решетка каменной соли

Получение поваренной соли
Мировая добыча соли — 192 млн. т. /год.
Ее получают:
из морской воды,
из рассолов соляных озер,
из подземных соляных пластов.
На границе Калмыкии с Астраханской областью на озере Баскунчак добывают 80 % от всей добычи в России.

Какой качественный и количественный состав поваренной соли?

Определение состава поваренной соли
Катион – ион металла- № 11 в ПСХЭ
Химический элемент – неметалл, р-семейства, самый распространенный в природе среди элементов 7 а группы. О каком элементе идет речь?
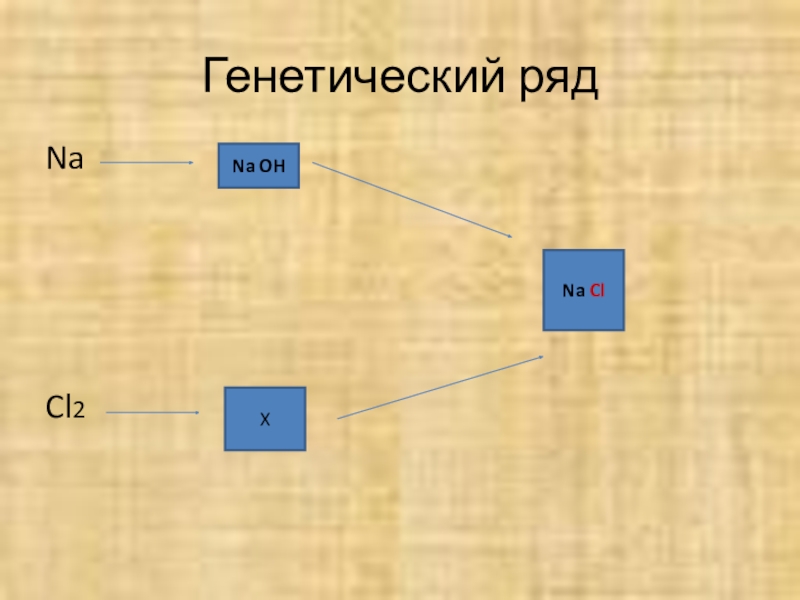
Генетический ряд
Na OH
Na Cl
X

Тема урока:
«Хлор и его важнейшие соединения»

Цель урока
: изучение физико-химических свойств хлора, его важнейших соединений и их применение.
Задачи:
1)усвоение физико-химических свойств хлора
2)формирование оперативно-контрольных умений, использование дополнительной литературы и компьютера;
3)развитие познавательного интереса, коммуникативных качеств, уверенности в своих силах, настойчивости, воспитание культуры умственного труда, умение работать в творческих группах с развитием навыков самостоятельной работы.

Образование молекулы хлора
Подвижная модель

О каких свойствах хлора идет разговор в тексте?
Групповая работа по вариантам (работа с текстом)

Свойства хлора
Во время I мировой войны хлор применяли в качестве боевого отравляющего вещества. Он вызывает раздражение слизистых оболочек дыхательных путей и глаз уже при содержании в воздухе 0,001 мг/л.
Хлор хранят в сжиженном виде в баллонах или специальных контейнерах под давлением. По железной дороге хлор перевозят в специальных цистернах. На станциях водоподготовки, железнодорожных станциях и по пути следования могут происходить аварии с розливом хлора, который достаточно быстро испаряется и переносится ветром.

Заполните соответствующую графу в таблице:
«Изучение физических свойств хлора»
ВЫВОДЫ: Хлор (Cl2) – газ желто-зеленого цвета, тяжелее воздуха, ядовит.
D (по воздуху) = 2,45

Проблемная ситуация (обсуждение):
Что вы будете делать, если оказались в помещении, где происходит утечка хлора, и у вас нет средств индивидуальной защиты, кроме носового платка?

Выводы
Самый распространенный элемент среди галогенов- это хлор.
Вещество- CL2 – очень токсичное газообразное вещество желто-зеленого цвета, тяжелее воздуха.
Хлор хвалился: «Нет мне равных!
Галоген я самый главный.
Зря болтать я не люблю:
Все на свете отбелю!»
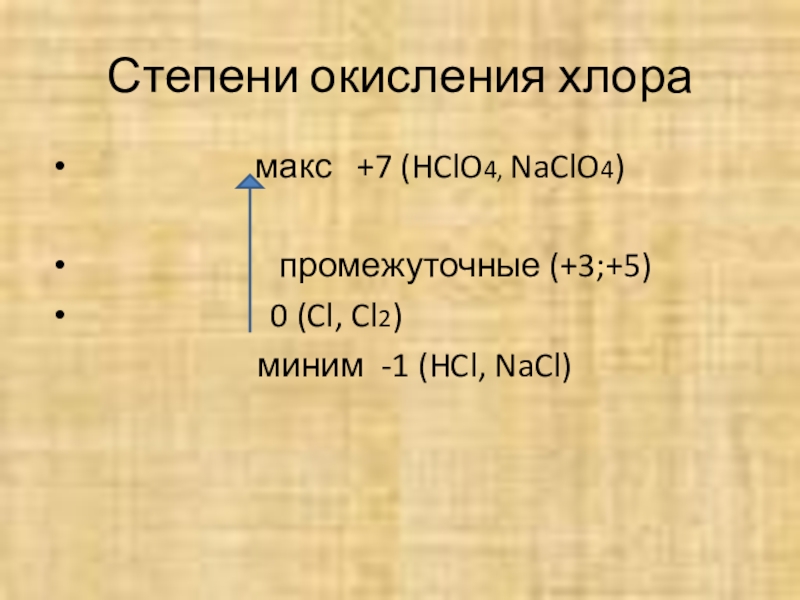
Степени окисления хлора
макс +7 (HClO4, NaClO4)
промежуточные (+3;+5)
0 (Cl, Cl2)
миним -1 (HCl, NaCl)

Закончите уравнения реакции, определите окислитель
1) Na +Cl2
2) Fe + Cl2
3) H2+ Cl2
0 -1 -1
4) Cl Cl Cl
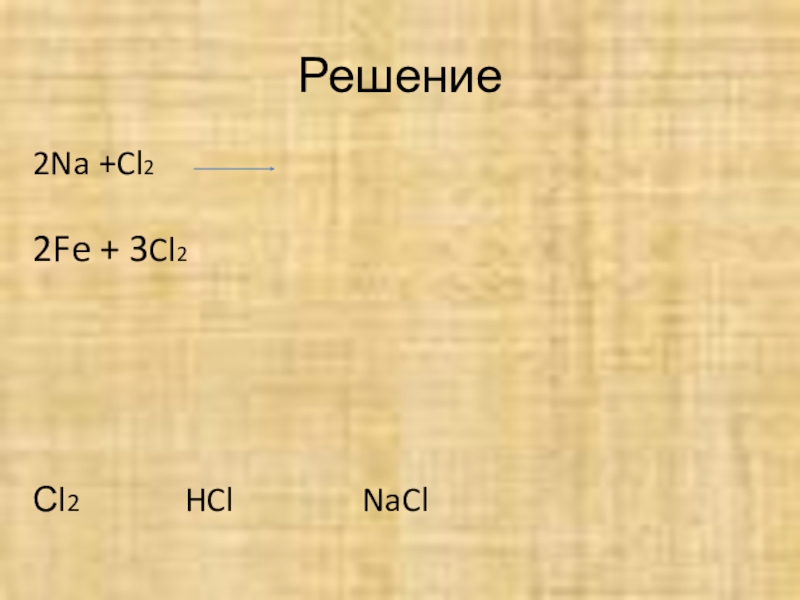
Решение
2Na +Cl2
2Fe + 3Cl2
Сl2 HCl NaCl
2FeCl3
H2+ Cl2= 2HCl

Изучение физических свойств хлороводорода
один из составляющих ядовитых вулканических газов, поэтому воды рек вблизи вулканов содержат соляную кислоту.
хлороводород и его водный раствор оказывают отравляющее действие на организм человека.

.
Проблемная ситуация:
Мы выяснили, что хлороводород и соляная кислота – это ядовитые вещества. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту – как лекарственное средство. Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?

Соляную кислоту прописывают больным с пониженной кислотностью желудочного сока. Соляная кислота входит в состав желудочного сока и способствует пищеварению. Я хочу подтвердить это, прочитав отрывок из рассказа М.М.Пришвина «Соляная кислота»: «Известно ли вам, что в кормлении волчат участвует и самец-волк? У матери в молоке не хватает необходимого для питания молодых волков соляной кислоты, и, чтобы пополнить этот недостаток, в добавку к молоку надо отрыгнуть маленькому своей пищи с соляной кислотой. В таком кормлении принимает участие и волк-самец».

Качественная реакция на хлорид- анион
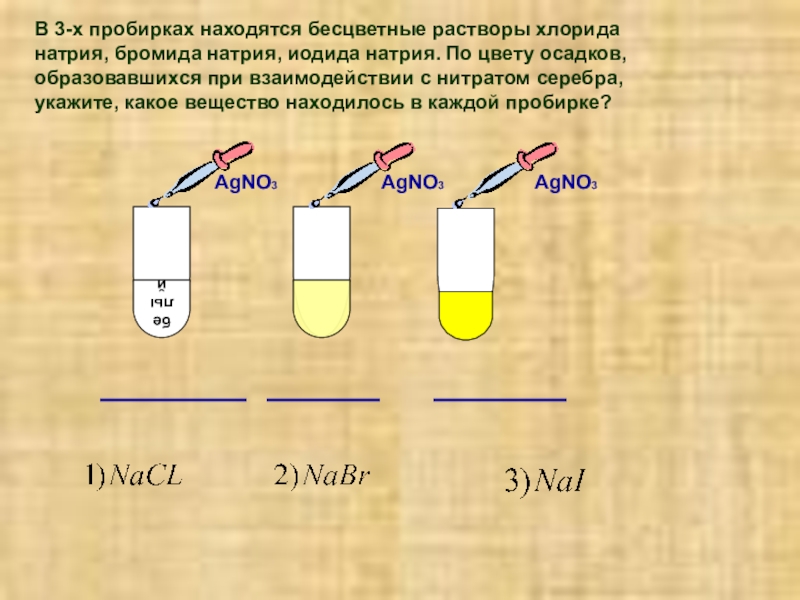
В 3-х пробирках находятся бесцветные растворы хлорида натрия, бромида натрия, иодида натрия. По цвету осадков, образовавшихся при взаимодействии с нитратом серебра, укажите, какое вещество находилось в каждой пробирке?
AgNO3
AgNO3
AgNO3
белый

Cl
«+» «-»
хорошо дезинфицирует
— опасный, ядовитый газ
он организует благоприятную среду для желудочного сока
— недостаточно хорошо изучен
-химически активен
-содержится во многих чистящих средствах
-используется в сельском хозяйстве для приготовления инсектицидов
— мы можем отравиться в домашних условиях

Выводы:
Самый распространенный элемент среди галогенов- это хлор.
Вещество- CL2 – очень токсичное газообразное вещество желто-зеленого цвета, тяжелее воздуха

Греческий поэт Гомер (VIII в. до н.э.), написавший Илиаду и Одиссею, называл поваренную соль «божественной». В те времена она ценилась выше золота: ведь, как гласила пословица, «без золота прожить можно, а без соли — нельзя». Из-за месторождений каменной соли происходили военные столкновения, а иногда нехватка соли вызывала «соляные бунты».
Опубликовано iio в 12 Октябрь, 2009 —
18:00
- Недогибченко О.В.
- НИПКиПРО
- Новосибирск 2002
- Учителям химии
- Химия
Данный
сборник является результатом многолетнего сбора, написания и применения на
уроках и во внеклассной работе химических стихов и сказок.
Стихи и сказки отражают
свойства, особенности химических веществ и явлений. Их использование помогает
сделать уроки химии яркими, эмоциональными, пробуждает у детей стремление к
творчеству.
Данный сборник может быть
использован молодыми учителями и студентами в своей педагогической
деятельности, а также учащимися, интересующимися химией и участвующими в
проведении внеклассных мероприятий по предметам естественного цикла.
Год: 2002
Стр.: 66 ISBN 5-87847-174-4
С О Д Е Р Ж А Н И Е
ПРЕДИСЛОВИЕ
АТОМЫ
О ПРИРОДЕ ВЕЩЕЙ
ЗОЛОТО И БУЛАТ
О ЗАКОНЕ СОХРАНЕНИЯ МАССЫ
ВЕЩЕСТВ.
МИР ЭЛЕКТРОНА
ЧИТАЯ МЕНДЕЛЕЕВА
ДИАЛОГ О КИСЛОРОДЕ
ВОДА
ОЗОН
УГЛЕРОД
СУД НАД УГЛЕКИСЛЫМ ГАЗОМ
БРАТЬЯ-КАРБОНАТЫ
КРЕМНИЙ
ПИСЬМО О ПОЛЬЗЕ СТЕКЛА
АЗОТ
ГАЛОГЕНЫ
ФОСФОР
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
ГИМН ПОВАРЕННОЙ СОЛИ
КРУГОВОРОТ ВЕЩЕСТВ
ЭЛЕКТРОЛИТИЧЕСКАЯ
ДИССОЦИАЦИЯ
ИОННАЯ СВЯЗЬ
КОРРОЗИЯ
СТАРЫЙ ЗНАКОМЫЙ
МИХАЙЛО ЛОМОНОСОВ
ИСТОРИЯ
АЛЮМИНИЙ
Р.ПЕРНС
МЕТАН
ПРИРОДНОЕ ТОПЛИВО
ВЗРЫВ
ГЛЮКОЗА
ВИТАМИНЫ
ФЕРМЕНТЫ
ЛЕКАРСТВА
О ПЬЯНСТВЕ
ИЗ ПОЭМЫ «ЧЕРНЫЙ ЧЕЛОВЕК»
ПИСЬМО В ГАЗЕТУ
СПИРТ
БАЛЛАДА О ДНК
КАУЧУК
БОЛЬШАЯ ХИМИЯ
ГИМН ХИМИКОВ
ХИМИЧЕСКИЕ ЧАСТУШКИ
ЧАСТУШКИ−САДЮШКИ
ПРИВЕТСТВИЕ
ПЕРЕМЕНА
ОБЪЯСНЕНИЕ В ЛЮБВИ
ПРОТИВОГАЗ
ХИМИЧЕСКИЕ ЗАГАДКИ
ПРАВИЛА ТЕХНИКИ
БЕЗОПАСНОСТИ
ПРИ РАБОТЕ В ХИМИЧЕСКОМ
КАБИНЕТЕ
ВОЛШЕБНИЦА-ХИМИЯ
ХИМИЧЕСКИЕ СКАЗКИ
СКАЗКА О ДВУХ БРАТЬЯХ
СКАЗКА О ВОДЕ
КАК СТАТЬ ЗВЕЗДОЙ
О ДРУЖБЕ
ДЕЛА СЕМЕЙНЫЕ
РАДИОАКТИВНЫЙ ЛУЧ
УГЛЕВОДОРОДЫ
СЕРЕБРЯНЫЕ ЗЕРКАЛА
СЕСТРИЦА БЕНЗОЛУШКА И
БРАТЕЦ ФЕНОЛУШКА
АТОМЫ
В.
Костров
Доказаны, увидены,
измерены
Ты, мысль сосредоточив,
посмотри-
Живительные сгусточки
материи
Пульсируют у сущего
внутри.
Ползут века
магнитофонной лентой,
Ученые седеют по ночам.
Что вы такое, семена
Вселенной,
Несущие начала всех
начал?
Введенный в круг высоких
категорий
Тысячелетним яростным
трудом,
Вдруг атом Бора, словно
атом Горя,
Явился нам чудовищным
грибом,
Нас опалил огнем
невыносимым
В нас бил страшней
свистящего свинца.
И ядовитый пепел
Хиросимы
Неслышно опускался на
сердца.
Нет, побеждают атомы
Добра,
Да, атомы Добра, Любви и
Света.
Да, будет беспокойная
планета
Спокойной и улыбчивой с
утра!
Все ближе эта новая
пора!
Мы молоды, упорны и
любимы!
Нерасщепимы атомы Добра,
И атомы Любви
неистребимы.
О
ПРИРОДЕ ВЕЩЕЙ
Лукреций
Кар
Прежде служили оружием
могучие руки, когти,
Зубы, каменья, обломки
ветвей от деревьев и пламя.
После того была найдена
медь, вместе с нею железо,
Все-таки в употребление
вошла раньше медь, чем железо,
Так как была она мягче,
притом изобильней гораздо.
Чтобы оружье иметь и
орудья для рубки деревьев,
Чтобы обтесывать лес и
выстругивать гладкие брусья,
Чтобы буравить, долбить
и просверливать в дереве дыры,
Это они серебром или
золотом делать пытались
Так же сначала, как
силой могучей и мощной меди.
Тщетно. Слабей была
прочность у этих металлов, и с медью
Вровень они не могли
выдерживать грубой работы.
Ценной тогда была медь,
а золото было в презренье.
ЗОЛОТО
И БУЛАТ
А.С.
Пушкин
Все мое, — сказало
злато. «Все мое», – сказал булат.
«Все куплю»,- сказало
злато. «Все возьму», – сказал булат.
*
* *
Мне приснилась иная
печаль
Про седую дамасскую
сталь.
Я увидел, как сталь
закалялась,
Как из юных рабов одного
Выбирали, кормили его,
Чтобы плоть его сил
набиралась.
Выжидали положенный
срок,
А потом раскаленный
клинок
В мускулистую плоть
погружали.
Вынимали готовый клинок.
Крепче стали не видел
Восток,
Крепче стали и горше
печали!
О
ЗАКОНЕ СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Э.
Дарвин
Химический состав свой
изменять
Должны все формы жизни в
вечном споре,
Они живут, чтоб умереть
им вскоре,
И умирают, чтоб ожить
опять.
Так вещество бессмертное
умеет
Бурь преходящих
побеждать порыв,
Не погибая в них, растет
и зреет,
По временам лишь форму
изменив.
Жизнь производит
веществам отбор,
Все вредное спешит
изгнать как сор,
А чистое, переварив
усвоить.
МИР
ЭЛЕКТРОНА
В.Я.
Брюсов
Быть может, эти
электроны –
Миры, где пять
материков,
Искусства, знанья,
войны, троны
И память сорока веков.
Еще, быть может, каждый
атом –
Вселенная, где сто
планет;
Там все, что здесь, в
объеме сжатом,
Но также то, чего здесь
нет.
ЧИТАЯ
МЕНДЕЛЕЕВА
С.
Щипачев
Другого ничего в природе
нет
Ни здесь, ни там, в
космических глубинах;
Все: от песчинок малых
до планет
Из элементов состоит
единых.
Как формула, как график
трудовой,
Строй менделеевской
системы строгой.
Вокруг тебя творится мир
живой,
Входи в него, вдыхай,
руками трогай!
Ты знаешь, газ легчайший
водород
В соединеньи с
кислородом – это
Июльский дождь от всех
своих щедрот,
Сентябрьские туманы на
рассветах.
Кипит железо, серебро,
сурьма
И темно-бурые растворы
брома,
И кажется вселенная сама
Одной лабораторией
огромной.
Тут мало оптикой
поможешь глазу,
Тут мысль пытливая всего
верней.
Пылинку и увидишь-то не
сразу –
Глубины мирозданья
скрыты в ней.
Будь то вода, что поле
оросила.
Будь то железо, медь или
гранит, –
Всю страшную космическую
силу,
Закованную в атомы
хранит.
Мы не отступим, мы
пробьем дорогу
Туда, где замкнут
мирозданья круг, –
С собой возьмем мы
знанья на подмогу
И это станет делом наших
рук.
ДИАЛОГ
О КИСЛОРОДЕ
Н.К.
Шабалина
Источник жизни –
кислород!
Как чародей великий тот,
Поможет он всему на
свете,
Что дышит, бегает,
растет…
А, может быть, наоборот
–
Злой разрушитель –
кислород?
Ведь все не без его
участья
Горит, ржавеет
и гниет…
Дает горение тепло,
Морозу лютому назло
На север, взяв с собой
огниво,
Жить человечество
пришло.
Все, что отжило на земле
Сгорит или сгниет в
тепле,
Но часто пища жизни
новой
Лежит в гнилушках и
золе.
А вот металлов целый
класс…
Они все так важны для
нас.
И видеть, как они
ржавеют, –
Не удовольстие для глаз.
Не так уж кислород
силен:
Такие газы, как неон,
И благородные металлы
Не вздумает окислить он.
И все же хочется
сказать,
Будь дорог он всем нам,
как мать,
Его не стал бы мир
зеленый
Без сожаленья отторгать.
Предположенья неверны,
Что выделения вредны.
Не все, что вредно,
отторжимо –
Излишки просто не нужны.
ВОДА
Н.К.
Шабалина
Известна важностью своей
на всей Земле вода.
Живет в воде для нас,
людей, и радость, и беда.
Накопит силы – забурлит,
размечет все подряд;
И без усилий растворит в
себе и мед, и яд…
Лихую жажду утолит
живительным глотком,
И все живое умертвит
нещадныи кипятком…
Любой сосуд – то ей не
труд – без щелочки займет,
А в лед замерзнет – свой
сосуд на части разорвет…
Что охлажденье, что
нагрев – закон не писан ей.
Любая жидкость,
затвердев, становится плотней.
Любая, только не вода. В
ней самый твердый лед,
Когда наступят холода,
по верху поплывет…
И замерзает не со дна
глубокий водоем,
И корка льда хранит
всегда в мороз живое в нем.
И химия в чести везде
живет уже века.
А вот аналога воде не
знаем мы пока.
ОЗОН
Н.К.
Шабалина
О нем известно во всех
странах света,
И помнить нам об этом
есть резон:
От злых влияний
ультрафиолета
Нас защищает наверху
озон.
Волшебник, всех оксидов
он родитель,
Металлам часто портит
внешний вид.
Он самый мощный в мире
окислитель,
И золото пред ним не
устоит.
Когда в грозу могучий
гром ударит,
И молния сверкнет над
головой,
Озон-волшебник чистоту
нам дарит
И свежий воздух
послегрозовой.
УГЛЕРОД
Н.К.
Шабалина
Героя нашего встречаете
везде вы.
Он разный даже в
состояньи чистом.
Он – бриллиант на пальце
королевы,
И сажа на щеках у
трубочиста.
А карандаш с графитовым
сердечком?
Он так порой зависит от
условий:
Соавтором быть может
мыслей вечных,
А может быть – носитель
пустословья…
Алмаз-король металлы
резать может,
Графит – писать и
смазывать как масло.
И нашу жизнь, когда
мороз тревожит,
Горящий уголь делает
прекрасной.
СУД
НАД УГЛЕКИСЛЫМ ГАЗОМ
Н.В.
Красавина
Суд прошел в 9 «Г», газ
судили на суде!
Ему свободу подарили, когда
проблемы разрешили.
Чтобы не было накладки,
изложу все по порядку.
Сначала говорил прокурор
сурово:
СО2 создает
эффект парниковый.
Осудить его срочно и
строго,
Пока не расстаял ледник
стометровый,
Иначе станет родная
Земля
Дном океана почти что
вся.
Свидетели бойко потом
выступали,
Газ углекислый они
осуждали:
За то, что приносит
тепло планете,
Мешает дышать и
взрослым, и детям.
Как известковую воду он
мутит,
Как он курильщику легкие
губит.
Сам подсудимый вину
признавал,
Рожденье свое он суду
рассказал.
Хотел говорить о хорошем
значенье,
Но был в состоянии очень
плачевном…
А потом на суде
адвокат выступал,
Газ углекислый он
защищал:
Фотосинтез – его рук
дело,
В нем он участвует очень
смело.
Вместо себя кислород
производит
И углеводы давать нам
изволит.
Сегодня судить человека
пора.
Ведь он этот газ выдает
на-гора.
Топлива много люди
сжигают,
Лес не сажают, а лишь
вырубают.
Вот и скопился газ на
планете,
Вот и мешает взрослым и
детям.
Суд оказался гуманным
очень:
Газ за решетку он не
заточит.
Даровать Газу свободу
решил,
Правильно суд наш,
друзья, поступил!
БРАТЬЯ
– КАРБОНАТЫ
Е.С.
НожкоА., П. Сугатов
На земле живут три брата
Из семейства Карбонатов.
Старший брат – красавец
Мрамор,
Славен именем Карары,
Превосходный зодчий. Он
Строил Рим и Парфенон.
Всем известен Известняк,
Потому и назван так.
Знаменит своим трудом,
Возводя за домом дом.
И способен, и умел
Младший мягкий братец
Мел.
Как рисует, посмотри.
Этот СаСО3!
Любят братья
порезвиться,
В жаркой печке
прокалиться.
СаО да СО2
образуются тогда.
Это углекислый газ,
Каждый с ним знаком из
вас,
Выдыхаем мы его.
Ну а это СаО – жарко
обожженная
Известь негашеная.
Известковым молоком
Стены белятся легко.
Светлый дом повеселел,
Превратив известку в
мел.
Фокус-покус для народа:
Стоит лишь подуть сквозь
воду,
Как она легко-легко
Превратится в молоко.
А теперь довольно ловко
Получаю газировку:
Молоко плюс уксус. Ай!
Льется пена через край!
Все в заботах, все в
работе
От зари и до зари –
Эти братья-карбонаты,
Эти СаСОз.
КРЕМНИЙ
Н.К.
Шабалина
Он с тобой в любое
время,
Лишь нагнись, возьми
кусок…
На Земле содержит
кремний
Камни, глина и песок.
Друг, проверенный
веками,-
В нем история сама,
Подружился кремний с
нами,
Стал полезным, и весьма.
Чтоб огнем согреть
жилище
Среди холода и скал,
Чтобы приготовить пищу,
Кремень искры высекал.
Не нальешь воды в
корзину…
Было трудно до поры.
Обожгли случайно глину –
Появились гончары.
Черепицу и кувшины.
Крынки и горшки для щей…
Люди делают из глины
Много нужных им вещей.
Как хорош хрусталь
лучистый:
В нем прохлада и тепло.
Научились люди чисто
Плавить из песка
стекло.
Кирпичи дает нам глина.
Краски, прочные вполне,
И подошва для ботинок
Космонавтам на Луне.
ПИСЬМО
О ПОЛЬЗЕ СТЕКЛА
М.В.
Ломоносов
Неправо о вещах те
думают, Шувалов,
Которые стекло чтут ниже
минералов.
Приманчивым лучом
блистающим в глаза.
Не меньше польза в нем,
не меньше в нем краса.
Не редко я для той с
Парнасских гор спускаюсь;
И ныне от нея наверх их
возвращаюсь,
Пою перед тобой в
восторге похвалу,
Ни камня дорогим, ни
злату, но стеклу.
И как я оное хваля
воспоминаю.
Не ломкость лживого я
счастья представляю,
Не должно тленности
примером тое быть,
Чего и сильный огнь не
может разрушить,
Других вещей земных
конечный разделитель:
Стекло им рождено; огонь
его родитель.
АЗОТ
О.В.
Недогибченко
Открыл
его Лавуазье, он нужен всюду и везде.
В
белках он – составная часть, и в воздухе его напасть.
Профессий
у него не счесть, им можно красить, можно съесть.
А
можно в лампах применить, и в холодильниках хранить,
А
также сплавам жизнь продлить, и фрукт, и овощ подкормить.
О
ком же речь идет? Кто незнакомец тот?
Весьма ленивый газ АЗОТ.
Тройные
связи не дают ему свой темперамент проявить.
Но
можно и его расшевелить; тепло, давление системе сообщить,
И
уж тогда его остановить нам не придется:
Он
то взорвется, то развеселит, то оживит, то попросту прольется.
ГАЛОГЕНЫ
О.В
Недогибченко, Т.Ф. Разина
Фтор
Фтор – окислитель мощный
самый,
Он так активен и силен,
Что вытесняет очень
славно
Всех окислителей вагон.
Сам кислород не устоит
Перед напором фтора
едким,
И образует он фторид,
Где кислород
одновалентный.
Работать с ним
весьма опасно,
Он так коварен и ершист,
Что за небрежность с ним
расплатой
Не раз уж становилась
жизнь.
Хлор
Желто-зеленый, ядовитый,
Весьма опасный галоген,
Хлор – очень сильный
окислитель,
Хлор – удушающий фосген.
Прогнать врага он может
смело,
В воде микробов
оглушить.
Когда берется он за
дело,
Скорее надо свет тушить.
Он на свету бомбит
метан,
Процесс растет как
снежный ком,
И вот уже в сосуде дан
И метилен, и хлороформ.
Хлоридов целую плеяду
Он образует с давних
пор.
Он – осмос в клетке, и в
быту отрада.
А медикам насущный
физраствор.
Бром
«Зловонный» – все же
некрасиво
И грубовато назван бром.
Действительно в
свободном виде
Довольно резко пахнет он
Бром быстро успокоит
нервы.
Вернет уверенность в
момент.
Он в фотографии не
первый,
Но очень важный элемент.
Вода из брома как экран
Нам обнаружит кратность
связи,
И отличить этен – этан
В реакциях поможет
разом.
Йод
Открыл случайно Куртуа
В соавторстве с котом,
Когда, упав из рук, зола
Смешалась с кислотой.
Он рану обработает,
Микробов изведет
Активный, вездесущий
И очень важный йод.
Без йода вырасти нельзя
И умным стать подчас.
И зоб грозит тому,
друзья,
Кто, может быть, из вас
Не ест морской капусты
И свеклы каждый раз.
ФОСФОР
О.В.
Недогибченко
Мечтая раздобыть свой
философский камень,
Способный приоткрыть
златые ворота,
Алхимик Бранд увидел
синий пламень
И фосфором нарек его
тогда.
Он, элементом мысли»
будет назван,
Плодоношенье трав
определит.
И даст начало удобреньям
разным
Природный фосфорит и
апатит.
Двуликий фосфор: миф о
нем развеян.
Он даст завесы дым –
лишь только тронь.
Или в компании с стеклом
и клеем
На спичке в коробке
смирит огонь.
ЩЕЛОЧНЫЕ
МЕТАЛЛЫ
О.В.
Недогибченко, Т.Ф. Разина
Литий
Пурпурным
светом в пламени вулканов
Из
недр земли выходит он во мгле.
Чтобы
затем трудиться неустанно
В
крылатых сплавах и в оптическом стекле.
Калий
Он – Соликамска
уроженец.
И худо будет, если вдруг
Не достает его в
растеньях.
Цветам, плодам он лучший
друг.
Собьется с ритма сердце
наше,
И наживешь себе врага.
Тогда придет на помощь
каша.
Орех, укроп и курага.
Натрий
Легко
он режется ножом,
Как
мячик бегает в воде.
Из
керосина лезет на рожон.
В
природе нет его нигде.
В озерах соль его таит.
А электролиз, как театр,
Преображает в гидроксид
С названьем чудным:
едкий натр.
Рубидий
Рубидий наш буквально
недотрога,
Горит он в воздухе,
взрывается в воде.
В земной коре его совсем
немного,
Он в минеральных водах и
слюде.
Рубидий обнаружен в
свекле,
Он почвы и морской воды
клиент,
Рубидий в виноградном
соке.
Вот что такое этот
элемент.
ГИМН
ПОВАРЕННОЙ СОЛИ
И.Н.
Хачатрян
Я соль поваренную
славлю!
Да, это натрия хлорид.
Ее на пьедестал я ставлю
Не только за приятный
вид.
Насыщен ею повсеместно
Океанический бассейн,
Следы ее и в водах
пресных,
Таких, как реки, Нил и
Рейн,
Найти мы, безусловно,
сможем,
Конечно, и в озерах
тоже.
Прекрасный на Руси
обычай:
Гостеприимно хлеб да
соль
Хозяева подносят лично,
Гость в доме появился
коль;
И до сих пор на наших
свадьбах
Так поступают сват и
сватья.
А вот еще и мудрость
есть:
Чтоб хорошо узнать
кого-то,
С ним должен ты пуд соли
съесть.
Немалый срок – почти два
года
Займет такой эксперимент
Средь будней, праздников
и бед.
Такую с детства знаю
сказку:
Свою любовь к отцу и
ласку
Сравнила дочь с любовью
к соли,
Но он воспринял это с
болью:
Отца сравненье возмутило
–
Лишил он дочь родного
крова.
Собрав все мужество и
силы
И не сказав дурного
слова,
Ушла, куда глаза глядят…
Лишь много времени
спустя,
Лишенный своего
богатства,
По свету странствуя,
старик,
Любуясь на хором
убранство,
К крыльцу парадному
приник.
Не знал он, что хозяйкой
дома
Была его родная дочь.
Ему накрыли стол
дубовый,
Поесть же был старик не
прочь,
Но что ни пробовал –
невкусно.
Тогда-то дочь сказала
грустно:
«В еду я соль не
положила –
Так объяснить тебе
решила
Свое сравнение в любви…»
Отец в слезах шептал:
«Прости…»
В народе есть еще
примета:
Просыпешь соль – и быть
скандалу.
Ну почему, скажите, это?
Ответ в истории сыскала.
Когда-то денежною мерой
Была поваренная соль;
Добытчик-муж ругался скверно
С домохозяйкою-женой,
Когда за суетой
случалось,
Что соль по полу
рассыпалась.
Да, мерой денег соль
была –
Свидетельствуют очевидцы
–
И на обмен в торговле
шла,
Стран
будоражила границы;
Катились бунты соляные
по России,
Когда на соль налоги
повышались;
Народы войны страшные
косили –
Так из-за соли страсти
разгорались…
Вопрос, чем вызван
вечный к соли интерес,
Помог решить технический
прогресс.
Кровь наша чуть соленая
на вкус –
Содержится в ней натрия
хлорид;
В межклеточном
пространстве натрий-плюс
Давленье Осмоса для
клеток сохранит.
Хлорид-ионы царствуют в
желудке,
Чтобы запас соляной
кислоты
Нам обеспечить, — это же
не шутки
Белковой пищи расщеплять
хвосты.
Во взрослом человеке
содержание
Хлорида натрия примерно
граммов триста,
Но так как есть процессы
вымывания,
Мы пополняем солью
организмы.
И важно пищу не
пересолить –
Избыток соли может
навредить.
Лишь десять граммов нам
достаточно, не боле,
Поваренной съедать за
сутки соли.
В хозяйстве исстари
использовали соль:
Крестьянин ли, рабочий
ли, король –
Любой к огурчикам питает
слабость,
Хозяюшкой засоленным на
радость;
И даже мясо можно
сохранить,
Достаточно его лишь
засолить.
Но соль нужна не только
для питания,
Ее используют для
полученья натрия
И хлора, натра
едкого и соды,
И медицины ей открыты
своды,
Она и в технике находит
примененье –
Столь велико ее
предназначенье!
Так будь же славен
натрия хлорид!
Вполне заслужено ты в
мире знаменит!
КРУГОВОРОТ
ВЕЩЕСТВ
И.Н.
Хачатрян
Загадочны морей
просторы…
Что там – под толщей
темных вод?
Долины, впадины и горы,
Веществ сплошной
круговорот.
Жизнь зародилась здесь
когда-то,
И от простейших до китов
Во всем неистовстве
богатом
Царит до самых берегов!
От взора внешнего
сокрыта,
Нас продолжая удивлять,
Отсюда, словно Афродита,
Жизнь вышла сушу
покорять!
Моря, как брызги
океана,
Разбросаны по всей
Земле.
В них волны плещут
неустанно
И манят царственно к
себе;
Чаруют шелестом прибоя
Или пугают в сильный
шторм.
Ты здесь о Вечности
невольно
С собой заводишь
разговор…
И созерцая моря краски,
Гармонией его пленен,
Ты, будто бы герой из
сказки,
На новый подвиг
устремлен!
Загадочны морей
просторы…
Что там под толщей
темных вод?
Долины, впадины и горы,
Веществ сплошной
круговорот…
ЭЛЕКТРОЛИТИЧЕСКАЯ
ДИССОЦИАЦИЯ
Н.К.
Шабалина
Жил один кристалл
ионный,
Для ионов дом огромный,
Был красивый он и
ровный,
Но случилась с ним беда.
Капля на него упала,
И кристалла вмиг не
стало:
На ионы распластала
Его ловкая вода.
Все семейство удивилось:
«Что снаружи
приключилось?»
Это рядом появилась
Вдруг молекул череда.
Подбежали шумным роем,
Окружили плотным строем;
Предложить хотим героям
Нашу дружбу навсегда…»
Водородом к анионам,
Гидроксилом к катионам,
Не уйти от них ионам
Ни туда и ни сюда.

