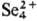СЕЛЕН (от греч.
selene-Луна; лат. Selenium), Se, хим. элемент VI гр. периодич. системы, относится
к халькогенам; ат. н. 34, ат. м. 78,96. Природный селен состоит из шести
изотопов: 74Se (0,87%), 76Se (9,02%), 77Se
(7,58%), 78Se (23,52%), 80Se (49,82%) и 82Se(9,19%).
Поперечное сечение захвата тепловых нейтронов для прир. смеси 12,3·10-28
м2. Конфигурация внеш. электронной оболочки атома 4s24р4;
степени окисления —2, +4 и +6, редко +2; энергии ионизации при последоват.
переходе от Se0 к Sе6+ равны 9,752, 21,2, 32,0, 42,9,
68,3, 81,7 эВ; сродство к электрону 2,020 эВ; электроотрицательность по Полингу
2,40; атомный радиус 0,160 нм, ионные радиусы (нм, в скобках даны координац.
числа) Se2- 0,184 (6), Se4+ 0,064 (6), Se6+
0,042 (4), 0,056 (6).
Среднее содержание в Земной
коре 1,4·10-5% по массе, в воде морей и океанов 4·10-3мг/л.
Известно более 50 минералов селена, напр. берцелианит Cu2Se, науманнит
Ag2Se, самородный Se, халькоменит CuSeO3 · 2 Н2О.
Содержание селена в пирите, галените, висмутине и др. сульфидах, а также в вулканич.
сере до неск. %. Извлекают его в осн. из медных, пиритных, свинцовых, никелевых
и др. руд, где он находится в рассеянном состоянии.
Свойства. При атм.
давлении существует ряд модификаций селена. Наиб. стабилен серый селен (g-Se, «металлический»
селен) с гексагон. кристаллич. решеткой, а = 0,436388 нм, с = 0,495935
нм, z = 3, пространств. группа C312. Его получают из
др. форм при их длит. нагревании, медленном охлаждении расплава, конденсацией
паров и т. д. Структура серого Se состоит из параллельных спиральных цепей.
Из р-ров в CS2 получены три моноклинные модификации красного селена:
a-Se — оранжево-красный, а = 0,9054 нм, b = 0,9083 нм, с
= 1,1601 нм, b = 90,81 °, z = 32, пространств. группа Р21/п,
т.пл. 170°С, плотн. 4,46 г/см3; b-Se-тем-но-красный,
а = 1,285 нм, b = 0,807 нм, с = 0,931 нм, b = = 93,13°,
z = 32, пространств. группа Р21/а, т.пл.
180 °С, плотн. 4,50 г/см3; для красного g-Se-a =
1,5018 нм, b = 1,4713 нм, с = 0,8789 нм, b = 93,61°,
z = 64, пространств. группа Р21/с, плотн.
4,33 г/см3. Эти три формы содержат кольцевые молекулы Se8
в форме короны.
Быстрым охлаждением расплава
получают стекловидный черный селен-хрупкое в-во со стеклянным блеском от красно-коричневого
до голубовато-черного цвета, плотн. 4,28
г/см3. Содержит в осн., как и жидкий селен, плоские зигзагообразные
цепочечные молекулы. Аморфный красный селен может быть получен, напр., восстановлением
H2SeO3 на холоду. Это тонкий порошок, плотн. 4,26 г/см3,
от ярко-красного до красновато-черного цвета. Имеет цепочечную структуру.
При давлении 27 МПа получена
кубич. модификация селена, а = 0,2982 нм. Моноклинный и аморфный селен при 1012
МПа образуют метастабильную гексагон. металлич. фазу.
Для серого g-Sе:т.
пл. 221 °С, т. кип. 685 °С; плотн. 4,807 г/см3, плотн. жидкого
4,06 г/см3 (221 °С); 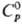
Дж/(моль·К);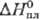
кДж/моль,29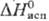
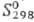
температурной зависимости давления пара: над твердым селеном lgp (гПа) = 13,7029-7644/T,
над жидким lgp(гПа) = 8,2354-5011/T, теплопроводность 0,5 Вт/(м·К);
температурный коэф. линейного расширения 25,5·10-6 К-1
(273 К); r8,0·102 Ом·м, температурный коэф. r0,6·10-3
К-1 (298-398 К); полупроводник с дырочной проводимостью, ширина запрещенной
зоны 1,8 эВ; диамагнитен, магн. восприимчивость — 0,469·10-9. Для
стекловидного селена r 1010 Ом·м. Твердость по Моосу серого селена 2,0,
по Бринеллю ~750 МПа, модуль нормальной упругости 10,2 ГПа. Селен хрупок, выше
60 °С становится пластичным.
Селен, особенно аморфный и
мелкодисперсный, активен химически. При нагр. на воздухе горит (цвет пламени-голубой)
с образованием SeO2 (см. Селена оксиды). С F2,
C12 и Вr2 реагирует при комнатной т-ре. Сплавляется с
I2, но иодиды при этом не образуются. Выше 200°С реагирует с
Н2, давая H2Se. При нагр. образует соед. со всеми металлами
(см. Селениды). С водой реагирует при нагр.: 3Se + 3H2O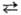
+ H2SeO3. Соляная и разб. серная к-ты с селеном не взаимодействуют.
В конц. H2SO4 селен раств. на холоду, давая зеленый р-р,
содержащий полимерные катионы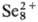
к-рый при хранении переходит в желтый р-р с катионами
. В HNO3 при нагревании селен окисляется до H2SeO3,
в конц. р-рах щелочей раств. с образованием селенида и селената(IV), в присут.
О2 получаются красно-коричневые р-ры, содержащие полиселениды вплоть
до Na2Se4. Селен раств. в р-рах сульфидов и полисульфидов
щелочных металлов с образованием тиоселенидов. При нагр. в р-ре Na2SO3
или KCN образует соотв. Na2SSeO3 или KCNSe. Сильные окислители
окисляют селен до Se(VI). Селен реагирует с алюминиевым порошком в щелочной среде:
12Se + 2Аl + 8NaOH
: 3Na2Se4 + 2NaAlO2 + 4H2O
Гидрид селена (селеноводород)
Н2Sе-бесцв. газ с неприятным запахом; т. кип. —41,35 °С, т. пл.
—65,72 °С; плотн. жидкого 2,12 г/см3; в сухом воздухе при комнатной
т-ре устойчив, во влажном постепенно окисляется до Se; при нагр. на воздухе
горит с образованием SeO2; мало раств. в воде (0,096 М при 15°С),
р-р имеет слабокислую р-цию; сильный восстановитель; получают из Se и Н2
при ~500 °С; используют для получения селена высокой чистоты, селенидов и селенорганических
соединений.
Гексафторид SеF6-бесцв.
газ; т.пл. — 34,6°С, т. возг. —46,6 °С; очень мало раств. в воде, не
гидролизуется. Тетрафторид SеF4-бесцв. жидкость; т. пл. -9,5°С,
т. кип. 101 °С; плотн. 2,75 г/см3; бурно реагирует с водой, разъедает
стекло. Получают фториды фторированием селена.
Тетрахлорид SеС14-бесцв.
или светло-желтые кристаллы; т. пл. 305 °С, т. возг. 196°С; плотн. 2,7
г/см3; водой гидролизуется, в конц. соляной к-те образует гексахлороселенистую
к-ту H2SeCl6; получают хлорированием селена; используют для
получения чистого селена и его соединений, как хлорирующий агент. Диселендихлорид
(монохлорид селена) Se2Cl2-маслянистая коричневая или темно-красная
жидкость; т. пл. — 85 °С, т. кип. 127°С (с разл.); плотн. 2,77 г/см3;
водой гидролизуется, этанолом и диэтиловым эфиром разлагается; получают взаимод.
Se с SeCl4; промежут. продукт в нек-рых способах получения и очистки
селена, реагент для синтеза
селенорг. соединений. Оксохлорид (селенилхлорид) SeOCl2-желтоватая
жидкость; т. пл. 10,9 °С, т. кип. 179,6°С; плотн. 2,445 г/см3;
дымит во влажном воздухе, легко гидролизуется; смешивается с ССl4,
CS2, СНСl3, бензолом; растворяет S, Se, I2,
хлориды мн. металлов; получают взаимод. SeO2 с SeCl4 при:
200 °С; используют для получения чистого селена, как хлорирующий агент, р-ритель,
пластификатор для полимеров.
Получение. Осн. источники
селена-шламы сернокислотного произ-ва (содержат своб. Se) и медеэлектролитные шламы
(содержат селениды тяжелых металлов). При небольшом содержании селена в шламах первого
типа их обогащают флотацией или экстракцией расплавл. S. Для извлечения селена шлам
или концентрат выщелачивают р-ром Na2S (из р-ра селен осаждается при
продувании воздуха) или Na2SO3 (с послед. действием H2SO4).
Применяют также окислит. обжиг с улавливанием возгона водой и послед. осаждением
селена действием NaHSO3 в соляной к-те или окислит. спекание шлама с
Na2CO3. После водного выщелачивания р-р подкисляется НС1,
осадок ТеО2 отфильтровывают, после чего селен осаждают действием FeSO4
[для восстановления Se(VI)] и SO2.
Из медеэлектролитных шламов
сначала удаляют Си обработкой разб. H2SO4 с продувкой
воздухом, а затем проводят окислит. обжиг с отгонкой SeO2 или спекание
с Na2CO3 в окислит. атмосфере с послед. водным выщелачиванием.
Часто окисление ведут без предварит. удаления меди нагреванием с конц. H2SO4,
после чего обжигом отгоняют SeO2. Его улавливают водой или содовым
р-ром и селен осаждают в кислой среде при действии SO2. Др. путь переработки
селенистых р-ров-восстановление металлич. А1 и осаждение селена продувкой воздухом.
Для концентрирования селенсодержащих р-ров применяют экстракцию, сорбцию на
анионитах из слабощелочных или нейтральных р-ров.
Из хим. методов рафинирования
чаще других используют сульфитно-циклич. метод, основанный на обратимой р-ции
селена с р-ром Na2SO3. Большинство др. хим. методов включает
окисление селена (напр., сжиганием в О2), очистку полученного SeO2возгонкой, фильтрацией паров, ионным обменом и т.д. и затем восстановление SeO2,
напр. SO2 или Н2. Селен высокой чистоты получают также очисткой
через летучие соед.-Н2Sе, SеОСl2 и др.
После хим. очистки селен переплавляют,
расплав фильтруют через стеклоткань или активир. уголь, подвергают вакуумной
дистилляции или ректификации в инертной атмосфере.
Определение. Качественно
селен обнаруживают по появлению красного осадка или розового окрашивания при восстановлении
его соед. действием Na2S2O5, NH2OH,
Ph2N2H2 и др. до Se0, желтого окрашивания
или коричнево-красного осадка с 3,3′-диаминобензидином, синего или зеленого
окрашивания с пирокатехином, пирролом. Количественно селен определяют фотометрическими
или флуорометрическими методами с 3,3′-диаминобензидином, о-фенилендиамином
и др., а также измерением окраски коллоидных р-ров селена, полученных, напр., с
N2H4. Используют титриметрич. (тиосульфатный и иодометрич.),
полярографич., атомно-адсорбционный методы, редко-гравиметрический.
Применение. Аморфный селен
входит в состав светочувствит. слоев в ксерографии. Серый селен-полупроводниковый
материал (для диодов, фоторезисторов, мишеней видиконов и др.), пигмент для
стекла, присадка к стали, добавка к сере при вулканизации, его используют для
получения разл. катализаторов, гербицидов, инсектицидов, лек. препаратов, пигментов
и т.д.
Мировое произ-во селена (без
СССР) ок. 1700 т/год (1988). Соединения селена очень ядовиты; сам селен менее токсичен,
но пары его ядовиты; ПДК аморфного селена в воздухе 2 мг/м3, SeO2,
Na2SeO3 0,1 мг/м3, селена в воде 0,01 мг/л. Селен
открыт Й. Берцелиусом в 1817.
Лит.: Бэгнал К.,
Химия селена, теллура и полония, М., 1971; Назарен-ко И. И., Ермаков А. Н.,
Аналитическая химия селена и теллура, М., 1971; Исакова Р. А., Резняков А. А.,
СпивакМ.М., Рафинирование селена, А.-А., 1975; Букетов E. А., Угорец
М. 3., Гидрохимическое окисление халь-когенов и халькогенидов, А.-А., 1975;
Федоров П. И., в кн.: Химия и технология
редких и рассеянных элементов, под ред. К. А. Большакова, 2 изд., ч. 3, М.,
1976, с. 92-158; Грейвер Т. Н., Зайцева И. Г., Косовер В. М., Селен и теллур.
Новая технология получения в рафинирования, М., 1977; Есир-кегенов Г. М., Селен
и теллур, А.-А., 1981. П.И. Федоров.
Содержание статьи
Селен является ценным микроэлементом, его наличие в допустимых количествах необходимо для полноценного функционирования человеческого организма. Достаточно долгое время этот химический элемент считался ядом. Он действительно ядовит в чистом виде и больших дозировках (более 400 мкг для взрослых). Однако содержание вещества в организме в малых количествах — жизненно необходимо. Основная его часть сконцентрирована в печени, селезенке, почках, а также сердце.
В медицинской практике селену отведено почетное место. Результаты ряда исследований доказали его эффективность в профилактике и лечении многих заболеваний. Он признан единственным микроэлементом, который помогает организму оказывать противоопухолевое сопротивление, поэтому считается мощным средством в борьбе с раковыми образованиями.
Показания к приему Селена

полезно почитать на hvastik.com
Цинк
… и 9 комментариев
Селен заслужено носит название «микроэлемента долголетия». Его действие направлено на профилактику инсультов и инфарктов, он помогает организму сопротивляться инфекциям и заболеваниям. Общими для применения селена считаются следующие показания:
- заболевания сердца сосудов,
- атеросклероз,
- профилактика онкологических заболеваний, таких как рак простаты, желудка, горла и кожи,
- ревматоидный артрит,
- макулярная дегенерация,
- бесплодие,
- синдром хронической усталости,
- устранение некоторых побочных эффектов химиотерапии,
Достаточное присутствие в организме человека витамина Е, помогает микроэлементу лучше усваиваться. Сотрудничество этих веществ способствует усиленному действию селена. И наоборот, употребление в больших количествах сахаросодержащих продуктов, а частности, кондитерских изделий, затрудняют его усвоение. Также его полноценному проникновению препятствуют некоторые виды лекарств, особенно Парацетамол.
Как появляется дефицит селена?
Чаще всего нехватка минерала возникает у вегетарианцев, по причине дефицита в меню пищи животного происхождения. Дефицит селена может привести ко множеству проблем со здоровьем, среди которых:
- мужское бесплодие
- остеоартрит
- дефицит йода
- боль в суставах
Но в большинстве развитых стран случаи дефицита селена у здоровых людей редки.
Продукты, содержащие селен
Дефицит селена крайне негативно отражается на здоровье человека. Но, не стоит игнорировать тот факт, что его избыток порой — намного опаснее.
Чтобы обогатить организм селеном, достаточно полноценного питания. Максимальное содержание микроэлемента присутствует в морских продуктах — мясе краба, креветках и жирной рыбе, а также в мясе, субпродуктах и печени. Однако, при их приготовлении, следует контролировать температурный режим, чтобы сохранить селен в нужной концентрации.
Помимо мясных продуктов достаточное количество микроэлемента содержится в:
- бразильском орехе ( до 100 мкг селена на один орех)
- молочные продукты, например деревенский творог может содержать до 20 мкг селена на 100 грамм
- яйца, 15 мкг на одно яйцо
- коричневый рис, 19 мкг на 100 гр.
- в чашке молока 1% жирности содержится 8 мкг селена
Однако максимальное количество селена и наиболее предпочтительным источником этого нутриента считаются морепродукты.
Во время термической обработки, микроэлемент селен почти полностью сохраняется, однако, при варке он переходит в бульон. Во время замачивания продуктов и их размораживания, количество минерала существенно уменьшается. Также селен почти не усваивается организмов в сочетании с сдобной выпечкой и сладостями.
Инструкция по применению селена
Недостаток вещества приводит не только к снижению работоспособности и иммунитета, но и провоцирует развитие сердечных заболеваний, сахарного диабета, мужского бесплодия и болезней суставов.
Наиболее предпочтительным способом приема селена, безусловно, является получение его из продуктов питания, список которых указан выше в статье. Однако это не всегда возможно, в этом случае селен можно получить из биологически активных добавок. Селен является обязательным элементом большинства витаминно-минеральных комплексов, а также производятся препараты исключительно с селеном.
Селен может быть представлен в разных химических формах с разной биодоступностью. В частности было произведено несколько исследований по сравнению биодоступности селена (по контролю мочи) в форме дрожжей с высоким содержанием селена (селенизованные дрожжи), селенита натрия и селенометионина. Эти исследования показали наивысшую биодоступность у селенометионина.
При приеме селена необходимо следовать инструкции указанной на препарате и не превышать максимальные суточные нормы. Для взрослых селен становится токсичным при приеме более 400 мкг.
Как обычно существует две таблицы по приему селена. Это рекомендованные суточные дозы. То есть те нормы нутриента которые должен потреблять здоровый человек в соответствии с возрастом. И не важно каким образом через пищу или принимая пищевые добавки.
Рекомендованные суточные нормы приема Селена для ЗДОРОВЫХ
- Младенцы до 6 месяцев — 15 мкг
- Дети — 20-40 мкг
- Взрослые — 55 мкг
Оптимальный способ получить необходимую суточную норму микроэлемента – разнообразить питание. Норма единиц каждого конкретного витамина, в том числе и селена, рассчитывается с учетом его пола и возраста. Также не менее важны такие факторы, как наличие болезней или состояние беременности, при которых суточная норма вещества должна увеличиваться в два раза.

В повышенной дозировке микроэлемента нуждаются также — курильщики, спортсмены и люди, ведущие активный способ жизни. В каждом конкретном случае, корректировать норму препарата должен исключительно наблюдающий врач.
Однако при приеме повышенных доз селена нужно учитывать предельно допустимые дозировки
Предельные допустимые нормы
- Младенцы до 6 месяцев — 45 мкг
- Дети — 60-280 мкг
- Взрослые — 400 мкг
Не забывайте что в больших дозах селен становится токсичным. Также этот факт нужно учитывать при продолжительных курсах.
Противопоказания и побочные действия селена

При дефиците селена человеческий организм не в состоянии полноценно функционировать, поэтому его восполнение вместе с продуктами – вполне оправдано. Однако, прием минерала в препаратах противопоказан в ряде случаев:
- беременность и кормление грудью — противопоказания для продолжительных курсов селена и больших его дозировок,
- гемодиализ,
- мужское бесплодие,
- хирургическое вмешательство,
- аутоимунные заболевания,
Побочные действия в период употребления препарата появляются крайне редко, однако в индивидуальных случаях или при превышении рекомендованных дозировок могут быть случаи тошноты, запоры, изменение настроения, ломкость ногтей.
Взаимодействие селена с другими препаратами
Селен уменьшает свертываемость крови (поэтому плановое хирургическое вмешательство является противопоказанием) поэтому его следует с осторожностью использовать со средствами со сходным действием аспирином, гепарином и прочими.
Прием селена в комплексе с бета-каротином, витамином Е, витамином С может снизить эффективность препаратов снижающих уровень холестерина. Также эта связка снижает эффективность ниацина, который принимают для повышения уровня хорошего холестерина.
Селен может усилить действие седативных средств (барбитуратов), что далеко не всегда желательно.
Таблица применимости Селена
- Астма
100 мкг/сутки
Астма предполагает ущерб организму от воздействия свободных радикалов, а селен способен защитить организм от их воздействия. В одном эксперименте, добавка селенита натрия улучшала симптомы у пациентов с астмой. - Атеросклероз
100 мкг/сутки
Некоторые врачи рекомендуют людям с атеросклерозом добавки с селеном, который уменьшает процент смертности от сердечных заболеваний. - Рак толстой кишки
200 мкг/сутки
Считается что селен эффективен при профилактике онкологических заболеваний, в том числе рака толстой кишки. - Депрессия
100 мкг/сутки
Дефицит Селена может способствовать депрессии. Компенсация дефицита селена через прием пищевых добавок может помочь при лечении депрессивных состояний. - Герпетиформный дерматит
200 мкг/сутки
Добавки с селеном и витамином Е эффективны при лечении кожных заболеваний, в том числе и в случае дерматитов. - Отеки
230 мкг/сутки
Пациенты с лимфедемой рук или области головошеи, которые были обработаны с средствами с содержанием селена обнаружили уменьшение отечности. - Инфаркт
100-200 мкг/сутки
Добавки с селеном эффективны для профилактики и лечения сердечно-сосудистых заболеваний и инфаркта в том числе. - СПИД (ВИЧ)
Под наблюдением врача: 400 мкг/сутки
Добавка Селена может привести к уменьшению числа инфекций и улучшить аппетит. - Иммунитет
100 мкг/сутки и 20 мг цинка
Селен улучшает иммунную функцию. - Инфекции
100 мкг/сутки и 20 мг цинка
Улучшая функционирование иммунитета селен помогает бороться с инфекциями. - Рак легких
200 мкг/сутки
По многочисленным исследованиям селен обладает противоопухолевыми свойствами и эффективен при профилактике и лечении онкологических заболеваний и рака лёгких в том числе. - Мужское бесплодие
100 мкг/сутки
В исследовании бесплодных мужчин со сниженной подвижностью сперматозоидов, добавки с селеном значительно увеличивали подвижность сперматозоидов. - Болезнь Осгуда Шлаттера
150 мкг/сутки и 400 МЕ витамина Е
Комплекс из витамина Е и селена может быть эффективным при лечении болезни Осгуда Шлаттера. - Панкреатическая недостаточность
600 мкг, под наблюдением лечащего врача
Прием антиоксидантных добавок, таких как селен, может облегчить боль и предотвратить рецидивы панкреатита. - Фенилкетонурия
Подростки и взрослые: 55 мкг/сутки; дети: 15-40 мкг/сутки
При лечении Фенилкетонурии необходимо придерживаться низкобелковой диеты, что в свою очередь приводит к дефициту селена, который организм получает из животной пищи. Таким образом больным Фенилкетонурией необходима фармподдержка селеном. - Рак простаты
200 мкг/сутки
По многочисленным исследованиям селен обладает противоопухолевым действием. Добавки с этим нутриентом могут снизить риск рака простаты. - Ревматоидный артрит
200 мкг/сутки
Пациенты с ревматоидным артритом имеют более низкие уровни Селена, чем у здоровых людей. Добавки с селеном могут уменьшить боль и воспаление суставов. - Изменения в PAP мазке
По рекомендации врача
Низкие уровни Селена были замечены у женщин с цервикальной дисплазией. - Возрастное слабоумие
По рекомендации врача
В ходе одного из исследований у пациентов с умеренными когнитивными нарушениями и низким уровнем селена в крови, было обнаружено улучшение показателей когнитивной функции при включении в диету бразильского ореха, богатого селеном. - Аритмия
По рекомендации врача
Селен может быть эффективен при лечении аритмии. - Кардиомиопатия
По рекомендации врача
Дефицит селена считается причиной одной из форм Кардиомиопатии, таким образом устранение этого дефицита является одним из важнейших элементов терапии. - Детские заболевания
По рекомендации врача
Селен поддерживает здоровую иммунную систему и помогает бороться с вирусными инфекциями. - Синдром Дауна
По рекомендации врача
Предварительные исследования показали, что антиоксидантная активность в организме улучшается, когда дети с синдромом Дауна принимают селен. - Болезни рта и десен
Спрей с содержанием 3.7% цитронеллы каждое утро в течении 6 дней в неделю
Селена часто рекомендуется врачами для предотвращения и лечения пародонтита. - Гепатит
100 мкг/сутки
В одном испытании, комбинация Альфа-липоевой кислоты, силимарина и Селена привело к значительному улучшению функции печени и общего состояние здоровья у людей с гепатитом С. - Высокий уровень холестерина
По рекомендации врача
Двойное слепое исследование показало, что у людей с умеренно повышенным уровнем холестерина, добавка селена в виде селенобогащенных дрожжей привело к небольшому, но статистически значимому снижению в сыворотке крови холестерина. - Гипотиреоз
По рекомендации врача
Селен играет важную роль в обмене гормонов щитовидной железы. - Цирроз печени
По рекомендации врача
Люди с циррозом печени часто имеют низкие уровни Селена и большую потребность в антиоксидантах. В одном исследовании, добавки с селеном улучшали функцию печени у пациентов с алкогольным циррозом. - Макулярная дегенерация
По рекомендации врача
Селен защищает от оксидативного стресса и может снизить риск макулярной дегенерации.
Фон: зеленый — научно доказано, оранжевый — доказательства недостаточны, Белый — исследования не производились
Самые популярные добавки с Селеном





| Селен | |
|---|---|
| Атомный номер | 34 |
| Внешний вид простого вещества | Мягкий неметалл, похожий на серу |
| Свойства атома | |
| Атомная масса (молярная масса) | 78,96 а. е. м. (г/моль) |
| Радиус атома | 140 пм |
| Энергия ионизации (первый электрон) | 940,4 (9,75) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d10 4s2 4p4 |
| Химические свойства | |
| Ковалентный радиус | 116 пм |
| Радиус иона | (+6e) 42 (-2e) 191 пм |
| Электроотрицательность (по Полингу) | 2,55 |
| Электродный потенциал | 0 |
| Степени окисления | 6, 4, -2 |
| Термодинамические свойства простого вещества | |
| Плотность | 4,79 г/см³ |
| Молярная теплоёмкость | 25,4[1]Дж/(K·моль) |
| Теплопроводность | 0,52 Вт/(м·K) |
| Температура плавления | 490 K |
| Теплота плавления | 5,23 кДж/моль |
| Температура кипения | 958,1 K |
| Теплота испарения | 59,7 кДж/моль |
| Молярный объём | 16,5 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=4,364 c=4,959 Å |
| Отношение c/a | 1,136 |
| Температура Дебая | 90 K |
| Se | 34 |
| 78,96 | |
| 4s2 4p4 | |
| Селен | |
Селен — химический элемент с атомным номером 34 в периодической системе, обозначается символом Se (Selenium), хрупкий блестящий на изломе неметалл чёрного цвета (устойчивая аллотропная форма, неустойчивая форма — киноварно-красная).
Схема атома селена
Элемент открыт Й. Я. Берцелиусом в 1817. Небольшое поествование Берцелиуса об открытии элемента: Велись научные работы вместе с Готлибом Ганом — анализировали и исследовали метод, который применяют для производства серной кислоты в Грипсхольме. Мы обнаружили в серной кислоте осадок, частью красный, частью светло-коричневый. Этот осадок, опробованный с помощью паяльной трубки, издавал слабый редечный запах и образовывал свинцовый королёк. Согласно Клапроту, такой запах служит указанием на присутствие теллура. Ган заметил при этом, что на руднике в Фалюне, где собирается сера, необходимая для производства кислоты, также ощущается подобный запах, указывающий на присутствие теллура. Любопытство, вызванное надеждой обнаружить в этом коричневом осадке новый редкий металл, заставило меня исследовать осадок. Приняв намерение отделить теллур, я не смог, однако, открыть в осадке никакого теллура. Тогда я собрал всё, что образовалось при получении серной кислоты путём сжигания фалюнской серы за несколько месяцев, и подверг полученный в большом количестве осадок обстоятельному исследованию. Я нашёл, что масса (то есть осадок) содержит до сих пор неизвестный металл, очень похожий по своим свойствам на теллур. В соответствии с этой аналогией я назвал новое тело селеном (Selenium) от греческого σελήνη (луна), так как теллур назван по имени Tellus — нашей планеты.
Происхождение названия
Название происходит от σελήνη — Луна. Элемент назван так в связи с тем, что в природе он является спутником химически сходного с ним теллура (названного в честь Земли).
Получение
Значительные количества селена получают из шлама медно-электролитных производств, в котором селен присутствует в виде селенида серебра. Применяют несколько способов получения: окислительный обжиг с возгонкой SeO2; нагревание шлама с концентрированной серной кислотой, окисление соединений селена до SeO2 с его последующей возгонкой; окислительное спекание с содой, конверсия полученной смеси соединений селена до соединений Se(IV) и их восстановление до элементарного селена действием SO2.
Физические свойства
Монокристаллический селен(99,9999 %)
Твёрдый селен имеет несколько аллотропных модификаций.Наиболее устойчивой модификацией является серый селен.
Химические свойства
Селен — аналог серы. Так же, как и серу, его можно сжечь на воздухе. Горит синим пламенем, превращаясь в двуокись SeO2. Только SeO2 — не газ, а кристаллическое вещество, хорошо растворимое в воде. Получить селенистую кислоту (SeO2 + H2O → H2SeO3) ничуть не сложнее, чем сернистую. А действуя на неё сильным окислителем (например, HClO3), получают селеновую кислоту H2SeO4, почти такую же сильную, как серная.
Применение
- Одним из важнейших направлений его технологии, добычи, и потребления являются полупроводниковые свойства как самого селена, так и его многочисленных соединений (селенидов), их сплавов с другими элементами, в которых селен стал играть ключевую роль. Эта роль селена постоянно растёт, растёт спрос и цены (отсюда дефицит этого элемента).
Цены на селен растут из года в год и в настоящее время колеблются около 120 долларов за 1 кг.
В современной технологии полупроводников применяются селениды многих элементов, например селениды олова, свинца, висмута, сурьмы, селениды лантаноидов. Особенно важны свойства фотоэлектрические и термоэлектрические как самого селена, так и селенидов.
- Стабильный изотоп селен-74 позволил на своей основе создать плазменный лазер с колоссальным усилением в ультрафиолетовой области (около миллиарда раз).
- Радиоактивный изотоп селен-75 используется в качестве мощного источника гамма-излучения для дефектоскопии.
- В медицине, а также в сельском хозяйстве используют микродобавки селена к лекарственным средствам, витаминным препаратам, БАД, и т. п.
Селенид калия совместно с пятиокисью ванадия применяется при термохимическом получении водорода и кислорода из воды (селеновый цикл, Ливерморская национальная лаборатория им. Лоуренса, Ливермор, США).
Биологическая роль
Входит в состав активных центров некоторых белков в форме аминокислоты селеноцистеина.
Микроэлемент, но большинство соединений достаточно токсично (селеноводород, селеновая и селенистая кислота) даже в средних концентрациях.
Изотопы
В природе существует 6 изотопов селена (74Se, 76Se, 77Se, 78Se, 80Se и 82Se), из них пять, насколько это известно, стабильны, а один (82Se) испытывает двойной бета-распад с периодом полураспада 9,7×1019 лет. Кроме того, искусственно созданы ещё 24 радиоактивных изотопа (а также 9 метастабильных возбуждённых состояний) в диапазоне массовых чисел от 65 до 94.
Периоды полураспада некоторых радиоактивных изотопов селена:
| Изотоп | Распространённость в природе, % | Период полураспада |
|---|---|---|
| 73Se | — | 7,1 час. |
| 74Se | 0,87 | — |
| 75Se | — | 120,4 сут. |
| 76Se | 9,02 | — |
| 77Se | 7,58 | — |
| 77mSe | — | 17,5 сек. |
| 78Se | 23,52 | — |
| 79Se | — | 6,5·104 лет |
| 79mSe | — | 3,91 мин. |
| 80Se | 49,82 | — |
| 81Se | — | 18,6 мин. |
| 81mSe | — | 62 мин. |
| 82Se | 9,19 | — |
| 83mSe | — | 69 сек. |
| 83Se | — | 25 мин. |
Дополнительная информация
- Категория:Соединения селена
- Селеновая кислота
Таблица
^
=>>
v
Йёнс Якоб Берцелиус (1779-1848)
Красный, серый и черный селен
Источник:
http://de.wikipedia.org/ wiki/Bild:Selen_1.jpg
| См. также: Селен в заданиях |
| Поделиться в |
История открытия:
Cелен открыт в 1817 году Йенсом Якобом Берцелиусом. Сохранился рассказ самого Берцелиуса о том, как произошло это открытие:
» Я исследовал в содружестве с Готлибом Ганом метод, который применяют для производства серной кислоты в Грипсхольме. Мы обнаружили в серной кислоте осадок, частью красный, частью светло-коричневый. … Любопытство, вызванное надеждой обнаружить в этом коричневом осадке новый редкий металл, заставило меня исследовать осадок. … Я нашел, что масса (то есть осадок) содержит до сих пор неизвестный металл, очень похожий по своим свойствам на теллур.
В соответствии с этой аналогией я назвал новое тело селеном (Selenium) от греческого selhnh (луна), так как теллур назван по имени Tellus — нашей планеты «.
Нахождение в природе, получение:
Содержание селена в земной коре около 500 мг/т. Селен образует 37 минералов, среди которых в первую очередь должны быть отмечены ашавалит FeSe, клаусталит PbSe, тиманнит HgSe, гуанахуатит Bi2(Se,S)3, хастит CoSe2, платинит PbBi2(S,Se)3. Изредка встречается самородный селен. Главное промышленное значение на селен имеют сульфидные месторождения. Содержание селена в сульфидах колеблется от 7 до 110 г/т. Концентрация селена в морской воде 4*10-4 мг/л.
Селен получают из отходов сернокислотного, целлюлозно-бумажного производства , а также значительные количества получают из шлама медно-электролитных производств, в котором селен присутствует в виде селенида серебра. Применяют несколько способов получения селена из шлама: окислительный обжиг с возгонкой SeO2; окислительное спекание с содой, конверсия полученной смеси соединений селена до соединений Se(IV) и их восстановление до элементарного селена действием SO2.
Физические свойства:
Разнообразие молекулярного строения обусловливает существование селена в разных аллотропных модификациях: аморфной (порошкообразный, коллоидный, стекловидный) и кристаллической (моноклинный, a— и b-формы и гексагональный g-форма). Аморфный (красный) порошкообразный и коллоидный селен получают при восстановлении из раствора селенистой кислоты, быстрым охлаждением паров селена. Стекловидный (черный) селен получают при нагревании любой модификации селена выше 220°С с последующим быстрым охлаждением. Он обладает стеклянным блеском, хрупок. Термодинамически наиболее устойчив гексагональный (серый) селен. Он получается из других форм селена нагреванием до плавления с медленным охлаждением до 180-210°С и выдержкой при этой температуре. Решетка его построена из расположенных параллельно спиральных цепочек атомов.
Химические свойства:
При обычной температуре селен устойчив к действию кислорода, воды и разбавленных кислот. При нагревании селен взаимодействует со всеми металлами, образуя селениды. В кислороде при дополнительном нагревании он медленно горит синим пламенем, превращаясь в диоксид SeO2.
С галогенами, за исключением йода, он реагирует при комнатной температуре с образованием соединений SeF6, SeF4, SeCl4, Se2Cl2 , SeBr4, и др. C хлорной или бромной водой селен реагирует по уравнению:
Se + 3Br2 + 4H2O = H2SeO4 + 6 HBr
Водород взаимодействует с селеном при t >200°С, давая H2Se.
В конц. H2SO4 на холоду селен растворяется , давая зеленый р-р, содержащий полимерные катионы Se82+.
С водой при нагревании и в конц. растворах щелочей селен диспропорционирует:
3Se + 3H2O = 2H2Se + H2SeO3 и 3Se + 6KOH = K2SeO3 + 2K2Se + 3H2O
образуя соединения селена(-2) и селена(+4).
Аналогично сере селен растворяется при нагревании в растворах Na2SO3 или KCN, образуя соответственно Na2SSeO3 (аналог тиосульфата) или KCNSe (аналог роданида).
Важнейшие соединения:
Для селена наиболее характерны степени окисления -2, +4, +6.
Оксид селена(IV) SeO2 — белые блестящие кристаллы с полимерной молекулой (SeOsub>2)sub>n , tпл. 350°С. Пары имеют желтовато-зеленый цвет и обладают запахом гнилой редьки Легко растворяется в воде с образованием H2SeO3.
Селенистая кислота, H2SeO3 — белые ромбические кристаллы.Обладает большой гигроскопичностью. Хорошо растворима в воде. Неустойчива, при нагревании выше 70°С распадается на воду и оксид селена(IV). Соли — селениты.
Селенит натрия, Na2SeO3 – бесцветные кристаллы, tпл. 711°С. Гигроскопичен, хорошо растворим в воде. При нагревании в инертной атмосфере разлагается на оксиды. При нагревании на воздухе окисляется до селената: 2Na2SeO3 + O2 = 2Na2SeO4
Оксид селена(VI) SeO3 — — бесцветные кристаллы, tпл. 121°С. Гигроскопичен, с водой реагирует с большим тепловыделением и образованием H2SeO4. Сильный окислитель, бурно реагирует с органическими веществами
Селеновая кислота, H2SeO4 — бесцветное кристаллическое вещество, хорошо растворимое в воде. Ядовита, гигроскопична, является сильным окислителем. Селеновая кислота — одно из немногих соединений, при нагревании растворяющих золото, образуя красно-желтый раствор селената золота(III).
2Au + 6H2SeO4 = Au2(SeO4)3 + 3H2SeO3 + 3H2O
Селенаты — соли селеновой кислоты. Селенат натрия Na2SeO4 — кристаллы ромбической сингонии; tпл. 730 °С. Получают нейтрализацией кислоты оксидом, гидроксидом или карбонатом натрия или окислением селенита натрия. Мало растворим в воде, ниже 32 °С кристаллизуется из водных растворов в виде декагидрата Na2SeO4·10H2O
Селеноводород, H2Se — бесцветный горючий газ с неприятным запахом. Самое токсичное соединение селена. На воздухе легко окисляется при обычной температуре до свободного селена. Также до свободного селена окисляется хлором, бромом и иодом. При горении в воздухе или кислороде образуется оксид селена(IV) и вода. Более сильная кислота, чем H2S.
Селениды — соединения селена с металлами. Кристаллические вещества, часто с металлическим блеском. Существуют моноселениды состава М2Se, MSe; полиселениды М2Sеn (кроме Li), где n = 2-6; гидроселениды MHSe. Кислородом воздуха окисляются до селена:
2Na2Sen + O2 + 2H2O = 2n Se + 4NaOH
Применение:
Селен используется в выпрямительных полупроводниковых диодах, а также для фотоэлектрических приборов, электрофотографических копировальных устройств, в качестве люминофоров в телевидении, оптических и сигнальных приборах, терморезисторах и т. п. Селен широко применяется для обесцвечивания зеленого стекла и получения рубиновых стекол; в металлургии — для придания стали мелкозернистой структуры, улучшения их механических свойств; в химической промышленности — в качестве катализатора.
Стабильный изотоп селен-74 позволил на своей основе создать плазменный лазер с колоссальным усилением в ультрафиолетовой области (около миллиарда раз).
Радиоактивный изотоп селен-75 используется в качестве мощного источника гамма-излучения для дефектоскопии.
Биологическая роль и токсичность:
Селен ходит в состав активных центров некоторых белков в форме аминокислоты селеноцистеина. Он обладает антиоксидантными свойствами, повышает восприятие света сетчаткой глаза, влияет на многие ферментативные реакции. Потребность человека и животных в селене не превышает 50-100 мкг/кг рациона.
Полковников А.А.
ХФ ТюмГУ, 581 группа. 2011 г.
Источники: Википедия:
Сайт «Справочник химика»:
Сайт «XuMuk.ru»:
Что мы знаем о селене? На школьных уроках химии нам рассказывали о том, что селен – химический элемент, мы могли решать различные химические уравнения и наблюдать реакции с его участием. Но элементов в таблице Менделеева так много, что весь объем информации охватить невозможно. Поэтому все изложено довольно кратко.
В этой статье можно подробно ознакомиться с элементом под названием «селен». Что это такое, каковы его свойства, где в природе можно встретить этот элемент и как он используется в индустрии. Помимо этого, немаловажно знать, какое влияние он оказывает на наш организм.
Что такое селен
Селен (элемент Selenium) – это химический элемент, аналог серы, который относится к 16 группе (согласно более ранней классификации – к 6-й) таблицы Менделеева. Атомный номер элемента – 34, а атомная масса составляет 78,96. Элемент проявляет преимущественно неметаллические свойства. В природе селен – это комплекс, состоящий из шести изотопов, как правило, сопутствует сере. То есть встречается в местах добычи серы. Итак, загадочный селен — что это такое и чем он так ценен? Он обладает множеством полезных свойств.
История открытия селена
Данный химический элемент был открыт шведским химиком и минералогом Йёнсом Якобом Берцелиусом в 1817 году.
В научной литературе есть история открытия минерала, рассказанная самим учёным.
Он рассказывает, что в то время он вместе с другим учёным по имени Юхан Готлиб Ган (получившим известность как первооткрыватель марганца и изучившим его свойства) проводил исследования метода производства серной кислоты в городе Грипсхольм.
В ходе лабораторных опытов в серной кислоте были найдены осадки красного с примесью светло-коричневого оттенка вещества. При взаимодействии с паяльной трубкой от осадочных материалов исходил легкий редечный запах и образовывался свинцовый королёк. Берлинский учёный Мартин Клапрот утверждал, что наличие характерного запаха говорит о наличии теллура. Коллега Берцелиуса еще отметил, что на рудниках, где добывается данная сера для кислоты (в Фалюне) также чувствуется аналогичный запах.
В надежде найти редкий недавно открытый металл (теллур) в растворе, учёные принялись за более детальное исследование осадка, но всё было тщетно. После Берцелиус собрал все продукты, которые накопились за несколько месяцев получения серной кислоты путем сжигания серы, и также принялся исследовать.
Исследования показали, что новый, ранее неизвестный элемент имеет схожие свойства с теллуром, но таковым не является. Так периодическая таблица получила новый элемент — селен.
Происхождение названия элемента
История происхождения наименования нового элемента довольно интересна. Периодическая таблица Менделеева определяет новый элемент как Selenium (Se). Название своё получил по названию нашего естественного спутника.
Изначально в русских изданиях элемент назывался «селениумом» (в десятых годах XIX столетия). Позднее, после 1835, года было принято наименование «селен».
Свойства селена
Формула селена – Se. Температура плавления вещества – 217 (α-Se) и 170–180 градусов Цельсия (β-Se), а закипает он при температуре 6850.
Степени окисления, что селен проявляет в реакциях: (-2), (+2), (+4), (+6), он устойчив к воздуху, кислороду, воде, соляной кислоте и разбавленной серной кислоте.
Поддается растворению в азотной кислоте высокой концентрации, «царской водке», более длительно растворяется в щелочной среде с окислением.
Формы селена
Существует две модификации селена:
- Кристаллическая (моноклинный селен a- и b-форм, гексагональный селен g-формы).
- Аморфная (порошкообразная, коллоидная и стекловидная формы селена).
Модификация аморфный красного цвета селен. Что это такое? Одна из неустойчивых модификаций элемента. Порошкообразная и коллоидная формы селена получаются путем восстановления вещества из раствора селенистой кислоты H2SeO3.
Черный стекловидный селен можно получить путём нагревания элемента любой модификации до температуры 220 градусов Цельсия с быстрым охлаждением.
Гексагональный селен имеет серый цвет. Эту модификацию, наиболее устойчивую термодинамически, можно получить также путем нагревания до температуры плавления с дальнейшим охлаждением до температуры 180-210 градусов Цельсия. Необходимо некоторое время выдерживать такой температурный режим.
Оксид селена
Есть ряд оксидов, которые образуются путем взаимодействия селена и кислорода: SeO2, SeO3,SeO, Se2O5. При этом SeO2 и SeO3 – это ангидриды селенистой (H2SeO3) и селеновой (H2SeO4) кислот, которые образуют соли селенит и селенат. Оксид селена SeO2 (хорошо растворяется в воде) и является самым устойчивым.
Интересные опыты над селеном
Перед тем, как начинать опыты с этим элементом, стоит помнить, что любые соединения с селеном ядовиты, поэтому необходимо принимать все меры безопасности, к примеру, надевать защитные средства и проводить реакции в вытяжном шкафу.
Цвет селена проявляется в ходе приятной глазу реакции. Если через колбу с селенистой кислотой пропустить сернистый газ, который является хорошим восстановителем, то полученный раствор станет желтым, потом оранжевым и в итоге — кроваво-красным.
Слабый раствор даст возможность получить аморфный коллоидный селен. В случае, если концентрация селенистой кислоты будет высокой, то в ходе реакции будет оседать от красного до тёмно-бордового оттенка порошок. Это будет аморфный порошкообразный селен элементарной формы.
Для того, чтобы привести вещество в стеклообразное состояние, необходимо его нагреть и резко охладить. Цвет изменится на черный, а вот красный оттенок можно будет заметить, только если смотреть на просвет.
Кристаллический моноклинный селен получить будет немного сложнее. Для этого нужно взять небольшое количество красного порошка и перемешать с сероуглеродом. К сосуду со смесью необходимо подключить обратный холодильник и кипятить в течение 2 часов. Вскоре начнет образовываться светло-оранжевая жидкость с лёгким зеленым оттенком, которую нужно будет медленно испарить в ёмкости под фильтровальной бумагой.
Применение селена
Впервые селен начали применять в керамической и стекольной промышленности. Об этом нам говорит «Справочник по редким металлам» 1965 года издания.
Селен добавляется в стеклянную массу с целью обесцвечивания стекла, устранения зеленоватого оттенка, который даёт примесь соединений железа. Для получения рубинового стекла в стекольной промышленности используется соединение селена и кадмия (кадмоселит CdSe). В производстве керамики кадмоселит придаёт ей красный цвет, а также окрашивает эмали.
Немного селена используется в качестве наполнителя в резиновой промышленности, а также в сталелитейной – для того, чтобы полученные сплавы имели мелкозернистую структуру.
Большинство полупроводниковой техники изготавливается с использованием селена. Это и стало главной причиной роста стоимости такого вещества, как селен. Цена возросла от 3,3 до 33 долларов за 1 килограмм в 1930 и 1956 годах соответственно.
Стоимость селена на мировом рынке в 2015 году составила 68 долларов за 1 кг. Тогда как в 2012 килограмм этого металла стоил около 130 долларов за один килограмм. Спрос на селен (цена тому подтверждение) падает из-за высокого предложения.
Вещество также широко используется при производстве фототехники.
Наличие селена в организме человека
Наш организм содержит приблизительно 10-14 миллиграммов этого вещества, которое сосредоточено в большей степени в таких органах, как печень, почки, сердце, селезенка, яички и семенные канатики у мужчин, а также в ядрах клеток.
Потребность человеческого организма в таком микроэлементе как селен невысока. Всего 55-70 микрограммов для взрослых. Предельной суточной дозой считается 400 микрограммов. Тем не менее есть болезнь, называемая болезнь Кешана, которая возникает при дефиците этого элемента. Примерно до 60-х годов селен считался ядовитым веществом, которое оказывает негативное воздействие на организм человека. Но после детального исследования были сделаны обратные выводы.
Часто при выявлении патологического содержания селена врачи могут назначать специальные препараты, содержащие комбинацию цинк-селен-магний, вещества, которые в комплексе восполнят недостаточность его в организме. Разумеется, не исключая продукты, которые содержат селен.
Воздействие на организм
Селену принадлежит очень важная роль в процессе жизнедеятельности организма:
- он активирует иммунитет – «стимулирует» лейкоциты на более активное воздействие на вредоносные микроорганизмы (вирусы);
- замедляет процессы старения в организме;
- снижает риски возникновения аритмии, внезапной коронарной смерти или кислородного голодания благодаря замедлению окисления холестерина;
- ускоряет приток крови к мозгу, активируя мыслительную деятельность, снимает симптомы хандры и депрессии (усталость, вялость, подавленность и беспокойность);
- тормозит развитие раковых клеток, обладая антиоксидантными свойствам;
- активно селен борется со свободными радикалами;
- при взаимодействии с витамином Е действует как противовоспалительное средство.
Конечно же, нельзя обойти вниманием такое важное свойство микроэлемента, как помощь в борьбе с опасными вирусами: ВИЧ/СПИД, гепатиты, лихорадка Эбола.
Благодаря наличию селена вирус задерживается внутри клетки; вещество предупреждает распространение вируса по организму. Но если селена недостаточно, то его функция не срабатывает должным образом.
Приём селена в комплексе с йодом поможет остановить прогрессирующее заболевание щитовидной железы (нехватка тироксина), а в некоторых случаях стимулирует регресс болезни (чаще у детей).
Также в медицине селен используется в целях профилактики сахарного диабета, поскольку он ускоряет потребление глюкозы организмом.
Препарат с витаминами может назначаться беременным. Он помогает справиться с симптомами токсикоза, снимет усталость и поднимет настроение.
Дефицит селена
Почему в организме может быть нехватка такого вещества, как селен? Что это такое – «дефицит селена» и как с ним бороться? На самом деле это неприятное заболевание, несмотря на то, что возникает оно довольно редко.
Важно знать, что злейшим врагом этого вещества является, конечно же, углеводы – мучное, сладкое. В сочетании с ними селен очень плохо усваивается организмом и от этого может возникать его недостаток.
Каковы же признаки дефицита? Прежде всего стоит отметить, что при дефиците селена будет снижаться работоспособность и общее настроение.
Нехватка селена ослабляет иммунитет, вследствие чего организм становится более восприимчивым к различным заболеваниям как психического, так и физического плана.
Также при дефиците этого вещества в организме нарушается процесс усвоения витамина Е.
Основными признаками недостатка селена являются: боли в мышцах и суставах, преждевременная усталость, анемия, обостряются болезни почек и поджелудочной железы.
Но если вы почувствовали какой-то из симптомов, ни в коем случае не следует заниматься медикаментозным самолечением. Обязательно необходимо посетить врача и проконсультироваться по поводу необходимости приёма тех или иных препаратов. Иначе можно самостоятельно вызвать избыток селена, что хуже в некоторых случаях. К примеру, если человек с онкологическим заболеванием будет бесконтрольно принимать селен, химия (химиотерапия) может не подействовать.
Избыток селена
Перенасыщенность селеном также производит негативный эффект на организм. Основными признаками профицита являются: поражение волос и ногтей, повреждение зубов, усталость и постоянные нервные расстройства, потеря аппетита, появление дерматитов, артритов, а также желтушность и шелушение кожи.
Но если вы не работаете на мощностях по добыче селена, или не живете около мест, где добывают это вещество, то можно не бояться избытка селена в организме.
Продукты богатые селеном
Больше всего селена содержится в мясе и печени – свиной, говяжьей, куриной, утиной или печени индейки. К примеру, в 100 граммах печени индейки содержится 71, а в свиной – 53 микрограмма селена.
В 100 граммах мяса осьминога содержится 44,8 мкг селена. Также в рацион стоит включить такие продукты, как креветки, красную рыбу, яйца, кукурузу, рис, фасоль, ячневую крупу и чечевицу, пшеницу, горох, капусту брокколи, неактивные хлебопекарские дрожжи (обработанные разогретой до 60 градусов водой). Не стоит забывать об орехах – фисташки, миндаль, грецкий орех и арахис также содержат селен, пусть и в небольших количествах.
Стоит также помнить о том, что при обработке продуктов вещество теряется, консервы и концентраты содержат в два раза меньше селена, чем свежие продукты. Поэтому, по возможности, необходимо употреблять как можно больше свежих продуктов с содержанием селена.