Каждый сталкивался с таким понятием, как щелочь, но не каждый может точно сказать, что же это такое. Особенно это относится к тем, кто давно окончил школу и начал забывать уроки химии. Что же это за вещество? Какова формула щелочи в химии? Каковы ее свойства? Рассмотрим все эти вопросы в данной статье.
Определение и основная формула
Начнем с определения. Щелочью называется хорошо растворимое в воде вещество, гидроксид щелочного (1-ая группа, основная подгруппа в таблице Менделеев) или щелочноземельного (2-ая группа, основная подгруппа в таблице Менделеева) металла. Стоит заметить, что бериллий и магний, хотя и принадлежат к щелочным металлам, щелочей не образуют. Их гидроксиды относят к основаниям.
Щелочи — самые сильные основания, растворение которых в воде сопровождается тепловыделением. Примером этого служит бурная реакция с водой гидроксида натрия. Из всех щелочей наименее растворим в воде гидроксид кальция (известный также как гашеная известь), который в чистом виде представляет собой порошок белого цвета.
Из определения можно сделать вывод, что химическая формула щелочи — ROH, где R — щелочноземельный (кальций, стронций, радий, барий) или щелочной (натрий, калий, литий, цезий, франций, рубидий) металл. Приведем некоторые примеры щелочей: NaOH, KOH, CsOH, RbOH.
Реакции
Абсолютно все щелочи реагируют с кислотами. Реакция протекает так же, как кислоты и основания — с образованием соли и воды. Пример:
NaOH+HCl=NaCl+H2O
Приведенная реакция — соляная кислота + щелочь. Формулы реакций различных щелочей с кислотами:
КОН+HCl=KCl+H2O
NaOH+HNO3=NaNO3+H2O
Помимо кислот, щелочи реагируют также с кислотными оксидами (SO2, SO3, CO2). Реакция проходит по тому же механизму, что и щелочи с кислотой — в результате взаимодействия образуется соль и вода.
Щелочи взаимодействуют и с амфотерными оксидами (ZnO, Al2O3). При этом образуются нормальные или комплексные соли. Самая типичная из таких реакций оксид цинка + едкая щелочь. Формула такой реакции:
2NaOH+ZnO=Na2ZnO2+H2O
В показанной реакции образуется нормальная соль натрия Na2ZnO2 и вода.
Реакции щелочей с амфотерными металлами протекают по тому же механизму. Приведем в качестве примера реакцию алюминий + щелочь. Формула реакции:
2KOH+2Al+6H2O=2K(Al(OH)4)+3H2
Это пример реакции с образованием комплексной соли.
Взаимодействие с индикаторами
Для определения pH исследуемого раствора используются специальные химические вещества — индикаторы, которые меняют свой цвет в зависимости от значения показателя водорода в среде. Самый распространенный индикатор, используемый в химических исследованиях, — лакмус. В щелочной среде он приобретет интенсивный синий цвет.
Другой доступный индикатор, фенолфталеин, в щелочной среде приобретает малиновый окрас. Однако в очень концентрированном растворе (показатель водорода близок к 14) фенолфталеин остается бесцветным, как и в нейтральной среде. Потому лакмус при работе с концентрированными щелочами использовать предпочтительнее.
Метиловый оранжевый индикатор в щелочной среде приобретает желтый окрас, при уменьшении pH среды цвет меняется от желтого до оранжевого и красного.
Физические свойства щелочей
Помимо этого, щелочи также хорошо растворяются в этаноле. Концентрированные и умеренные растворы имеют pH от 7.1 и выше. Растворы щелочей мыльные на ощупь. Концентрированные составы — довольно едкие химические соединения, контакт с которыми вызывает химические ожоги кожи, глаз, любых слизистых оболочек, поэтому работать с ними следует осторожно. Воздействие едкого вещества можно нейтрализовать раствором кислоты.
Щелочи могут находиться как в твердом, так и в жидком состоянии. Гидроксид натрия — самая распространенная щелочь (формула NaOH), которая в твердом состоянии представляет собой вещество белого света.
Гидроксид кальция при нормальных условиях — белый порошок. Гидроксиды радия и бария в твердом агрегатном состоянии — бесцветные кристаллы. Гидроксиды стронция и лития также бесцветны. Все твердые щелочи поглощают воду из воздуха. Гидроксид цезия — самая сильная щелочь (формула CsOH). Щелочные свойства металлов 1-ой группы основной подгруппы возрастают сверху вниз. Эти вещества нашли применение в химической промышленности. В основном их используют в щелочных аккумуляторах в качестве электролитов. Чаще всего применяют гидроксиды калия и натрия.
Химический ожог щелочью
При использовании неразбавленных щелочей всегда стоит помнить, что они являются едкими веществами, которые при попадании на открытые участки тела вызывают покраснение, зуд, жжение, отек, в тяжелых случаях образуются пузыри. При длительном контакте такого опасного состава со слизистой органов зрения возможно наступление слепоты.
При химическом ожоге щелочью необходимо промыть пораженное место водой и очень слабым раствором кислоты — лимонной или уксусной. Даже незначительное количество едкой щелочи может вызвать обширное поражение кожи и ожог слизистых, поэтому с такими веществами стоит обращаться аккуратно и держать подальше от детей.
Щелочь (синоним – алкали) — так называется любой из растворимых гидроксидов щелочных металлов, то есть лития, натрия, калия , рубидия и цезия. Щелочи являются сильными основаниями, они вступают в реакцию с кислотами с получением нейтральных солей. Они едкие и в концентрированном виде являются коррозионными веществами для органических тканей. Термин щелочь также применяется к растворимым гидроксидам таких щелочноземельных металлов, как кальций, стронций и барий, а также к гидроксиду аммония . Название вещества — щелочь , первоначально применялось к золе сожженных растений, содержащих натрий или калий, из которых можно было выщелачивать оксиды натрия или калия.
Среди всех производимых промышленностью щелочей наибольшая доля таких производств приходится на выработку кальцинированной соды (Na2CO3 -карбонат натрия ) и каустической соды (NaOH-гидроксид натрия ). Следующими по объему производства идут в списке щелочи гидроксид калия (KOH-едкий кали) и гидроксид магния (Mg(OH)2-магния гидрат).
Производство широкого спектра потребительских товаров зависит от использования щелочей
Немного исторических моментов из истории получения щелочи.
Люди на протяжении столетий используют щелочь, получая ее сначала от выщелачивания (водных растворов) некоторых пустынных земель. До конца 18 века выщелачивание из древесной золы или морской водоросли было основным источником получения щелочей. В 1775 году Французская Академия наук предложила денежные призы за новые методы производства щелочей. Премия за кальцинированную соду была присуждена французу Николасу Леблану , который в 1791 году запатентовал процесс превращения хлорида натрия в карбонат натрия.
Лебланский способ производства доминировал в мировом производстве до конца 19-го века, но после первой мировой войны был полностью вытеснен другим методом конверсии соли, который был усовершенствован в 1860-х годах Эрнестом Солве из Бельгии. В конце XIX века появились электролитические методы производства каустической соды, объемы которых быстро росли.
По методу Солве, аммиачно-содовый процесс производства кальцинированной соды протекал следующим образом: поваренная соль в виде сильного рассола химически обрабатывалась для устранения примесей кальция и магния и затем насыщалась рециркулирующим газом аммиака в башнях. После, аммиачный рассол насыщался газом с использованием газообразного диоксида углерода при умеренном давлении в башне другого типа. Эти два процесса дают бикарбонат аммония и хлорид натрия, двойное разложение которого дает желаемый бикарбонат натрия, а также хлорид аммония. Затем бикарбонат натрия нагревают до разложения его до необходимого карбоната натрия. Аммиак, вовлеченный в процесс, почти полностью восстанавливается путем обработки хлоридом аммония с известью, с получением аммиака и хлорида кальция. Восстановленный аммиак затем повторно используют в описанных выше процессах.
Электролитическое производство каустической соды включает электролиз сильного солевого раствора в электролитической ячейке . (Электролиз — это разрушение соединения в растворе в его составляющие с помощью электрического тока для того, чтобы вызвать химическое изменение.) Электролиз хлорида натрия дает хлор, гидроксид натрия, либо металлический натрий. Гидроксид натрия в некоторых случаях конкурирует с карбонатом натрия в одних и тех же процессах применений. И в любом случае оба являются взаимопревращаемыми с помощью довольно не сложных процессов. Хлорид натрия может быть
превращен в щелочь одним из двух процессов, причем разница между ними заключается лишь в том, что процесс аммиачно-содовой реакции дает хлор в виде хлорида кальция, соединения с небольшим экономическим значением, тогда как электролитические процессы производят элементарный хлор , который имеет бесчисленное применение в химической промышленности.
В нескольких местах в мире существуют значительные запасы минеральной формы кальцинированной соды, известной как природная щелочь. На таких месторождениях производят большую часть природной щелочи в мире из обширных месторождений в подземных шахтах.
Природный натрий металлический.
Прочитайте статью Щелочи (источник «Энциклопедический словарь химика»)и получите больше представления о том что такое щелочь, или посмотрите видеоролик об этом химическом реактиве Щелочи.
Использование щелочи в окружающей нас среде
Щелочь снискала широкое применение в нашей жизни. Благодаря щелочи можно в той или иной форме добиться смягчения воды и удалить из нее примеси, такие как марганец, фториды и органические танины. В тяжелых отраслях промышленности используют щелочь в виде извести для поглощения и нейтрализации оксидов серы в выбросах в атмосферу, тем самым уменьшая вероятность выпадения кислотных осадков. Диоксид серы, производимый промышленными предприятиями и выпускаемый в атмосферу, возвращается на землю в виде кислотных дождей или серной кислоты. Такие территории, подвергшихся воздействию кислотных дождей, обрабатываются с помощью авиации препаратами, в состав которых входит щелочь. Это позволяет контролировать и нейтрализовывать критический уровень рН воды и почвы на участках, где произошли такие техногенные выбросы. Внесение щелочи в отходы и сточные воды, поддерживая правильный уровень рН в окислительных процессах при их разложении. Стабилизирует образования осадка в сточных водах и уменьшает запах или образования патогенных бактерий. Обработанный негашеной известью ил из сточных водоемов, соответствует экологическим нормам, что делает его пригодным в дальнейшем в использовании в качестве удобрения на сельскохозяйственных землях.
Промышленное применение щелочи
В промышленных и горных работах применение щелочей в сточных водах помогает нейтрализовать вредные соединения и произвести их очистку. Обработка избыточной щелочью, повышает рН воды до 10,5-11 и может дезинфицировать воду и удалять тяжелые металлы. Щелочи, такие как известь, являются ключевыми в химическом производстве карбида кальция, лимонной кислоты, нефтехимии и магнезии. В бумажной промышленности карбонат кальция является каустифицирующим агентом для отбеливания. Сталелитейная промышленность зависит от извести в качестве компонента для удаления примесей, таких как газообразный монооксид углерода, кремния, марганца и фосфора.
Моющие средства образованные щелочью
Щелочные моющие средства помогают при очистке поверхностей с сильными загрязнениями. Эти экономичные, водорастворимые щелочи с рН от 9 до 12,5 могут нейтрализовать кислоты в различных типах грязи и отложениях.
Щелочь в производстве стекла и керамики
Щелочь является основным сырьем в производстве стекла. Известняк, а также песок, кальцинированная сода, известь и другие химикаты, обжигаются при чрезвычайно высоких температурах и превращаются в расплавленную массу. Стеклодувы и гончары используют щелочи для глазурей и флюсов, которые реагируют с кислотами с образованием силикатов (стекла) при нагревании. Концентрированные щелочи создают более насыщенный цвет в глазури.
Литература о щелочи
В книге И. Нечаева «Рассказы об элементах», изданной в 1940 году, доступным и понятным языком для обывателя
«Среди многочисленных веществ, которыми химики с давних времен пользовались в своих лабораториях, почетное место всегда занимали едкие щелочи — едкое кали и едкий натр. Сотни различных химических реакций осуществляются в лабораториях, на заводах и в быту при участии щелочей. С помощью едких кали и натра можно, например, сделать растворимыми большинство нерастворимых веществ, а самые сильные кислоты и удушливые пары можно благодаря щелочам лишить всей их жгучести и ядовитости.
Едкие щелочи — очень своеобразные вещества. На вид это беловатые, довольно твердые камни, ничем как будто не примечательные. Но попробуйте взять едкое кали или натр и зажать его в руке. Вы почувствуете легкое жжение, почти как от прикосновения к крапиве. Долго держать в руке едкие щелочи было бы нестерпимо больно: они могут разъесть кожу и мясо до кости. Вот почему их называют «едкими», в отличие от других, менее «злых» щелочей — всем известных соды и поташа. Из соды и поташа, кстати сказать, почти всегда и по лучались едкие натр и кали.
У едких щелочей сильнейшее влечение к воде. Оставьте кусок совершенно сухого едкого кали или натра на воздухе. Через короткое время на его поверхности неизвестно откуда появится жидкость, потом он весь станет мокрым и рыхлым и под конец расползется бесформенной массой, как кисель. Это из воздуха щелочь притягивает к себе пары воды и образует с влагой густой раствор. Кому впервые приходится погрузить пальцы в раствор едкой щелочи, тот с удивлением заявляет: — Как мыло! И это совершенно правильно. Щелочь — скользкая, как мыло. Больше того: мыло потому и «мыльно» на ощупь, что его изготовляют с помощью щелочей. Раствор едкой щелочи и на вкус напоминает мыло.
Но химик узнаёт едкую щелочь не по вкусу, а по тому, как это вещество ведет себя с краской лакмус и с кислотами. Бумажка, про питанная синей краской лакмус, мгновенно краснеет, когда ее опус кают в кислоту; а если этой покрасневшей бумажкой дотронуться до щелочи, то она тотчас же опять становится синей. Едкая щелочь и кислота не могут мирно существовать рядом ни одной секунды. Они тотчас же вступают в бурную реакцию, шипя и разогреваясь, и уничтожают друг друга до тех пор, пока в растворе не останется ни крупинки щелочи или ни капли кислоты. Только тогда наступает успо коение. Щелочь и кислота «нейтрализовали» друг друга, говорят в таких случаях. От соединения их между собой получается «нейтральная» соль — ни кислая, ни едкая. Так, например, от соединения жгучей соляной кислоты с едким натром получается обыкновеннейшая поваренная соль.»
Отличительные признаки щелочи.
Из выше прочитанного мы уже знаем, что противоположностью щелочи является кислота. Вместо горького вкуса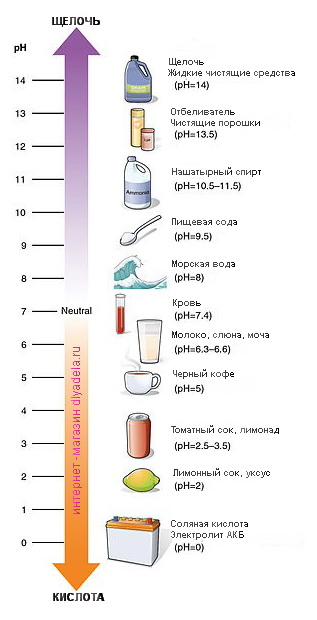
Почему вещество щелочное?
Таким образом, нам уже известно, что рН уровень представляет собой шкалу, значения которой колеблятся от 0-14 и указывают, является ли вещество щелочью или кислотой. Однако мы действительно не знаем, почему. Давайте рассмотрим этот вопрос более детально.
Уровень рH вещества зависит от того, как атомы расположены и объединены в веществе. Чистая вода находится прямо в середине шкалы и имеет pH 7. Это означает, что она содержит равное количество атомов водорода (H +) и гидроксидных атомов (OH-). Когда вещество имеет больше атомов водорода (Н +), это кислота. Когда вещество имеет больше гидроксидных атомов (OH-), оно является щелочным.
Где купить щелочь?
Купить щелочь в Новосибирске со степенью очистки ЧДА (чистая для анализов) в магазине «Для дела» можно на странице заказов: едкий натр NaOH или едкий кали KOH. Для иногородних покупателей товар может быть отправлен Почтой РФ или транспортными компаниями.
Авторские права
Права на данную статью принадлежат администратору сайта dlyadela.ru : Фарафонову Константину Владимировичу. Для подтверждения авторских прав была произведена процедура депонирования материалов опубликованного контента. Любое копирования материалов этой статьи не допускается, без письменного согласия правообладателя. Оценочная стоимость контета страницы https://dlyadela.ru/page/scheloch установлена в размере 100 долларов США.
Лицо, несанкционированно осуществившее частичное или полное копирование представленных на странице материалов и разместившее их в последствие на сторонних интернет-ресурсах, выражает свое согласие выплатить правообладателю пятикратную оценочную стоимость украденного контента.
Если вы желаете использовать материалы нашего сайта, пожалуйста, свяжитесь с нами.
Материал по химии
Оглавление
Как связаны щелочи с основаниями?
Щелочи – это небольшая группа неорганических веществ, относящихся к основным гидроксидам или основаниям. Для начала разберемся, какие вещества можно называть основаниями. Основания – это вещества, содержащие гидроксо-группу (‒OH), которая в неорганической химии (в случае с основаниями) пишется в конце молекулы, например: NaOH, Fe(OH)2, Ba(OH)2, но это определение не точное, ведь Fe(OH)3 и Zn(OH)2 имеют сходную формулу, однако, основаниями не являются. Точнее будет сказать, что основания – это гидроксиды, в которых металл находится в степени окисления «+1» или «+2» (кроме цинка и бериллия, образующих в степени окисления «+2» амфотерные оксиды и гидроксиды).
Таблица 1. – Основания и амфотерные гидроксиды
| Это основания: | Это НЕ основания: |
| NaOH KOH Mg(OH)2 Ca(OH)2 Fe(OH)2 | Al(OH)3 Fe(OH)3 Cr(OH)3 Zn(OH)2 Be(OH)2 |
| Потому что содержат металл в степени окисления «+1» или «+2» | Так как в этой группе есть гидроксиды, имеющие металл в степени окисления «+3», и два исключения — Zn(OH)2 и Be(OH)2. Все приведенные выше вещества являются амфотерными гидроксидами, а не основаниями |
Подробнее об отличиях понятий «гидроксиды» и «основания» можно прочитать в статье «Классификация гидроксидов и оснований»
Кроме отличий в степени окисления, основания и амфотерные гидроксиды отличаются так же по реакционной способности. Так, амфотерные гидроксиды могут реагировать как с кислотами, так и с основаниями, а основания могут реагировать с кислотами, но не могут реагировать с другими основаниями. Подробнее о химических свойствах амфотерных гидроксидов можно прочитать в статье «Амфотерные гидроксиды. Получение, химические свойства, образование средних и комплексных солей»
Чем отличаются щёлочи от остальных оснований?
Основания можно разделить на две группы: растворимые и нерастворимые. Растворимые иначе называют щелочами. То есть щелочи – это растворимые основания (растворимые основные гидроксиды).
Таблица 2. – Основания и щёлочи
| Щелочи (растворимые основания) | Остальные основания (нерастворимые основания) |
| NaOH KOH Ba(OH)2 | Mg(OH)2 Fe(OH)2 Ni(OH)2 |
Как определить, является ли основание растворимым, то есть щелочью, если его нет в таблице растворимости?
В состав щелочей входят металлы IА-группы Периодической Системы Д. И. Менделеева, а также кальций, стронций и барий.
Полный список щелочей:
NaOH – гидроксид натрия, едкий натр, гидроокись натрия, каустическая сода
KOH – гидроксид натрия, едкое кали, гидроокись калия
LiOH – гидроксид лития, гидроокись лития
CsOH – гидроксид цезия, гидроокись цезия
FrOH – гидроксид франция, гидроокись франция
RbOH – гидроксид рубидия, гидроокись рубидия
Ba(OH)2 – гидроксид бария, едкий барий, баритовая вода
Ca(OH)2 – гидроксид кальция, гашеная известь, известковое молоко, известковая вода.
Sr(OH)2 – гидроксид стронция
Остальные основания считаем нерастворимыми (кроме аммиака, образующего гидрат аммония, являющегося хоть и растворимым, но нестойким соединением). Гидроксид аммония, образующийся при пропускании аммиака через воду, можно представить в виде формулы NH4OH (лучше NH3·H2O – гидрат аммония) является растворимым (раствор называют нашатырным спиртом), однако щелочью это вещество не является.
Гидроксид лития и гидроксид кальция растворяются не так хорошо, как другие основания, но все равно считаются щелочами.
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Комментарий к заданию: Галлий, в представленном гидроксиде, имеет степень окисления +3, поэтому он относится к группе амфотерных гидроксидов. Гидроксид рубидия – щелочь, так как рубидий – элемент IА-группы. Гидроксид хрома – нерастворимое основание, так как хром в степени окисления +2 не является амфотерным, и не относится к щелочным или щелочноземельным металлам, поэтому не может образовать щелочь.
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Комментарий к заданию: Стронций является щелочноземельным металлом (металлы IIА-группы, кроме магния и бериллия, образуют растворимые гидроксиды), поэтому образует щелочь. Гидроксид цинка вместе с гидроксидом бериллия входят в группу исключений и, несмотря на вторую валентность, образуют амфотерные гидроксиды. Гидроксид железа нерастворим и не входит в группу амфотерных веществ, он является нерастворимым основанием.
Щёлочи, являясь сильными основаниями, диссоциируют в воде очень быстро, тогда как нерастворимые основания диссоциируют медленно, ступенчато:
| Диссоциация щелочей | Диссоциация слабых оснований |
| Ca(OH)2 = Ca2+ + 2OH‒ | Fe(OH)2 = FeOH+ + OH‒ (I ступень) FeOH+ = Fe2+ + OH‒(II ступень) |
| Диссоциация настолько быстрая, что ступенчатостью процесса можно пренебречь | Диссоциация очень медленная, быстрее идет по первой ступени, по второй ступени практически не идёт |
Физические свойства щелочей
Гидроксиды щелочных металлов (металлов IА-группы) – твердые бесцветные кристаллические вещества. Как уже было описано выше, большинство из них очень хорошо растворимы в воде. Гидроксиды щелочноземельных металлов хуже растворяются в воде.
Химические свойства щелочей
Основные свойства гидроксидов в Периодической системе возрастают справа налево и сверху вниз. Поэтому все щелочи, образованные металлами IА-группы сильнее щелочей, образованных металлами IIА-группы.
Щелочи окрашивают фенолфталеин в малиновый цвет.
Твёрдые щелочи и их концентрированные растворы разъедают живые ткани, поэтому работать с ними нужно в перчатках, а при растирании твёрдой щелочи в ступке необходимо надевать очки.
- Щелочи реагируют с кислотными оксидами, образуя либо соль и воду, либо кислую соль:
Щелочь + кислотный оксид = соль + вода
Щелочь + кислотный оксид = кислая соль
Рассмотрим эти реакции на примере образования карбонатов и гидрокарбонатов.
Для щелочей, содержащих одновалентный катион (катион в степени окисления «+1») справедлива общая схема реакции:
2MeOH + CO2 = Me2CO3 + H2O
Или
MeOH + CO2 = MeHCO3
Например:
2NaOH + CO2 = Na2CO3 + H2O
NaOH + CO2 = NaHCO3
2KOH + CO2 = K2CO3 + H2O
KOH + CO2 = KHCO3
Для щелочей, содержащих двухвалентный металл (катион в степени окисления «+2») справедлива общая схема реакции:
Me(OH)2 + CO2 = MeCO3 + H2O
Или
Me(OH)2 + 2CO2 = Me(HCO3)2
Например:
Ca(OH)2 + CO2 = CaCO3 + H2O
Ca(OH)2 + 2CO2 = Ca(HCO3)2
Ba(OH)2 + CO2 = BaCO3 + H2O
Ba(OH)2 + 2CO2 = Ba(HCO3)2
Щелочи при плавлении разрушают стекло и фарфор, основным компонентом которых является кислотный оксид SiO2:
2NaOH(тв) + SiO2(тв) = Na2SiO3(тв) + H2O(г)
Некоторые оксиды диспропорционируют в щелочах (участвуют в реакции самоокисления-самовосстановления). К таким оксидам относят оксид азота IV, который в щелочах превращается одновременно и в нитрит-ион (NO2‒), и нитрат-ион (NO3‒):
2KOH + 2NO2 = KNO2 + KNO3 + H2O
2Ca(OH)2 + 4NO2 = Ca(NO2)2 + Ca(NO3)2 + 2H2O
Для того, чтобы получить только нитрат-ион необходимо присутствие кислорода:
4KOH + 4NO2 + O2 = 4KNO3 + 2H2O
2Ca(OH)2 + 4NO2 + O2 = 2Ca(NO3)2 + 2H2O
О других свойствах кислотных оксидов можно прочитать в статье «Свойства кислотных оксидов»
- Щелочи реагируют с кислотами. Притом, если кислота одноосновная, то образуется только средняя соль, если кислота многоосновная, то может образоваться как средняя, так и кислая соль.
Узнать, как определить тип кислоты можно в статье «Классификация кислот»
А) щелочь + одноосновная кислота = соль + вода
NaOH + HClO3 = NaClO3 + H2O
LiOH + HNO3 = LiNO3 + H2O
KOH + HI = KI + H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Ba(OH)2 + 2HClO4 = Ba(ClO4)2 + 2H2O
Sr(OH)2 + HPO3 = Sr(PO3)2 + H2O
Б) щелочь + двухосновная кислота = соль + вода
Щелочь + двухосновная кислота = кислая соль + вода
2NaOH + H2SO4 = Na2SO4 + 2H2O
NaOH + H2SO4 = NaHSO4 + H2O
Ba(OH)2 + H2S = BaS + 2H2O
Ba(OH)2 + 2H2S = Ba(HS)2 + 2H2O
Для получения кислой соли необходим недостаток щелочи (избыток кислоты).
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Sr(OH)2 + SO2 =
- Sr(OH)2 +2SO2 =
- Sr(OH)2 + H2SO4 =
- Sr(OH)2 + 2H2SO4 =
- SrSO4 + 2H2O
- SrSO3 + H2O
- SrSO4 + H2O
- Sr(HSO4)2 + 2H2O
- Sr(HSO3)2 + H2O
- Sr(HSO3)2
- В отличие от нерастворимых оснований, щелочи реагируют с растворимыми солями. Условия типичны для обменных реакций (в продуктах должен появиться газ или осадок):
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
LiOH + NH4Cl = LiCl + NH3↑ + H2O
2KOH + Fe(NO3)2 = 2KNO3 + Fe(OH)2↓
Ca(OH)2 + 2NaF = CaF2↓ + 2NaOH
Ba(OH)2 + K2SO4 = BaSO4↓ + 2KOH
Sr(OH)2 + Na2SiO3 = SrSiO3↓ + 2NaOH
Из предложенного перечня веществ выберете три вещества, с которыми гидроксид натрия (р-р) не реагирует:
- LiCl
- NH4Br
- CrSO4
- PbSO4
- KNO3
- CuSO4
Комментарий к заданию: помните, что исходная соль должна быть растворимой, а одно из полученных веществ – газ или осадок.
- Щелочи реагируют с кислыми солями с образованием средних солей:
NaHSO3 + NaOH = Na2SO3 + H2O
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
- Твёрдые щелочи реагируют с амфотерными оксидами и гидроксидами при сплавлении, при этом образуется средняя соль, в катион которой входит щелочной или щелочноземельный металл, а в анион – амфотерный металл:
2NaOH + Al2O3 = 2NaAlO2 + H2O
2NaOH + ZnO = Na2ZnO2 + H2O
Ca(OH)2 + Al2O3 = Ca(AlO2)2 + H2O
Ca(OH)2 + ZnO = CaZnO2 + H2O
Из предложенного перечня веществ выберете три вещества, с которыми реагирует гидроксид калия:
Комментарий к заданию: Не забывайте, что щелочи реагируют не только с амфотерными, но и с кислотными оксидами.
О том, как амфотерные оксиды реагируют с щелочами и другими веществами, а также о том, как можно прочитать в статье «Амфотерные оксиды»
NaOH + Al(OH)3 = NaAlO2 + 2H2O
NaOH + Zn(OH)2 = Na2ZnO2 + H2O
Ca(OH)2 + 2Al(OH)3 = Ca(AlO2)2 + 4H2O
Ca(OH)2 + Zn(OH)2 = CaZnO2 + 2H2O
Подробнее о свойствах амфотерных гидроксидов можно прочитать в этой статье
- Концентрированные растворы щелочей растворяют амфотерные оксиды и гидроксиды с образованием комплексных солей:
2KOH + Fe2O3 + 3H2O = 2K[Fe(OH)4]
2KOH + BeO + H2O = K2[Be(OH)4]
Ba(OH)2 + Fe2O3 + 3H2O = Ba[Fe(OH)4]2
Ba(OH)2 + BeO + H2O = Ba[Be(OH)4]
KOH + Fe(OH)3 = K[Fe(OH)4]
2KOH + Be(OH)2 = K2[Be(OH)4]
Ba(OH)2 + 2Fe(OH)3 = Ba[Fe(OH)4]2
Ba(OH)2 + Be(OH)2 = Ba[Be(OH)4]
- Концентрированные щелочи вступают в реакции с некоторыми металлами (Al, Be, Zn) с образованием комплексной соли и выделением водорода:
2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2↑
2NaOH + Be + 2H2O = Na2[Be(OH)4] + H2↑
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2↑
Ba(OH)2 + 2Al + 6H2O = Ba[Al(OH)4]2 + 3H2↑
Ba(OH)2 + Zn + 2H2O = Ba[Zn(OH)4] + H2↑
- Хлор, бром, йод диспропорционируют в щелочах, продукты реакции зависят от температуры, при которой происходит реакция:
Cl2 + 2NaOH(холодный) = NaCl + NaClO +H2O
3Cl2 + 6NaOH(горячий) = 5NaCl + NaClO3 + 3H2O
- Фосфор, сера также самоокисляются-самовосстанавливаются в щелочах:
P4 + 3NaOH + 3H2O = 3NaH2PO2 + PH3
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
- Кремний реагирует с щелочами в качестве восстановителя:
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
Получение щелочей
- Щелочи можно получить из гидридов, нитридов, фосфидов, карбидов:
LiH + H2O = LiOH + H2↑
CaH2 + 2H2O = Ca(OH)2 + 2H2↑
Na3N + 3H2O = 3NaOH + NH3↑
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3↑
K3P + 3H2O = 3KOH + PH3↑
Ba3P2 + 6H2O = 3Ba(OH)2 + 2PH3↑
Na4C + 4H2O = 4NaOH + CH4↑
CaC2 + 2H2O = Ca(OH)2 + C2H2↑
- При растворении оксида щелочного или щелочноземельного металла в воде образуется раствор щелочи:
Na2O + H2O = 2NaOH
BaO + H2O = Ba(OH)2
Реакции идут с выделением большого количества теплоты, то есть являются экзотермическими.
- Щелочи можно получить растворением пероксидов в воде (характерно для получения гидроксида натрия, гидроксида калия и гидроксида бария):
Na2O2 + 2H2O = H2O2 + 2NaOH
BaO2 + 2H2O = H2O2 + Ba(OH)2
- Раствор щелочи получают при растворении щелочного или щелочноземельного металла в воде:
2K + 2H2O = 2KOH + H2↑
Sr + 2H2O = Sr(OH)2 + H2↑
- Растворы щелочей можно получить обменными реакциями:
Li2SO4 + Ba(OH)2 = 2LiOH + BaSO4↓
K2SO4 + Sr(OH)2 = 2KOH + SrSO4↓
- Раствор щелочи можно получить электролизом раствора соли, содержащей катион щелочного или щелочноземельного металла и бескислородный анион, например раствор гидроксида калия получают электролизом раствора хлорида калия:
KCl + H2O = KOH + H20↑ + Cl20↑
Катод: 2H2O + 2ē = H20↑ + 2OH‒
Анод: 2Cl‒ ‒2ē = Cl20
Электролизом расплава соли, содержащей щелочной металл, щелочь получить нельзя. Этим способом получают сам щелочной металл.

И получается такое вещество, которое не относится ни к кислотам, ни к щелочам. Оно не способно вызывать ожоги. Но это будет только при правильной пропорции кислоты и щёлочи (иногда для верности пользуются фенолфталеином, он окрашивает щёлочь в слегка фиолетовый цвет).
Кислота и щёлочи — это как две противоположности. Но они очень важны при изготовлении таких вещей как: удобрения, пластик, мыла, моющие средства, красок, бумаги и даже взрывчаток. Это далеко не весь список.
Что такое кислота
Кислота — это и есть что-то кислое, оно характеризуется кислым вкусом. Кислота содержится в уксусе – уксусная кислота, в лимоне – лимонная кислота, в молоке – молочная кислота, в желудке – соляная кислота и т.п. Но это всё так называемые слабые кислоты, помимо них существуют кислоты с большей концентрацией (серная, синильная кислоты и т.д. хотя этот учёный пробовал). Они гораздо опаснее для человека и пробовать их не рекомендуется никому. Они способны разъесть одежду, кожу, вызвать тяжёлый ожог на коже, разъесть бетон и другие вещества. Например, соляная кислота нам нужна для того, чтобы желудок быстрее переваривал пищу, а также для уничтожения большинства вредных бактерий, которые приходят вместе с пищей.
Что такое щелочь?
Щелочь — это те вещества, которые хорошо растворяются в воде. При этом реакция сопровождается с выделением тепла, с увеличением температуры. Если щёлочь сравнивать с кислотой, то на ощупь она намного «мыльнее», то есть скользкая. Вообще, щёлочи не сильно отстают от кислот по разъеданию и по силе. Они также могут с лёгкостью разъесть древесину, пластик, одежду и тому подобное.
Кстати, из щёлочей делают мыло, стекло, бумагу, ткань и это не весь список. Щёлочь можно найти у себя на кухне, ну или в магазине под названием пищевая сода. Кстати, пищевая сода это очень хороший помощник всем домохозяйкам.
Кислоты и щёлочи – отличия
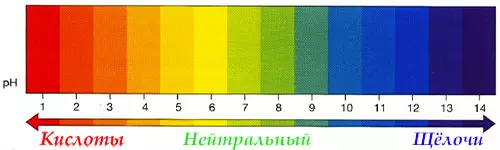
Кислоты и щёлочи отличают по показателям pH (шкала pH). Ниже Вы видите картинку – это специальная шкала, на которой имеются числа от 0 и до 14. Нулём обозначают самые сильные кислоты, а четырнадцатью – самую сильную щёлочь. Но какая же середина между этими числами? Может быть 5, может быть 7, а может быть 10? Серединой принято считать число 7 (нейтральное положение). То есть числа до 7 — это все кислоты, а больше 7 — это щёлочи.
pH продуктов
Сильные кислоты и слабые кислоты
Есть некоторые кислоты, которые мы можем употреблять, в то время как работа с другими предполагает строгие меры безопасности.
Сильные кислоты — это те, которые полностью диссоциируют или ионизируются в водных растворах.
Один из способов визуализировать, как отличить слабые и сильные кислоты, по аналогии с игроками в регби:
- сильная кислота является игроком, который бросает мяч, как только он его получает;
- слабая кислота, как игрок , который получает мяч и бежит с ним.
Примеры сильных кислот
Среди известных сильных кислот выделяют:
- HCl соляная кислота,
- серная кислота H 2 SO 4 ,
- азотная кислота HNO 3
- хлорная кислота HClO 4
- фторантимоновая кислота H [SbF 6 ]
Примеры слабых кислот
Обычно кислоты органических соединений известны как слабые:
- уксусная кислота H 3 CCOOH,
- масляная или бутановая кислота H 7 C 3 COOH (органическая кислота в масле),
- лимонная кислота или 2-гидрокси кислота 1,2,3-трикарбоксилпропан C 6 H 8 O 7,
- молочная кислота или 2-гидроксипропановая кислота H 6 C 3 O 3 .
Показатель кислотности растворов рН, механизм действия
Именно для этой шкалы разработаны специальные индикаторы — лакмусы. Это обычная полоска, которая реагирует на среду. В кислотной среде она окрашивается в красный цвет, а в щелочной среде – в синий цвет. Она необходима не только в химии, но и в быту.
Например, если у Вас есть аквариум, то немаловажную роль играет кислотность воды. От неё зависит вся жизнь аквариума. К примеру, показатель кислотности воды для аквариумных рыбок колеблется от 5 до 9 рН. Если будет больше или меньше, то рыбка будет чувствовать себя не комфортно, а может и вовсе умереть. Всё тоже самое и с растениями для аквариумов.
Работа с кислотами и щёлочами
Работа с кислотами и щёлочами требует большой внимательности и осторожности. Ведь при попадании на кожу они вызывают сильные ожоги. Старайтесь работать в проветриваемом помещении. Вдыхать пары щёлочей и кислот также не рекомендуется. Для личной безопасности стоит воспользоваться очками, перчатками и специальной одеждой, чтобы не повредить глаза, руки и любимую одёжку.
При работе с кислотами следует помнить, что сначала вливают кислоту в раствор (воду), а не наоборот. В противном случае произойдёт бурная реакция, которая сопровождается брызгами. А сам процесс добавления кислоты в раствор следует делать очень медленно, при этом контролировать степень нагрева сосуда и обязательно добавлять кислоту по стенкам сосуда.
При работе со щёлочами первым следует добавлять понемногу щёлочь. К тому же запрещено пользоваться стеклянной посудой, рекомендуют фарфоровую или специальную посуду.
При химической обработке металлов (оксидирование, анодирование, травление и др.) погружать в раствор и вынимать из раствора изделие следует с помощью специальных приспособлений или инструментов, но никак не руками, даже если они в резиновых перчатках. Кстати, щёлочь входит в состав некоторых батареек.
Запомните, что при химических ожогах кожи поражённое место нужно промыть сильной струёй проточной воды. И окончательно нейтрализовать: от кислот — 3%-ным раствором питьевой соды, а щёлочь — 1%-ным раствором уксусной кислоты.