растворенное вещество, в решении,это вещество, которое растворяется в растворителе. Как правило, растворенное вещество содержится в меньшей пропорции и может быть твердым, жидким или газообразным. Напротив, растворитель является компонентом раствора, который находится в большем количестве.
Например, в соленой воде соль — это растворенное вещество, а вода — это растворитель. Однако не все растворимые вещества являются твердыми или растворители являются жидкими.
В этом смысле существует несколько возможных комбинаций растворенных веществ и растворителей: газ в жидкости, газ в твердом теле, жидкость в жидкости, жидкость в твердом теле, твердое тело в жидкости или твердое тело в твердом теле.
Чтобы распознать, какое решение является решением, следует принять во внимание два аспекта. Во-первых, растворенное вещество — это вещество, которое находится в меньшей пропорции. Кроме того, именно он изменяет свое физическое состояние (твердое, жидкое или газообразное) при интеграции в раствор..
индекс
- 1 Растворы, растворители и растворенные вещества
- 2 Определение растворенного вещества
- 3 Характеристики
- 3.1 Растворимость
- 3.2 Температура
- 3.3 Насыщенность раствора
- 3.4 Давление
- 3.5 Полярность
- 4 Различия между растворенным веществом и растворителем
- 5 примеров растворенного вещества
- 5.1 растворенные вещества в газообразном состоянии
- 5.2 растворенные вещества в твердом состоянии
- 5.3 растворенные вещества в жидком состоянии
- 5.4 Solutos, которые можно использовать дома
- 6 Ссылки
Растворы, растворители и растворенные вещества
В химии существуют гомогенные смеси, составляющие которых компоненты по своему содержанию разделены на равные пропорции. Одним из наиболее распространенных типов гомогенных смесей являются растворы, которые представляют собой стабильные гомогенные смеси двух или более веществ, в которых растворенное вещество растворяется в растворителе..
Растворы, растворители и растворенные вещества наблюдаются в повседневных ситуациях и в диапазоне от промышленного до лабораторного. Эти вещества, образованные из смесей, являются объектами изучения из-за характеристик, которые они представляют, и сил и / или притяжений, возникающих между ними..
Определение растворенного вещества
Как отмечено выше, растворенным веществом является то вещество, которое растворяется в другом, называемом растворителем..
Обычно растворенное вещество имеет меньшую долю и может встречаться в любом из трех состояний вещества. Когда дается решение между двумя веществами, находящимися в одной фазе, метод выбора того, что в меньшей пропорции, используется для определения того, какой растворяется, а какой — растворитель..
Способность растворять растворенное вещество будет зависеть от растворимости. Температура растворителя также представляет собой определяющий фактор, когда речь идет о знании возможности образования или не образования раствора, поскольку чем выше температура растворителя, тем большее количество растворенного вещества может быть растворено в этом.
Существуют вещества, называемые поверхностно-активными веществами, которые становятся менее растворимыми при более высоких температурах, но они являются исключениями и выполняют определенные функции.
Процесс, в котором растворитель взаимодействует с растворенным веществом с образованием раствора, определяется как сольватация и включает образование связей и водородных мостиков в дополнение к притяжению силами Ван-дер-Ваальса..
черты
Растворенные вещества содержат огромное количество химических веществ в разных состояниях, имеют различную способность растворяться и имеют многочисленные характеристики, которые играют важную роль в образовании гомогенных смесей. Некоторые из основных характеристик растворенных веществ следующие:
растворимость
Растворимость — это способность соединения растворяться в другом веществе. Эта способность тесно связана с смешиваемостью, то есть способностью жидкости смешиваться с определенной; Если вы не можете присоединиться, это несмешиваемость.
Смешиваемость имеет диапазон больше, чем конкретное число, поэтому можно сказать, что одно вещество полностью, частично или не смешивается с другим.
Растворимость растворенного вещества зависит, в свою очередь, от других факторов, которые могут увеличивать или уменьшать эту емкость из-за их влияния на баланс межмолекулярных сил, которые создаются между растворенным веществом и растворителем..
Даже менее ожидаемые особенности, такие как размер капли растворенного вещества или порядок в структуре кристалла, могут влиять на их способность растворяться.
температура
Температура системы, в которой растворяется растворенное вещество, может влиять на его растворимость: для большинства твердых веществ и жидкостей они увеличивают его способность растворяться в зависимости от повышения температуры.
В отличие от этого, в газах наблюдается сложное поведение, которое проявляется в меньшей растворимости в воде при более высоких температурах, но большей в органических растворителях..
Насыщенность раствора
Это называется насыщением раствора до степени, в которой раствор растворяет растворенное вещество, и называется насыщенным раствором до того, которое растворило как можно больше растворенного вещества. С этого момента добавленное растворенное вещество будет осаждаться в виде избытка на дне использованного контейнера; до этого решение называется ненасыщенным.
Можно пройти точку насыщения и продолжить растворение растворенного вещества, но это требует повышения температуры. Раствор, который содержит избыток растворенного вещества и который был нагрет, называется перенасыщенным раствором.
давление
Изменения давления обычно не влияют на растворимость твердых веществ и жидкостей, за исключением некоторых исключительных случаев (накопление сульфата кальция в нефтяных трубах), но в газах это является определяющим фактором их способности растворяться.
Фактически растворимость газа в растворителе прямо пропорциональна парциальному давлению этого газа в указанном растворителе..
полярность
Полярность растворенного вещества имеет решающее значение при измерении его растворяющей способности; растворенное вещество лучше растворяется в растворителе, химическая структура которого аналогична.
Например, высокополярные или гидрофильные вещества будут иметь более высокую растворимость в высокополярных растворителях, в то время как они будут практически нерастворимы в неполярных веществах..
Аналогично, межмолекулярные силы играют важную роль в сольватации и в той легкости, с которой растворитель может растворять растворенное вещество: чем больше диполь-дипольные силы, водородные связи и другие связи, тем больше способность растворителя растворяться растворить и сформировать решение.
Различия между растворенным веществом и растворителем
— Растворение — это вещество, которое растворяется; растворитель является средством для растворения растворенного вещества (веществ).
— Раствор может быть в твердой, жидкой или газовой фазе; растворитель обычно находится в жидкой фазе, но он также существует в твердой и газообразной.
— Растворимость растворенного вещества зависит больше от таких свойств, как поверхность; Способность сольвата зависит от полярности, температуры и давления, среди других факторов.
— Растворение обычно является желаемым компонентом, который необходимо экстрагировать в промышленных процессах; Растворитель обычно не является желаемым компонентом и отбрасывается в промышленных процессах..
Примеры растворенного вещества
— Сахар является примером твердофазного растворенного вещества, обычно используемого для подслащивания воды..
— Гексан может быть найден в парафиновом воске, служащем жидким растворенным веществом, которое делает это твердое вещество более податливым.
— Углекислый газ — это газ, добавляемый в напитки для придания им шипучести.
Растворенные вещества в газообразном состоянии
Углекислый газ в воде (безалкогольные напитки)
Углекислый газ — это вода, которая содержит углекислый газ и производится путем пропускания углекислого газа под давлением через воду.
Газированные минеральные воды встречаются в природе в течение длительного времени. Эти шипучие воды существуют из-за избытка углекислого газа в водоносном горизонте, который растворился под давлением.
Одним из наиболее известных примеров растворенных веществ являются коммерческие безалкогольные напитки, которые сочетаются с сиропом.
Присутствие углекислого газа делает эти воды и безалкогольные напитки более аппетитными и визуально привлекательными.
Кислород и другие газы в азоте (воздух)
Воздух в атмосфере состоит из молекул разных газов. В основном он состоит из 78% азота и около 21% кислорода (растворенного вещества). Кроме того, он содержит почти 1% аргона и других молекул, но в очень небольших количествах.
Пропан в бутане (кулинарный газ)
Эта комбинация, также известная как сжиженный нефтяной газ (СНГ), начала использоваться с 1860 года в качестве источника топлива для домашних целей..
С тех пор она расширила свое производство и потребление для бытового и промышленного использования. Поскольку оба газа чрезвычайно без запаха и опасны, добавляется вещество, называемое меркаптаном, которое делает любую утечку заметной..
Растворенные вещества в твердом состоянии
Медь цинк (латунь)
Коммерческий сплав, известный как латунь, состоит из цинка (от 5 до 40%), растворенного в меди. Цинк помогает увеличить прочность на разрыв. К этому сплаву могут быть добавлены другие элементы, такие как олово, железо, алюминий, никель и кремний..
Йод в спирте (настойка йода)
Другим примером широко известного растворенного вещества является настойка йода. Этот раствор содержит йод в этиловом спирте (от 44 до 50%). Настойка йода используется как антисептик.
Соль в воде (морская вода)
Морская вода покрывает более 70% поверхности Земли. Это сложная смесь из 96,5% воды, 2,5% солей и небольших количеств других веществ. Это включает в себя неорганические и растворенные органические материалы, частицы и некоторые атмосферные газы.
Растворенные вещества в жидком состоянии
Алкоголь в воде (алкогольные напитки)
Этанол или этиловый спирт (растворенный) при сбраживании сахара смешивают с водой в фиксированных пропорциях для производства алкогольных напитков.
Это соединение легко усваивается организмом, но его чрезмерное потребление может нанести серьезный вред здоровью..
Вода в воздухе (влажность в воздухе)
Вода в воздухе обычно известна как туман. Это вызвано маленькими каплями воды, взвешенными в воздухе, и в основном из-за охлаждения земли ночью.
Таким образом, это охлаждение вызывает снижение температуры окружающего воздуха. Затем явление возникает, когда конденсированная вода сохраняется в этом.
Уксусная кислота в воде (уксус)
Уксус — жидкость с острым ароматом, используемая, чтобы добавить аромат или сохранить пищу. Его готовят из раствора уксусной кислоты, смешанного с водой..
Концентрация уксусной кислоты является переменной. Например, у дистиллированного уксуса есть пропорция, которая идет от 5 до 8%.
Ртуть в серебре (амальгамы или зубные пломбы)
Амальгамы, используемые для пломбирования зубов, состоят из 2% ртути со сплавом, который действует как растворитель. Этот сплав содержит 70% серебра. Вы также можете добавить олово, медь и цинк.
Solutos, которые можно использовать дома
Сахар в воде
Сахар является молекулярным и полярным соединением, и поэтому обладает способностью растворяться в воде, которая также является полярным элементом..
Способ структурирования сахара вызывает изменение процесса растворения. Например, если сахар находится в комочках, растворение займет больше времени, чем в зернах.
Некоторые специалисты считают, что вода с сахаром является очень важным источником энергии для организма. Были даже исследования, которые показывают эффективность этого решения у людей, которые делают физическую активность.
Сахар в муке
При приготовлении пирога обычно сначала смешивают твердые ингредиенты, а затем добавляют жидкости..
Сахар — это раствор, который прикрепляется к муке, в результате чего получается базовая смесь для кекса. В дополнение к этим двум ингредиентам добавляются другие, такие как яйца, масло или ваниль..
Этот тип растворенного вещества является твердым, и в этом случае его смешивают с растворителем, который также является твердым. Полученную основу также можно использовать для приготовления сладкого хлеба, печенья, тортов, бисквитов, маленьких пудингов и многих других сладких продуктов..
Порошок сока в воде
Существует широкий спектр порошкообразных соков, которые готовятся путем растворения этого элемента в воде. В этом случае растворяется порошок сока, а растворитель — вода..
Количество растворителя должно быть больше, чем растворенного, поэтому обычно одну или две столовые ложки порошка сока растворяют в стакане воды. Даже есть некоторые порошки, концентрация которых выше, и следует использовать меньшее количество.
Есть противники этих соков, поскольку они указывают, что компоненты, которые они включают (как консерванты, стабилизаторы и подсластители, среди других), вредны для здоровья.
Хлор в воде
Одним из способов очистки воды является использование хлора в виде растворенного в воде раствора. Это дезинфицирующее средство является одним из наиболее используемых для уничтожения микробов, и оно идеально для того, чтобы превратить непитьевую воду в питьевую быстро, экономично и легко..
Хлор как растворенное вещество этого раствора следует вводить в воду в концентрации не выше 0,2 и 0,5 мг / л..
Количество используемого хлора должно быть очень низким, потому что это вещество может быть чрезвычайно токсичным при употреблении или воздействии большого количества.
Этот метод очистки воды известен как хлорирование и может применяться во время экскурсии в гору или для очистки воды в доме, чтобы устранить бактерии и микробы, которые могут быть обнаружены в трубах, через которые проходит вода..
Живопись в воде
Вода — самый универсальный из существующих растворителей, а также основа, на которой растворяется раствор, такой как краска..
Краска обычно растворяется по разным причинам. Наиболее распространенным является облегчение очистки кистей и других инструментов, используемых для покраски..
Есть много видов картин; Те, которые лучше всего растворяются в воде, это латекс. Помимо лучшей очистки инструментов, преимущество разбавления краски в воде перед началом окрашивания состоит в том, что она гарантирует лучший результат на окрашенной поверхности..
Сухое молоко в воде
Сухое молоко представляет собой растворенное вещество, которое образуется в результате обезвоживания уже пастеризованного молока. Цель этого процесса — обеспечить лучшее хранение молока.
Этот раствор растворяется в воде и генерирует жидкое молоко, которое обычно принимается во время завтрака, вместе с кофе или различными препаратами.
Как и в случае сокового порошка, количество разбавляемого молока должно быть меньше количества воды, в которой вы хотите приготовить раствор..
Моющее средство в воде
При стирке белья используются жидкие или порошковые моющие средства. Они растворяются в воде, образуя раствор, который действует как дезинфицирующее и чистящее средство для текстильных тканей..
Количество растворенного вещества, которое необходимо использовать в этом растворе, является переменным, в зависимости от типа моющего средства, его представления и компонентов, которые в нем содержатся..
Раствор, состоящий из моющего средства и воды, может очень загрязнять окружающую среду, когда он вступает в контакт с водосливами, поэтому рекомендуется использовать биоразлагаемые моющие средства, которые могут разлагаться в течение очень короткого времени и оказывать гораздо меньшее воздействие на окружающую среду..
желатин
Желатин — это элемент, состоящий из сухожилий, связок и костей животных. Это соединение может быть в порошке или в листах.
В обоих случаях этот раствор должен быть растворен в горячей воде для достижения конечного результата: сладкая пища идеально подходит для десерта и имеет много полезных для здоровья свойств..
Одним из преимуществ этого соединения является то, что оно способствует быстрому восстановлению тканей и является противовоспалительной пищей. Кроме того, он имеет большое количество белков и играет важную роль в укреплении иммунной системы..
Еда небольшого количества ежедневного количества желатина поможет восстановить суставы и, таким образом, предвидит появление остеопороза..
Шоколад в молоке
Шоколад является элементом, который образуется благодаря смеси какао и масла какао. Эта еда действует как растворенное вещество при смешивании с молоком для приготовления так называемого горячего шоколада.
Для приготовления необходимого количества молока нагревают и добавляют шоколад кусочками, порошком или жидкостью, постоянно помешивая..
Чтобы растворенное вещество растворялось наилучшим образом и избегая комков, необходимо взбить смесь без паузы..
Какао-порошок в воде
Вы также можете приготовить горячий шоколад, используя какао-порошок. Это растворенное вещество образуется только из массы порошкообразного какао. В отличие от шоколада, какао не содержит масла этого фрукта.
Какао можно полностью растворить в воде, чтобы получить напиток со вкусом шоколада. В этих случаях важно подсластить смесь сахаром, медом или подсластителем; иначе результат будет крайне горьким.
ссылки
- Ламберт Н. и Мохаммед М. (1993). Химия для СХС. Оксфорд: Хайнеманн.
- Стин, Д. П. (2008). Двуокись углерода, карбонизация и принципы технологии розлива. В D. P. Steen, Philip и P. R. Ashurst (редакторы), Газированные безалкогольные напитки: разработка и производство, стр. 112-143. Оксфорд: издательство Blackwell.
- Что в воздухе? (с / ф). UCAR Центр Научного Образования. Получено 17 октября 2017 г. с сайта eo.ucar.edu
- Сжиженный нефтяной газ. (2013, 12 июля). Энциклопедия Британника.
Получено 16 октября 2017 г. с сайта britannica.com - Lytle, D.A. and Schock, M.R. (1996). Время застоя, состав, влияние рН и ортофосфата на выщелачивание металла из латуни. Огайо: США Агентство по охране окружающей среды.
- Крабви, Т. Д.; Pelletier, S.J. and Pruett, T.L. (2001). Хирургический Антисепсис В S. S. Block (редактор), Дезинфекция, Стерилизация и Сохранение, стр. 919-934. Филадельфия: Липпинкотт Уильямс и Уилкинс.
- Бирн, Р. Х. и др. (2017, 07 июня). Забортной. Энциклопедия Британника. Получено 17 октября 2017 г. с сайта britannica.com
- Плутовская Б. и Варденцки В. (2012). Газовая хроматография-ольфактометрия алкогольных напитков. В J. Piggott (редактор), Алкогольные напитки: сенсорная оценка и исследования потребителей, стр.101-122. Филадельфия: Издательство Вудхед.
- Что такое туман? (2017, 12 июля). Мет Офис (Великобритания). metoffice.gov.uk
- Хельменстин, А. М … (2016, 16 февраля). Каков химический состав уксуса? Получено 17 октября 2017 г.
- Phinney, D.J. и Halstead, J.H. (2017). Стоматологическая помощь: комплексный подход. Массачусетс: Cengage Learning.
- Britannica, E. (s.f.). Решение-химия. Получено с сайта britannica.com
- Wikipedia. (Н.Д.). Растворимость. Получено с en.wikipedia.org
- Classzone. (Н.Д.). Растворенные вещества. Получено с frsd.k12.nj.us
- ChemGuide. (Н.Д.). Насыщенные растворы и растворимость. Получено с сайта chem.libretexts.org
- Madhusha. (Н.Д.). Разница между растворителем и растворенным веществом. Получено с сайта pediaa.com.
Растворение поваренной соли (NaCl) в воде
Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. «Гомогенный» — значит, каждый из компонентов распределён в массе другого в виде своих частиц, то есть атомов, молекул или ионов.[1].
Раствор — однофазная система переменного, или гетерогенного, состава, состоящая из двух или более компонентов.
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает[1].
Образование того или иного типа раствора обусловливается интенсивностью межмолекулярного, межатомного, межионного или другого вида взаимодействия, то есть, теми же силами, которые определяют возникновение того или иного агрегатного состояния. Отличия: образование раствора зависит от характера и интенсивности взаимодействия частиц разных веществ[1].
По сравнению с индивидуальными веществами по структуре растворы сложнее[1].
Растворы бывают газовыми, жидкими и твёрдыми[1].
Твёрдые, жидкие, газообразные растворы
Чаще под раствором подразумевается жидкое вещество, например раствор соли или спирта в воде (или даже раствор золота в ртути — амальгама).
Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше.
В химической практике обычно под растворами понимают гомогенные системы, растворитель может быть жидким, твёрдым (твёрдый раствор), газообразным. Однако нередко допускается и микрогетерогенность — см. «Золи».
«Раствором» именуют и смесь цемента с водой, песком и так далее. Хотя это и не является раствором в химическом смысле этого слова.
Истинные и коллоидные растворы
Коллоидные и истинные растворы (изучением коллоидных систем занимается коллоидная химия) отличаются главным образом размерами частиц.
В истинных растворах размер частиц менее 1·10−9 м, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1·10−9 м — 5·10−7 м, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа (см. эффект Тиндаля).
Растворение
Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии при растворении твёрдых веществ и её уменьшением при растворении газов. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда — цвет, и другие) меняются.
В случае химического взаимодействия растворителя и растворённого вещества сильно меняются и химические свойства — например, при растворении газа хлороводорода в воде образуется жидкая соляная кислота.
Растворы электролитов и неэлектролитов
Электролиты — вещества, проводящие в расплавах или водных растворах электрический ток. В расплавах или водных растворах они диссоциируют на ионы. Неэлектролиты — вещества, водные растворы и расплавы которых не проводят электрический ток, так как их молекулы не диссоциируют на ионы. Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов).
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Растворы полимеров
Растворы высокомолекулярных веществ ВМС — белков, углеводов и др. обладают одновременно многими свойствами истинных и коллоидных растворов. Средняя молекулярная масса растворенноо…
Концентрация растворов
В зависимости от цели для описания концентрации растворов используются разные физические величины.
Мнемонические правила
В случаях приготовления растворов сильных кислот согласно правилам техники безопасности кислоту нужно добавлять в воду, но ни в коем случае не наоборот. Для запоминания этого лабораторного приёма существует несколько мнемонических правил:
Сначала вода,
Потом кислота,
Иначе случится
Большая бедаХимик, запомни как оду!
Льют кислоту в воду!
- Не плюй в кислоту, а то она ответит!
- Чай с лимоном (здесь нужно представить, как в чай Вы кладете дольку лимона).
«коньяк выдержанный» (кислоту в воду)
См. также
- Эмульсия
- Суспензия
- Гель
- Золь
- Нанодисперсия
- Эвтектика
- Твёрдый раствор
- Электролитическая диссоциация
- Концентрированный раствор
- Разбавленный раствор
- Насыщенный раствор
- Ненасыщенный раствор
- Пересыщенный раствор
Примечания
Литература
- Streitwieser Andrew Introduction to Organic Chemistry. — 4th ed.. — Macmillan Publishing Company, New York, 1992. — ISBN ISBN 0-02-418170-6
РАСТВОРЫ, однофазные системы, состоящие из двух или более компонентов. По своему агрегатному состоянию растворы могут быть твердыми, жидкими или газообразными. Так, воздух – это газообразный раствор, гомогенная смесь газов; водка – жидкий раствор, смесь нескольких веществ, образующих одну жидкую фазу; морская вода – жидкий раствор, смесь твердого (соль) и жидкого (вода) веществ, образующих одну жидкую фазу; латунь – твердый раствор, смесь двух твердых веществ (меди и цинка), образующих одну твердую фазу. Смесь бензина и воды не является раствором, поскольку эти жидкости не растворяются друг в друге, оставаясь в виде двух жидких фаз с границей раздела. Компоненты растворов сохраняют свои уникальные свойства и не вступают в химические реакции между собой с образованием новых соединений. Так, при смешивании двух объемов водорода с одним объемом кислорода получается газообразный раствор. Если эту газовую смесь поджечь, то образуется новое вещество – вода, которая сама по себе раствором не является. Компонент, присутствующий в растворе в большем количестве, принято называть растворителем, остальные компоненты – растворенными веществами.
Однако иногда бывает трудно провести грань между физическим перемешиванием веществ и их химическим взаимодействием. Например, при смешивании газообразного хлороводорода HCl с водой H2O образуются ионы H3O+ и Cl–. Они притягивают к себе соседние молекулы воды, образуя гидраты. Таким образом, исходные компоненты – HCl и H2O – после смешивания претерпевают существенные изменения. Тем не менее ионизация и гидратация (в общем случае – сольватация) рассматриваются как физические процессы, происходящие при образовании растворов.
Одним из важнейших типов смесей, представляющих собой гомогенную фазу, являются коллоидные растворы: гели, золи, эмульсии и аэрозоли. Размер частиц в коллоидных растворах составляет 1–1000 нм, в истинных растворах ~0,1 нм (порядка размера молекул).
Основные понятия.
Два вещества, растворяющиеся друг в друге в любых пропорциях с образованием истинных растворов, называют полностью взаиморастворимыми. Такими веществами являются все газы, многие жидкости (например, этиловый спирт – вода, глицерин – вода, бензол – бензин), некоторые твердые вещества (например, серебро – золото). Для получения твердых растворов необходимо сначала расплавить исходные вещества, затем смешать их и дать затвердеть. При их полной взаиморастворимости образуется одна твердая фаза; если же растворимость частичная, то в образовавшемся твердом веществе сохраняются мелкие кристаллы одного из исходных компонентов.
Если два компонента образуют одну фазу при смешивании только в определенных пропорциях, а в других случаях возникают две фазы, то они называются частично взаиморастворимыми. Таковы, например, вода и бензол: истинные растворы получаются из них только при добавлении незначительного количества воды к большому объему бензола или незначительного количества бензола к большому объему воды. Если же смешать равные количества воды и бензола, то образуется двухфазная жидкая система. Нижний ее слой – это вода с небольшим количеством бензола, а верхний – бензол с малой примесью воды. Известны также вещества, совсем не растворяющиеся одно в другом, например, вода и ртуть. Если два вещества лишь частично взаиморастворимы, то при данных температуре и давлении существует предельное количество одного вещества, которое способно образовать истинный раствор с другим в равновесных условиях. Раствор с предельной концентрацией растворенного вещества называют насыщенным. Можно приготовить и так называемый пересыщенный раствор, в котором концентрация растворенного вещества даже больше, чем в насыщенном. Однако пересыщенные растворы неустойчивы, и при малейшем изменении условий, например при перемешивании, попадании частичек пыли или добавлении кристалликов растворяемого вещества, избыток растворенного вещества выпадает в осадок.
Всякая жидкость начинает кипеть при той температуре, при которой давление ее насыщенного пара достигает величины внешнего давления. Например, вода под давлением 101,3 кПа кипит при 100° С потому, что при этой температуре давление водяного пара как раз равно 101,3 кПа. Если же растворить в воде какое-нибудь нелетучее вещество, то давление ее пара понизится. Чтобы довести давление пара полученного раствора до 101,3 кПа, нужно нагреть раствор выше 100° С. Отсюда следует, что температура кипения раствора всегда выше температуры кипения чистого растворителя. Аналогично объясняется и понижение температуры замерзания растворов.
Закон Рауля.
В 1887 французский физик Ф.Рауль, изучая растворы различных нелетучих жидкостей и твердых веществ, установил закон, связывающий понижение давления пара над разбавленными растворами неэлектролитов с концентрацией: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. Из закона Рауля следует, что повышение температуры кипения или понижение температуры замерзания разбавленного раствора по сравнению с чистым растворителем пропорционально молярной концентрации (или мольной доле) растворенного вещества и может быть использовано для определения его молекулярной массы.
Раствор, поведение которого подчиняется закону Рауля, называется идеальным. Наиболее близки к идеальным растворы неполярных газов и жидкостей (молекулы которых не меняют ориентации в электрическом поле). В этом случае теплота растворения равна нулю, а свойства растворов можно прямо предсказать, зная свойства исходных компонентов и пропорции, в которых они смешиваются. Для реальных растворов сделать такое предсказание нельзя. При образовании реальных растворов обычно выделяется или поглощается тепло. Процессы с выделением тепла называются экзотермическими, а с поглощением – эндотермическими.
Те характеристики раствора, которые зависят в основном от его концентрации (числа молекул растворенного вещества на единицу объема или массы растворителя), а не от природы растворенного вещества, называют коллигативными. Например, температура кипения чистой воды при нормальном атмосферном давлении равна 100° С, а температура кипения раствора, содержащего 1 моль растворенного (недиссоциирующего) вещества в 1000 г воды, составляет уже 100,52° С независимо от природы этого вещества. Если же вещество диссоциирует, образуя ионы, то температура кипения увеличивается пропорционально росту общего числа частиц растворенного вещества, которое благодаря диссоциации превышает число молекул вещества, добавленных в раствор. Другими важными коллигативными величинами являются температура замерзания раствора, осмотическое давление и парциальное давление паров растворителя.
Концентрация раствора
– это величина, отражающая пропорции между растворенным веществом и растворителем. Такие качественные понятия, как «разбавленный» и «концентрированный», говорят только о том, что раствор содержит мало или много растворенного вещества. Для количественного выражения концентрации растворов часто используют проценты (массовые или объемные), а в научной литературе – число молей или химических эквивалентов (см. ЭКВИВАЛЕНТНАЯ МАССА) растворенного вещества на единицу массы или объема растворителя либо раствора. Чтобы не возникало путаницы, следует всегда точно указывать единицы измерения концентрации. Рассмотрим следующий пример. Раствор, состоящий из 90 г воды (ее объем равен 90 мл, поскольку плотность воды равна 1г/мл) и 10 г этилового спирта (его объем равен 12,6 мл, поскольку плотность спирта равна 0,794 г/мл), имеет массу 100 г, но объем этого раствора равен 101,6 мл (а был бы равен 102,6 мл, если бы при смешивании воды и спирта их объемы просто складывались). Процентную концентрацию раствора можно рассчитать по-разному:
или
или
Единицы концентраций, используемые в научной литературе, основаны на таких понятиях, как моль и эквивалент, поскольку все химические расчеты и уравнения химических реакций должны основываться на том, что вещества вступают в реакции между собой в определенных соотношениях. Например, 1 экв. NaCl, равный 58,5 г, взаимодействует с 1 экв. AgNO3, равным 170 г. Ясно, что растворы, содержащие по 1 экв. этих веществ, имеют совершенно разные процентные концентрации.
Молярность
(M или моль/л) – число молей растворенного веществ, содержащихся в 1 л раствора.
Моляльность
(м) – число молей растворенного вещества, содержащихся в 1000 г растворителя.
Нормальность
(н.) – число химических эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Мольная доля
(безразмерная величина) – число молей данного компонента, отнесенное к общему числу молей растворенного вещества и растворителя. (Мольный процент – мольная доля, умноженная на 100.)
Наиболее распространенная единица – молярность, но при ее расчете следует учитывать некоторые неоднозначности. Например, чтобы получить 1M раствор данного вещества, растворяют в заведомо небольшом количестве воды точную его навеску, равную мол. массе в граммах, и доводят объем раствора до 1 л. Количество воды, необходимое для приготовления данного раствора, может слегка различаться в зависимости от температуры и давления. Поэтому два одномолярных раствора, приготовленных в разных условиях, в действительности имеют не совсем одинаковые концентрации. Моляльность вычисляется исходя из определенной массы растворителя (1000 г), которая не зависит от температуры и давления. В лабораторной практике гораздо удобнее отмеривать определенные объемы жидкостей (для этого существуют бюретки, пипетки, мерные колбы), чем взвешивать их, поэтому в научной литературе концентрации чаще выражают в молях, а моляльность обычно применяют только при особо точных измерениях.
Нормальность используется для упрощения расчетов. Как мы уже говорили, вещества взаимодействуют друг с другом в количествах, соответствующих их эквивалентам. Приготовив растворы разных веществ одинаковой нормальности и взяв равные их объемы, мы можем быть уверены в том, что они содержат одно и то же количество эквивалентов.
В тех случаях, когда трудно (или нет необходимости) делать различие между растворителем и растворенным веществом, концентрацию измеряют в мольных долях. Мольные доли, как и моляльности, не зависят от температуры и давления.
Зная плотности растворенного вещества и раствора, можно пересчитать одну концентрацию в другую: молярность в моляльность, мольную долю и наоборот. Для разбавленных растворов данного растворенного вещества и растворителя эти три величины пропорциональны друг другу.
Растворимость
данного вещества – это его способность образовывать растворы с другими веществами. Количественно растворимость газа, жидкости или твердого тела измеряется концентрацией их насыщенного раствора при данной температуре. Это важная характеристика вещества, помогающая понять его природу, а также влиять на ход реакций, в которых это вещество участвует.
Газы.
В отсутствие химического взаимодействия газы смешиваются друг с другом в любых пропорциях, и в этом случае говорить о насыщении нет смысла. Однако при растворении газа в жидкости существует некая предельная концентрация, зависящая от давления и температуры. Растворимость газов в некоторых жидкостях коррелирует с их способностью к сжижению. Наиболее легко сжижаемые газы, например NH3, HCl, SO2, более растворимы, чем трудно сжижаемые газы, например O2, H2 и He. При наличии химического взаимодействия между растворителем и газом (например, между водой и NH3 или HCl) растворимость увеличивается. Растворимость данного газа изменяется с природой растворителя, однако порядок, в котором располагаются газы в соответствии с увеличением их растворимости, остается примерно одинаковым для разных растворителей.
Процесс растворения подчиняется принципу Ле Шателье (1884): если на систему, находящуюся в равновесии, оказывается какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится. Растворение газов в жидкостях обычно сопровождается выделением тепла. При этом, в соответствии с принципом Ле Шателье, растворимость газов уменьшается. Это уменьшение тем заметнее, чем выше растворимость газов: такие газы имеют и бóльшую теплоту растворения. «Мягкий» вкус кипяченой или дистиллированной воды объясняется отсутствием в ней воздуха, поскольку его растворимость при высокой температуре весьма мала.
С ростом давления растворимость газов увеличивается. Согласно закону Генри (1803), масса газа, который может раствориться в данном объеме жидкости при постоянной температуре, пропорциональна его давлению. Это свойство используется для приготовления газированных напитков. Углекислый газ растворяют в жидкости при давлении 3–4 атм.; в этих условиях в данном объеме может раствориться в 3–4 раза больше газа (по массе), чем при 1 атм. Когда емкость с такой жидкостью открывают, давление в ней падает, и часть растворенного газа выделяется в виде пузырьков. Аналогичный эффект наблюдается при открывании бутылки шампанского или выходе на поверхность подземных вод, насыщенных на большой глубине углекислым газом.
При растворении в одной жидкости смеси газов растворимость каждого из них остается такой же, как и в отсутствие других компонентов при таком же давлении, как в случае смеси (закон Дальтона).
Жидкости.
Взаимная растворимость двух жидкостей определяется тем, насколько сходно строение их молекул («подобное растворяется в подобном»). Для неполярных жидкостей, например углеводородов, характерны слабые межмолекулярные взаимодействия, поэтому молекулы одной жидкости легко проникают между молекулами другой, т.е. жидкости хорошо смешиваются. Напротив, полярные и неполярные жидкости, например вода и углеводороды, смешиваются друг с другом плохо. Каждой молекуле воды нужно сначала вырваться из окружения других таких же молекул, сильно притягивающими ее к себе, и проникнуть между молекулами углеводорода, притягивающими ее слабо. И наоборот, молекулы углеводорода, чтобы раствориться в воде, должны протиснуться между молекулами воды, преодолевая их сильное взаимное притяжение, а для этого нужна энергия. При повышении температуры кинетическая энергия молекул возрастает, межмолекулярное взаимодействие ослабевает и растворимость воды и углеводородов увеличивается. При значительном повышении температуры можно добиться их полной взаимной растворимости. Такую температуру называют верхней критической температурой растворения (ВКТР).
В некоторых случаях взаимная растворимость двух частично смешивающихся жидкостей увеличивается при понижении температуры. Этот эффект наблюдается в том случае, когда при смешивании выделяется тепло, обычно в результате химической реакции. При значительном понижении температуры, но не ниже точки замерзания, можно достичь нижней критической температуры растворения (НКТР). Можно предположить, что все системы, имеющие НКТР, имеют и ВКТР (обратное не обязательно). Однако в большинстве случаев одна из смешивающихся жидкостей кипит при температуре ниже ВКТР. У системы никотин–вода НКТР равна 61° С, а ВКТР составляет 208° C. В интервале 61–208° C эти жидкости ограниченно растворимы, а вне этого интервала обладают полной взаимной растворимостью.
Твердые вещества.
Все твердые вещества проявляют ограниченную растворимость в жидкостях. Их насыщенные растворы имеют при данной температуре определенный состав, который зависит от природы растворенного вещества и растворителя. Так, растворимость хлорида натрия в воде в несколько миллионов раз выше растворимости нафталина в воде, а при растворении их в бензоле наблюдается обратная картина. Этот пример иллюстрирует общее правило, согласно которому твердое вещество легко растворяется в жидкости, имеющей с ним сходные химические и физические свойства, но не растворяется в жидкости с противоположными свойствами.
Соли обычно легко растворяются в воде и хуже – в других полярных растворителях, например в спирте и жидком аммиаке. Однако растворимость солей тоже существенно различается: например, нитрат аммония обладает в миллионы раз большей растворимостью в воде, чем хлорид серебра.
Растворение твердых веществ в жидкостях обычно сопровождается поглощением тепла, и в соответствии с принципом Ле Шателье их растворимость должна увеличиваться при нагревании. Этот эффект можно использовать для очистки веществ методом перекристаллизации. Для этого их растворяют при высокой температуре до получения насыщенного раствора, затем раствор охлаждают и после выпадения растворенного вещества в осадок профильтровывают. Есть вещества (например, гидроксид, сульфат и ацетат кальция), растворимость которых в воде с ростом температуры уменьшается.
Твердые вещества, как и жидкости, тоже могут растворяться друг в друге полностью, образуя гомогенную смесь – истинный твердый раствор, аналогичный жидкому раствору. Частично растворимые друг в друге вещества образуют два равновесных сопряженных твердых раствора, составы которых изменяются с температурой.
Коэффициент распределения.
Если к равновесной системе двух несмешивающихся или частично смешивающихся жидкостей добавить раствор какого-либо вещества, то оно распределяется между жидкостями в определенной пропорции, не зависящей от общего количества вещества, в отсутствие химических взаимодействий в системе. Это правило получило название закона распределения, а отношение концентраций растворенного вещества в жидкостях – коэффициента распределения. Коэффициент распределения примерно равен отношению растворимостей данного вещества в двух жидкостях, т.е. вещество распределяется между жидкостями соответственно его растворимостям. Это свойство используется для экстракции данного вещества из его раствора в одном растворителе с помощью другого растворителя. Еще одним примером его применения является процесс экстракции серебра из руд, в состав которых оно часто входит вместе со свинцом. Для этого в расплавленную руду добавляют цинк, который не смешивается со свинцом. Серебро распределяется между расплавленным свинцом и цинком, преимущественно в верхнем слое последнего. Этот слой собирают и отделяют серебро дистилляцией цинка.
Произведение растворимости
(ПР). Между избытком (осадком) твердого вещества MxBy и его насыщенным раствором устанавливается динамическое равновесие, описываемое уравнением
Константа равновесия этой реакции равна
и называется произведением растворимости. Она постоянна при данных температуре и давлении и является величиной, на основании которой рассчитывают растворимость осадка и изменяют ее. Если в раствор добавить соединение, диссоциирующее на ионы, одноименные с ионами малорастворимой соли, то в соответствии с выражением для ПР растворимость соли уменьшается. При добавлении же соединения, реагирующего с одним из ионов, она, напротив, увеличится.
О некоторых свойствах растворов ионных соединений см. также ЭЛЕКТРОЛИТЫ.
Содержание:
- Растворы
- Численное выражение состава растворов
- Растворимость веществ в воде
- Тепловые явления при растворения
- Электролиты и неэлектролиты
- Теория электролитической диссоциации
- Механизм диссоциации
- Гидратация ионов
- Диссоциация кислот, оснований и солеи в водных растворах
- Степень дмссоциации
- Сильные и слабые электролиты
- Реакции ионного обмена
- Диссоциация воды. рН
- Протолитическая теория кислот и оснований
- Растворы и растворимость
- Растворение веществ в воде
- Решение задач на тему: растворимость веществ
- Определение масс растворенного вещества и растворителя для приготовления насыщенного раствора при определенной температуре
- Расчет масс растворяемого вещества и для приготовления насыщенного раствора по известной массе растворителя
- Расчет массы растворителя, необходимого для растворения определенной массы вещества при определенной температуре
- Определение растворимости вещества выпариванием
- Массовая доля растворенного вещества
- Молярная концентрация вещества в растворе
- Расчет молярной концентрации раствора
- Расчет массы вещества, необходимой для приготовления раствора
- Массовые доли растворенного вещества
- Расчет массы вещества и массы растворителя, необходимых для приготовления раствора определенной концентрации
- Расчет массы (объема) раствора по известной концентрации раствора и по массе растворенного вещества
- Расчет массы растворенного вещества по известной массе растворителя и концентрации раствора
- Расчет объема раствора
- Пересчет процентной концентрации раствора на молярную
- Расчет объема раствора процентной концентрации для приготовления раствора молярной концентрации
- Расчётные задачи по уравнениям реакций с использованием концентрации раствора
- Способы изменения концентрации раствора
- Определение концентрации раствора, полученного смешением двух растворов с известными концентрациями
- Определение концентрации раствора после разбавления
- Определение концентрации после увеличения массы растворенного вещества в растворе
Растворы – это однородные гомогенные системы, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Растворенное вещество равномерно распределено в растворителе. Раствор может состоять из двух и более компонентов.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Растворы
Раствор — это однородная (гомогенная) смесь двух или более компонентов (составных частей, или веществ).
Численное выражение состава растворов
В природе и технике растворы имеют огромное значение. Растения усваивают вещества в виде растворов. Усвоение пищи связано с переводом питательных веществ в раствор. Все природные воды являются растворами. Растворами являются важнейшие физиологические жидкости — кровь, лимфа и др. Многие химические реакции протекают в растворах.
Растворы — это однородные (гомогенные) системы, состоящие из двух и более компонентов (составных частей) и продуктов их взаимодействия.
Так, например, раствор серной кислоты состоит из растворителя — воды (первый компонент), растворенного вещества — кислоты (второй компонент) и продуктов их взаимодействия — гидратированных ионов: 




По агрегатному состоянию растворы бывают жидкие, твердые и газообразные. Примером жидких растворов могут быть растворы солей в воде; примером твердых — сплав никеля и меди (из которых делают разменную монету) или сплав серебра и золота; примером газообразных — смеси газов, воздух. Наибольшее значение имеют жидкие (водные) растворы.
Важной характеристикой любого раствора является его состав.
Существуют различные способы численного выражения состава растворов: массовая доля растворенного вещества, молярная концентрация и др.
Массовая доля растворенного вещества — это безразмерная физическая величина, равная отношению массы растворенного вещества к общей массе раствора, т. е.
где 

Массовую долю растворенного вещества 
Молярная концентрация или молярность — это величина, равная отношению количества растворенного вещества к объему раствора, т. е.
где с(Х) — молярная концентрация частиц X, п(Х) — количество вещества частиц X, содержащихся в растворе, V — объем раствора. Основной единицей молярной концентрации является моль/л. Примеры записи молярной концентрации: с(НСl) = 0,1 моль/л, с(



Раствор, в 1 л которого содержится 1 моль растворенного вещества, называется молярным.
Если в 1 л раствора содержится 0,1 моль вещества, то он называется децимолярным, 0,01 моль — сантимолярным, 0,001 моль — миллимолярным. Молярность раствора обычно обозначается буквой М. Например, 1MNaOH — молярный раствор гидроксида натрия, 1 л такого раствора содержит 1 моль вещества или 1 моль

Чтобы приготовить, например, децимолярный раствор гидроксида натрия, надо отвесить 4 г его, внести в литровую мерную колбу, на горлышке которой отмечен объем, точно равный 1 л (рис. 5.1, а), добавить дистиллированной воды до полного растворения вещества и затем раствор довести до метки [нижняя часть мениска должна касаться метки (рис. 5.1, б)].
Пользоваться молярной концентрацией удобно, так как известно число молей (количество вещества), содержащееся в определенном объеме раствора. Например, для нейтрализации 1 л 1М раствора NaOH необходимы в соответствии с уравнениями реакций:
a) 
следующие объемы растворов кислот: 1 л 1М НСl или 0,5 л 1М 


Растворимость веществ в воде
Растворимость — это свойство вещества растворяться в воде или другом растворителе. В воде могут растворяться твердые, жидкие и газообразные вещества.
По растворимости в воде все вещества делятся на три группы: 1) хорошо растворимые, 2) мало растворимые и 3) практически нерастворимые. Последние называют также нерастворимыми веществами. Однако следует отметить, что абсолютно нерастворимых веществ нет. Если опустить в воду стеклянную палочку или кусочек золота или серебра, то они в ничтожно малых количествах все же растворяются в воде. Как известно, растворы серебра или золота в воде убивают микробов.
Стекло, серебро, золото — это примеры практически нерастворимых в воде веществ (твердые вещества). К ним следует также отнести керосин, растительное масло (жидкие вещества), благородные газы (газообразные вещества). Примером малорастворимых в воде веществ могут служить гипс, сульфат свинца (твердые вещества), диэтиловый эфир, бензол (жидкие вещества), метан, азот, кислород (газообразные вещества). Многие вещества в воде растворяются весьма хорошо. Примером таких веществ могут служить сахар, медный купорос, гидроксид натрия (твердые вещества), спирт, ацетон (жидкие вещества), хлороводород, аммиак (газообразные вещества).
Из приведенных примеров следует, что растворимость прежде всего зависит от природы веществ. Кроме того, она зависит также от температуры и давления. Сам процесс растворения обусловлен взаимодействием частиц растворимого вещества и растворителя; это самопроизвольный процесс.
Процесс растворения твердых веществ в жидкостях можно представить так: под влиянием растворителя от поверхности твердого вещества постепенно отрываются отдельные ионы или молекулы и равномерно распределяются по всему объему растворителя. Если растворитель соприкасается с большим количеством вещества, то через некоторое время раствор становится насыщенным.
Насыщенным называется такой раствор, который находится в динамическом равновесии с избытком растворенного вещества.
Чтобы приготовить насыщенный раствор, надо в воду при данной температуре добавлять при перемешивании вещество до тех пор, пока не образуется осадок, т. е. избыток вещества останется нерастворенным. В этом случае наступит динамическое равновесие между раствором и избытком растворяемого вещества: сколько частиц вещества будет переходить в раствор, столько их будет выделяться (кристаллизоваться) из раствора. В насыщенном растворе при данной температуре содержится максимально возможное количество растворенного вещества.
В ненасыщенном растворе содержится меньше вещества, а в пересыщенном — больше, чем в насыщенном. Пересыщенные растворы весьма неустойчивы. Легкое сотрясение сосуда или введение в раствор кристалла соли вызывает выпадение в осадок избытка растворенного вещества. Пересыщенные растворы образуют сахароза, 



Часто малорастворимые и практически нерастворимые вещества объединяют одним названием — малорастворимые. Тогда говорят только о растворимых и малорастворимых веществах.
Количественно растворимость выражается концентрацией насыщенного раствора. Чаще всего ее выражают максимальным числом граммов вещества, которое можно растворить в 100 г растворителя при данной температуре. Это количество иногда называют коэффициентом растворимости или просто растворимостью вещества. Так, например, при 18°С в 100 г воды растворяется 51,7 г соли нитрата свинца (II) 
Говоря о растворимости вещества, следует указывать температуру при растворении. Чаще всего растворимость твердых веществ с увеличением температуры возрастает. Это наглядно изображается с помощью кривых растворимости (рис. 5.2). По оси абсцисс откладывают температуру, а по оси ординат — коэффициент растворимости. Однако растворимость некоторых веществ при увеличении температуры возрастает незначительно (например, NaСl, 



С помощью кривых растворимости легко рассчитать, сколько соли выпадет из раствора при его охлаждении. Например, если взять 100 г воды и приготовить при 45°С насыщенный раствор нитрата калия, а затем его охладить до 0°С, то, как следует из кривой растворимости (рис. 5.2), должно выпасть 60 г кристаллов соли. По кривым растворимости легко определяют коэффициент растворимости веществ при разных температурах.
Выделение вещества из раствора при понижении температуры называется кристаллизацией. Если в растворе содержались примеси, то при кристаллизации вещество всегда получается чистым, так как по отношению к примесям раствор остается ненасыщенным даже при понижении температуры и примеси не выпадают в осадок. На этом основан метод очистки веществ, называемый перекристаллизацией.
При растворении газов в воде выделяется теплота. Поэтому в соответствии с принципом Ле Шателье при повышении температуры растворимость газов уменьшается, а при понижении — увеличивается (рис. 5.3). Растворимость газов увеличивается при повышении давления. Так как объем газа, растворяющийся в данном объеме воды, не зависит от давления, то растворимость газа обычно выражают в мл, растворяющихся в 100 г растворителя (рис. 5.3).
Тепловые явления при растворения
Растворение веществ сопровождается тепловым эффектом: выделением или поглощением теплоты — в зависимости от природы вещества. При растворении в воде, например, гидроксида калия, серной кислоты наблюдается сильное разогревание раствора, т. е. выделение теплоты, а при растворении нитрата аммония — сильное охлаждение раствора, т. е. поглощение теплоты. В первом случае осуществляется экзотермический процесс (




В результате химического взаимодействия растворенного вещества с растворителем образуются соединения, которые называют сольватами (или гидратами, если растворителем является вода). Образование таких соединений роднит растворы с химическими соединениями.
Великий русский химик Д. И. Менделеев создал химическую теорию растворов, которую он обосновал многочисленными экспериментальными данными, изложенными в его книге «Исследования водных растворов по их удельному весу», вышедшей в 1887 г. «Растворы суть химические соединения, определяемые силами, действующими между растворителем и растворенным веществом»,— писал он в этой книге. Теперь известна природа этих сил. Сольваты (гидраты) образуются за счет донорно-акцепторного, ион-дипольного взаимодействий, за счет водородных связен, а также дисперсионного взаимодействия (в случае растворов родственных веществ, например бензола и толуола).
Особенно склонны к гидратации (соединению с водой) ионы. Ионы присоединяют полярные молекулы воды, в результате образуются гидратированные ионы (см. § 5.4); поэтому, например, в растворе ион меди (II) голубой, в безводном сульфате меди он бесцветный. Многие из таких соединений непрочны и легко разлагаются при выделении их в свободном виде, однако в ряде случаев образуются прочные соединения, которые можно легко выделить из раствора кристаллизацией. При этом выпадают кристаллы, содержащие молекулы воды.
Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами, а вода, входящая в состав кристаллогидратов, называется кристаллизационной. Кристаллогидратами являются многие природные минералы. Ряд веществ (в том числе и органические) получаются в чистом виде только в форме кристаллогидратов. Д. И. Менделеев доказал существование гидратов серной кислоты, а также ряда других веществ. В химических формулах гидратов и кристаллогидратов формулу воды пишут отдельно (через точку), например 





Таким образом, растворение — не только физический, но и химический процесс. Растворы образуются путем взаимодействия частиц растворенного вещества с частицами растворителя. Ученик Д. И. Менделеева Д. П. Коновалов всегда подчеркивал, что между химическими соединениями и растворами нет границ.
Жидкие растворы занимают промежуточное положение между химическими соединениями постоянного состава и механическими смесями. Как и химические соединения, они однородны и характеризуются тепловыми явлениями, а также часто наблюдающейся контракцией — сокращением объема при смешивании жидкостей. С другой стороны, в отличие от химических соединений растворы не подчиняются закону постоянства состава. Они, как и смеси, могут быть легко разделены на составные части. Процесс растворения есть физико-химический процесс, а растворы — физико-химические системы.
Много внимания изучению растворов уделял М. В. Ломоносов. Он провел исследования по установлению зависимости растворимости веществ от температуры, изучал выделение и поглощение теплоты при растворении и открыл охлаждающие смеси. М. В. Ломоносов впервые установил, что растворы замерзают (кристаллизуются) при более низкой температуре, чем растворитель. Он же дал молекулярно-кинетическое объяснение растворению, близкое к современному, полагая, что частицы растворенного вещества равномерно распределяются среди частиц растворителя.
Около 40 лет научной работы посвятил изучению растворов Д. И. Менделеев. Его химическая теория растворов оказалась исключительно плодотворной. На ее основе возникли новые научные дисциплины — такие, как физико-химический анализ, химия комплексных соединений, электрохимия неводных растворов. Ныне эта теория общепризнана.
Большой вклад в развитие химической теории растворов сделали известные русские ученые Д. П. Коновалов, И. А. Каблуков, Н. С. Курнаков.
Электролиты и неэлектролиты
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать е помощью простого прибора (рис. 5.4). Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Электролиты — проводники второго рода. В растворе или расплаве они распадаются на ионы, благодаря чему и протекает ток. Очевидно, чем больше ионов в растворе, тем лучше он проводит электрический ток. Чистая вода электрический ток проводит очень плохо.
Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией.
Так, хлорид натрия NaCl при растворении в воде полностью распадается на ионы натрия 



Теория электролитической диссоциации
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи. Современное содержание этой теории можно свести к следующим трем положениям:
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительные и отрицательные.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома — это простые ионы (









2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами, вторые — анионами.
Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
3. Диссоциация — обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КА на катион 

Теория электролитической диссоциации является одной из основных теорий в неорганической химии и полностью согласуется с атомно-молекулярным учением и теорией строения атома.
Механизм диссоциации
Существенным является вопрос о механизме электролитической диссоциации. В самом деле, почему электролиты диссоциируют на ионы? Учение о химической связи атомов помогает ответить на этот вопрос.
Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов (см. § 3.3). При их растворении
диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При этом, как показано на рис. 5.5, образуются гидротированные ионы, т. е. ионы, химически связанные с молекулами воды.
Аналогично диссоциируют и электролиты, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества также ориентнруются диполи воды, которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы, а положительными полюсами — к отрицательному полюсу. В результате этого взаимодействия связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула превращается в ионную и затем легко образуются гид-ратированные ионы (рис. 5.6). Диссоциация полярных молекул может быть полной или частичной.
Таким образом, электролитами являются соединения с ионной или полярной связью — соли, кислоты и основания. И диссоциировать на ноны они могут в полярных растворителях.
Гидратация ионов
Известный русский химик И. А. Каблуков показал, что электролитическую диссоциацию нельзя объяснить без химической теории растворов Д. И. Менделеева. Как известно, Д. И. Менделеев экспериментально обосновал образование химических соединении при взаимодействии растворенного вещества с растворителем. Действительно, при растворении происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы (см. рис. 5.6). Эти ионы связаны с молекулами воды, т. е. гидратированы. И. А. Каблуков полагал, что в водном растворе содержатся только гидратирован-ные ионы. В настоящее время это представление общепринято.
Итак, гидратация ионов (в общем случае сольватация — химическая связыюнов с молекулами неводного растворителя) — основная причина диссоциации. Она отчасти затрудняет их обратное соединение (ассоциацию).
Гидратированные ионы содержат как постоянное, так и переменное число молекул воды. Гидрат постоянного состава образует ион водорода 



Следует помнить, что в растворах нет иона 


Механизм возникновения прочной ковалентной связи в ионе 
Молекула воды — донор, протон — акцептор.
Однако мнения химиков разделились. Одни полагают, что в растворе существуют только ионы гидроксония 







Но обычно для простоты написания указания в скобках опускают.
Диссоциация кислот, оснований и солеи в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
Например:
Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации. Так, HCl, 







Двух- и многоосновные кислоты диссоциируют ступенчато (постепенно). Например:
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами 



Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Например,
Основания, растворимые в воде, называются щелочами. Их немного. Это основания щелочных и щелочноземельных металлов: LiOH, NaOH, КОН, RbOH, CsOH, FrOH и 




Кислотность основания определяется числом его гидроксильных групп (гидроксогрупп). Например, 


Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид-ионы. Эти электролиты называются амфотерными, или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы 

Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленные наличием катионов водорода 

Диссоциацию амфотерного гидроксида цннка 
Солями называются электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония 
Например:
Так диссоциируют средние соли. Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
и далее
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы. Например:
и далее
Степень дмссоциации
Поскольку электролитическая диссоциация — процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа 
Степень диссоциации — это отношение числа распавшихся на ионы молекул п к общему числу растворенных молекул N:
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если 


Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита, т. е. при разбавлении его водой, степень диссоциации всегда увеличивается. Как правило, увеличивает степень диссоциации и повышение температуры. По степени диссоциации электролиты делят на сильные и слабые (см. ниже).
Рассмотрим смещение равновесия, устанавливающегося между недиссоциированными молекулами и ионами при электролитической диссоциации слабого электролита — уксусной кислоты:
При разбавлении раствора уксусной кислоты водой равновесие сместится в сторону образования ионов, — степень диссоциации кислоты возрастает. Наоборот, при упаривании раствора равновесие смещается в сторону образования молекул кислоты — степень диссоциации уменьшается.
Сильные и слабые электролиты
Различают сильные и слабые электролиты.
Сильные электролиты при растворении в воде полностью диссоциируют на ионы.
К ним относятся:
1) почти все соли;
2) многие минеральные кислоты, например 




3) основания щелочных и щелочноземельных металлов.
Диссоциация сильного электролита, например NaCl, обычно изображается уравнением
Как отмечалось выше, в кристалле хлорида натрия отсутствуют молекулы NaCl. При растворении кристаллическая структура разрушается, гидратированные ноны переходят в раствор. Молекулы в растворе также отсутствуют. Поэтому о недиссоциированных молекулах в растворах сильных электролитов можно говорить лишь условно. Их скорее можно представлять как ионные пары (
Однако для простоты его пишут как уравнение (а), под символом NaCl понимая ионную пару (квазимолекулу). Концентрация квазимолекул в растворе всегда очень мала, а концентрация ионов велика.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы.
К ним относятся;
1) почти все органические кислоты;
2) некоторые минеральные кислоты, например 




3) многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также 

К слабым электролитам относится вода.
Слабые электролиты не могут дать большой концентрации ионов в растворе.
Реакции ионного обмена
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций — ионными уравнениями. Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер.
При составлении ионных уравнений реакций следует руководствоваться тем, что вещества малодиссоциированные, малорастворимые (выпадающие в осадок) и газообразные записываются в молекулярной форме. Знак 

Для закрепления этих положении рассмотрим два примера.
Пример 1. Напишите уравнения реакций между растворами хлорида железа (III) и гидроксида натрия в молекулярной и ионной формах,
Разобьем решение задачи на четыре этапа.
1. Запишем уравнение реакции в молекулярной форме:
2. Перепишем это уравнение, изобразив хорошо диссоциирующие вещества в виде ионов, а уходящие из сферы реакции — в виде молекул:
Эго ионное уравнение реакции.
3. Исключим из обеих частей ионного уравнения одинаковые ионы, т. е. ионы, не участвующие в реакции (они подчеркнуты):
4. Запишем уравнение реакции в окончательном виде:
Это сокращенное ионное уравнение реакции. Как видно из этого уравнения, сущность реакции сводится к взаимодействию ионов 


Пример 2. Напишите уравнения реакций между растворами хлорида калия и нитрата натрия. Так как продукты взаимодействия хорошо растворимы в воде и не уходят из сферы реакции, то данная реакция обратима.
Как и в примере 1, записываем по этапам:
Уравнения для следующих этапов написать нельзя, так как с точки зрения теории электролитической диссоциации реакция не происходит. Однако если выпаривать этот раствор, то будут возникать новые химические связи между ионами и получится смесь четырех солей: 



Ионными уравнениями могут быть изображены любые реакции, протекающие в растворах между электролитами. Если при таких реакциях не происходит изменения зарядов ионов (не изменяется степень окисления), то они называются ионообменными.
Диссоциация воды. рН
Вода как слабый электролит в незначительной степени диссоциирует на ионы 

Концентрацию ионов обычно выражают в молях ионов в 1 л. Как видно из уравнения диссоциации воды, в ней величины [






Произведение концентраций ионов водорода и гидроксид-ионов в воде называется ионным произведением воды (обозначается Кв). При определенной температуре 

Постоянство произведения [














Из постоянства произведения [






Таким образом, кислотность и щелочность раствора можно выражать через концентрацию либо ионов 







Чтобы избежать неудобств, связанных с применением чисел с отрицательными показателями степени, концентрацию водородных ионов принято выражать через водородный показатель, обозначаемый символом рН (читается «пэ-аш»).
Водородным показателем рН называется десятичный логарифм концентрации водородных ионов, взятый с обратным знаком:
или
где [
Понятие «водородный показатель» было введено датским химиком Сёренсеном в 1909 г.: буква р — начальная буква датского слова potenz — математическая степень, буква Н — символ водорода.
С помощью рН реакция растворов характеризуется так: нейтральная — рН 7, кислая — рН<7, щелочная — рН>7. Наглядно зависимость между концентрацией ионов водорода, величиной рН и реакцией раствора можно выразить схемой
Из схемы видно, что чем меньше рН, тем больше концентрация ионов 

Приведем значения рН некоторых наиболее известных растворов и укажем соответствующую им реакцию среды: желудочный сок — рН 1,7 (сильнокислая реакция), торфяная вода — рН 4 (слабокислая), дождевая вода — рН 6 (слабокислая), водопроводная вода — рН 7,5 (слабощелочная), кровь — рН 7,4 (слабощелочная), слюна — рН 6,9 (слабокислая), слезы — рН 7 (нейтральная).
Исключительно велика роль рН в самых различных явлениях и процессах — и в природе, и в технике. Многие производственные процессы в химической, пищевой, текстильной и других отраслях промышленности протекают лишь при определенной реакции среды. Столь же необходима для нормального развития сельскохозяйственных культур и получения высоких урожаев и определенная реакция почвенного раствора. В зависимости от значения рН почвенного раствора почвы подразделяются на сильнокислые (рН 3—4), кислые (рН 4—5), слабокислые (рН 5—6), нейтральные (рН 6—7), слабощелочные (рН 7—8), щелочные (рН 8—9) и, наконец, сильнощелочные (рН 9—11).
Чаще всего растения страдают от повышенной кислотности, для устранения которой применяется известкование почв — внесение в них известняков — карбонатов кальция или магния. Если же почвы отличаются повышенной щелочностью (солонцеватые и солончаковые почвы), то для ее устранения производят гипсование — внесение размолотого гипса 
Необходимость в известковании или гипсовании почв устанавливается с учетом водородного показателя раствора (солевой вытяжки); в зависимости от величины рН устанавливается по таблицам и доза вносимых веществ.
Протолитическая теория кислот и оснований
Теория электролитической диссоциации объяснила многочисленные явления и процессы, протекающие в водных растворах электролитов. Так, например, в разных реакциях нейтрализации
одно и то же значение теплового эффекта (57,3 кДж/моль) объясняется образованием малодиссоцнированных молекул воды из 

При смешении растворов NaCI и
тепловой эффект не наблюдается. Это объясняется тем, что химического взаимодействия между ионами 



Электролитическая диссоциация явилась основой успешного развития теории растворов и изучения процессов, протекающих в них.
В этом заключается ее большое значение в химии. Однако эта теория не объясняет процессов, протекающих в неводных растворах. Так, например, если хлорид аммония в водном растворе ведет себя как соль (диссоциирует на ионы 

Согласно этой теории
кислотами являются вещества, молекулы или ионы, отщепляющие при данной реакции протоны. Основаниями являются вещества, молекулы или ионы, присоединяющие протоны. Как те, так и другие получили общее название протолитов.
Реакция отщепления протона изображается уравнением
Кислота и основание такого процесса называются сопряженными. Это кислотно-основная пара. Например, ион 


Свободные протоны в растворах самостоятельно не существуют. Они переходят от кислоты к какому-либо основанию. Поэтому в растворе всегда протекают два процесса:
и равновесие между ними изображают уравнением
Например, реакцию нейтрализации уксусной кислоты аммиаком можно представить так:
Здесь уксусная кислота является кислотой (отдает протоны 


Аналогично можно изобразить проявление основных свойств азотной кислоты, растворенной в жидком фтороводороде:
Таким образом, из кислоты и основания всегда получаются новые сопряженные кислота и основание. Протолитическая теория рассматривает реакцию нейтрализации как переход протона кислоты к основанию.
Как видно, протолитическая теория расширила круг кислот и оснований по сравнению с представлениями теории электролитической диссоциации: ими могут быть и ионы. Одно и то же вещество в зависимости от того, с чем оно реагирует, может быть или кислотой, или основанием. Теория вскрыла относительность понятий о кислотах и основаниях и показала, что продукты их взаимодействия следует рассматривать как новые кислоты и основания. Протолитическая теория является современной и более общей теорией кислот и оснований.
Раствором называют жидкую или твердую гомогенную систему, состоящую из двух или большего числа исходных веществ (компонентов), относительное содержание которых в системе может изменяться в широких пределах.
Растворы и растворимость
Растворимостью называют способность вещества образовывать растворы — одни вещества могут растворяться друг в друге неограниченно; другие — только в ограниченных количествах или же практически не растворяться вообще. Растворимость конкретного вещества зависит от его природы и природы растворителя, а также условий, при которых происходит процесс растворения: температура, давление, наличие третьих веществ.
Растворение веществ в воде
Вода – основная биологическая жидкость, инертный растворитель для многих органических и неорганических веществ. Вода необходима для всех живых организмов (рис. 49). Поваренная соль (NaCl) хорошо растворяется в воде (рис. 50).
Способность веществ переходить в раствор называется растворимостью. На растворимость веществ влияют различные факторы.
Растворимость многих твердых веществ увеличивается при повышении температуры. Для газообразных веществ растворимость повышается с увеличением давления и уменьшается с повышением температуры. Растворимость жидких веществ зависит от их химической природы. Спирт и серная кислота неограниченно растворяются в воде, бензин и растительное масло с ней даже не смешиваются.
Любая природная вода является раствором. Воды Каспийского моря содержат 13 г/л, Черного – 19 г/л, Мертвого – 260 г/л различных солей. Содержание солей в Мертвом море очень велико, поэтому в нем нет жизни. Морская вода является многокомпонентным раствором, так как в ней растворены различные вещества.
Раствор – это однородная система, образованная несколькими веществами, между которыми происходят физические и химические взаимодействия.
Компоненты – это вещества, которые образуют раствор. Один из компонентов раствора – растворитель, другой – растворенное вещество (рис. 51).
При растворении веществ образуются насыщенные, ненасыщенные и перенасыщенные растворы. Раствор, который содержит максимальное количество растворенного вещества при данной температуре, называется насыщенным. В ненасыщенном растворе растворенного вещества содержится меньше, чем в насыщенном при данной температуре. А в перенасыщенном растворе растворенного вещества содержится больше, чем в насыщенном при данной температуре. Количественной характеристикой растворимости является коэффициент растворимости.
Коэффициент растворимости (S) показывает, какая максимальная масса вещества
может раствориться в 100 г (1000 г) воды при данной температуре (рис. 52). Растворимость
в воде выражается в граммах вещества на 100 или 1000 г воды (г/100 г 
Лабораторный опыт № 5
«Изучение растворимости веществ».
Цель: исследовать растворимость различных веществ в воде.
Ход работы
1. В три химических стакана налейте с помощью цилиндра определенный объем дистиллированной воды.
2. Испытайте растворимость трех веществ: 
Вопросы и задания
1. Сравните свои наблюдения по растворимости с табличными данными в конце учебника.
2. Влияние какого фактора на растворимость вы исследовали на данном опыте?
Практическая работа №4
Влияние температуры на растворимость твердых веществ
Цель: уметь рассчитывать растворимость вещества на 100 г воды, используя технику выпаривания, сравнивать полученные результаты со справочными данными.
Ход работы
1. Взвесьте на технических весах 10 г 
2. Налейте 20 мл дистиллированной воды в стакан, насыпьте соль, измерьте температуру.
3. Поставьте на асбестированную сетку и нагрейте до полного растворения, измерьте температуру.

4. Привяжите на стеклянную палочку нить и подвесьте над стаканом и охладите до комнатной температуры. Следите, чтобы нить висела вертикально посередине стакана.
Решение задач на тему: растворимость веществ
Обычно мы пользуемся водными растворами. Плотность воды 1 г/мл, поэтому масса воды численно равна объему.
Определение масс растворенного вещества и растворителя для приготовления насыщенного раствора при определенной температуре
Сколько граммов нитрата калия и воды потребуется для приготовления 500 г насыщенного раствора при температуре 30°C, если растворимость при этой температуре равна 45 г?
Расчет масс растворяемого вещества и  для приготовления насыщенного раствора по известной массе растворителя
для приготовления насыщенного раствора по известной массе растворителя
Сколько граммов нитрата свинца 


Расчет массы растворителя, необходимого для растворения определенной массы вещества при определенной температуре
Сколько воды потребуется для растворения 500 г нитрата калия 


Определение растворимости вещества выпариванием
При какой температуре раствор становится насыщенным, если выпарено 50 г воды из 500 г насыщенного раствора нитрата натрия при температуре 40°С (

Массовая доля растворенного вещества
Для обозначения соотношения растворенного вещества и растворителя в растворе используется понятие «концентрация».
Концентрация — это величина, определяемая количеством или массой растворенного вещества в единице объема или массы раствора.
Рассмотрим массовую долю растворенного вещества, или процентную концентрацию. В зависимости от количества растворенного вещества растворы подразделяются на
разбавленные и концентрированные. Концентрация веществ выражается массовой долей растворенного вещества в растворе и молярной концентрацией. Вначале рассмотрим процентную концентрацию или массовую долю растворенного вещества в растворе.
В разбавленных растворах количество вещества меньше, чем в насыщенных растворах, а в концентрированных – больше. Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе раствора. Она обозначается греческой буквой 
Если взять определенный объем раствора, то его массу можно выразить следующим образом:
где 
Тогда
Плотность раствора определяют с помощью ареометра (рис. 55, 56).

По этой формуле можно определить следующие величины:
Задача 1. Какова процентная концентрация раствора, если известно, что 20 г вещества содержится в 90 г раствора?
Задача 2. Определите процентную концентрацию раствора, полученного при растворении 45 г соли в 2200 мл воды 
Молярная концентрация вещества в растворе
Второй способ выражения концентрации – молярная концентрация.
Молярной концентрацией раствора (С) называется число молей растворенного вещества в одном литре раствора.
Преобразуя эту формулу, получим следующую формулу:
Молярная концентрация более точна, чем массовая доля растворенного вещества.
Растворы веществ с определенной молярной концентрацией готовят в специальной посуде (мерных колбах).
По формуле можно определить следующие величины:
Расчет молярной концентрации раствора
Задача 1. Рассчитать молярную концентрацию раствора гидроксида натрия, если 0,8 г вещества растворено в 100 мл раствора.
Задача 2. Определите молярную концентрацию, если 5,3 г карбоната натрия содержится в растворе объемом 0,5 л.
Расчет массы вещества, необходимой для приготовления раствора
Задача 3. Сколько граммов гидроксида калия потребуется для приготовления 250 мл раствора концентрацией 0,1 моль/л?
Практическая работа №5
Приготовление растворов с заданной процентной и молярной концентрацией
Опыт 1
Задание
Приготовить 150 г 5%-ного раствора сахара.
Ход работы
1. Вычислите, какая масса сахара потребуется для приготовления данного раствора.
2. Взвесьте эту массу на технических весах в предварительно взвешенном на технических весах стаканчике.
3. Рассчитайте объем воды для растворения взятой навески.
4. Отмерьте мерным цилиндром этот объем воды.
5. Вылейте воду в стакан, растворите в ней сахар, перемешивая раствор стеклянной палочкой.
Опыт 2
Задание
Приготовить 250 мл 0,25 молярного раствора поваренной соли.
Ход работы
1. Рассчитайте, какая масса поваренной соли потребуется для приготовления 250 мл 0,25 молярного раствора соли.
2. На предварительно взвешенном часовом стекле взвесьте рассчитанную в п. 1 массу соли на электронных весах.
3. Взятую взвешанную массу соли всыпьте через воронку в мерную колбу емкостью 250 мл и тщательно смойте дистиллированной водой с воронки оставшуюся на ней соль.
4. Долейте в колбу воду до метки, закройте пробкой и хорошо перемешайте.
5. Вылейте раствор в сухой цилиндр (узкий) и определите плотность.
Вопросы и задания
1. Какая концентрация более точная? Почему?
2. Как вы считаете, может ли плотность водного раствора быть меньше плотности воды?
Типовые задачи по теме «Концентрация растворов»
Массовые доли растворенного вещества
Массовая доля растворенного вещества – это отношение массы растворенного вещества m1 к общей массе раствора m, выраженное в процентах. Пример 1. Для лечения гипертонической болезни (повышенное давление) применяют 25%-ный раствор сульфата магния MgSO 4 . Это означает, что в 100 г такого раствора содержится 25 г MgSO 4 . Здесь выделено слово “раствора”.
Расчет массы вещества и массы растворителя, необходимых для приготовления раствора определенной концентрации
Сколько граммов соли и воды потребуется для приготовления 300 г 35%-ного раствора?
Расчет массы (объема) раствора по известной концентрации раствора и по массе растворенного вещества
Какой объем 14,3%-ного раствора можно приготовить из 30 г сульфата натрия? 
Расчет массы растворенного вещества по известной массе растворителя и концентрации раствора
Сколько вещества нужно растворить в 250 мл воды для приготовления раствора с концентрацией 12%?
Расчет объема раствора
Какой объем 0,3 молярного раствора гидроксида натрия можно приготовить из 3 г этого вещества?
Пересчет процентной концентрации раствора на молярную
Определите молярную концентрацию 40%-ного раствора серной кислоты плотностью 1,307 г/мл.
Расчет объема раствора процентной концентрации для приготовления раствора молярной концентрации
Рассчитать объем 20%-ного раствора соляной кислоты (r = 1,1 г/мл) необходимый для приготовления 0,5 литров раствора концентрацией 0,1 моль/л.
Расчётные задачи по уравнениям реакций с использованием концентрации раствора
Раствор – смесь, состоящая по крайней мере из двух компонентов – растворенное вещество, растворитель. Поэтому при решении задач по уравнению реакции необходимо рассчитать массу чистого вещества в растворе.
Задача 1
Рассчитать объем (н. у.) и количество вещества водорода по реакции взаимодействия цинка с 12%-ным раствором серной кислоты (r = 1,083 г/мл) объемом 50 мл.
Задача 2
Рассчитать объем раствора гидроксида натрия с концентрацией 0,25 моль/л, необходимого для нейтрализации 20%-ной (r = 1,12 г/мл) азотной кислоты объемом 25 мл. Сколько нитрата натрия образуется?
Способы изменения концентрации раствора
Существует несколько способов изменения концентрации раствора:
смешение двух растворов с известными концентрациями, разбавление или сгущение путем выпаривания и добавления растворенного вещества.
Определение концентрации раствора, полученного смешением двух растворов с известными концентрациями
Какова концентрация раствора, полученного смешением 400 г 10%-ного и 300 г 25%-ного растворов?

m (3) = m (1) + m (2) =400 + 300 = 700 г

m (общ.) = m (1) + m (2) = 40 + 75 =115 г

Определение концентрации раствора после разбавления
В лабораториях растворы нужной концентрации готовят путем разбавления концентрированных растворов.
К 500 г 15%-ного раствора соли добавили 200 г воды. Опре делите процентную концентрацию полученного раствора.


Определение концентрации после увеличения массы растворенного вещества в растворе
Концентрацию раствора можно повысить двумя способами:
1) добавлением растворенного вещества;
2) испарением части растворителя
а) Определите концентрацию раствора после добавления 30 г вещества к 250 г 5%-ного раствора.


растворе:
б) Определите процентную концентрацию раствора после испарения 200 г воды из 700 г 15%-ного раствора.


ДЕЛАЕМ ВЫВОДЫ
- 1. Растворы — однородные системы, состоящие из растворенного вещества и растворителя.
- 2. Вещества характеризуются растворимостью.
- 3. Растворимость зависит от агрегатного состояния вещества, температуры и давления (для газообразных веществ).
- 4. Концентрация растворов выражается массовой долей растворенного вещества и молярной концентрацией.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Определение и классификация
Растворимость веществ
Растворение:
- порошков
- кристаллических веществ
- смолистых веществ
- газообразных веществ
Определение и классификация
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
Классификация по характеру агрегатного состояния
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми. Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные
составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе.
Классификация по размеру частиц
В зависимости от размеров частиц растворы делятся на истинные и коллоидные. В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня, частицы растворенного
вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя.
Классификация по растворителю
В химической практике наиболее важны растворы, приготовленные на основе жидкого растворителя. Именно жидкие смеси в химии называют просто растворами. Наиболее широко применяемым неорганическим растворителем является вода. Растворы
с другими растворителями называются неводными.
Плотность раствора отличается от плотности растворителя. Раствор кипит при более высокой температуре, чем растворитель. Последним свойством пользуются, применяя солевые бани. Температура замерзания раствора, наоборот, ниже, чем у растворителя.
Вернуться к содержанию
Растворимость для различных веществ колеблется в значительных пределах и зависит от их природы, взаимодействия частиц растворенного вещества между собой и с молекулами растворителя, а также от внешних условий (давления, температуры
и т. д.). Растворимость твердого вещества можно повысить, если раствор нагревать. Однако некоторые соли не подчиняются этому правилу. Растворимость их или понижается с повышением температуры или повышается только до определенной
температуры, выше которой растворимость уменьшается.
Вернуться к содержанию
Скорость растворения твердого вещества зависит от размера его частиц. Чем крупнее куски, тем медленнее идет растворение; наоборот, чем мельче отдельные частицы твердого вещества, тем скорее переходит оно в раствор. Поэтому перед растворением
твердого вещества его всегда следует измельчить в ступке и отвешивать для растворения только измельченное вещество. Растворение тонко измельченного вещества значительно легче, но при этом возникают свои трудности. Дело в том, что
некоторые порошки при высыпании их в воду не смачиваются и плавают на поверхности воды, образуя тонкую пленку. В подобных случаях порошок вначале обливают небольшим количеством чистого спирта (метилового или этилового), а уже затем
приливают воду или высыпают в нее порошок. Явление всплывания порошка при этом не наблюдается. Само собой разумеется, что применять спирт можно лишь в том случае, если он не оказывает химического действия на вещество или на его
раствор. Спирта следует брать очень немного, лишь бы он только смочил порошок.
Вернуться к содержанию
Растворение кристаллических веществ
Иногда при растворении твердых веществ, например кристаллических, их помещают в колбу. При неправильном введении таких веществ (особенно крупных кусков или кристаллов) случается, что колба разбивается. Чтобы не разбить колбу, поступают
так: наклоняют ее под углом не больше 45° (лучше меньше) и опускают твердое вещество, чтобы оно скатывалось по горлу и стенке шара колбы. Удобнее сначала налить в колбу часть рассчитанного количества растворителя, например воды,
а затем вводить твердое вещество, как описано выше, иногда встряхивая колбу. Оставшуюся часть растворителя вводят после того, как будет пересыпано все количество твердого вещества, предназначенного для растворения.
Вернуться к содержанию
Растворение смолистых веществ
Большие трудности встречаются при растворении смолистых веществ, так как их размельчить в порошок нельзя. Такие вещества полезно разрезать (если это возможно) на небольшие куски и постепенно вводить в растворитель.
Растворение газообразных веществ
Почти все газообразные вещества способны в той или иной мере растворяться в воде или органических растворителях. Некоторые из них, например NH3, HCl, жадно поглощаются водой. Другие же газы (кислород, водород и др.) обладают
меньшей или незначительной растворимостью в воде, причем она зависит от температуры воды и внешнего давления. Поэтому воду для удаления растворенных в ней газов кипятят.
Вернуться к содержанию
Ссылка на источник
30.07.2021 12:06:59 | Автор статьи: Усачёва Вера


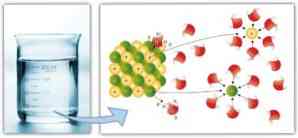






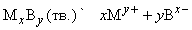
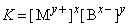
























































 для приготовления насыщенного раствора по известной массе растворителя
для приготовления насыщенного раствора по известной массе растворителя































































