Тема 2.урок№2. Атомы и молекулы.
Химические элементы.
Если бы я захотел читать, еще не
зная букв, это было бы бессмыслицей.
Точно так же, если бы я захотел
судить о явлениях природы, не имея
никакого представления о началах
вещей, это было бы такой же бессмыслицей.
М.В. Ломоносов
Цель урока: формирование понятия молекула, атомом, химический
элемент.
Задачи урока:
- дать понятие: молекула,
атом, химический элемент. - познакомить учащихся с
этимологическими началами названий химических элементов; - совершенствовать
умственную деятельность: умение анализировать, делать выводы, планировать
свою деятельность;
Оборудование:
плакаты, сахар, ступка с пестиком,
Тип урока: комбинированный.
Ход урока
1. Организационный момент.
Просто в один момент соединились
в одно целое мы,
Словно атомы в молекулу некую,
Атомы рвутся — их сложно сдержать
Вместе лететь, глубже дышать
Каждый твой выдох губами в меня
Слишком люблю, слишком тебя
Атомы рвутся на части опять
Вместе лететь, глубже дышатьI.Актуализация знаний учащихся.

молекулах

назад высказал мысль о том, что все тела в природе состоят из мельчайших
невидимых, непроницаемых, неделимых, вечно движущихся частиц – атомов. Слово
“атом” в переводе означает “неделимый”. Позднее, в средние века,
учение об атомах преследовалось религией, которая тормозила развитие науки в
целом, и химии в частности.
Учение о молекулах и атомах было разработано в середине
18 века великим русским ученым Михаилом Васильевичем Ломоносовым (1711
– 1765 гг.) Он утверждал, что тела в природе состоят из корпускл (молекул), в
состав которых входят элементы (атомы). Многообразие веществ ученый прозорливо
объяснял соединением разных атомов в молекулах и различным расположением атомов
в них. Удивительно верной и смелой для того времени была мысль М. В. Ломоносова
о том, что некоторые корпускулы (молекулы) могут состоять из одинаковых
элементов (атомов). Учение об атомах получило дальнейшее развитие в трудах
известного английского ученого Джона Дальтона (1766 –
1844 гг.).
2.практическое доказательство величины атома.
Атомы и молекулы
чрезвычайно малы: в любом крошечном кусочке вещества, который мы в состоянии
разглядеть (например, в пылинке) содержится больше атомов, чем звезд во всей
нашей Галактике.
Осознать значение
числа радиуса атомного ядра очень сложно. Например, радиус атома углерода равен
1,5–10 м. Возьмите карандаш (графит – это углерод), проведите
отрезок прямой линии длиной 3 см. (Учащиеся проводят линию).
Как вы думаете,
сколько атомов углерода содержится в проведенной вами линии?
Учащиеся дают
свои ответы.
Полученная линия
содержит 100 мл атомов углерода в длину и около 1 мл в ширину.
II. .
Изучение новой темы
1. Из истории изучения атомов и молекул
Люди давно
догадывались о том, что вещества состоят из отдельных мельчайших частиц. Их называют
атомами. Во многих случаях атомы не существуют по одиночке, а объединяются
в группы – молекулы.
Рассмотрим пример с
сахаром: Какими свойствами обладает сахар? (Учащиеся отвечают: растворяется
в воде, сладкий, белый). Представим, что крупинки сахара это молекулы. Раздробим
молекулы до атомов, (учитель растирает сахар в ступке, ученик по желанию ему помогает).
А сейчас смотрим, мы размельчили наши «молекулы», свойства сахара изменились? (Учащиеся
отвечают, что нет). Какой вывод мы можем сделать? (Учащиеся отвечают,
что свойства при измельчение не изменяются).
2.атомы и молекулы
Какое определение вы
дадите молекуле и атому? С химической точки зрения.
Дети дают
определения, потом записывают их в тетрадь: молекула — это наименьшая частица
вещества, определяющая его свойства и способная к самостоятельному существованию;
молекулы построены из атомов; атом – это мельчайшая неделимая частица вещества,
являющаяся носителем его свойств.

На плакате мы видим,
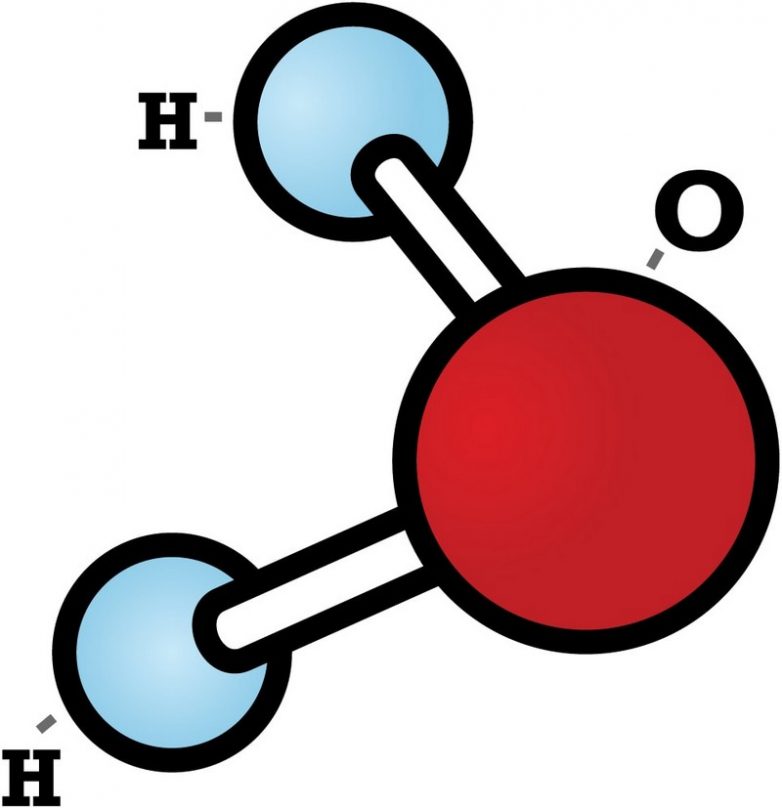
что молекула воды состоит из атомов двух видов. Это атомы водорода и кислорода.
Рассмотрев
изображение модели молекулы воды, какой мы можем сделать вывод?
Молекулы
состоят ещё из более мелких частиц – атомов. Например, наименьшая частица воды
– молекула воды. Она состоит их трех атомов: двух атомов Н – водорода и одного
атома О – кислорода. Знания об атомах сегодня в науке позволяют создавать новые
вещества с нужными для человека свойствами. Ученые доказали, что молекулы
разных веществ отличаются друг от друга, а все молекулы одного и того же
вещества — одинаковы. Молекулы воды одинаковы, молекулы углерода в графите и
алмазе одинаковы. А на вопрос: почему отличаются свойства этих тел, мы ответим
с вами на следующих наших уроках.
Так, молекула сахара — сладкая, а соли — соленая.
Мир молекул уникален и удивителен. Вот еще один
опыт. В мензурку нальём 10 мл воды и поместим в нее 10 г сахара. Объем сладкой
воды получился меньше 20 мл. Кто может ответить почему? Однако при этом масса
смеси в точности равна сумме масс воды и сахара.
Почему
же так происходит?
Воздушный шарик можно сжать без особого труда. Почему?
Между молекулами есть промежутки. Запишите в таблицу второе утверждение. Доказательствами
существования промежутков служат изменение объема
вещества, т.е. расширение и сжатие вещества при изменении температуры, и
явление диффузии. Молекулы вещества находятся в
непрерывном тепловом движении.
Посмотрите на то оборудование, которое у вас на парте, и подумайте, что из
этого оборудования вы могли бы использовать для доказательства второго
утверждения.
Вывод: все вещества состоят из молекул и между
молекулами есть промежутки!
Это интересно:
1.Если бы размер молекулы увеличить до
размера точки в конце предложения в книге, то
толщина человеческого
волоса стала бы равна 40 м, а человек, стоя на поверхности Земли, упирался бы головой в Луну !
2.Если из детского резинового шарика, надутого и
наполненного водородом (массой 3г), каждую секунду выпускать по 1 миллиону
молекул, то понадобится 30 миллиардов лет!
3.Если удалить пустые промежутки из всех атомов
человеческого тела, то все, что останется, сможет
пролезть через игольное ушко.
3.Химические элементы
В конце 17 столетия
английский ученый Роберт Бойль впервые использовал в науке понятие о химическом
элементе как составной части вещества. Он считал химический элемент – это
вещество, которое нельзя разложить на более простые. Более чем через 100 лет
другой английский ученый – Джон Дальтон связал понятие о химическом элементе с
атомной гипотезой о строении вещества. Определение, которое дал Дальтон, химики
используют и в наши дни.
Химический элемент –
это совокупность атомов определенного вида. (Дети записывают определение).
В природе найдено 89
различных химических элементов. Достижения ядерной физики позволили получить
ряд элементов искусственным путем. Поэтому в настоящее время изучено более 110
химических элементов. Каждый химический элемент имеет условное обозначение –
химический знак или символ, название.
В 1813 году Берцелиус
предложил для обозначения химических элементов использовать буквы латинского
алфавита. Система Берцелиуса очень проста. Химический элемент обозначают первой
буквой латинского названия элемента. В некоторых случаях к первой букве добавляют
еще букву с середины названия. Разработанными им знаками мы пользуемся до сих
пор. Знаки химических элементов читаются по определенным правилам. Некоторые
знаки читаются как буквы латинского алфавита. Исключение Н, который читают как
букву Франц. алфавита.
Предложение
Берцелиуса было принято всеми учеными, так как такие символы оказались очень
удобным: их легко написать в тетради и напечатать в книге, они понятны каждому
образованному человеку, независимо от того, на каком языке он говорит. Знаки 10
элементов читают как латинское название этих элементов. Знаки остальных
элементов читаются как русские названия.
Для обозначения
химических элементов используют одинаковые знаки во всех странах мира. Знаки
химических элементов вы можете найти во всех блицах периодической системы разных
стран.
Ребята обратите
внимание: калий и кальций, в название кальция есть буква «цэ», с которой и
начинается написание знака, в название калия ее нет. Магний и марганец. Натрий
и азот. (Обратить внимание на эти знаки их некоторые учащиеся путают)
Вопрос: Ученые древних времен считали, что как слова
состоят из букв, так и вещества состоят из элементов. Даже великий французский
химик Лавуазье принимал термины элемент и простое вещество как равнозначные.
Только Менделеев начал различать эти понятия. Что же такое химический элемент?
Ххимический элемент – это один атом или их совокупность.
4.
Знаки химических элементов
Внимание,
перед вами таблицы (раздаются таблицы).
| Название химического | Химический | Произношение |
| Азот | N | Эн |
| Алюминий | Al | Алюминий |
| Барий | Ba | Барий |
| Бор | B | Бор |
| Бром | Br | Бром |
| Водород | H | Аш |
| Железо | Fe | Феррум |
| Золото | Au | Аурум |
| Иод | I | Иод |
| Калий | K | Калий |
| Кальций | Ca | Кальций |
| Кислород | O | О |
| Кремний | Si | Силициум |
| Магний | Mg | Магний |
| Марганец | Mn | Марганец |
| Медь | Cu | Купрум |
| Натрий | Na | Натрий |
| Ртуть | Hg | Гидраргирум |
| Свинец | Pb | Плюмбум |
| Сера | S | Эс |
| Серебро | Ag | Аргентум |
| Углерод | C | Це |
| Фосфор | P | Пэ |
| Фтор | F | Фтор |
| Хлор | Cl | Хлор |
| Цинк | Zn | Цинк |
Внимательно прочитайте первую строку (по столбикам, один из
ребят – вслух).
Название – говорим русским словом.
Химический знак – одна большая латинская буква, либо одна
большая, одна малая.
Произношение – может быть разным.
Объяснение у доски:
Азот – знак «N» и читаем «эн».
Фтор — знак «F», читаем «фтор».
Медь – знак «Cu», читаем «купрум».
Задание. В вашей таблице 26 элементов. Ваша задача,
подсчитать, у скольких элементов название и произношение совпадают, и у
скольких они разные. Привести примеры.
Выполнение задания.
III.. Закрепление, тренаж.
1. На доске записаны химические формулы.
Попробуем применить полученные нами сегодня знания и
умения на практике.
Прочитаем эти формулы, если затрудняемся – «подглядываем» в
таблицу.
CuO, HCl, HNO3, AgSO4,
NaOH, SiO2, H2CO3,
CaCl2,
PbO2, MnO4, H2O,
CO2.
Чтение формул вслух (можно по очереди или по желанию).
2. Слово учителя. А теперь постарайтесь разгадать ребусы:
Ag,,ина — страна в Южной Америке.
C C — африканская муха.
B Mg,,,,шина — инструмент стоматолога.
,Br НК,,, – полевой цветок.
Ответы: Аргентина, цеце, бормашина, ромашка.
IV. Подведение итогов.
Слово учителя. Итак, вернёмся к нашим первоначальным
вопросам:
1. Как обозначают химические элементы? 2. Кто ввёл
химическую символику?
3. Зачем нужны знаки химических элементов? Знаем ли мы
ответы на эти вопросы? Ученики отвечают на вопросы. За лучшие ответы
выставляются оценки.
V. Домашнее задание.
§ 5
1. По таблице выучить знаки и их произношение.
2. Составить ребус или загадку при помощи химических
знаков (творческое задание – выполняется по желанию).
Статья «ПЕРВОНАЧАЛЬНЫЕ СВЕДЕНИЯ О СТРОЕНИИ
ВЕЩЕСТВА. ПОНЯТИЕ О МОЛЕКУЛЯРНОМ СТРОЕНИИ ВЕЩЕСТВА. Информационные
материалы и методические указания к уроку».
Как показали исследования, при изучении физики целесообразно
как можно более раннее изучение первоначальных сведений
о молекулярном строении вещества. В этом случае знания
учащихся о строении вещества будут активно использоваться,
пополняться и уточняться в процессе изучения всего
курса физики. При этом повышается научный уровень преподавания,
становится возможным не только описание явлений,
по и более глубокое их объяснение, что важно для формирования
научного мировоззрения учащихся.
Ориентировочно материал темы может быть распределен по
урокам следующим образом.
ПОНЯТИЕ О МОЛЕКУЛЯРНОМ СТРОЕНИИ ВЕЩЕСТВА
При изучении материала этой темы необходимо использовать
знания учащихся, полученные на уроках природоведения,
а также наблюдения школьников в повседневной жизни (изменение
объема тел при внешних механических воздействиях и
при изменении температуры, делимость вещества, распространение
запаха, растворимость некоторых веществ, испарение
жидкостей).
Необходимо рассказать ученикам, что развитие всей современной
техники немыслимо без знания строения вещества. Так,
для сооружения первого в мире советского «Лунохода-1» потребовались
особо легкие и высокопрочные материалы. Чтобы
успешно решить эту задачу, нужно было обладать специальными
знаниями о строении вещества.
Исследование проблемы полезно начать с анализа фактов,
хорошо известных шестиклассникам из повседневных наблюдений.
Ученики знают, например, что вода может существовать в
трех состояниях: твердом, жидком и газообразном. Перед
классом ставят вопрос: «Почему одно и то же вещество может
быть в твердом, жидком и газообразном состоянии?»
В связи с этим полезно рассказать о древнегреческих ученых,
которые, размышляя над подобными вопросами и наблюдая
различные явления природы, около 2500 лет назад пришли
к мысли, что все окружающие нас тела только кажутся нам
сплошными, а на самом деле состоят из мельчайших невидимых
глазу частичек, которые они называли атомами, т. е. «неделимыми».
Исходя из представления об атомном строении вещества,
древнегреческие ученые объяснили многие явления, в частности
такие, как испарение, распространение запаха некоторых веществ
и др.
В XVIII в. большой вклад в развитие учения о строении вещества
внес выдающийся русский ученый М. В. Ломоносов.
В своей работе «О нечувствительных частицах тел» М. В. Ломоносов
писал: «Металлы и другие тела растворяются в растворителях
и разделяются на очень малые части, которые не отделимы
от растворителей, но составляют с ними однородное
тело. Летучие тела рассеиваются по воздуху и исчезают в нем.
Горючие распадаются от действия огня в неосязаемые частицы».
Указав на ряд других опытных данных, М. В. Ломоносов
сделал смелый и правильный вывод: «Физические тела разделяются
на мельчайшие части, в отдельности, ускользающие от
чувства зрения, так что тела состоят из нечувствительных, физических
частиц»2.
На уроке целесообразно продемонстрировать окрашивание
2—3 л воды небольшим кристалликом марганцовокислого ка-
лия, распыление одеколона с помощью пульверизатора, растворение
сахара в воде.
Важно поставить опыты по деформации тел, по изменению
объема твердых, жидких и газообразных веществ при нагревании
и охлаждении.
В итоге все изложенное должно подвести учащихся к первоначальным
представлениям о том, что все вещества состоят
из молекул.
Следует обратить внимание учеников на то, что все молекулы
одного и того же вещества (воды, железа, меди) одинаковы,
а молекулы разных веществ отличаются друг от друга.
В целях большей наглядности можно показать модели молекул
различных веществ, изготовленных из пластилина или
глины. Рассказ о молекулах и атомах следует завершить показом
фотографий молекул веществ, полученных с помощью электронного
микроскопа (рис. 16-1 и 16-2).
Можно также сообщить учащимся, что современная наука
доказала сложность строения молекул, которые состоят из еще
более мелких частиц — атомов. Однако развивать в VI классе
эту мысль не представляется возможным. Поэтому далее все
внимание необходимо сосредоточить на изучении молекулярного
строения вещества и свойств молекул как мельчайших частичек
данного вещества.
Перед классом ставят вопрос: «Если все тела состоят из
отдельных частиц — молекул и атомов, то почему мы их не ви-
представляются
нам сплошными?» Причина,
как выясняют, в чрезвычайно
малых размерах молекул. Для
характеристики размеров молекул
полезно привести ряд образных
сравнений:
1) Если уложить в ряд сто
миллионов молекул воды, то получится
цепочка длиной всего
около 2 см.
2) Молекула водорода во
столько раз меньше яблока, во
сколько раз яблоко меньше земного
шара.
Перед учащимися ставят новый
вопрос: «Как молекулы расположены^
в телах?» В связи с
этим показывают опыт со смешением воды и спирта (рис. 16-3).
В этом опыте спирт можно заменить ацетоном или насыщенным
раствором сульфатаммония (удобрение). Смесь воды и
спирта имеет заметно меньший объем, чем сумма объемов воды
и спирта, взятых в отдельности. Это показывает, что между
молекулами воды и спирта есть промежутки.
П п к я з я т р л ь г т в п м наличия промежутков между молекулами
твердых тел может служить тот факт, что под большим давлением
(в ‘несколько десятков тысяч атмосфер)
Масло просачивается сквозь толстостенный стальной сосуд, в который
оно заключено, и мелкими капельками
выступает на наружной поверхности этого сосуда без разрушения его.
О наличии промежутков между молекулами
Газов говорит их большая сжимаемость.
В газах молекулы расположены
на расстояниях, значительно превосходящих
их собственные размеры, а з
жидкостях и твердых телах упаковка
молекул и атомов «плотная», подобная,
например, упаковке яблок в ящике. При
этом, однако, между частицами вещества
остаются промежутки.
Усвоению и закреплению материала
о строении вещества могут помочь следующие
задачи-вопросы:
Подводя итоги первого урока, делают следующие выводы.
Все вещества состоят из мельчайших частиц — молекул и
атомов. Размеры молекул чрезвычайно малы. Между молекулами
и атомами имеются промежутки. Молекулы одного и того
же вещества одинаковы. Молекулы различных веществ отличаются
друг от друга.
Использованная
литература:
Все твёрдые и осязаемые тела состоят из вещества, собранного в атомах и молекулах, но между частицами есть пространство, в котором как будто бы ничего нет. Если следовать этой логике, то окажется, что и сами атомы состоят из пустоты.
Внутри атомов находятся электроны — точечные частицы, которые не имеют размеров, а ядро атома примерно в 10 тысяч раз меньше самого атома. Выходит, что любой атом почти целиком состоит из пустоты — почти всё вещество атома сосредоточено в его ядре. Ядро, в свою очередь, состоит из нейтронов и протонов, а они сложены из ещё более элементарных частей, которые называются кварками. И кварки тоже не имеют размеров — это просто точки.
Подобные рассуждения исходят из неверных допущений. На самом деле пустоты не существует…
— на уровне микромира (одной триллионной доли миллиметра) есть как минимум три явления, которые делают размышления о пустоте бессмысленными.
Примерно так атом выглядит на самом деле — миниатюрное ядро в центре электронного облака, а между ними как будто бы ничего нет
Вещество не имеет чётких границ и вообще состоит из волн
Поведение молекул, атомов и отдельных частиц вроде нейтронов и протонов описывает квантовая механика со своими законами. Одно из основных правил квантовой механики — принцип неопределённости Гейзенберга. В вольной трактовке он звучит так:
“Нельзя с одинаковой точностью узнать местонахождение частицы и её скорость. Чем больше определена скорость частицы — тем более размыто её местоположение, и наоборот.”
Это ограничение фундаментально, оно не зависит от качества измерительных приборов. Чтобы как можно точнее определить скорость частицы — нужно пронаблюдать за ней какое-то время. В таких условиях о местоположении частицы можно сказать лишь «ну, её можно обнаружить где-то в этой области».
Принцип неопределённости — следствие двойственной природы любых частиц вещества. Тот же электрон — одновременно и частица, и волна. Как всякая волна, он «размыт» в пространстве. Поэтому в атоме его изображают не точкой, а целым облаком. Там, где яркость облака ниже — электрон находится реже, но вероятность его нахождения там никогда не равна нулю.
Когда атомы собраны в молекулы, их электронные облака могут пересекать и перекрывать друг друга. Так что невозможно с уверенностью говорить о том, что между атомами — абсолютно пустое пространство. Там всегда может оказаться электрон. Принцип неопределённости может «забрасывать» его даже в самые «неудобные» области, просто вероятность этого крайне мала.
Электронные облака атома водорода на разных уровнях энергии электрона
Существуют «фотографии» и даже целые «видеозаписи» атомов, где они выглядят как чётко очерченные шарики. Но это не настоящие изображения атомов как они есть, а всего лишь визуализации, построенные на собранных данных. На таких визуализациях местоположение и границы атомов всегда изображаются «в среднем». Иначе понятная картинка превратилась бы в расплывчатую кашу.
Чем масштабнее вещественное тело — тем определённее его границы и местоположение. Поэтому отдельная частица может «заполнить собой» целую комнату (и даже Вселенную, это не запрещено), а тела, которые состоят из огромного числа частиц (стулья, машины и дома), не расплываются и занимают вполне конечное и определённое место.
Впрочем, даже большие тела не избавлены от квантовой «расплывчатости», просто их волновая составляющая так сильно сокращается, что становится незаметной. Но её можно засечь высокоточным оборудованием. Так, в обсерватории LIGO с помощью лазеров учёные зафиксировали квантовое «дрожание» 40-килограммового зеркала — оно колебалось в пределах одной миллионной одной миллиардной миллиметра.
Виртуальные частицы — «клей» мироздания
Пусть электрон с ненулевой вероятностью может проявиться где угодно — всё-таки в атоме есть «тёмные» области, где вероятность нахождения электрона крайне мала. То есть, в этих областях большую часть времени нет никаких электронов, как и протонов, как и нейтронов. Значит, там абсолютно пусто?
И снова нет. Даже в самой «тёмной» области между ядром атома и его электроном есть нечто вполне материальное — «привязь», с помощью которой ядро удерживает электрон в атоме. Эта «привязь» — поток виртуальных фотонов, которые безостановочно снуют между ядром и электроном.
Виртуальные частицы так называются, потому что их нельзя зафиксировать напрямую. Они слишком быстро исчезают, распадаясь или превращаясь в другие частицы примерно за одну триллионную одной триллионной доли секунды. Расстояние, на которое они успевают переместиться, сравнимо с их «расплывчатостью» из-за принципа неопределённости. Это позволяет виртуальным частицам нарушать некоторые законы физики.
«Нормальные» частицы вроде реальных электронов и фотонов подчиняются базовым законам физики — их импульсы однозначно связаны с энергией, а энергию они не могут брать из ниоткуда. Но виртуальные частицы могут появляться сами по себе вопреки закону сохранения энергии, могут иметь отрицательную или мнимую массу. Всё это — полная бессмыслица с точки зрения физики. Тем не менее, есть масса признаков существования виртуальных частиц.
Эти «неправильные» частицы поистине вездесущи — они безостановочно рождаются и тут же исчезают во всех точках пространства: и между атомами, и внутри атомов, и даже внутри микрочастиц. Более того, они успевают «передать информацию» от одной реальной частицы к другой, если те находятся достаточно близко. Как в случае с электроном и протоном в ядре атома.
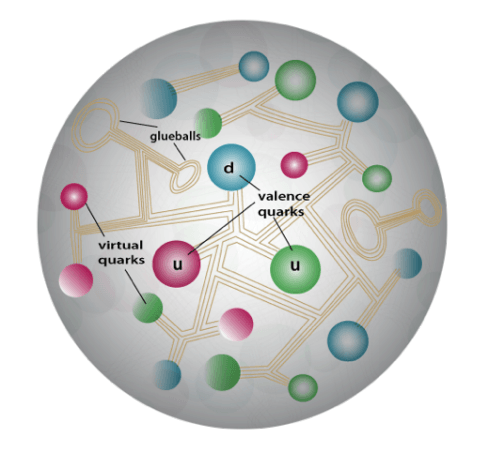
Схема строения протона — реальные кварки, виртуальные кварки и виртуальные глюоны. Численные масштабы не соблюдены
Внутри самого протона роль виртуальных частиц становится ещё более заметной. Протон состоит из кварков — фундаментальных частиц, которые скреплены между собой «клеем» из виртуальных глюонов, частиц-переносчиков сильного взаимодействия. Там же, прямо внутри протона «бушует море» виртуальных кварков, которые постоянно появляются и исчезают, внося некоторый вклад в массу протона.
Существование таких частиц может показаться странным и неестественным: как что-то природное может нарушать законы самой же природы? Причина — в принципе неопределённости. На очень малых расстояниях и промежутках времени некоторые физические пропорции могут «сломаться», потому что энергия, масса, импульс как бы не успевают принять определённых значений.
Весь мир как возмущения квантовых полей
Двойственность материи, где электрон или фотон одновременно частица и волна, может показаться очень надуманной и неуклюжей концепцией. Это вина квантовой механики: при всей математической точности она довольно плохо описывает суть материи, потому что пытается «скрестить ежа с ужом» — классическую (макроскопическую) картину мира с микроскопической.
Но можно «спуститься на уровень ниже» и перейти к квантовой теории поля — она полностью отметает классические представления о реальности. В этой теории уже нет частиц как отдельных точек или очень маленьких шариков. Всё существующее здесь представлено в виде квантовых полей, а любые частицы — лишь как возмущения этих полей, локальные всплески энергии.
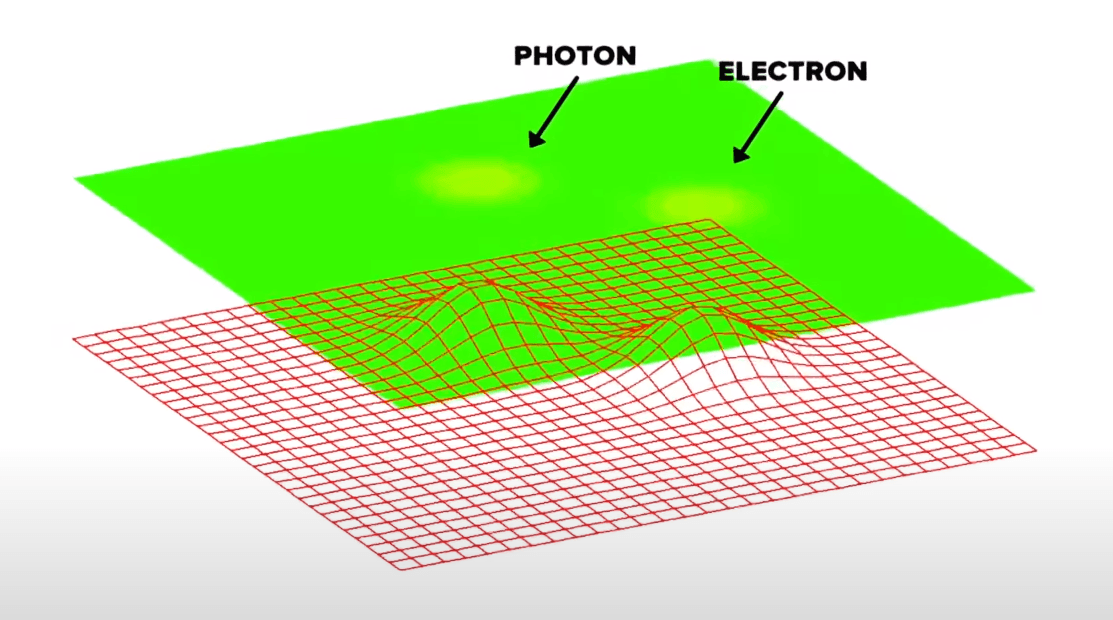
Фотон и электрон как возмущения квантового поля
В таком случае, идея абсолютной пустоты отпадает как несостоятельная, даже если закрыть глаза на неопределённость положения реальных частиц и на постоянное «бурление» виртуальных частиц. Любое квантовое поле — совершенно монолитная материальная сущность, которая заполняет собой каждую точку пространства и имеет в каждой точке ненулевую энергию — энергию вакуума.
Такой подход позволяет иначе взглянуть на существование виртуальных частиц. Из-за принципа неопределённости поля постоянно колеблются, создавая иллюзию рождения частиц. Далеко не всегда это нормальные, полноценные частицы. Как правило, колебания полей порождают «дефективных уродцев» с «поломанными» свойствами. В нашей Вселенной такие частицы долго не живут — они-то и называются виртуальными.
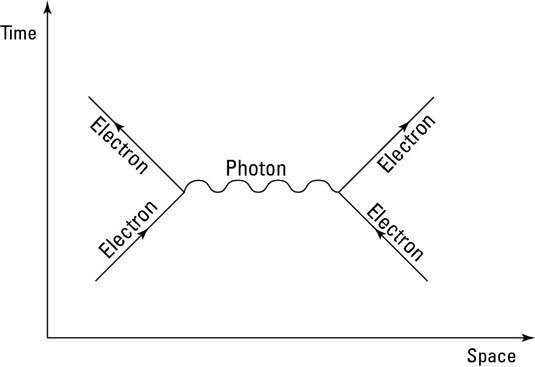
Типичная диаграмма Фейнмана, которая изображает взаимодействие двух электронов через обмен виртуальным фотоном. Как правило, волнистыми линиями на таких диаграммах обозначаются только виртуальные частицы Изображение Dummies
Чем ближе свойства рождённой частицы к «физическому идеалу» — тем дольше она живёт. Тем частицам, что называются реальными, просто повезло иметь нормальные, пропорциональные свойства, которые соответствуют законам физики. Поэтому разница между реальными и виртуальными частицами — чисто количественная. По сути, всё это одно и то же, только первые проходят «естественный отбор», а вторые — нет.
Материя везде, пустоты не существует
Квантовые поля буквально «вшиты» в само пространство и заполняют его. В каком-то смысле, это и есть настоящая, фундаментальная материя нашей Вселенной. То, что люди привыкли видеть в повседневной жизни — лишь волновая «рябь» квантовых полей. Считать, что между частицами ничего нет — всё равно, что смотреть на горные вершины и думать, что между ними бесконечная пустота, только потому что пелена облаков скрывает землю внизу.
Понятие пустоты в физике вообще довольно условно, что демонстрирует эффект Унру. Его описание гласит: если начать достаточно быстро ускоряться, то из «пустоты» внезапно появятся частицы тёплого газа. То есть, «пустотность» окружающей среды зависит от ускорения наблюдателя, что совсем уж непривычно и полностью противоречит человеческой интуиции.
И пусть эффект Унру до сих пор не подтверждён на опыте — он хорошо показывает, насколько беспомощными могут быть попытки человека судить о пустоте и материи за пределами своей повседневной реальности, которая составляет очень и очень небольшую часть Вселенной.
источник
Просмотрено:
391
Предмет
химия
Класс 8
Дата
Тема учебного занятия
«Атомы, молекулы и ионы»
Цель и задача учебного занятия
Сформировать представления о строении атома. Объяснить различие между атомом, молекулой и ионом.
Основные понятия
Атом, молекула, ионы, протоны, нейтроны, электроны.
Тип и форма учебного занятия
урок – изучение нового материала
Планируемые образовательные результаты
Предметные
Метапредметные
Личностные
Понимать смысл понятий «атом», «молекула», «ион». Знать, как устроен атом.
Формировать умение преобразовывать текстовую информацию в схему.
Формировать мировоззрение, соответствующее современному уровню развития науки.
Основные виды деятельности учащихся
Работать с текстом, находить в нём ответы на заданные учителем вопросы, схематично изображать строение атома на основе словесного описания. Готовить презентации по теме урока.
Технологии обучения или элементы технологий
Технология развития критического мышления, игровые технологии, проблемно- развивающее обучение, здоровьесберегающие технологии, ИКТ
Средства обучения, дидактическое обеспечение урока
проектор, презентация, интерактивная доска, учебник, рабочая тетрадь, ПСХЭ
Организационная структура урока
Этапы урока
Деятельность преподавателя
Деятельность учеников
I. Организационный момент
Приветствие учеников. Выявление отсутствующих. цели и задач урока, этапов урока и времени каждого этапа.
Настраивание на восприятие материала урока.
II. Актуализация знаний
Повторите из раздела физики «Первоначальные сведения о строении вещества».
Какими опытами можно доказать, что существуют атомы и молекулы?
Отвечают на вопросы учителя
III. Постановка проблемы урока
(мотивация и целеполагание)
Итак ребята , мы повторили первоначальные сведения о строении вещества. Как вы думаете из чего состоит все что нас окружает?
Учащиеся выдвигают гипотезу и формулируют тему?
Отвечают на вопросы учителя
Выдвигают гипотезы, предположения, определяют тему и цели урока.
IV. Изучение нового материала
Изучение нового материала начинается с первоначальных представлений об атомах и молекулах.
Древнегреческим философом Демокритом (2500 лет назад) был введён термин «атом», что означает «неделимый». Ломоносов утверждал, что вещества состоят из корпускул (молекул), в состав которых входят элементы (атомы). Давайте рассмотрим рис. 14 учебника – разложение воды электрическим током.
Молекула воды, состоящая из двух атомов водорода и одного атома кислорода, при пропускании электрического тока распадается. Из двух молекул воды образуется одна двухатомная молекула кислорода и две двухатомные молекулы водорода.
Учащиеся рассматривают схематичное изображение этого процесса в учебнике (с. 26).
Определения: молекулы – это мельчайшие частицы многих веществ, состав и химические свойства которых такие же, как у данного вещества.
Атомы – это мельчайшие химически неделимые вещества.
Основные заслуги в развитии атомно-молекулярных представлений принадлежат английскому учёному Дж. Дальтону.
Учащиеся продолжают работу с учебником: ищут ответ на вопрос, какие вещества состоят из отдельных атомов.
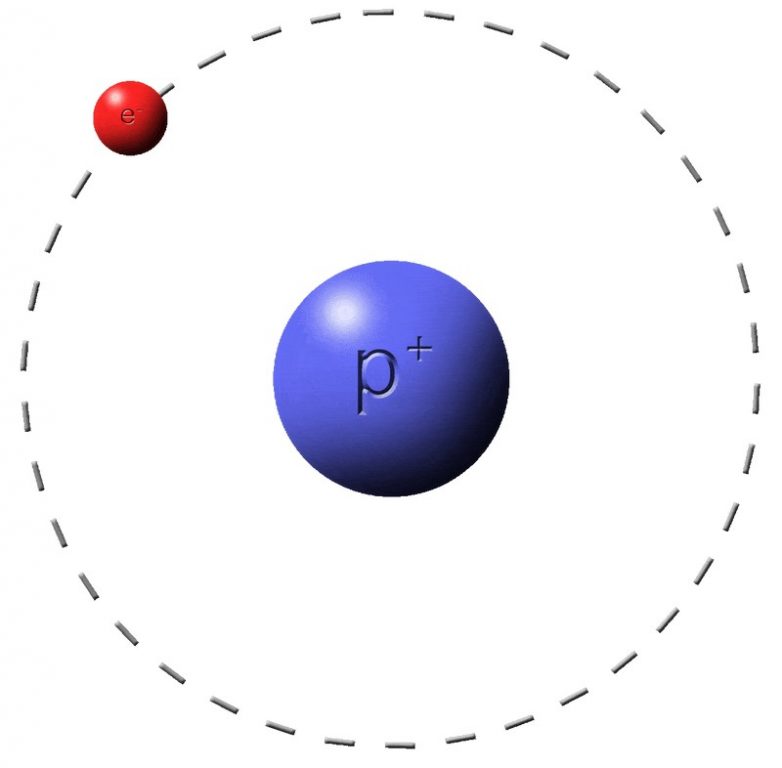
Строение атома: в центре атома находится положительно заряженное ядро, вокруг которого находятся отрицательно заряженные электроны. Внутри ядра находятся положительно заряженные протоны и нейтральные – нейтроны.
Атом — это нейтральная частица, если число протонов в нём равно числу электронов. Что же произойдёт, если атом потеряет либо приобретёт один или несколько электронов? Учащиеся должны сделать вывод, что нейтральный атом превратится в заряженную частицу (положительную или отрицательную).
Определение: если атом теряет или приобретает один или несколько электронов, то он превращается в заряженную частицу ИОН.
Работают в тетради, с учебником
V. Закрепление изученного материала
1. Верны ли следующие суждения о молекулах?
А) молекулы являются химически делимыми частицами.
Б) молекулы состоят из атомов.
2. Установите соответствие между названием элементарной частицы и её зарядом:
1) протон а) -1
2) нейтрон б) +1
3) электрон в) 0
Работают на местах
VI. Рефлексия
Попробуем подвести итоги. Основные выводы:
- Что такое атом и молекула? Чем они различаются?
- Что такое ион? В каком случае атом превращается в ион?
- В каком случае атом электронейтрален?
- Какие элементарные частицы входят в состав ядра?
Итак, ребята. Над какой темой мы сегодня работали? Поделитесь своими впечатлениями об уроке. Что вы нового узнали? Что хотели бы узнать? Что вызвало затруднения?
Участвуют в эвристической беседе.
VII. Итоги урока
Выставление оценок. Домашнее задание: п. 7, с. 25 – 27, с. 28, упр. 2,4,5,8. Подготовить презентацию по теме: «Роль Ломоносова и Дальтона в создании атомно – молеклярного учения».
САМОАНАЛИЗ
Тему сформировали учащиеся правильно. Была поставлена цель и задачи . Цель и задачи были достигнуты.
Планируемые результаты: Предметные – закрепили. Метапредментные – связь с физикой установлена. Личностные — сформированы.
Все разнообразие нашего мира построено из атомов и молекул. Удивительно, как проявления форм жизни образовались лишь на основе протонов, нейтронов и электронов. Элементарная основа позволяет каждому веществу и организму выполнять свою функцию. Так из семи нот пишется музыка разных направлений, разных стилей. Мы собрали 10 самых интересных фактов об атомах и молекулах.
Самый легкий из атомов – атом водорода
В периодической таблице химических элементов водород стоит на первом месте. Его ядро состоит лишь из одного протона, вокруг которого вращается единственный электрон. Простейшее строение определяет минимальную массу, которую может иметь атом – 1,008 а.е.м. или 1,7х10-24 г.
На Земле водород существует в виде соединений с другими веществами или образует двухатомную молекулу Н2. Если считать в массовом отношении, на его долю приходится 1% земной коры. Если перевести массу в количество атомов, то содержание водорода окажется более внушительным – 17%. Этот показатель ставит элемент на второе место после кислорода (52%).
Во Вселенной водород составляет 88,6% от общей доли атомов, находящихся в космосе в виде звездного вещества и космической пыли.
Главной молекулой живой природы является молекула ДНК
В молекуле ДНК сосредоточена информация о строении каждой клетки живого организма, словно это проектное бюро города, где собраны подробные планы всех зданий. Внешне она напоминает перевитую веревочную лестницу, состоящую из двух нитей и соединенную водородными связями. ДНК вирусов может представлять одну цепочку.
Информация зашифрована в генах, то есть участках молекулы. Ген представляет собой определенную последовательность нуклеотидов, способных передать код для построения белков и РНК (информационных, транспортных, рибосомных, матричных).
Спираль ДНК человека, если ее вытянуть, протянется почти на 2 м. Это тем более удивительно, что она умещается в ядре размером меньше микрометра. Свернуться в компактную хромосому молекуле помогают нуклеосомы. На них ДНК наматывается, как на катушку.
Пыль – это частица, состоящая из квадриллиона атомов
Пылью называют твердые минеральные или органические частицы размером не более 0,05 мм. Природа образования может быть как естественной, так и связанной с деятельностью человека (антропогенной). В воздух поднимаются вулканический пепел, морская соль, сухая почва, продукты горения после пожаров, пыльца растений. Человек способствует загрязнению воздуха продуктами отопления и горных разработок, выхлопами автотранспорта, удобрениями. Вспашка земли и оголение почвы выкосами травы опасны выветриванием и переносом верхнего слоя грунта ветром.
Если сравнивать твердую взвесь с газообразными загрязнителями воздуха, то последние присутствуют в виде отдельных молекул. Пыль же в каждой частице содержит огромное число молекул и еще большее число атомов.
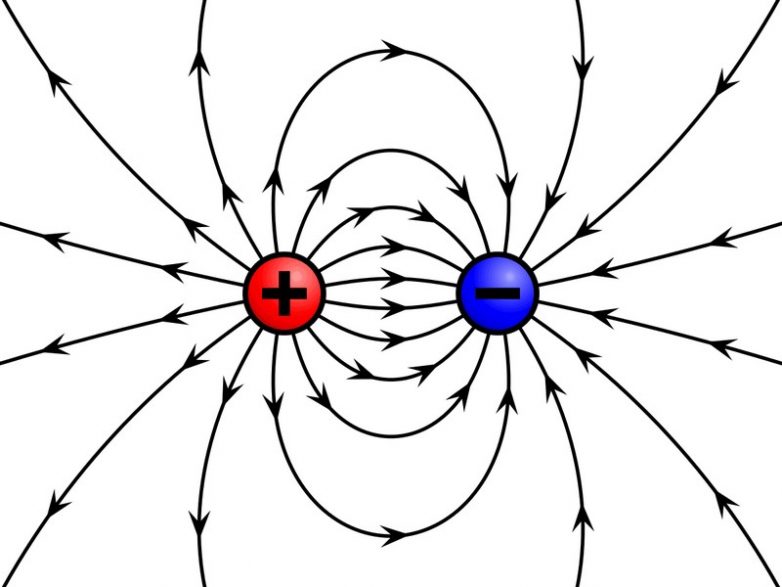
Атом может иметь электрический заряд
В составе атома электроны несут отрицательный заряд, протоны – положительный. Нейтроны не имеют заряда, то есть нейтральны. Когда количество протонов равно количеству электронов, заряд атома равен нулю. В случае, если электронов больше или меньше, чем протонов, у атома появляется заряд. Он становится ионом.
Ядро, состоящее из нейтронов и протонов, обладает ощутимой массой. Нужно определенное количество энергии, чтобы заставить его терять протоны. Электроны, которые вращаются вокруг него, значительно легче могут перемещаться от одного атома к другому. Добавление электронов приводит к образованию отрицательного заряда, потеря частиц – положительного. Атомы с положительным зарядом называют катионами, атомы с избытком электронов становятся анионами.
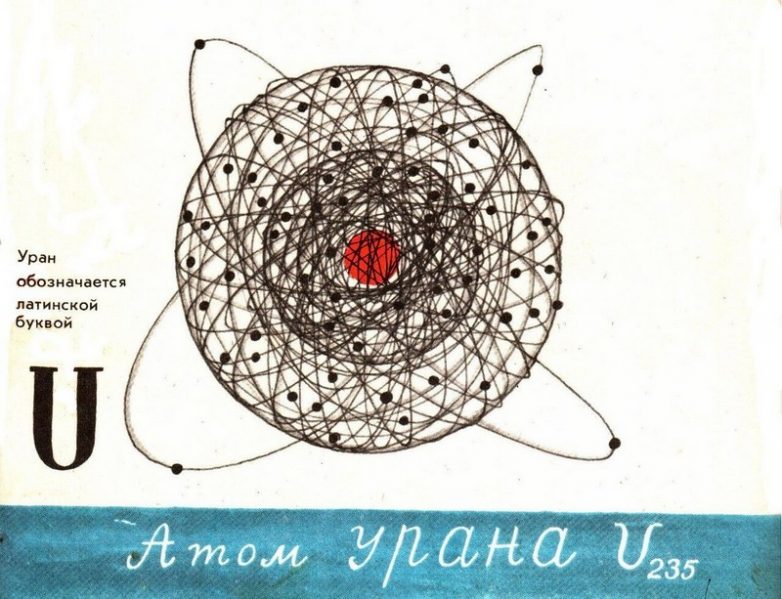
Самый тяжелый из атомов – атом урана
Из природных элементов атом урана имеет самую большую массу – 238,0289 а.е.м. В природе находится в основном в виде изотопа U-238. Атом с его 92 протонами чрезвычайно перегружен, при любой возможности выбрасывает протоны и нейтроны с огромной скоростью.
Открыл элемент германский химик Мартин Клапрот в 1789 году при анализе отработанной руды после добычи серебра. «Странное вещество», похожее на металл было диоксидом урана, но выяснилось это только через 50 лет. Клапрот назвал находку в честь далекой планеты, открытой к этому времени Гершелем.
В конце 19 века во Франции Анри Беккерель обнаружил радиоактивность урана, то есть способность терять частицы. Распад может иметь 14 циклов. Уран превращается в радий, радон и другие элементы, образуя на последней стадии свинец.
Слово «атом» происходит из древнегреческого языка и означает «неделимый»
Еще в Древней Греции философ и математик Демокрит предположил, что окружающее состоит из мельчайших частичек. Отсюда произошел термин «атом» или «atomos». Однако подтверждение теория получила только в результате работы ученых в последние 150 лет и с помощью изобретенного микроскопа.
Первое исследование провел англичанин Джон Дальтон на рубеже 18-19 веков. Он установил, что химические элементы вступают в реакции в строго определенном соотношении (закон кратных отношений).
Сейчас мы знаем, что атом представляет собой наименьшую частицу химического элемента и не всегда является неделимым. В состав атома входит ядро с протонами и нейтронами или просто нуклонами от латинского слова «nucleus» – ядро. Снаружи вокруг атома расположено электронное облако.
Стекло не является твердым телом
Твердость вещества – характеристика, основанная на прочности химических связей между атомами и молекулами. В жидкости частицы могут перемещаться относительно друг друга. В твердых телах они лишены такой возможности.
При производстве стекла молекулы кремния, обычно принимающие структуру кристаллической решетки, не успевают занят положенное им место. Стекло быстро остывает и частицы остаются перемешанными хаотично. Такое вещество называют аморфным, однако все же оно твердое.
Вязкость стекла сопоставима с вязкостью свинца, но ведь свинец никто не называет жидкостью. Бытует мнение, что со временем оконные стекла «стекают» вниз. В пример ставят витражи в средневековых храмах. Следует уточнить, что утолщения в их основании появились не с течением времени, а были изначально. Причина кроется в несовершенстве технологии производства.
Молекула меньше яблока во столько же раз, во сколько яблоко меньше Земли
Чтобы представить видимые и невидимые параметры окружающего мира, представим все молекулы одного кубического сантиметра воздуха в виде кирпичей. Их количества хватило бы для покрытия поверхности планеты на высоту 40-этажного дома.
Размеры молекул и атомов настолько малы, что в решении задач молекулярной физики используют относительные величины. Установить их удалось лишь с изобретением электронного микроскопа. Средний диаметр атома и простейшей молекулы составляет порядка 10-10 м. Так, размер молекулы белка – 43х10-10 м. Крупные молекулы достигают 10-7 м.
В ионный микроскоп можно разглядеть строение кристалла и даже определить межатомные расстояния.
Ученые смогли охладить молекулы монофторида стронция практически до абсолютного нуля
Выбор пал на монофторид стронция (SrF) неслучайно. Принцип охлаждения атомов основан на периодическом повторении поглощения и испускания фотонов под воздействием лазера. Таким образом атом теряет кинетическую энергию. Молекулы не настолько чувствительны. Мешает колебательная и вращательная энергия межатомных связей. У фторида стронция эти явления минимальны.
Группа ученых Йельского университета во главе с Д. Демиллем добилась охлаждения молекулы до 300 мкК (0,0003 К). За счет подобранной длины волны лазер погасил вращательные межатомные движения. В дальнейшем молекулы вели себя аналогично атому.
Практически такое достижение в перспективе можно использовать в квантовых компьютерах.
Скорость движения молекул воды может достигать 650 м/с
Молекулы воды находятся в постоянном тепловом движении. Они колеблются с большой частотой (одно колебание за 10-12 … 10-13 с) возле определенного положения, изредка прыгая на освободившееся соседнее место. Скорость движения при этом может приближаться к 600-650 м/с.
И все же молекулы не разлетаются, остаются жидкостью. Происходит это за счет водородных связей. В молекуле H2O пары электронов смещены в сторону кислорода. Водород, оставшийся практически без электрона, представляет собой положительно заряженное ядро. В результате протон водорода притягивает соседние атомы кислорода, образуя прочную межмолекулярную связь.
Благодаря такому сцеплению вода в условиях Земли принимает в основном жидкое состояние, а не кипит как аналогичные гидриды (серы, селена) при –80°С. Водородные связи определяют физические и химические свойства воды, на которых основана жизнь на нашей планете.