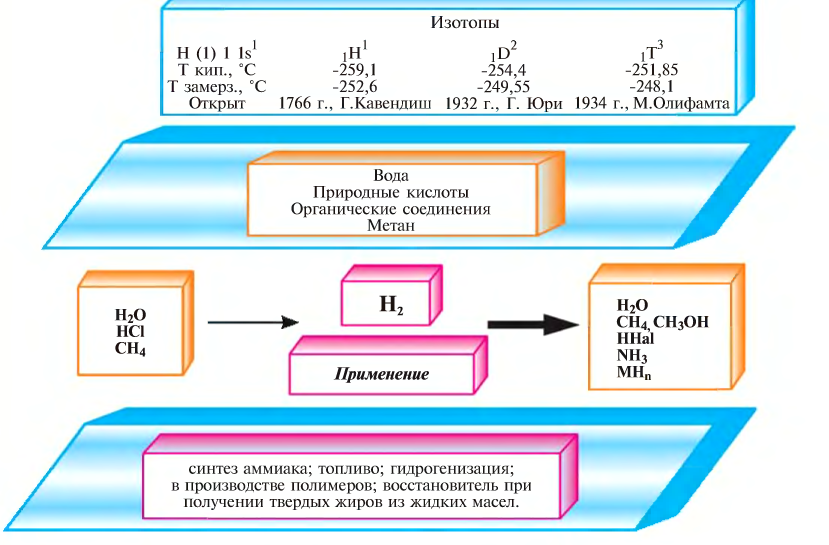
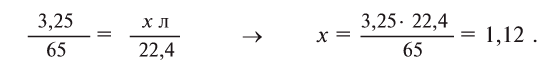
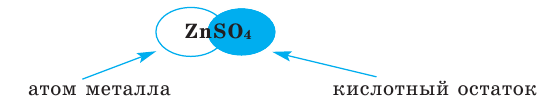
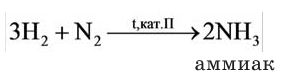
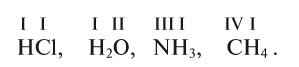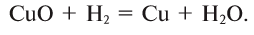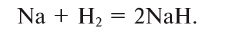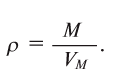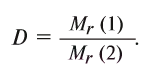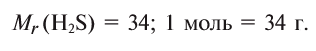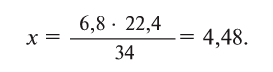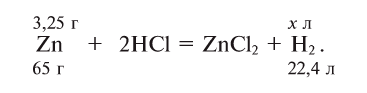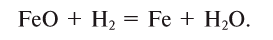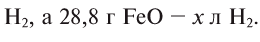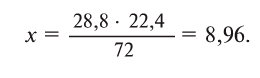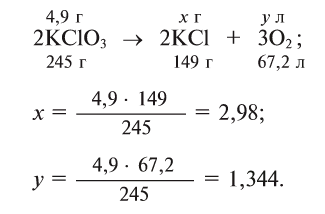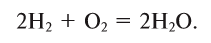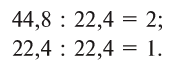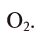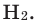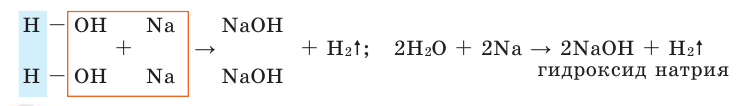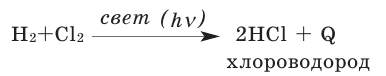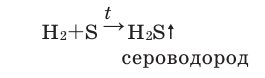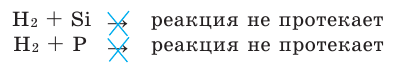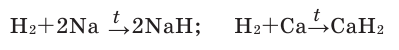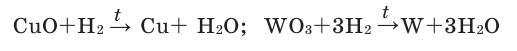Содержание:
- Движение электронов в атомах
- Распределение электронов в атомах
- Электронные формулы атомов
- Образование ионов
- Составление формул соединений
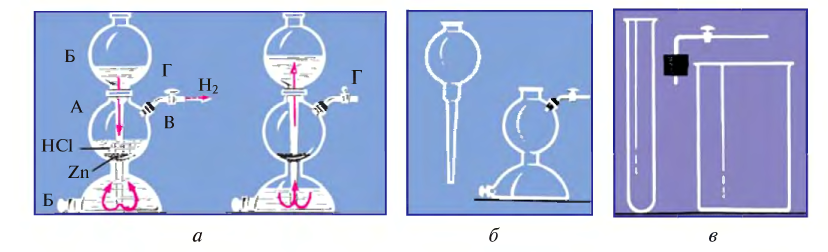
Движение электронов в атоме — это когда электрон в атоме находится в постоянном движении вокруг ядра. Но у такого движения отсутствует определенная траектория. Это выглядит примерно так, как показано на рисунке снизу. В каждый момент времени электрон находится в определенной точке околоядерного пространства.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Движение электронов в атомах
Электронное облако — модель движения электрона в атоме; область пространства, в каждой точке которой может находиться данный электрон. … Размер зависит от энергии электрона. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Распределение электронов в атомах
Вспомните! Атом, молекула. Строение атома
Из курса 7 класса мы узнали, что атом является сложной системой, состоящей из ядра и электронов (рис. 1). Выясним теперь закономерности расположения электронов вокруг ядра. Число электронов равно заряду ядра атома (атомному номеру элемента). Однако
электроны притягиваются к ядру не с одинаковой силой, так как обладают различным запасом энергии и поэтому находятся на разном расстоянии от ядра.
Электроны с близкими значениями энергии располагаются на одинаковом расстоянии от ядра. Эти расстояния называются энергетическими уровнями. Их обозначают буквой n и нумеруют по мере удаления от ядра: 1, 2, 3, 4, 5, 6, 7. Значение n определяется номером периода, в котором расположен элемент. Максимальное число электро-
нов на каждом энергетическом уровне (емкость энергетического уровня)
определяется формулой 
энергетического уровня. Если n = 1, N = 2; n = 4, 
Электроны, расположенные ближе к ядру, сильнее притягиваются к
нему. По мере отдаления от ядра энергия связи уменьшается. Радиус r показывает удаленность каждого энергетического уровня от ядра.
Электроны заселяют пространство вокруг ядра поэтапно, образуя энергетические уровни (рис. 2). Почему так важно знать, как располагаются электроны в атоме? Потому что от строения электронных оболочек элемента зависят его физические и химические свойства (табл. 1). Потому что при непосредственном участии электронов атомов происходят образование и разрыв химических связей, т. е. протекают химические реакции. Скорость движения электрона очень велика, и определить его положение в пространстве в определенный момент времени невозможно. В одном месте пространства его можно обнаружить часто, в другом – редко. Область пространства, в которой вероятность нахождения электронов максимальна, называется электронным облаком, или орбиталью (s, p, d, f).
Форма электронных облаков различная: сферическая обозначается буквой s (s-облако); гантелеобразная – р-облако, причем р-облака ориентированы взаимно перпендикулярно вдоль трех осей x, y, z (рис. 3).
s-oблако может располагаться в пространстве симметрично точке пере-
сечения осей координат, поэтому его обозначают одной ячейкой 
может располагаться вдоль трех осей x, y, z, поэтому их обозначают
или тремя ячейками 
Электроны вращаются не только вокруг ядра, но и вокруг своей оси, как
Земля вокруг Солнца и своей оси.
Вращение электрона вокруг своей оси называют спином (от англ. spin – волчок). Электроны могут вращаться по часовой стрелке или против нее. На каждой орбитали могут располагаться только два разнонаправленных электрона. Поэтому при составлении электронно-графических формул атомов электроны изображают в ячейке двумя разнонаправленными стрелками
Электронное облако, энергетический уровень, электронная формула, ячейка, спин.
Электронные формулы атомов
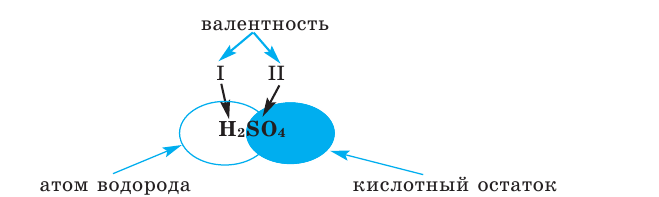
Теперь перейдем к рассмотрению электронных формул атомов. Начнем с первого элемента в таблице Менделеева – атома водорода. У атома водорода имеется один электрон, который расположен на s-подуровне первого энергетического уровня, поэтому электронная формула атома водорода 

В Периодической системе атомы водорода и гелия расположены в 1-м периоде, т. е. у этих элементов запас энергии электронов одинаковый, поэтому они находятся на одном энергетическом уровне. Согласно формуле 
Следующий: литий – элемент 2-го периода. У лития имеются два энергетических уровня вокруг ядра, внутренний повторяет электронное строение атома гелия. Два его электрона находятся на первом энергетическом уровне, третий электрон – на втором. Во 2-м периоде п = 2,

У атома неона второй энергетический уровень заполнен электронами, т. е.
второй слой завершен.
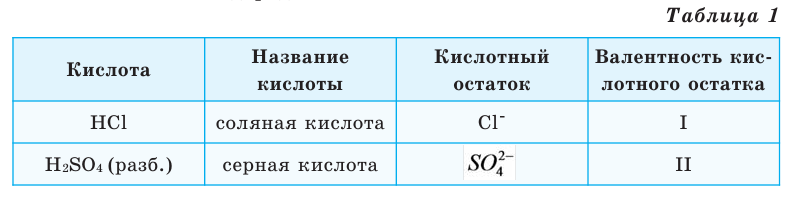
Такая закономерность повторяется на третьем энергетическом уровне – от натрия до аргона. У элементов этого периода строение внутренних двух уровней повторяет структуру неона (табл. 2).
У атома аргона завершается третий энергетический уровень. Элементы, у которых внешний энергетический уровень завершен, обладают инертностью.
После аргона в таблице расположен калий. У атома калия следующий электрон образует новый, четвертый энергетический уровень, а внутренние три уровня повторяют электронное строение аргона (табл. 1).
При сравнении электронной структуры элементов 2-го и 3-го периодов заметно, что число электронов на внешнем энергетическом уровне у атомов лития, натрия и калия одинаковое 
Такие сходства в структурах внешних уровней наблюдаются у элементов, расположенных в одной группе, например, у фтора и хлора 7 электронов. У неона и аргона на внешних энергетических уровнях по 8 электронов.
Каждый период (кроме 1-го) начинается с щелочного металла и заканчивается инертным газом. По периодам слева направо число электронов увеличивается от 1 до 8, электроны внешнего энергетического уровня слабее притягиваются к ядру. У элементов главных (А) подгрупп электроны внешнего энергетического уровня являются валентными, т. е. определяют валентность элемента (табл. 3).
Рассмотренные 20 элементов являются элементами главных подгрупп, их очередные электроны помещаются на внешних s— и р-подуровнях, поэтому их называют s— и р-элементами.
К s-элементам относятся элементы главных подгрупп I и II группы; к р-элементам – элементы главных подгрупп III–VIII группы. Объединение элементов в одну группу объясняется одинаковым числом у них валентных электронов.
Ознакомившись с электронным строением атома, мы можем дать следующее определение периодов и групп в Периодической системе:
Периодами называются горизонтальные ряды элементов с одинаковым числом энергетических уровней, начинающиеся со щелочного металла и заканчивающиеся инертным газом (кроме 1-го периода).
Группами называются вертикальные ряды элементов с одинаковым числом валентных электронов.
Электронная формула, электронно-графическая формула, s-, р-элементы.
Лабораторный опыт №1
изготовление моделей атомов
Цель работы: изготовить модели атомов.
Оборудование: разноцветный пластилин, шаростержневые модели атомов.
Ход работы
Атомы элементов можно смоделировать с помощью разноцветного пластилина (рис. 4, 5).
Смоделируйте атомы: водорода, углерода, серы, йода, кислорода, железа. Подберите цвета пластилина или готовых шариков таким образом, чтобы цвета соответствовали простым веществам: водород –бесцветный (можно белый); углерод – черный; сера –желтая; йод – темно-красный; кислород – бесцветный (можно голубой или синий, т.к. сжиженный кислород голубого цвета); железо – серый.

Образование ионов
Вспомните! Cтроение атома, завершенный слой, электронная конфигурация элемента
После ознакомления с электронным строением атомов можно приступить к изучению способности элементов образовывать химические соединения.
Каждый период в системе заканчивается инертным газом. Как вы думаете, почему они так инертны? Для выяснения этого вопроса рассмотрим электронные структуры этих элементов. Нам известно строение атомов 

У других элементов химическая активность определяется именно этой недостроенностью внешнего электронного слоя. Они могут завершить внешние электронные слои путем отдачи или присоединения электронов при образовании соединений (рис. 7).

Если элемент отдает электрон, он превращается в положительно заряженную частицу, а если принимает электрон — в отрицательно заряженную частицу, которые называются ионами, т. е. имеют завершенный энергетический уровень.
А это зависит от двух факторов:
1) от электронного строения атомов;
2) от радиуса атомов.
Заряды ионов пишутся арабскими цифрами сверху
над символом элемента, знак заряда указывается после
числового значения: например:
У элементов, расположенных в начале периодов, на внешней орбитали электронов мало (1–3). Поэтому они легко отдают эти электроны, принимая при этом электронное строение инертного газа, которым заканчивается предыдущий период. А у элементов, расположенных в конце периодов, число электронов на внешнем уровне больше, поэтому они легко принимают электроны. При этом они принимают конфигурацию инертного газа, которым заканчивается данный период. По периодам число электронов на внешнем электронном уровне (валентные электроны) постепенно увеличивается. Слева направо увеличиваются заряды ядер атомов. То есть в этом направлении усиливается способность принимать электрон.
Напишем формулы валентных электронов элементов III периода. Определим число неспаренных электронов и число электронов, недостающих до завершения энергетического уровня (табл.4).
Рассмотрим, как заряжаются атомы элементов при образовании соединения с изменением их электронных структур.
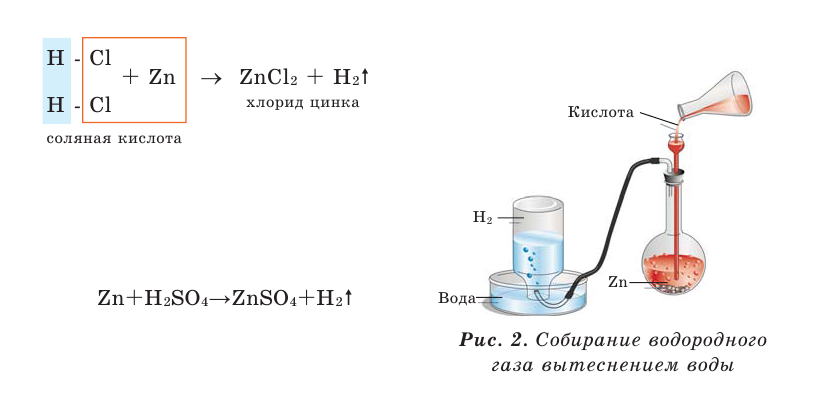
Для завершения внешнего слоя атому хлора недостает лишь одного электрона, поэтому он принимает один электрон от атома магния, превращаясь при этом в отрицательно заряженный ион.
А у атома магния на внешнем слое имеются два электрона, он отдает каждому атому хлора по одному электрону, т. е. требуется два атома хлора.
Как изменяются эти свойства по группам? Число валентных электронов одинаковое у элементов, расположенных в одной группе. А число электронных слоев, т. е. атомных радиусов в этом направлении, увеличивается. По этой причине усиливается способность отдать электрон 
Способность элемента отдать электрон характеризует металлические а принимать — неметаллические свойства.
Для выяснения этого вопроса рассмотрим электронное строение и значения атомных радиусов элементов IA и VIIA групп (табл. 5).
По периодам слева направо металлические свойства ослабевают, неметаллические свойства постепенно усиливаются;
По группам сверху вниз усиливаются металлические свойства.
Ионы, условия образования положительно и отрицательно заряженных ионов.
Составление формул соединений
По пройденным материалам вы знаете, что атомы являются электронейтральными частицами. Потому что количество электронов, которые вращаются вокруг ядра, численно равно заряду ядра, точно так же, абсолютные значения положительно и отрицательно заряженных частиц, составляющих молекулу, будут равны. Поэтому и молекула электронейтральна.
Теперь попытаемся составить формулу обыкновенной поваренной соли. В состав этого вещества входят элементы натрий и хлор в виде ионов. А образование этих ионов вам знакомо из предыдущего параграфа. Теперь обратим внимание на числовые значения зарядов данных ионов:
При образовании иона натрия заряд ядра превышает на единицу общее количество электронов, которые вращаются вокруг ядра.
А при образовании ионов хлора, наоборот, общее количество электронов становится больше на единицу, чем заряд ядра.
При написании формул бинарных (состоящих из двух элементов) соединений мы должны придерживаться такого правила:
В молекулах бинарных соединений положительно заряженная частица
пишется (в основном) на первом месте, отрицательная – на втором.
В соединениях, состоящих из элементов металла и неметалла, частицы атомов металла всегда положительно заряжены, а неметаллы – отрицательно.
Тогда формула поваренной соли выглядит так: NaCl (хлорид натрия).
В название бинарных соединений к международному или сокращенному названию элемента добавляется окончание ид, 


Далее рассмотрим составление формулы хлорида магния:
Используя правило «нулевой суммы», составим такое уравнение:
+2 + (–1)х = 0 ⇒ х = 2, следовательно, формула вещества:
І. Рассмотрим примеры составления формул и определения зарядов элементов соединений по этому способу.
Пример 1. Составьте формулу оксида трехвалентного элемента.
1. Напишем схему формулы оксида трехвалентного элемента –
2. Укажем заряды элементов в этом соединении: 
3. Находим значение наименьшего кратного абсолютных значений зарядов атомов элементов (3 · 2 = 6).
4. Разделив значение наименьшего кратного на абсолютное значение зарядов элементов, запишем их как индексы при них:
6 : 3 = 2, 6 : 2 = 3; х = 2, у = 3;
тогда формула оксида
Алгебраическая сумма зарядов элементов в соединении равна нулю.
+3 · 2 = +6; –2 · 3 = –6; +6 + (–6) = 0
II. Если дана формула вещества, можно определить заряды элементов в
соединении.
Пример 2. Определите заряд фосфора (V) в его оксиде.
1. 
2. В соответствии с вышеуказанным правилом, составляем уравнение с
одним неизвестным:
2х + 5 · (–2) = 0; 2х = +10; х = +5
Метод «нулевой суммы»
ДЕЛАЕМ ВЫВОДЫ:
- 1. Электроны заселяют пространство вокруг ядра поэтапно, образуя энергетические уровни.
- 2. Область пространства, в которой вероятность нахождения электронов максимальна, называется электронным облаком, или орбиталью. Формы s-облаков — сферическая, а р-облаков — гантелеобразная.
- 3. Изображение электронов в атоме с помощью электронных облаков и распределение по уровням и подуровням называется электроннографической формулой.
- 4. Если элемент отдает электрон, он превращается в положительно заряженную частицу, а если принимает электрон — в отрицательно заряженную частицу. Эти заряженные частицы называются ионами.
- 5. Алгебраическая сумма зарядов элементов в соединении равна нулю.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Я покажу те атомы, из которых природа творит все вещи…
Лукреций
Великая идея: вещество состоит из атомов
Мы видели внешние проявления изменений в образовании биосферы и внутренние механизмы этих изменений в молекулярных основаниях генетики. Мы видели то, что не изменяется, энергию, и видели, в терминах энтропии, почему изменяются вещи. Теперь мы исследуем материальную основу изменений еще более детально, совершив, таким образом, переход от мастодонтов к элементам.
Что сообщает наука о природе вещества, материала, из которого сделано все, доступное ощущениям? Мы изучим этот чрезвычайно важный вопрос в два этапа. На первом этапе, составляющем предмет настоящей главы, мы исследуем вопрос, который окажется лежащим на поверхностном уровне, хотя и не выглядит таким, и опишем появление концепции атома, этой валюты всех рассуждений в химии. Мы увидим, почему различные атомы имеют различные индивидуальности, которые мы называем их химическими свойствами. Пусть не оттолкнет вас мысль о том, что эта глава посвящена химии. Химия является мостом между постигаемым миром веществ и воображаемым миром атомов, и несмотря на зачастую ужасные воспоминания о столкновениях с этим предметом в школе, он способен глубоко очаровывать и просвещать, даже если его скорее вертят в руках (как здесь), чем разжевывают. Моя цель — ввести сюда немного химии, чтобы ваши глаза увидели мир вокруг вас, и ваше восхищение им стало глубже. Затем, в следующей главе, мы оставим поверхностный взгляд на атомы и погрузимся в самые глубины того понятия, которое мы именуем материей. Тогда мы приблизимся к пониманию того, чем материя является на самом деле, и сделаем это таким способом, который мог бы удовлетворить даже древних греков.
Греки много думали о материи и предложили так много различных гипотез о ее природе, что по крайней мере одна из них, вполне вероятно, могла оказаться правильной. Некоторые из их предположений были совершенно ложны, но демонстрировали достойный одобрения дух исследования. Так, Фалес из Милета (около 500 до н.э.), считающийся в народном воображении отцом философии, найдя высоко в горах ископаемые морские раковины, незадолго до своей кончины внезапно пришел к заключению, что все сделано из воды. Тысячу лет спустя этот взгляд нашел свое место в Коране:
Мы… сделали из воды всякую вещь живую. Неужели они не уверуют?[20]
Величие этого источника в глазах некоторых придает такому взгляду авторитетность даже сегодня. Однако греки продвигались в своих поисках понимания, считая, что одной сущности недостаточно для объяснения многообразия сущностей мира. Так, Гераклит из Эфеса (приблизительно 540-475 до н.э.), развивая идею Фалеса, заключил, что необходим агент изменений, и добавил в котел бытия огонь. Вскоре Эмпедокл из Сицилии (приблизительно 492-432 до н.э.), считая, что твердость трудно образовать только из воды, воздуха и огня, усовершенствовал эту первосмесь еще больше, добавив к ней землю, и предположив, а возможно и веря, что все может быть построено из воздуха, земли, огня и воды (рис. 5.1). Аристотель (384-322 до н.э.) был почти полностью согласен с эмпедокловой редукцией мира к четырем элементам, возражая только, что подлунный мир Земли, это театр перемен и распада, совершенно отличен от вечной небесной сферы, и что эмпедокловы элементы приложимы к первому, но недостаточны для понимания последней. Для вневременной, совершенной небесной сферы Аристотель считал обязательным пятый основной элемент, квинтэссенцию.

Рис. 5.1. Две самых ранних периодических таблицы элементов. Диаграмма слева показывает четыре элемента, положенные древними греками в основу материи, и свойства, сообщаемые этими элементами тем веществам, которые они образуют. Диаграмма справа дает китайскую версию, восходящую к даосскому взгляду на бытие, основанному Лао-цзы (около 600 до н.э.), в котором пять элементов возникают из взаимодействия ян (мужское, положительное, теплое, светлое) и инь (женское, отрицательное, холодное и темное).
Все это было, конечно, совершенно неверно, так как ни одна из этих сущностей не является элементарной, за исключением, возможно, гипотетической, экспериментально ненаблюдаемой и, как мы знаем, не существующей квинтэссенции на небесах. Но формулирование и разработка концепции о том, что сложное возникает из простого, были фундаментально важным понятийным шагом, и этот подход до сих пор лежит в сердцевине современной науки.
Предположение о существовании элементов, пусть даже и неправильных элементов, подняло вопрос, который находится в центре внимания настоящей главы: является ли вещество непрерывным или дискретным. Другими словами, можно ли делить элементы ad infinitum на все более малые кусочки, или они дискретны, и в этом случае деление приведет нас к далее неделимому, к атомам? У греков спекуляции процветали и обладали той свободой, которую дает лишь отсутствие экспериментальных данных, поэтому обе идеи нашли своих сторонников. То, что одна из этих идей, атомистическая точка зрения, оказалась верной, не заставляет нас непременно восхищаться ее приверженцами, поскольку они поддерживали эту версию, исходя из прихотливого умозрения и философских пристрастий, которые в наши дни не считаются особо надежными составляющими научного метода при поиске истины.
Мы можем проследить линию удачных спекуляций до Левкиппа из Милета (не ранее 450-420 до н.э.), который представлял себе материю гранулированной, состоящей из атомов, которые ставят предел делимости. Только если существует конец возможности деления, утверждал Левкипп, материя может быть вечной, ибо в противном случае все давным-давно распылилось бы в ничто. Однако его точка зрения на атомы была далека от той, которую мы теперь считаем ортодоксальной. Так, он представлял себе, что атомы имеют большой диапазон форм и размеров и что почти все различные вещества сделаны из различных атомов. Эти взгляды развил и назвал умозрительные неделимые сущности атомами ученик Левкиппа, «смеющийся философ» Демокрит из Абдеры (приблизительно 350-322 до н. э.). Демокрит придерживался точки зрения, что существуют атомы молока и атомы угля, атомы костей и атомы воды. Его воображение текло, не стесненное экспериментом, и он считал существующими атомы дыхания, звука и души. Атомы души он считал особенно красивыми, как и приличествует душе; среди атомов цвета атомы белого были гладкими и округлыми, как бы интерпретирующими сам этот цвет.
Эти мысли были частью системы верований эпикурейцев, последователей Эпикура (341-270 до н.э.), который использовал их для атак на суеверия, утверждая, что, поскольку все, включая богов, сделано из атомов, то даже боги — для Эпикура боги были обаятельно безучастными, они были существами, жившими в свое удовольствие, образцами удовлетворенности и высокомерия, не утруждавшими себя вмешательством в ничтожные человеческие дела — были субъектами законов природы. Эпикурейский взгляд на мир, прихотливое сочетание гедонизма и атомизма, рассматривал ощущения как основу знания и считал их впечатлениями души, происходящими от образов, передаваемых изящными фильмами, составленными из атомов, которые испускают ощущаемые объекты. Атомический взгляд на структуру материи и ощущения предстал перед восприимчивой и утомленной тиранами и богами римской публикой в дидактической, написанной искусными гекзаметрами, эпической поэме Тита Лукреция Кара (около 95-55) De rerum natura (О природе вещей), которую можно рассматривать как первое руководство по физической химии. Этот текст считался утраченным вплоть до пятнадцатого века, но после его нового обретения он подвигнул умы многих современников этого события опять обратиться к атомизму.
Платон и его ученик Аристотель были ярыми противниками атомизма, и их авторитетный, хотя и пагубно влияющий взгляд на мир доминировал на всем протяжении Средних веков, ни в малейшей степени не считаясь с сильным течением материализма и атеизма эпикурейского толка. Аристотель полагал, что атомизм, который он считал чистым вымыслом и поэтому — не в пример его собственным чистым вымыслам — заслуживающим лишь презрения, не способен дать объяснение богатейшему узору чувственного опыта, который характеризует реальный мир. Кроме того, он наложил анафему на пустоту, которая была бы необходима, если бы атомы должны были двигаться. Ведь в пустоте, как он думал, не может поддерживаться движение, ибо в пустоте нет тягловой силы, а движения без тягловой силы не бывает (см. главу 3).
Сила авторитета Аристотеля была такова, что его взгляды, с небольшими дополнительными вкраплениями, формировали мировосприятие людей целых два тысячелетия. Они поддерживали алхимиков в их ложно направленных и по большей части бесплодных усилиях, а его взгляды на движение душили также и физику. И так же, как в семнадцатом веке, мир пробудился и осознал пустоту аристотелевской физики из кресла, людям постепенно стало приходить в голову, что его химия из кресла тоже пуста. Однако, хотя мы можем осмеивать Аристотеля с наших позиций, лежащих далеко вниз по течению от его интеллектуального наследия и отделенных от его образа мыслей несколькими научными революциями, мы не станем переадресовывать наши похвалы эпикурейцам, несмотря на то, что, как кажется на первый взгляд, они были ближе к истине. Эпикурейцы тоже были ограничены своими креслами, и их атомизм был столь же произвольной спекуляцией, как и антиатомизм Аристотеля. Все ранние постулаты об атомах были чистыми догадками: это была спекулятивная философия, а не наука.
Науке потребовалось больше времени, чтобы прийти к пониманию природы вещества, чем к пониманию движения вещества. Сама по себе природа материи оказалась более неуловимой, чем движение материи в пространстве, поскольку, хотя можно без труда прикрепить числа к положениям в пространстве и времени и приколоть таким образом динамику к лацкану физики, далеко не ясно, как числа можно прикрепить к веществу. В самом деле, а приложимы ли числа вообще к свойствам, которые обычно называют химическими? Не суждено ли природе материи навсегда остаться лишь материей для анекдотов и спекуляций?
Ключом к проблеме оказался баланс (рис. 5.2). В руках Антуана Лорана де Лавуазье (1743-94), который широко известен как отец современной химии и «носитель духа счетоводства, поднявшийся до гениальности», химические весы превратились в скальпель, который стало возможно употребить для глубокого проникновения в тайну вещества. Тщательная и вдумчивая проработка дала возможность употребить весы для прикрепления чисел к веществу и ввести химические реакции в царство арифметики.

Рис. 5.2. Классические химические весы, не слишком отличающиеся от тех, которые Лавуазье использовал в своих исследованиях, позволивших ему привязать к веществу числа и этим превративших химию в физическую науку, и их современный двойник.
В частности, появилась возможность использовать весы для определения масс веществ, участвующих в реакции. В результате на основе этих данных начали появляться модели, а модели, как мы уже видели, являются живой кровью науки и зародышами теорий.
Модель масс для соединяющихся элементов стала желудем на ветке дуба атомической гипотезы Дальтона. Джон Дальтон (1766-1844), мрачный, не различавший цвета сын ткача-квакера, в двенадцать лет школьный учитель и педантичный наблюдатель погоды, не имел других развлечений, кроме боулинга по вечерам каждый четверг. Возможно, подсознательная память о шарах боулинга и привела его к теории, которую он впервые представил на лекции в Королевском обществе в декабре 1803 г. и опубликовал в 1807 г. Его гипотеза заключалась в том, что вещество состоит из атомов, которые не могут быть сотворенными или разрушенными, что все атомы данного элемента идентичны и что в химических реакциях атомы просто меняют партнеров. Главной его концепцией было то, что каждый атом имеет характерную массу и что химические весы являются поэтому счетчиком изменений массы, происходящих при смене атомами своих партнеров. Это был шаг, называемый философами науки трансдукцией, в котором концепция на микроскопическом уровне связана с наблюдаемым макроскопическим свойством. Большая часть современных физики и химии является результатом трансдукции, так что наблюдаемое интерпретируется в терминах воображаемого, а определенные измерения, сделанные в масштабе, соизмеримом с человеком, интерпретируется в терминах сущностей, которые в миллиарды раз меньше.
Дальтон на самом деле пошел несколько дальше, чем теперь считается удобным помнить. Он полагал, что атомы различных элементов окружены различными количествами теплорода, гипотетической (и впоследствии отвергнутой) невесомой жидкости, которую мы ощущаем как тепло (глава 3). Он предполагал, что атомы газообразных элементов имеют самую толстую оболочку из теплорода, которая позволяет им передвигаться почти свободно. Атомы твердых тел имеют самые тонкие оболочки, и это означает, что они остаются на местах. Эти приводящие в легкое замешательство умопомрачительные следствия атомической гипотезы были прочно забыты.
Используя весы, Дальтон сумел составить список масс своих атомов, по отношению к принятой за 1 массе атома водорода, легчайшего из элементов. Он назвал эти относительные массы атомов атомными весами, и этим названием все еще пользуются. Его эксперименты были грубыми, а его интерпретация этих экспериментов зависела от предположений о том, как много атомов одного элемента соединены с атомами другого, и тут его догадки часто оказывались неверными (рис. 5.3). Так, используя в качестве гида простоту, он предположил, что вода состоит из одного атома кислорода и одного атома водорода, и заключил, что атомный вес кислорода равен 7 (на самом деле, исходя из его предположения, точные измерения дали бы 8); мы знаем, что в действительности вода состоит из двух атомов водорода и одного атома кислорода, поэтому истинный атомный вес кислорода равен 16, т.е. атом кислорода в 16 раз тяжелее атома водорода. Тем не менее это самая ранняя версия трансдукции во всей ее славе, когда лабораторные наблюдения выражают свойства невидимого.

Рис. 5.3. Атомистическая гипотеза возникла у Дальтона в начале девятнадцатого столетия, и он неоднократно читал о ней лекции. Здесь изображено факсимиле части оформления лекции, прочитанной Дальтоном 19 октября 1835 г. членам Манчестерского механического общества. Неудобоваримые для типографии символы элементов были заменены орфографически более простыми, к немалой досаде Дальтона.
В отличие от древнегреческих умозрений об атомной природе вещества, теория Дальтона была научной. В ней не было никаких ленивых, или даже энергичных, умствований; это были наблюдения, основанные на эксперименте и соединенные с рациональностью. Не все, однако, приняли ее в качестве характеристики реальности. Многие годы среди ученых бытовала точка зрения, что атомы — это вычислительная фикция, полезные символы для совершения расчетов, в том числе расчета масс, но безо всякого реального смысла. Большинство возражений отпало около 1858 г., когда итальянский химик и революционер Станислао Канниццаро (1826-1910) опубликовал гораздо более точный список атомных весов известных элементов, но даже в конце девятнадцатого столетия некоторые крайние консерваторы отказывались прикрепить свое знамя к атомистическому флагштоку.
Современная техника наблюдения продрались сквозь лес возражений, которые пришлось преодолевать Дальтону и его последователям. Сегодня мы имеем возможность видеть атомы как отдельные капли материи (рис. 5.4). и больше нет никаких сомнений в их существовании. Конечно, некоторые социологи науки могут размахивать своими сверхпессимистическими флагами и утверждать, что прибор, использованный для получения этих изображений, является скорее социальной конструкцией, и спроектирован он так, чтобы выражать современную парадигму; однако ученым виднее.

Рис. 5.4. Дальтон вывел заключение о существовании атомов из регулярностей масс элементов, соединяющихся друг с другом. Сегодня мы можем «видеть» атомы, и никакого сомнения в их существовании не возникает. Прибор, с помощью которого получено изображение атомов кремния на поверхности кремниевого образца, называется сканирующим туннельным микроскопом. Он, почти буквально, чувствует проходимую им поверхность, а компьютеры преобразуют сигналы, посылаемые зондом, в изображение с разрешением атомного масштаба.
Итак, что же такое атомы? На что они похожи? Как они сделаны? Дальтон, как и греки, предположил, что атомы есть предел делимости; никакой атом нельзя разрезать на куски, никакой атом не имеет более мелких составляющих. Но если бы это было так, было бы трудно понять, как можно объяснить богатый спектр свойств элементов, поскольку разнообразие свойств проистекает из богатства соединений. То, что атомы на самом деле имеют внутреннюю структуру, впервые продемонстрировал Дж. Дж. Томсон (1856-1940), который в 1897 г. показал, что из атомов могут вылетать электроны. Он объявил о своем открытии в Королевском обществе 30 апреля 1897 г. Электроны были первыми из идентифицированных субатомных частиц, частиц, меньших, чем атом, а работа Томсона в Кавендишской лаборатории в Кембридже показала, что они являются универсальной составляющей вещества и что поэтому атомы действительно обладают внутренней структурой.
В это время (в самом конце девятнадцатого века) случилось великое замешательство относительно того, как могли быть организованы электроны. Кое-кто подозревал, что один атом может состоять из тысяч электронов. Проблема осложнялась отсутствием какой-либо информации о существовании частиц с положительным зарядом, компенсирующим отрицательный электрический заряд электронов. Эту проблему отправила на покой работа новозеландца Эрнеста Резерфорда (лорд Резерфорд Нельсон, 1871-1937), который, находясь в Манчестере, наткнулся в 1910 г. на существование ядра, мельчайшего пятнышка положительно заряженного вещества, лежащего в центре атома, которое, будучи много меньше самого атома, ответственно фактически за всю его массу.
Здесь будет уместно дать представление о размерах и массах различных объектов, которые к этому времени появились на сцене. Типичный атом имеет диаметр около 3 миллиардных метра (3×10−9 м, 3 нанометра, 3 нм). Так, миллион таких атомов, выложенный в ряд, протянется на 3 мм в длину. Теперь вы, может быть, получили возможность вообразить размер этих атомов. Легче представить себе то же тире увеличенным примерно до длины 3 километра, тогда каждый атом занял бы 3 миллиметра, как икринка рыбки «морской воробей».
Как вы, вероятно, догадываетесь, атомы являются довольно большими: им приходится быть такими, потому что в них много чего набито. Большинство людей думает, что атомы очень маленькие, но это лишь потому, что мы сами очень большие: нам приходится быть такими, потому что в нас много чего набито. Когда вы начинаете думать, что атомы большие, они становятся гораздо менее устрашающими. Было бы полезно в воображении надувать атом до тех пор, пока он не достигнет примерно метра в поперечнике.
Ядро атома тоже велико, поскольку в него тоже набито много вещей. Большинство людей думает, что оно очень, очень маленькое; но это не очень хорошие мысли, потому что такие мысли мешают уму вообразить, на что оно похоже. Некоторые ученые могли бы подумать, что такая помеха очень хорошая вещь, поскольку перенесение макроскопических идей на сущности столь малые, как атомы, не говоря уж о ядре, чревато опасностью, ибо знакомые понятия просто не приложимы к столь малым объектам (как мы с лихвой убедимся в главе 7, посвященной квантовой теории). Пусть так, но давайте по крайней мере попробуем вообразить себе диаметр ядра. Эксперименты показывают, что диаметр ядра составляет примерно одну десятитысячную диаметра атома. Поэтому, если мы подумаем об атоме, как о шаре примерно с метровым диаметром, его ядро будет пятнышком с диаметром лишь в одну десятую миллиметра. Поэтому для таких увесистых творений, как мы, ядро действительно очень мало; даже для воспринимающего существа размером с атом оно казалось бы довольно маленьким, хотя и различимым. Но для физиков-ядерщиков, которым необходимо понимать устройство ядер, оно довольно большое.
Как мы отметили, ядро является большим, потому что в него так много набито. В нем располагается положительный заряд атома, который компенсирует отрицательный заряд окружающих его электронов. Здесь также располагается почти вся масса атома, так как только около 0,1 процента его общей массы находится в электронах. Когда вы поднимаете тяжелый объект, вы в действительности поднимаете ядра. Если бы атомы вашего тела могли бы лишиться своих ядер, вы весили бы всего около 20 грамм. Другая, менее известная черта ядер состоит в том, что многие из них вращаются вокруг своей оси, хотя некоторые и не вращаются. Ядра водорода и азота вращаются, ядра углерода и кислорода нет. Вращение ядра не может быть изменено, это, подобно электрическому заряду, внутреннее свойство, и каждому ядру водорода суждено вращаться вечно с одной и той же неизменной скоростью.
В начале двадцатого века стало ясно, что электрон был не первой субатомной частицей, которая была открыта. Самая первая была известна, но не опознавалась в этом качестве, уже более века. Ядро атома водорода, простейшего из всех атомов, состоит из единственной субатомной частицы, протона. Эта частица является сущностью, ответственной за свойства кислот, и когда вы ощущаете кислый вкус лимонного сока, на самом деле ваш язык щекочут протоны. К сожалению, мы не можем здесь исследовать это явление или выяснять, почему язык является хорошим детектором по крайней мере для элементарной частицы одного типа. Протон представляет собой тяжелую частицу с положительным зарядом, равным и противоположным заряду электрона, и с массой примерно в тысячу раз большей массы электрона.
Атом водорода состоит из одного протона и присоединенного к нему электрона: положительный заряд ядра компенсируется отрицательным зарядом электрона. Следующий простейший элемент, гелий, имеет ядро, построенное из двух протонов, поэтому у него два присоединенных электрона. Число протонов в ядре атома называется атомным номером элемента, так что атомный номер водорода равен 1, атомный номер гелия равен 2, и так далее. Из того факта, что атом электрически нейтрален, а такими являются все атомы, следует, что число присутствующих в нем электронов равно атомному числу, поскольку полный положительный заряд ядра компенсируется полным отрицательным зарядом присоединенных электронов.
Осознание того, что ядру элемента можно приписать номер и что этот номер можно интерпретировать в терминах состава ядра, означает, что можно наконец провести перекличку элементов. Теперь пропущенный элемент, можно идентифицировать, узнав, был ли обнаружен элемент именно с таким атомным номером, а размышления о том, существует ли какой-нибудь элемент между двумя другими, можно прекратить, если их атомные номера являются соседними. Атомные номера стало возможно определять благодаря технике, разработанной Генри Моусли (1887-1915) незадолго до его призыва на военную службу для того лишь, чтобы под Галлиполи его настигла пуля снайпера. Как написал Уилфред Оуэн перед встречей со своей собственной пулей однажды вечером на исходе той же войны:
Отвага была моей, и с ней тайна,
Мудрость моею была, и с нею власть.
Это и была власть, основанная на мудрости, сорвавшая покров тайны, и теперь мы знаем весь список элементов, знаем о ядре и числе электронов, присутствующих в каждом атоме.
Точное расположение электронов вокруг ядра все еще оставалось проблемой. На этом этапе обсуждения важно понять то, что атом представляет собой почти полностью пустое пространство. Вся его масса, как мы видели, сосредоточена в мельчайшем центральном ядре, а окружающее ядро пространство, вплоть до расстояния, составляющего примерно 10 тысяч диаметров ядра, занято горстью электронов — например, шестью, в случае углерода. Ваше тело представляет собой это почти пустое пространство, хотя, так или иначе, вы кажетесь материальным. Вы являетесь пустотой в реальном, а не ироническом смысле, думаете почти пустыми мозгами, одеваетесь в пустоту, сидите на пустоте и поддерживаетесь ею. Чтобы вообразить пустоту атома, представьте, что вы стоите на ядре размером с Землю, глядя в ясное звездное ночное небо. Пустота пространства, которое вы видите вокруг себя, не будет отличаться от пустоты атома внутри вас.
Однако эта пустота вне ядра является средоточием индивидуальности элемента. В то время как ядро является пассивным наблюдателем, просто отвечающим за размещение вокруг себя дополняющих его электронов центром контроля, дымок электронов, занимающих почти пустое пространство, является участником химических реакций.
Ученые не смогли устоять перед искушением высказать предположение, что электроны по отношению к ядру подобны планетам по отношению к звезде или Луне по отношению к Земле, и этот образ все еще столь могуществен, что было бы лучше, если бы я не упоминал о нем. «Сатурнианская» планетарная модель атома была предложена японским физиком Хантаро Нагаока (1865-1950) в 1904 г. и стала естественно предполагаемой моделью после того, как несколько лет спустя Резерфорд открыл ядро. Планетарную модель, которую теперь представляли в виде планет, вращающихся вокруг звезды, а не в виде колец вокруг Сатурна, как предлагал Нагаока, призвали к жизни в 1912 г., когда Нильс Бор использовал раннюю версию квантовой теории для описания движения одиночного электрона в атоме водорода и для своего успешного расчета спектра излучения атома. Можно лишь позавидовать, представляя себе всю глубину восторга Бора, когда он обнаружил, что его расчеты почти точно согласуются с наблюдениями.
Но даже это — планетарная модель и, как казалось, подтверждающий ее талантливый расчет Бора — было неверно. Отсюда можно извлечь два урока для науки и жизни. Во-первых, мы не можем полагаться на перенесение, без основательной оглядки, знакомых закономерностей макромира в доселе неизвестный нам микромир. Под поверхностью реальности живут драконы. Во-вторых, даже количественное согласие может, при некоторых обстоятельствах, быть недостоверным свидетельством истины. Этими некоторыми обстоятельствами, сделавшими свидетельство недостоверным, в данном примере была «красота» — термин, со смыслом которого мы встретимся в следующей главе, а пока это лишь забавная и загадочная — характеристика электрического притяжения электрона к ядру.
Вы должны выбросить из вашего сознания, а еще лучше из вашего бессознательного, образ планет, вращающихся вокруг центрального ядра: он просто неверен. Это ложная модель атома, это научная фикция, мертвая, отброшенная модель. Чтобы увидеть ее ошибочность, надо понять, что электроны не являются частицами в привычном смысле, но имеют внутренние свойства, подобные волновым. Этот двойственный характер, лежащий в сердце квантовой теории и появляющийся на сцене в главе 7, устраняет понятие траектории, в данном случае орбитального пути планетарного электрона вокруг центрального звездоподобного ядра, и делает абсолютно неприемлемым образ электрона в виде частицы на орбите.
В главе 7 мы увидим, как Эрвин Шредингер (1887-1961) создал уравнение, решения которого рассказывают нам о поведении электронов. Все, что нам необходимо знать на этом этапе, это несколько следствий из него, касающихся атомов. То, что на сегодняшний день считается достаточно точной структурой атома водорода — к другим атомам мы придем позднее, — было одним из первых результатов использования уравнения Шредингера. В серии из четырех знаменитых работ (первая в трех частях), опубликованной в 1926 г., написанной во время каникул с любовницей и названной им «поздним эротическим взрывом», Шредингер решил свое уравнение для электрона в атоме водорода и получил из совершенно других предпосылок то же выражение для его энергии, которое до этого обнаружил Бор.
Чтобы понять результат вычислений Шредингера, мы должны знать, что решения его уравнения предсказывают вероятность того, что электрон будет обнаружен в некоторой точке пространства, а не точное положение электрона в любой момент, как в классической физике. Эти решения называются атомными орбиталями. В таком названии выражен намек на планетарный электрон на орбите, но без строгого смысла этой классической концепции, здесь неприменимой.
Рисунок 5.5 показывает форму обладающей самой низкой энергией атомной орбитали в атоме водорода, орбитали электрона в нормальном (основном) состоянии атома. Иллюстрация изображает вероятность обнаружения электрона в разных участках области с помощью плотности тени в них. Как можно видеть, благодаря тому, что облако является более плотным вблизи ядра, следует считать, что электрон «роится» вокруг и вблизи ядра, как осы вокруг вазы с вареньем, и с наибольшей вероятностью находится у самого ядра. Если бы вы мысленно помещали маленький полый шар в разных местах атома, вы обнаруживали бы электрон внутри шара чаще, когда шар располагается у ядра. Облако вероятности сферически симметрично (предпочтительные направления отсутствуют), поэтому мы можем также представить орбиталь сферической поверхностью, которая охватывает большую часть облака. Однако не следует думать, что орбиталь имеет резкий край: как показывает изображение на рисунке, вероятность обнаружить электрон в определенной точке постепенно стремится к нулю и — по крайней мере в принципе — достигает нуля лишь на бесконечном удалении от атома.

Рис. 5.5. Здесь изображены некоторые представления s-орбитали самого низкого энергетического уровня для атома водорода. Диаграмма слева показывает вероятность обнаружения электрона в каждой точке в виде плотности тени. Сопровождающий ее график показывает, как вероятность экспоненциально убывает с увеличением расстояние до ядра. Диаграмма справа показывает «граничную поверхность», представляющую собой поверхность, охватывающую 90 процентов вероятности обнаружения электрона.
С этой точки зрения все атомы бесконечно велики, что находится в резком противоречии со взглядом на атомы, как на очень маленькие. Практически, конечно, вероятность нахождения электрона далеко от ядра (больше, чем на расстоянии в несколько сот триллионных метра) пренебрежимо мала. Лучше представлять себе атом водорода с электроном, находящимся в ограниченной области пространства очень близкой к ядру (в области с радиусом около 100 триллионных метров, 100 пикометров, 100 пм). Эта сферическая орбиталь с низшим уровнем энергии называется s-орбиталью. Было бы приятно думать, и в любом случае это полезное мнемоническое правило, что s означает сферичность; но на самом деле это название создано по техническим причинам, связанным с шириной линий в спектре атома водорода.
Одна из особенностей, которая станет яснее, когда мы больше узнаем о квантовой теории, но о которой нам необходимо знать уже на этой стадии, состоит в том, что из факта сферической симметричности орбитали, изображенной на иллюстрации, следует, что электрон, который она описывает, имеет нулевой момент импульса, момент количества движения вокруг ядра. Мы встретили момент импульса в главе 3, где видели, что он подобен импульсу, но связан с движением по кругу, а не по прямой линии. Все, о чем нам надо знать на этом этапе, это о волновом свойстве орбитали, заключающемся в том, что о моменте импульса можно судить по тому, как быстро меняется плотность тени, когда мы путешествуем вокруг ядра. Этот факт может показаться лишь незначительной технической деталью, однако вскоре мы убедимся, что он составляет основу великолепия мира.
Когда Шредингер решил свое уравнение для атома водорода, он обнаружил, что существует много других атомных орбиталей, каждая из которых соответствует более высокой энергии, чем энергия основного состояния. В качестве аналогии можно привести колебания сферы с обертонами собственной частоты, соответствующими состояниям с более высокой энергией. Электрон может подняться на эти орбиты, если сообщить ему достаточную энергию, например, с помощью вспышки молнии электрического разряда или если он поглотит энергию биения фотонов, которые мы называем вспышкой света.
У этих орбиталей с более высокой энергией есть несколько характеристик, о которых нам следует знать. Во-первых, имеется целая серия s-орбиталей, каждая из которых является сферической, но с различными расстояниями от ядра: они образуют серию концентрических оболочек, подобную русской матрешке, с ядром в центре. Ни в одной из этих s-орбиталей электрон не имеет момента импульса, поэтому его можно обнаружить у самого ядра. И снова, не дайте одурачить себя, думая, что все это лишь педантичные академические детали: на таких деталях выстроены города и огромные индустрии.
Существуют также решения, не обладающие сферической симметрией, в которых облака электронной вероятности сконцентрированы в областях, находящихся в разных местах по отношению к ядру, а не распределены однородно вокруг него. Нам необходимо знать о трех типах орбиталей, показанных на рис. 5.6. Орбитали, в которых вероятность собрана в две области, называются p-орбиталями, орбитали с четырьмя областями называются d-орбиталями, а орбитали с шестью областями называются f-орбиталями. Благодаря тому, что плотность тени, изображающая вероятность нахождения электрона в данном месте, меняется, когда мы, по пути измеряя ее, движемся по кругу вокруг ядра, p-, d— и f-орбитали соответствуют состоянию с ненулевым моментом импульса электрона, который они описывают, причем d-орбитали соответствуют более высокому моменту импульса, чем p-орбитали, а еще более искривленные f-орбитали соответствуют еще более высокому моменту импульса. Момент импульса является источником центробежной силы, которая отбрасывает электрон от ядра. Есть еще один незначительный технический момент, который скоро приобретет огромное значение: в результате такого центробежного эффекта в любой из этих орбиталей никогда нельзя обнаружить электрон возле самого ядра.

Рис. 5.6. Двудольное распределение плотности вероятности нахождения электрона (изображенное в виде граничной поверхности) является характерным для p-орбитали, четырехдольное распределение характерно для d-орбитали, а шестидольное для f-орбитали. Поскольку орбитали последовательно становятся все более искривленными (то есть соответствуют волнам обращения вокруг сферы с более короткой длиной), соответствующий им момент импульса электрона возрастает. Ни в одной из этих орбиталей не существует вероятности нахождения электрона непосредственно у самого ядра: он все больше отбрасывается от ядра по мере возрастания момента импульса.
Нам необходимо узнать еще два свойства решений, которые Шредингер получил для своего уравнения. (Я прошу прощения за эту прелюдию, но вскоре она покажется весьма уместной.) Во-первых, посмотрим на энергетическую схему, изображенную на рис. 5.7. Мы видим, что с возрастанием энергии все большие группы орбиталей становятся допустимыми, потому что чем выше частоты и чем более искривлены пути возможных колебаний сферы, тем серьезнее может искажаться ее форма. При самой низкой энергии допустима только одна орбиталь, s-орбиталь на рис. 5.5. На следующем уровне допустимы одна s-орбиталь и три p-орбитали. На следующем, еще более высоком, уровне имеются одна s-орбиталь, три p-орбитали, 5 d-орбиталей и так далее. В этой схеме нет ничего магического, это просто схема решений уравнения Шредингера для атома водорода. Группы энергетических уровней называются электронными оболочками, потому что орбитали, принадлежащие к ним, образуют концентрические распределения вероятностей расположения электрона, более или менее подобные слоям в луковице. И последняя (да!) важная вещь это то, что орбитали водорода в каждой оболочке имеют в точности одну и ту же энергию. Это очень замечательное свойство и, как можно проследить, именно «красивый» характер взаимодействия между электроном и ядром привел к тому, что концептуально ошибочные вычисления Бора оказались количественно верными.

Рис. 5.7. Энергетические уровни типичных атомов. Для водорода, имеющего один электрон, все орбитали данного уровня имеют в точности одну и ту же энергию. Для отличных от водорода атомов (как изображено здесь) каждый уровень содержит орбитали с последовательно возрастающей энергией. Во всех случаях p-орбитали впервые появляются во второй оболочке, d-орбитали появляются в третьей оболочке, а f-орбитали в четвертой оболочке. Существуют оболочки более высоких энергий, чем показанные здесь. Каждый ящик представляет орбиталь, которую могут занимать не более двух электронов. Две вставки показывают аналогичные электронные структуры лития (с одним электроном вне сердцевины) и натрия (с одним электроном вне сердцевины).
Теперь я проведу вас от атома водорода сквозь строй атомов других элементов. Нам известен порядок, в котором следует обсуждать эти элементы, поскольку мы знаем их атомные номера и, следовательно, число электронов, которые должны присутствовать в каждом случае. Например, если атомный номер элемента равен 15 (это номер фосфора), то его ядро имеет пятнадцать единиц положительного заряда, и, для достижения электрической нейтральности, каждый атом должен иметь пятнадцать электронов. Основная идея заключается в том, что, с небольшими видоизменениями, которые мы скоро узнаем, электроны этих атомов будут описываться орбиталями и энергиями, подобными тем, которые Шредингер нашел для водорода. Но по ходу этого конструирования атомов мы обнаружим некоторые замечательные вещи.
Элементом с атомным номером 2 является гелий; он имеет двойной заряд ядра и два электрона. Состояние с наименьшей энергией для обоих электронов описывается такой же s-орбиталью, как и основное состояние атома водорода. Поскольку заряд ядра здесь больше, чем у водорода, эти два электрона будут притягиваться ближе к ядру; но, так как электроны отталкиваются друг от друга (частицы с одинаковым зарядом отталкиваются друг от друга), этому всасыванию будет оказываться некоторое сопротивление. В результате атом будет несколько более компактным, чем атом водорода, но не намного меньшим.
Следующим по порядку элементом, с атомным номером 3, является литий. Ядро лития имеет тройной заряд и окружено тремя электронами. Теперь возникает удивительная вещь. Эти три электрона не могут — просто не могут — занимать самую нижнюю энергетическую s-орбиталь. Есть свойство, которое мы до сих пор совершенно пропускали в нашем обсуждении, а теперь должны ввести: электрон имеет три постоянные внутренние характеристики: массу, заряд и спин. Как мы видели ранее, многие ядра вращаются, и точно так же каждый электрон во Вселенной обладает этим свойством. Для наших целей достаточно, чтобы мы представляли спин просто как классическое вращательное движение, подобное вращению планеты вокруг оси. Однако следует иметь в виду, что в данном контексте спин является чисто квантово-механическим свойством, и на самом деле его нельзя считать классическим. Например, электрон надо дважды перевернуть, чтобы он вернулся в исходное состояние! Второе квантовое свойство спина — более соответствующее стилю предыдущего обсуждения — заключается в том, что электрон (снова используя классический язык) имеет фиксированную скорость вращения, но может вращаться с этой скоростью либо по часовой стрелке, либо против часовой стрелки. Никаких промежуточных скоростей или ориентации вращения не допускается.
Третье квантовое свойство спина — и у него нету никакой классической интерпретации — это принцип запрета, предложенный в 1924 г. австрийским физиком Вольфгангом Паули (1900-58) и утверждающий следующее:
На одной орбитали может присутствовать не более, чем два электрона, и если два электрона имеют одну и ту же орбиталь, их спины должны быть парными.
Термин «парные» означает, что если один электрон вращается по часовой стрелке, то другой вращается против часовой стрелки. Этот принцип является ключевым для понимания химии. Он также является ключевым для понимания того, что объекты являются твердыми, несмотря на то, что состоят в основном из пустоты, потому что электроны одного атома не могут находиться в области, занятой электронами другого атома. Таким образом, несмотря на то, что электроны занимают ничтожную часть области, которую мы называем «атом», другие атомы не могут проникнуть в эту область. Так, объем нашего тела и наша способность отличаться от любого другого из окружающих нас предметов обусловлена в конечном счете электронным спином. Выключите спины электронов, и все вещество — все обитатели мира, все горы, океаны и леса, все существующее — коллапсирует в однородную каплю бесформенной слизи. Спин является источниками нашей индивидуальности.
Теперь мы можем завершить историю с литием. Представим себе последовательное добавление трех электронов и распределение их по орбиталям так, чтобы получить наименьший общий уровень энергии, принимая во внимание принцип запрета. Первые два электрона занимают первую s-орбиталь. Эта орбиталь теперь содержит два электрона, поэтому она полна. Поэтому третий электрон вынужден занять одну из s— или p-орбиталей следующей оболочки. Но какую орбиталь он займет, если все четыре орбитали имеют одну и ту же энергию?
То, что они имеют одну и ту же энергию, не верно. Мы утверждали это для водорода, как следствие до некоего загадочного «красивого» свойства электрического взаимодействия между ядром и электроном. Когда в атоме присутствует более чем один электрон, эта «красота» (под которой мы имеем в виду весьма специальный вид симметрии) теряется, и s— и p-орбитали больше не обладают одинаковой энергией. Причины этих различий можно усмотреть в том факте, что электрон на s-орбитали может находиться непосредственно у ядра, а электрон на p-орбитали там обнаружить нельзя.
Коротко говоря, электрон на второй s-орбитали может проникать в область, занятую двумя электронами первой s-орбитали, и испытывать полную силу притяжения тройного заряда ядра лития. Из-за центробежного влияния момента импульса, электрон на p-орбитали не может проникнуть так же близко к ядру и поэтому не испытывает его полной силы притяжения. В результате он будет иметь более высокую энергию (как показано на рис. 5.7).
Имея в виду эту разницу энергий, теперь можно сделать вывод, что атом лития содержит два электрона на s-орбитали в первой оболочке, окруженной электроном, занимающим s-орбиталь следующего энергетического уровня. Мы можем представлять себе, что эти электроны образуют две физических концентрических оболочки, причем одна прилегает к ядру в форме сферической сердцевины, а другая, окружающая ее, подобна мякоти плода вокруг косточки (рис. 5.8).

Следующим элементом (с атомным номером 4) является бериллий с четырьмя электронами вокруг ядра. Здесь на один электрон больше, чем в литии, и этот электрон можно присоединить к последнему внешнему электрону на второй s-орбитали. Далее идет пятый элемент, бор, с атомным номером 5 и пятью электронами. Вторая s-орбиталь заполнена, поэтому пятый электрон должен попасть на одну из трех p-орбиталей. Та же ситуация сохраняется для следующих пяти элементов, поскольку имеются три p-орбитали, и на этих орбиталях можно расположить шесть электронов. Так, углерод (шесть электронов) имеет внутреннюю сердцевину из двух электронов, как у гелия, еще два электрона на окружающей ее s-орбитали и еще два электрона на p-орбиталях. Оказывается, что последним двум электронам энергетически выгоднее занимать разные p-орбитали оболочки, так как тогда они дальше располагаются и меньше отталкиваются друг от друга. Азот (семь электронов) имеет еще один электрон на p-орбитали, кислород (восемь электронов), фтор (девять электронов) и неон (десять электронов) строятся тем же способом.
На этом этапе все десять p-орбиталей оболочки заполнены, и следующий электрон (в натрии, атомный номер 11) должен занять следующую, более высокую атомную орбиталь, которая является следующей s-орбиталью. Структура атома натрия подобна структуре атома лития с заполненной внутренней сердцевиной и одиночным s-электроном, образующим концентрическую внешнюю оболочку.
Это чрезвычайный момент в нашем обсуждении, хотя я и оставил проблеск, осветивший местность, почти незамеченным. Мы видели, что структура атома гелия состоит из заполненной оболочки; нам также следует знать, что гелий является инертным одноатомным газом (то есть газом, состоящим из одиночных атомов в свободном движении). Далее мы пришли к восьмому элементу, неону, еще одному инертному одноатомному газу, каждый атом которого имеет заполненную оболочку электронов. Непосредственно вслед за неоном мы уловили вспышку, идущую от лития, легко вступающего в реакции металла; его атомная структура состоит из одного электрона вне заполненной сердцевины. И теперь на сцене появляется восьмой, считая от лития, элемент, натрий, еще один металл, легко вступающий в реакции. Структура атома натрия совершенно подобна структуре атома лития, с одиночным электроном вне заполненной оболочки. Мы пролили немного света на периодичность элементов, на осознание того, что вещество является не случайным набором разрозненных элементов, а семейством, содержащим члены с подобными химическими свойствами и подобными электронными структурами.
Чтобы понять роль этого открытия и увидеть его в соответствующем историческом и культурном контексте, нам надо вернуться в девятнадцатое столетие, временно позабыть о структуре атомов и увидеть элементы с их внешней стороны, более близорукими и эмпирическими глазами этого века.
К середине девятнадцатого столетия было известно около пяти дюжин элементов. Некоторые были известны с доисторических времен, но не рассматривались в качестве элементов. Так, железо, уголь, медь и сера были известны древним. Они являются истинными элементами в современном смысле этого слова, а не в гадательном смысле древних греков. Элементы, по словам Роберта Бойля (1627-91) в его «Скептическом химике» (1661) представляют собой
некоторые примитивные и простые или совершенно несмешанные тела; которые не составлены из других тел или, говоря иначе, являющиеся ингредиентами, из которых все эти поименованные совершенно смешанные тела непосредственно составлены и на которые они в конце концов разлагаются.
По менее нудному и более операциональному определению Антуана Лавуазье они представляют собой
все вещества, которые мы не смогли разложить далее никаким способом.
Определение Лавуазье оставляет открытой возможность того, что более напряженными усилиями можно достичь этого разложения и таким образом спихнуть вещество со стола, где расположилось братство элементов. Лавуазье составил список из тридцати трех элементов, соответствующих его определению. Восемь, конечно, пришлось выбросить, когда стало возможным использовать более строгие процедуры, а два (свет и теплород) и вовсе не относились к делу. Современное определение стоит в стороне от этих попыток нащупать химический подход, и прямолинейно определяет элементы как
вещества, состоящие из атомов с одним и тем же атомным номером.
Современная эпоха для элементов началась всерьез, когда Хенниг Бранд (не ранее 1669 г.) из Гамбурга открыл фосфор, первый за много веков новый элемент. Использованная им процедура была не такой, чтобы внушить его соседям или другим возможным искателям новизны любовь к нему. Он собрал пятьдесят ведер человеческой мочи, которую заставил испаряться и разлагаться, выкипячивая ее до тестообразного осадка, дал осадку перебродить и подверг нагреванию черный остаток, смешав его с песком и собирая испарения в реторту. Эта с виду магическая субстанция светилась в воздухе и поэтому была сочтена средством для борьбы со смертью или, на худой конец, для получения выгоды. Как и в процедуре Бранда, самой ранней техникой разложения соединений на составляющие было нагревание, иногда нагревание вместе с другими веществами, как, например, с углем, для извлечения железа из железной руды, а иногда только нагревание, как при оспариваемом открытии кислорода посредством нагревания окиси ртути.
До индустриальной революции получение жара высокого накала было делом трудно достижимым, и одна из прометеевых процедур заключалась в краже огня у Солнца посредством мощных линз. Новое оружие свалилось в руки встряхивателей вещества с появлением гальванического элемента и возможности использовать электрический ток. Так, Хемфри Дэви (1778-1829) подключал электроды почти ко всему, что лежало в окрестностях Королевского общества, и в течение недели в октябре 1807 г. впервые получил калий с помощью электролиза расплавленного поташа (нитрата калия), а затем натрий с помощью электролиза расплавленной соды (углекислого натрия). Джон Дэви, брат Хемфри, рассказывал, что Хемфри «безумствовал и плясал от радости» вокруг своего открытия. Всего Дэви открыл шесть новых элементов (натрий, калий, кальций, магний, стронций и барий). Волна открытий, в основном обязанная своим происхождением использованию электролиза, довела к 1818 г. число элементов до пятидесяти девяти. Шведский химик Йене Берцелиус (1779-1848) сам открыл три элемента (цезий, селен и торий) и отсоединил символические обозначения элементов от чуть-чуть алхимического и неудобного для типографий стиля Дальтона, введя более практичные буквенные обозначения, используемые нами и сегодня, такие как Ce для цезия, Se для селена и Th для тория. Дальтон был чрезвычайно рассержен этим иностранным вторжением на его территорию и получил первый из своих двух ударов во время спора с коллегой о символах.
В картинке-головоломке трудно увидеть рисунок, пока не подобрано достаточно много составляющих ее фрагментов. Первый рисунок, отображающий свойства вещества, начал проявляться в 1820 г., когда собирание фрагментов было завершено почти наполовину. Существовало два аспекта этой головоломки: во-первых, качественные свойства элементов, их подобия и различия, и во-вторых, возникающая количественная характеристика атомов элементов, их атомный вес. Иоганн Доберейнер (1780-1849) из Йены, необразованный, но наблюдательный сын кучера, достигший впоследствии звания профессора университета, заметил нечто весьма необычное, нечто приводящее в гармонию эти две составляющих загадки. Он заметил, что некоторые тройки химически подобных элементов имеют атомные веса, такие, что вес одного из этих элементов близок к среднему арифметическому двух других. Например, хлор, бром и йод химически подобны, а их атомные веса равны соответственно 35, 80 и 127 (среднее от 35 и 127 равно 81). Доберейнер обнаружил три таких тройки и этим призвал к жизни идею о том, что элементы, по каким-то причинам, образуют нечто вроде гобелена.
Охота за организующим принципом началась. У меня нет намерения в деталях описывать историю этой охоты или воздавать должное всем действующим лицам, поскольку я больше заинтересован представить здесь результаты, чем усилия, затраченные на их получение. Но двое из участников заслуживают того, чтобы пригласить их на сцену. Джон Ньюлэндс (1837-98) имел англо-итальянское происхождение, и, подобно Канниццаро был настолько охвачен националистическим энтузиазмом, что в двадцать три года отправился на Сицилию сражаться вместе с краснорубашечниками Гарибальди. Остепенившись, он вернулся в Англию и обнаружил еще одну составляющую рисунка. Он увидел, что Доберейнер заметил только разбросанные триады, в то время как существует более систематический узор, по крайней мере для более легких элементов. А именно, он обнаружил, что если выстроить легкие элементы в порядке возрастания атомного веса, то подобия их свойств повторяются через каждые восемь элементов (газообразные элементы гелий, неон и аргон были в то время неизвестны). Не слишком благоразумно, с ретроспективной точки зрения, он уподобил эту повторяемость нотам музыкального ряда и отнес ее на счет своего «закона октав». Эта фантастическая аналогия дорого ему обошлась: над ним насмехались за столь возмутительное и заведомо произвольное предложение, а кое-кто предлагал ему расположить элементы по алфавиту или использовать какой-нибудь другой замысловатый критерий.
Однако он был прав. Свойства ранних элементов действительно повторяются как ноты музыкального ряда, но отнюдь не по музыкальной причине. Как мы видели, структуры атомов у элементов действительно периодически повторяются, поскольку внутренние оболочки заполняются и схема заселения орбиталей повторяется снова. Но такое теоретическое основание находилось слишком далеко в будущем, и ничем не могло помочь в начале девятнадцатого века, когда атомы еще пребывали в концептуальном младенчестве, а электроны не были известны.
Вторым участником был, конечно, Дмитрий Иванович Менделеев (1834-1907), согласно некоему источнику, младший среди детей одиннадцати, четырнадцати и семнадцати лет (триада чисел Доберейнера!), сын торговца лошадьми (Менделеев — мену делать — меняться) и матери, героически сделавшей все возможное для своего выдающегося и не по годам развитого меньшего сына. Ко времени, когда Менделеев сел писать свой предварительный главный труд по химии, Основы химии, число известных элементов достигло шестидесяти одного. Перед ним стояла проблема, как организовать материал, чтобы представить его читателю в логической, последовательной форме. Именно в этом пункте рождественская история, по-видимому, отклоняется от суровой правды.
Рождественская история рассказывает о том, как Менделеев трудился многие дни, а возможно, и недели, чтобы прийти наконец к некоторой логической организации. Истощенный этими усилиями, он заснул 17 февраля 1869 г.[21] и увидел «во сне стол, на котором все элементы лежали в нужном порядке. Проснувшись, я немедленно записал их на лист бумаги» (рис. 5.9). Еще одной популярной составляющей этой истории является то, что страсть Менделеева к раскладыванию пасьянсов для коротания времени в долгих поездках привела его к мысли записать названия элементов на карточки и раскладывать пасьянсы из них. Власть этих образов и точность с которой был датирован сон оказались такими, что заставили принять все это за чистую монету. Однако все было, по-видимому, не так: свидетельства очевидцев вступают в противоречие с обеими составляющими рождественской сказки. Сновидения не было, и даже правдоподобная сказка об элементах в виде пасьянса оказывается не столько фактом, сколько украшением.

Рис. 5.9. Факсимиле страницы из Zeitschrift für Chemie (Журнал химии) 1869 г., в котором Менделеев анонсировал раннюю версию периодической таблицы.
Какой бы ни была правда, фактом является то, что Менделеев представил миру таблицу, свою периодическую таблицу, которая собрала все элементы в некое подобие генеалогического дерева. Он использовал атомные веса для упорядочения элементов и обнаружил повторяемые подобия через периоды в восемь, восемь и восемнадцать элементов. Ему пришлось перекраивать таблицу то тут, то там (обычно это описывается как химический инсайт, но на самом деле больше похоже на метод, которым пользовался Прокруст по отношению к своим жертвам, не помещавшимся на его ложе). Так, порядок элементов, основанный на атомном весе, не везде согласовывался с картиной химического подобия, поэтому Менделеев проигнорировал этот порядок и избрал свой собственный. Теперь мы знаем, что эта процедура была правильной, поскольку атомный вес не является наилучшим критерием для упорядочивания элементов: элементы лучше всего упорядочивать по их атомным номерам и, по причинам, теперь полностью понятным, атомный вес не всегда дает точно тот же порядок, что и атомный номер. Кроме того, в таблице имелись приводящие в замешательство щели. Но в этом случае замешательство пошло на пользу дела, так как Менделеев был столь уверен в своей формулировке таблицы, что смог, с помощью интерполяции свойств известных элементов, предсказать свойства еще не открытых элементов в этих щелях. Так, он предсказал существование и свойства элементов, которые он назвал эка-алюминием и эка-кремнием (эка в санскрите значит один), позднее открытых во Франции под именем галлий и в Германии под именем германий соответственно. Он также делал и ошибки, предсказывая элементы, которых в действительности не существует; но, благодаря доброй воле благодарных последователей, эти ошибки были благополучно забыты.
Сегодня мы знаем около 110 элементов, и щели в корпусе таблицы отсутствуют. Мы знаем это потому, что атомные номера последовательно и без пропусков пробегают ряд от 1 до 110. Имеются спорадические сообщения об открытии элементов до номера 114, но они появляются и исчезают, и номер 113 все еще не появился. Это бесполезный «академический» конец периодической таблицы, и тот факт, что он с краю немного потрепан, не имеет большого практического значения.
Современная форма периодической таблицы показана на рис. 5.10. Как мы можем видеть, он повернут на 90° по сравнению с картинкой Менделеева, но основные черты его схемы легко узнать. Вертикальные колонки называются группами, а горизонтальные ряды называются периодами.

Рис. 5.10. Современная форма периодической таблицы. Я показал только некоторые элементы, т.е. которые, насколько я могу судить, достаточно хорошо известны, или стоящие во главе своих групп (K это калий, Na — натрий, Fe — железо, Pb — свинец, Sn — олово: химики время от времени залезают в латынь). Пронумерованные вертикальные колонки называются группами, а горизонтальные ряды назывался периодами. Водород (несколько идиосинкразически, но, на мой взгляд, разумно) поставлен во главе всей таблицы и не приписан ни к какой группе. Светло-серым отмечены металлы, темно-серым неметаллы, а просто серым — металлоиды, элементы, по своим свойствам застрявшие между металлами и неметаллами. Двухрядный блок элементов внизу таблицы следовало бы вставить в указанное место, но это сделало бы таблицу слишком нескладной. Таблица постепенно растет, по мере того как создаются новые элементы.
Октавы Ньюлэндса еще слышны в периодах 2 и 3, а триады Доберейнера разбросаны там и тут. Вертикальные группы содержат элементы, имеющие значительные подобия, так же как и все типы соединений, которые они образуют, и демонстрируют систематические изменения от верхнего к нижнему краю. Элементы в горизонтальных периодах демонстрируют плавное изменение при перемещении слева направо. Например, металлы оказываются в левом конце периода, а неметаллы на правом. Элементы в длинной тонкой центральной секции, такие как железо (Fe) и платина (Pt), являются переходными металлами, поскольку они представляют переход между очень реактивными металлами, такими как натрий (Na) или кальций (Ca) в левой части таблицы, и много менее реактивными металлами, такими как олово (Sn) или свинец (Pb) справа. Очень тонкая секция из двадцати восьми элементов, помещенная ниже основной части, состоит из внутренних переходных металлов. Эту полосу следовало бы, на самом деле, вставить в основную таблицу, но это сделало бы таблицу слишком длинной и тонкой для того, чтобы напечатать ее приемлемым образом. Внутренние переходные металлы все очень похожи по своим химическим свойствам и находились среди элементов, выделенных и идентифицированных в самую последнюю очередь. Самая нижняя линия, следующая за ураном (U), фактически состоит только из элементов, полученных искусственно.
Периодическая таблица все еще растет. Ученые используют ускорители частиц, чтобы швырять ядра одного элемента в ядра других элементов, в надежде, что два ядра сольются и образуют ядро еще неизвестного элемента. Так был получен элемент 112 (еще не имеющий названия). Однако такие ядра очень неустойчивы, и жизнь нескольких атомов, сделанных таким способом, была весьма быстротечной.
Я надеюсь, что теперь вы получили возможность понять, почему химики считают периодическую таблицу своей единственной самой главной концепцией. Она суммирует свойства элементов — изменение их физических свойств, таких как плотность, изменение свойств атомов, таких как их диаметры, и изменение их химических свойств, таких как число и тип связей, которые они образуют с другими атомами (рис. 5.11). Просто взглянув на нее, мы можем узнать, имеет ли элемент характерные свойства металла (железо), неметалла (сера) или чего-то промежуточного (кремний). Мы можем предвидеть химические свойства элемента, замечая свойства его соседей и думая о тенденциях, ожидаемых при движении вниз по группе или вдоль по периоду. Говоря коротко, периодическая таблица — это в высшей степени сжатое и полезное резюме свойств элементов, обладающее значительной предсказательной силой. Мы проделали долгий путь от первоначальной периодической таблицы, содержавшей землю, воздух, огонь и воду в обыкновенном квадрате!

Рис. 5.11. Периодичность свойств элементов иллюстрируется диаграммой, которая показывает диаметры атомов. Наименьшие атомы расположены ближе к верхнему правому углу. Наибольшие атомы расположены ближе к нижнему левому углу. Детали распределения хорошо понятны. Размер атомов является важным критерием для определения физических свойств (таких, как плотность) и химических свойств (таких, как число связей, которые может сформировать атом) элемента.
Менделеев составил свою таблицу эмпирически. Он ничего не знал о структуре атомов и не мог предложить внутреннего концептуального основания для своей таблицы. У нас необходимое понимание есть. Мы теперь знаем, что периодическая таблица есть отображение ритмов заполнения энергетических уровней в атомах (рис. 5.7).
Образ источника периодичности промелькнул перед нами ранее в этой главе, когда мы заметили подобие между гелием и неоном, с одной стороны, и литием и натрием, с другой, и обнаружили, что электронные структуры их атомов аналогичны: гелий и неон имеют атомы с заполненными оболочками, а в атомах лития и натрия одиночный электрон занимает s-орбиталь вне заполненных оболочек. Этот образ лежит в основании всей таблицы. Так, если переходить от атома к атому по пути возрастания атомного номера, то с каждым шагом атомный номер возрастает на единицу и потому возрастает число электронов, необходимых для компенсации заряда ядра. Каждый добавляющийся электрон занимает следующую допустимую атомную орбиталь, подчиняясь принципу запрета Паули, согласно которому одну орбиталь могут занять не более чем два электрона.
Эта последовательность соответствует внешнему виду периодической таблицы. Так, у атомов элементов из групп 1 и 2 (группы, содержащие, например, натрий и магний) s-орбиталь занята. На s-орбитали может находиться до двух электронов, что соответствует двум группам в этой части таблицы: в группе 1 на орбитали находится один электрон, а в группе 2 — два электрона. В правой стороне таблицы имеется блок из шести групп: в этих элементах электроны находятся в процессе заполнения трех p-орбиталей соответствующих оболочек атомов. На этих орбиталях может находиться до шести электронов: элементы группы 13 (такие, как бор, B) имеют один такой электрон, элементы группы 14 (такие, как углерод, C) — два, и так далее, до заполненных орбиталей в группе 18, состоящей из почти полностью инертных, так называемых благородных газов. Узкая полоса в середине таблицы, переходные металлы, состоят из элементов, в которых заполняются d-орбитали соответствующих оболочек: пять d-орбиталей могут вместить до десяти электронов, что в точности соответствует десяти элементам в каждом ряду этого блока групп. Внутренние переходные элементы являются элементами заполняются f-орбитали. В каждой оболочке имеется семь f-орбиталей, что соответствует четырнадцати членам в каждом ряду этого блока.
Мы совершили полный круг. Химики девятнадцатого века разглядели родственные отношения между элементами. Полный перечень родственных связей — настолько, насколько элементы уже были открыты — был создан Менделеевым к концу века. Однако его конструкция носила эмпирический характер, и понимания того, почему элементы приходятся друг другу кузенами, в то время быть не могло. Как же могло случиться, что один сорт вещества является родственным другому? На этот вопрос удалось пролить свет, когда в начале двадцатого века стала понятна структура атомов. Как только в 1920-х гг. были обнаружены ядра и правила, управляющие размещением электронов, немедленно стало ясно, что периодическая таблица является отображением решений уравнения Шредингера. Таблица представляет собой математическую картину вещества. С помощью двух простых идей — что электроны самоорганизуются так, чтобы занять наиболее низкий из возможных уровень энергии, и что на любой данной орбитали не могут находиться более двух электронов — устройство вещества стало доступным для понимания. Химия есть сердце понимания вещества, а в самом сердце химии лежит главное, о чем она повествует, — атомы.
20.
Коран. 21:30.
21.
По юлианскому календарю (или 1 марта по григорианскому).
Енолы и енолят-ионы
Вы будете перенаправлены на Автор24
Енолы или алкенолы ($alpha$-гидроксиалкены) — класс соединений, содержащих гидрокси группу и ненасыщенную углеродную связь, с общей формулой $R_1R_2C=CR_3OH$. Особенность енолов заключается в том, что они находятся в таутомерном равновесном состоянии с соответствующими им карбонильными соединениями — альдегидами или кетонами:
Правило Эльтекова — Эрленмейера
Известно, что олефины не могут иметь гидроксил у атома углерода в $sp2$ гибридном состоянии, поэтому такие структуры неустойчивы и изомеризуются в оксослолукы по правилу Эльтекова — Эрленмейера:
Готовые работы на аналогичную тему
- Курсовая работа Енолы и енолят-ионы 430 руб.
- Реферат Енолы и енолят-ионы 270 руб.
- Контрольная работа Енолы и енолят-ионы 240 руб.
Для структур, имеющих гидроксил у ненасыщенного атома углерода, а не извязаного с электроноакцепторными группами ($ > C=O$, $-NO_2$ и другие), правило Эльтекова — Эрленмейера всегда срабатывает, потому виниловый спирт и его гомологи не существуют, а попытки их получить завершаются перегруппировкой в соответствующий альдегид или, соответственно, в его гомологи.
Особенности енолов
Сегодня известно много соединений, правда, обычно сложных или с несколькими атомами кислорода, которые устойчивы и могут быть выделены не только карбонильной форме, но и в виде ненасыщенного спирта — енола, например:
Изомерию между карбонильным соединением и ненасыщенным спиртом-енолом образуется в результате перемещения одного атома водорода от атома углерода к кислороду. Этот процесс называют таутомерией, или десмотропией, а смеси этих ·таутомерных формам соединений, в которых оба изомера находятся в равновесии, алеотропными смесями. Подробнее таутомерия будет рассмотрена в отдельном разделе.
В случае винилового спирта перегруппировка вызывает мезомерный эффект, что идет до конца:
В результате мезомерного эффекта атом водорода гидроксильной группы отщепляется в виде протона и атакует заряд $delta$- на втором ненасыщенном атоме углерода.
Получение енолов и их производных
В отличие от енолов, эфиры и другие производные винилового спирта не только существуют в стабильном виде, но их широко используют в промышленности как мономеры. Понятно, что их получают косвенным путем.
Виниловые эфиры, как указано, получают в промышленности через присоединение к ацетилену карбоновых кислот при наличии солей ртути (II), кадмия или цинка:
Сюда надо добавить действие уксусного ангидрида на кетоны при наличии каталитических количеств серной кислоты:
и также действие кетенов на ацетальдегид:
Из виниловых эфиров особенно важен винилацетат, который полимеризуется по радикальному механизму в поливинилацетат. Поливинилацетат используют для производства эмульсионных красок и лаков, прозрачных пластмасс, в производстве стеклопакетов, для склеивания слоев силикатного стекла и для синтеза поливинилового спирта:
Поливиниловый спирт применяют в производстве синтетической крови, плазмозаменителей, эмульгаторов важных полимерных материалов. В практике используют поливиниловые спирты после их ацилирования например, бутиральдегидом (поливтилбутираль $R = C_3H_7$):
Виниловые эфиры получили А. Фаворский, М. Шостаковский и В. Реппе независимо друг от друга через взаимодействие ацетилена со спиртами:
Виниловые эфиры можно синтезировать также взаимодействием винилацетата с соответствующими спиртами. Их особенностью является гидролиз, который легко происходит в кислой среде:
Главное назначение виниловых эфиров — соединительная основа многослойных пленок, производство клеев, лаков, эмалей. Виниловые эфиры легко полимеризовать с инициированием реакции кислотами Льюиса, например, хлоридом железа (III). Так получают жидкие вяжущие полимеры, применяемые в качестве загустителей. Полимеризацией винилбутилового эфира получают бальзам Шостаковского (винилин):
Виниловые эфиры образуют и твердые сополимеры, однако только в результате гомолитичной полимеризации, инициированной пероксидами.
При нагревании алкилвиниловые эфиры перегруппировываются по Кляйзену с преобразованием в альдегиды вследствие сильного $М$-эффекта сопряженной системы:
Аллиловый спирт
До недавнего времени аллиловый спирт получали гидролизом аллилхлорида, или синтезировали хлорированием пропилена при высокой температуре за Львовым:
Еще раньше аллиловый спирт производили, нагревая глицерин с оксалатной кислотой. Эстер, образовавшийся после гидролиза, терял фрагменты оксалатной кислоты в виде углекислого газа:
Сегодня в промышленности аллиловый спирт получают изомеризации пропиленоксида.
Из аллилового спирта получают глицерин, акролеин, акриловую кислоту. Эфиры аллилового спирта используют в производстве пластмасс.
Строение аллилового спирта обусловлено, с одной стороны, его ненасыщенностью, состоящей, например, в способности этого соединения присоединять два атома галогена или водорода. С другой стороны, аллиловый спирт можно окислять до ненасыщенного альдегида — акролеина, и далее — до ненасыщенной кислоты (акриловой кислоты), это свидетельствует о наличии первичной спиртовой группы. Каталитическое восстановление аллилового спирта водородом при наличии платины или никеля дает нормальный пропиловый спирт.
Енолят-анионы и енамины. Таутомерия. Альдольные реакции
Енолят-анионы и енамины
Карбонильная группа полярна и частично положительный заряд с ее атома углерода передается на соседний (a-атом) углерода, делая соединенные с ним атомы водорода подвижными.
Альдегиды и кетоны могут проявлять, таким образом, свойства С-Н-кислот. Конечно, кислотность карбонильных соединений очень мала, тем не менее именно кислотностью a-атомов водорода объясняются многие их химические свойства. Кислотность a водородов в альдегидах и кетонах объясняется, прежде всего, тем, что при этом анион, образующийся из них при отщеплении протона, стабилизирован резонансом. Отрицательный заряд в нем делокализован.
 (1)
(1)
Резонансно стабилизированный анион может присоединять протон или к атому углерода или к атому кислорода. В первом случае образуется кетонная форма, а во втором енольная форма.
Енолят-анионы могут реагировать с алкилгалогенидами по механизму SN2
 (2)
(2)
или с альдегидами и кетонами
 (3)
(3)
енолят-анион кетон тетраэдральный промежуточный
к карбонильной группе
Итак, подвижный атом водорода, хотя и очень медленно может переходить к кислороду с образованием, так называемой, енольной формы:
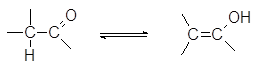
Кетонные и енольные формы карбонильных соединений являются своеобразными структурными изомерами. Поскольку эти изомеры легко переходят друг в друга под действием кислот или оснований для такого вида изомерии используется специальный термин таутомерия.
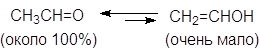
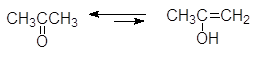
Енольная форма обычных альдегидов и кетонов не была выделена в чистом виде, т.к. она быстро превращается в карбонильную форму.
Для b-дикарбонильных соединений енольная форма может быть выделена в чистом виде, так как у этих соединений енольные формы достаточно стабильны, причем в некоторых случаях они даже более стабильны, чем карбонильные.
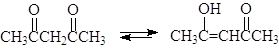
2,4-пентандион (24%) енольная форма (76%)
Cтабильность енольной формы b-дикарбонильных соединений объясняется возникающим сопряжением и образованием внутримолекулярной водородной связи:
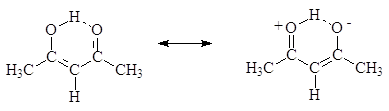
Превращение карбонильных и енольных форм друг в друга является примером таутомерного превращения, понятие о котором мы теперь можем сформулировать в общем виде.
Термин таутомерия обозначает обратимое превращение органических соединений. Чаще всего таутомерия относится к миграции протонов, т.е. перемещению протона от одного атома к другому, при котором, как правило, происходит перемещение двойной связи. В определенном смысле таутомерный сдвиг протонов является внутримолекулярным кислотно-основным превращением. Возникающие при миграции протона изомеры называют таутомерами.
При таутомерных превращениях оптических изомеров они могут превращаться в рацемическую смесь. Например, (R)-втор-бутилфенилкетон при стоянии перестает вращать плоскость поляризованного света.
 (4)
(4)
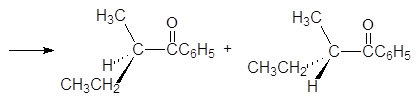
Упр. 1. Напишите формулу 2,4-циклогексадиен-1-она и объясните, почему он существует практически только в енольной форме?
При действии на ацетальдегид разбавленного раствора NaOH при обычной или даже пониженной температуре происходит его димеризация с образованием 3-гидроксибутаналя. Поскольку 3-гидроксибутаналь одновременно является альдегидом и спиртом (алкоголь) его обычно называют “альдоль”, а реакции такого типа стали называть альдольными реакциями или реакциями альдольного присоединения.
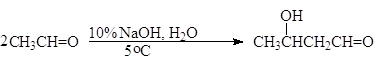
Кетоны также вступают в катализируемое основаниями альдольное присоединение, равновесие не столь благоприятно, как в случае альдегидов. Это препятствие преодолевается проведением реакции в условиях быстрого выведения продукта из реакционной смеси. Из ацетона, например, таким путем может быть получен диацетоновый спирт:

Альдольное присоединение проходит по трехстадийному механизму. На первой стадии основание (гидроксид-анион) отрывает протон от a углерода молекулы ацетальдегида давая енолят-ион с делокализованным отрицательным зарядом:
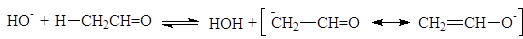 (М 1) енолят-анион
(М 1) енолят-анион
На второй стадии енолят-анион выступает в роли нуклеофила и атакует карбонильный атом углерода другой молекулы ацетальдегида. На этой стадии образуется алкоксид-анион.

На третьей стадии алкоксид-анион отрывает протон от молекулы воды и превращается в альдоль.
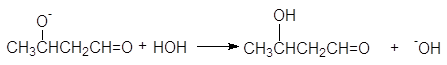
более сильное адьдоль менее сильное основание
В механизме альдольного присоединения проявляются два основных свойства карбонильных соединений: кислотность a водородов и склонность карбонильной группы к реакциям нуклеофильного присоединения.
Если реакционную смесь, образующуюся при альдольном присоединии, нагреть то происходит дегидратация, приводящая к образованию кротонового альдегида (2-бутеналя):
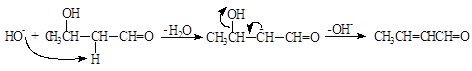 (7)
(7)
Следует помнить, что подвижными в карбонильных соединениях являются лишь a-атомы водорода.
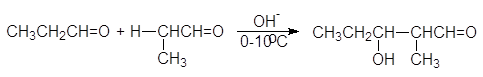 (8)
(8)
Упр 2. На примере пропионового альдегида разберите механизм альдольного присоединения в условиях щелочногo катализа.
Дегидратация легко происходит по тому, что участвующий в ней a водород подвижен, а в образующемся продукте возникает сопряжение. В некоторых альдольных реакциях дегидратация осуществляется так легко, что альдоль выделить и не удается.
Превращение альдегида в непредельный альдегид через альдоль называется альдольной (кротоновой) конденсацией. Конденсацией называют реакцию, в результате которой молекулы соединяясь, выделяют небольшие молекулы таких веществ как вода или спирт.
продукт присоединения продукт конденсации
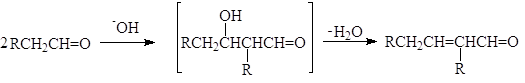
не выделяют еналь

В такую же конденсацию вступают и кетоны

Альдольная конденсация может катализироваться и кислотами. Так, ацетон в присутствии HCl превращается в 4-метил-3-пентен-2-он. Реакция начинается с образования енола:
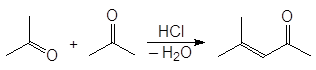 (9)
(9)
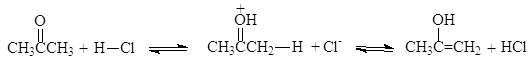 (М 2)
(М 2)
Енол далее присоединяется к протонированной форме другой молекулы ацетона:
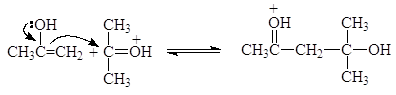
Затем происходит дегидратация и образуется 4-метил-3-пентен-2-он (окись мезитила):
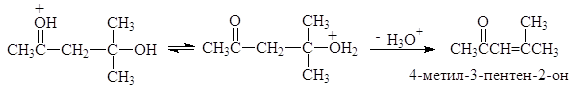
В альдольных реакциях могут участвовать и два различных карбонильных соединения. В этом случае их называют перекрестными альдольными реакциями. Использование в перекресной альдольной реакции карбонильных соединений, каждое из которых имеет a водороды не рационально, так как при этом образуются многокомпонентные смеси продуктов реакции.
Частным случаем перекресной альдольной конденсации является реакция Клайзена-Шмидта. Она заключается в конденсации ароматических альдегидов с алифатическими и жирноароматическими альдегидами и кетонами в присутствии водных растворов щелочей и приводит к образованию a,b-ненасыщенных альдегидов или кетонов.
 (10)
(10)
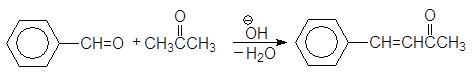 (11)
(11)
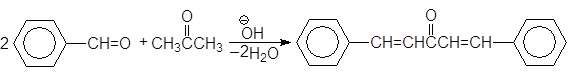 (12)
(12)
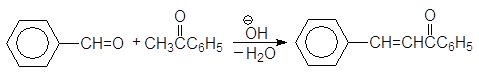 (13)
(13)
Дикарбонильные соединения легко вступают во внутримолекулярные альдольные реакции особенно в том случае, когда при этом образуются пяти и шестичленные циклы:
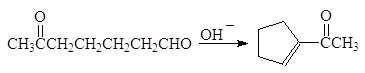 (14)
(14)
Упр. 3. Напишите реакции альдольного присоединения (а) бутаналя,
(б) циклогексанона, (в) фенилацетальдегида и (г) циклопентанона.
Продукты альдольного присоединения образуются в результате нуклеофильного присоединенния a-углеродного атома одной молекулы к карбонильной группе другой.
(а) 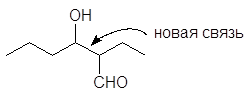 (б)
(б) 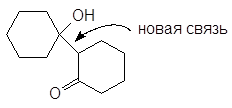
Упр. 4. Нарисуйте продукты дегидратации альдолей из упр.3
(а) (б)
(б)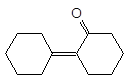
Упр. 5. Катализируемая кислотой альдольная конденсация ацетона может приводить и к образованию 2,6-диметил-2,5-гептадиен-4-она (форона). Напишите эту реакцию и объясните ее механизм.
Упр. 6. Нагревание ацетона с серной кислотой приводит к образованию
1,3,5-триметилбензола (мезитилена). Напишите эту реакцию.
Упр. 7. Нарисуйте прдукты катализируемых щелочью следующих реакций альдольного присоединения: (а) бутаналь, (б) циклогексанон, (в)фенилацетальдегид, (г) циклопентанон
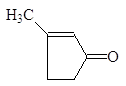 Упр. 9. Напишите внутримолекулярные реакции альдольной конденсации, приводящие к образованию
Упр. 9. Напишите внутримолекулярные реакции альдольной конденсации, приводящие к образованию
Большая Энциклопедия Нефти и Газа
Енолят-ион
Енолят-ион , образующийся при восстановлении а р-ненасыщенных карбонильных соединений в жидком аммиаке или в ГМФТА, способен вступать во многие региоспецифические реакции под действием самых разнообразных электрофильных агентов. Подробно эти реакции будут рассмотрены в гл. С-алкилирование литиевого енолята 2-метилциклогексанона, образующегося при восстановлении 2-метилциклогексен — 2-она. [1]
Образуется енолят-ион , который в отличие от обычного алкоксидно-го иона обладает сопряженной системой — неподеленная электронная пара кислородного атома и л-связь СС. Группа — ОН и тем более — О: — действуют как сильные электронодоноры. [2]
Когда енолят-ион служит продуктом одной из стадий химической последовательности, как, например, при синтезе ( 140) из ( 138) схема ( 224), то последний иногда лучше сначала превратить в силильное производное, ( 138) — — ( 139), а затем регенерировать, ( 139) — ( 138), для использования в следующей реакции. [3]
Когда енолят-ион служит продуктом одной из стадий хими ческой последовательности, как, например, при синтезе ( 14 ( Г из ( 138) схема ( 224), то последний иногда лучше сначал; превратить в силильное производное, ( 138) — — ( 139), а затем реге нерировать, ( 139) — — ( 138), для использования в следующей реак ции. [4]
Устойчивость енолят-ионов зависит от прочности связи между металлом и кислородом. Еноляты магния не обладают такой же реакционной способностью, как еноляты меди или лития. Устойчивость зависит также от протяженности области свободной циркуляции электронов. Эта область может охватывать 3 — 7 атомов в зависимости от исходной структуры. [5]
Образование енолят-ионов еще легче происходит, если атом углерода расположен между двумя активирующими функциональными группами: область резонанса охватывает тогда пять атомов. [6]
Стабилизация енолят-иона за счет сопряжения уменьшает величину ДС для депротонирования карбонильного соединения и уменьшает тем самым значение рЛ а для карбонильных соединений по сравнению с алканом. [8]
Наличие енолят-иона в реакциях полимеризации и альдоль-ной конденсации, где электрофильносгь карбонильного атома углерода компенсирует слабую нуклеофильность енолят-иона, весьма вероятно. [9]
Протежирование енолят-иона идет в основном по кислороду, так как этот атом более отрицателен, чем атом углерода, что приводит к енолу 9, который таутомеризуется. Поэтому, хотя общий результат реакции — это присоединение к двойной углерод-углеродной связи, механизм на самом деле представляет собой нуклеофильное 1 4-присоединение к системе С С-С О ( или аналогичной системе) и поэтому очень похож на механизм присоединения к двойной углерод-кислородной или другим сходным связям ( см. гл. Когда Z представляет собой группу CN или С О, то Y — может атаковать и этот атом углерода, и такая реакция иногда конкурирует с основной. Этот процесс называется 1 2-присоединением. Присоединение к этим субстратам известно также под названием сопряженного присоединения. [10]
Образование енолят-ионов 1 3 — Дикарбонилъных соединений — малонового эфира, ацетоуксусного эфира и других 1 3-кетоэфиров облегчается при наличии двух электроноакцепторных заместителей — карбонильной и карбалкоксильной групп. Енолят-ионы малонового и ацетоуксусного эфира обладают более высокой стабильностью по сравнению с енолят-ионами кетонов и сложных эфиров одноосновных кислот вследствие более эффективной делокализации заряда с помощью обоих акцепторных заместителей. Это отражается на низкой величине рЛ а этих соединений. Щелочные соли малонового эфира и 1 3-кетоэфиров количественно получаются нз исходных С — Н кислот с помощью самых разнообразных оснований: СНзСЩОКа; ( СНз) зСОК; NaH, KH, ЛДА и др. в спирте или в апротоииой среде и легко могут быть выделены в индивидуальном виде и храниться в течение длительного времени. [11]
Присоединение енолят-ионов 1 3-дикарбонилъных соединений и кетонов проводится, как правило, в протонной среде — этаноле, который протонирует анионный аддукт с образованием конечного продукта сопряженного присоединения. В качестве основания обычно используют этилат натрия или третичный амин. Ниже прна едены некоторые типичные примеры присоединения енолят-ионов к а р-ненаеыщенным кетонам, сложным эфирам и нитрилам. [12]
Ацилирование енолят-ионов кетонов ангидридами и галогенангидридами кислот осуществляется в полном соответствии с принципом ЖМКО по атому кислорода. Однако такое направленне реакции характерно только в том случае, когда раствор щелочного енолята медленно прибавляется к избытку ацилирующего агента в растворе ТГФ, ДМЭ или диполярного апротонного растворителя. [13]
Однако если енолят-ион взаимодействует с сильными кислотами — то протонирование является сильно экзотермической реакцией, и переходное состояние достигается очень рано. В соответствии с этим имеет место быстрое протонирование по кислороду с образованием енола, который затем медленно изомеризуется в более устойчивую кетонную форму. Установлено, что некоторые сильно экзотермичные реакции алкилиро-вания идут по кислороду, приводя к образованию эфиров енолов. Факторы, которые обусловливают тот или другой тип взаимодействия, еще исследуются. [14]
Стерический объем енолят-иона оказывает, по-видимому, лишь незначительное влияние на общую, легкость протекания реакции, хотя объемные группы в орго-положении по отношению к нуклеофугному заместителю будут блокировать замещение в анионах стерически затрудненных енолятов. [15]
Енолы и енолят-ионы
При действии на ацетальдегид разбавленного раствора NaOH при обычной или даже пониженной температуре происходит его димеризация с образованием 3-гидроксибутаналя. Поскольку 3-гидроксибутаналь одновременно является альдегидом и спиртом (алкоголь) его обычно называют “альдоль”
, а реакции такого типа стали называть альдольными реакциями нефтьмагистраль
или реакциями альдольного присоединения.
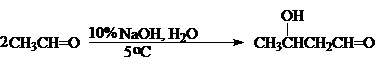
Кетоны также вступают в катализируемое основаниями альдольное присоединение, равновесие не столь благоприятно, как в случае альдегидов. Это препятствие преодолевается проведением реакции в условиях быстрого выведения продукта из реакционной смеси. Из ацетона, например, таким путем может быть получен диацетоновый спирт:
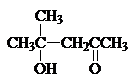

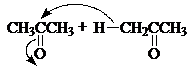
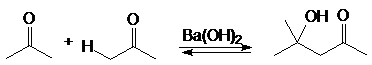
Альдольное присоединение проходит по трехстадийному механизму. На первой стадии основание (гидроксид-анион) отрывает протон от a углерода молекулы ацетальдегида давая енолят-ион с делокализованным отрицательным зарядом:
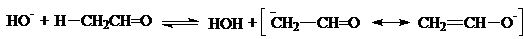 (М 1)
(М 1)
На второй стадии енолят-анион выступает в роли нуклеофила и атакует карбонильный атом углерода другой молекулы ацетальдегида. На этой стадии образуется алкоксид-анион.
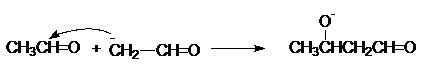
На третьей стадии алкоксид-анион отрывает протон от молекулы воды и превращается в альдоль.
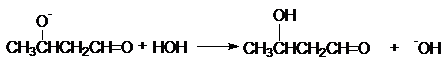
более сильное адьдоль менее сильное основание
В механизме альдольного присоединения проявляются два основных свойства карбонильных соединений: кислотность a водородов и склонность карбонильной группы к реакциям нуклеофильного присоединения.
Если реакционную смесь, образующуюся при альдольном присоединии, нагреть то происходит дегидратация, приводящая к образованию кротонового альдегида (2-бутеналя):
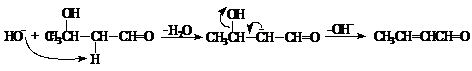 (7)
(7)
Следует помнить, что подвижными в карбонильных соединениях являются лишь a-атомы водорода.
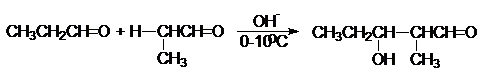 (8)
(8)
На примере пропионового альдегида разберите механизм альдольного присоединения в условиях щелочногo катализа.
Дегидратация легко происходит по тому, что участвующий в ней a водород подвижен, а в образующемся продукте возникает сопряжение. В некоторых альдольных реакциях дегидратация осуществляется так легко, что альдоль выделить и не удается.
Превращение альдегида в непредельный альдегид через альдоль называется альдольной (кротоновой) конденсацией. Конденсацией называют реакцию, в результате которой молекулы соединяясь, выделяют небольшие молекулы таких веществ как вода или спирт.
продукт присоединения продукт конденсации
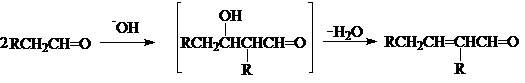
не выделяют еналь
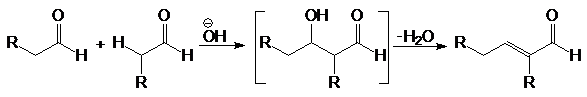
В такую же конденсацию вступают и кетоны
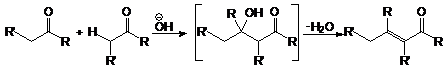
Альдольная конденсация может катализироваться и кислотами. Так, ацетон в присутствии HCl превращается в 4-метил-3-пентен-2-он. Реакция начинается с образования енола:
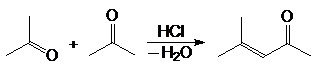 (9)
(9)
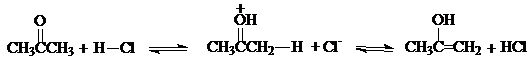 (М 2)
(М 2)
Енол далее присоединяется к протонированной форме другой молекулы ацетона:

Затем происходит дегидратация и образуется 4-метил-3-пентен-2-он (окись мезитила):
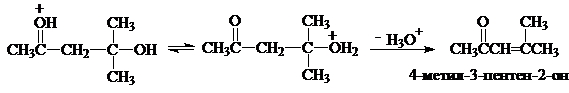
В альдольных реакциях могут участвовать и два различных карбонильных соединения. В этом случае их называют перекрестными альдольными реакциями.
Использование в перекресной альдольной реакции карбонильных соединений, каждое из которых имеет a водороды не рационально, так как при этом образуются многокомпонентные смеси продуктов реакции.
Частным случаем перекресной альдольной конденсации является реакция Клайзена-Шмидта. Она заключается в конденсации ароматических альдегидов с алифатическими и жирноароматическими альдегидами и кетонами в присутствии водных растворов щелочей и приводит к образованию a,b-ненасыщенных альдегидов или кетонов.
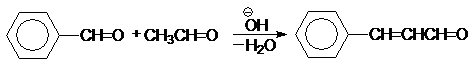 (10)
(10)
Смотрите также
Выбор конструкционного материала аппарата и опор
Оборудование современных процессов нефтепереработки и нефтехимии должно работать при низких и высоких температурах, значительных механических напряжениях, в агрессивных рабочих средах. Поэтому мате .
Материал для химического кружка
Изложенный в дипломной работе материал может быть использован в школьном курсе химии при подготовке и проведении интегрированных уроков (химия и биология, химия и экология) или в химическом кружке. .
Адсорбция
Адсорбция (от лат. ad — на, при и sorbeo — поглощаю), поглощение к.-л. вещества из газообразной среды или раствора поверхностным слоем жидкости или твёрдого тела. Например, если поместить в .
Енолы
Енолы — α-гидроксиалкены, соединения общей формулы R 1 R 2 C=CR 3 OH. Енолы находятся в таутомерном равновесии с соответствующим карбонильным соединением — альдегидом или кетоном:
Карбонильная форма термодинамически выгодней енольной на 54 — 71 кдж/моль; согласно правилу Эльтекова, поэтому в большинстве случаев кетоформа в равновесной смеси преобладает. Так, в ацетоне енольная форма составляет лишь 2.4⋅10 −6, в циклогексаноне — 2.5⋅10 −6.
При повышении кислотности протонов в α-положении к карбонильной группе содержание енольной формы возрастает, в случае β-дикарбонильных соединениях за счёт стабилизации енольной формы при образовании внутримолекулярной водородной связи, участвующей в шестичленном плоском цикле, содержание енольной формы повышается. В ацетоуксусном эфире около 7 %, а в ацетилацетоне — 76 %:
В тех случаях, когда содержание енольной формы составляет порядка процента, её можно отделить, например используя общее правило, что внутримолекулярно-хелатированные енолы более летучи и в то же время труднее кристаллизуются. Енольную форму можно оттитровать, при этом титрование проводят быстро, чтобы равновесие енол-кетон не успело восстановить концентрации.
Енолят-ионы часто генерируют из соответствующих карбонильных соединений при низких температурах. Чаще всего для этого применяют ЛДА или гексаметилдисилазиды щелочных металлов или алкиллитиевые соединения при −78 °C. Енолят-ионы стабилизированы за счёт мезомерии см. Теория химического строения и являются амбидентантными нуклеофилами:
подходящим, поскольку оно превращает субстрат в енолят — ион нацело и исчезает вероятность протекания реакции енолят — иона с оставшимся субстратом. Так, кетоны
подходящим, поскольку оно превращает субстрат в енолят — ион нацело и исчезает вероятность протекания реакции енолят — иона с оставшимся субстратом. Так, кетоны
Cl3C — промежуточном состоянии между sp3 и sp2 — гибридизациями например, в енолят — анионах и sp1 — гибридизации в ацетиленидах R — С C — Ионизация под действием
и карбоновых кислот, исследовал независимо от Эльтекова перегруппировку енолов в альдегиды и кетоны, а также пинаколиновую перегруппировку, установил структурную
β — гидроксикарбоновых кислот 3 В качестве интермедиата в реакции образуется цинковый енолят который иногда называют енолятом Реформатского Реакции Реформатского
комнатной температуре. Сквараиновой кислоте приписывают структуру енола однако для енола она является весьма сильной кислотой и по значению константы кислотности
присутствии катализатора межфазного переноса удаётся защищать также спирты, енолы и тиолы. В присутствии DMAP с ди — трет — бутилдикарбонатом реагируют даже амиды
краситель. Лейкоформу получают путем восстановления в щелочах с формированием енола кубование Индиго является крупнотоннажным потребляемым в больших количествах
Марковникова. Если в этом случае изначально был взят алкин, то образовавшийся енол подвергнется кетоенольной таутомеризации по правилу Эльтекова — Эрленмейера
фосфоенолпируват — карбоксикиназойruen. Образующийся при декарбоксилировании енолят — ион фосфорилируется гуанозинтрифосфатом ГТФ или инозинтрифосфатом. Фосфоенолпируват
енолизация кетона с образованием нуклеофильного енола после чего иминиевый ион атакует C — нуклеофильный центр енола с образованием основания Манниха: Кроме смеси
Гипогалогенит содержащий галоген в степени окисления 1 электрофильно атакует енол 2 Когда α — положение полностью галогенировано, происходит нуклеофильное
- легко превращается в ацетальдегид. Получены его простые и сложные эфиры. Енолы Большая Советская энциклопедия в 30 т. А. М. Прохоров гл. ред.
- фосфорной и карбоновых кислот, а также слабых кислот, какими являются тиолы и енолы 1. Фосфоангидридная связь. ΔG — 32 кДж моль. Представители: все нуклеозидтрифосфаты
- Обычно преобладают реакции по атому углерода при этом енолят — ионы активнее енолов Енолы и еноляты часто применяются в реакциях конденсации, например
- карбонильной группе. Триметилсилиловые эфиры енолов могут также быть использованы в качестве эквивалента енола в конденсации Мукайямы альдольной конденсации
- енолизация кетонов по обе стороны от карбонильной группы а образовавшиеся енолы окисляются по кратным связям с расщеплением молекулы. Легче расщепляется
- α — метиленовой группой и превращающееся под действием катализатора в енолят — ион или енол называют метиленовой компонентой. Очевидно, что карбонильной компонентой
- может протекать через образование енола эфира силильного енола в реакции Мукаяма — Михаэля, или чаще — через енолят — ион. В последнем случае стабилизированное
- ацетиленкарбоновых кислот. В качестве катализатора используют основания. Ацилирование енола 1, 3 кетоальдегида диэтоксифосфинилалкановыми кислотами способствует образованию
- способность амбидентных енолят — ионов. Дис д — ра хим.наук. Москва, МГУ. 1974 г. Реутов О. А., Курц А. Л. Успехи химии амбидентных енолят — и фенолят — ионов
- подходящим, поскольку оно превращает субстрат в енолят — ион нацело и исчезает вероятность протекания реакции енолят — иона с оставшимся субстратом. Так, кетоны
- подходящим, поскольку оно превращает субстрат в енолят — ион нацело и исчезает вероятность протекания реакции енолят — иона с оставшимся субстратом. Так, кетоны
- Cl3C — промежуточном состоянии между sp3 и sp2 — гибридизациями например, в енолят — анионах и sp1 — гибридизации в ацетиленидах R — С C — Ионизация под действием
- и карбоновых кислот, исследовал независимо от Эльтекова перегруппировку енолов в альдегиды и кетоны, а также пинаколиновую перегруппировку, установил структурную
- β — гидроксикарбоновых кислот 3 В качестве интермедиата в реакции образуется цинковый енолят который иногда называют енолятом Реформатского Реакции Реформатского
- комнатной температуре. Сквараиновой кислоте приписывают структуру енола однако для енола она является весьма сильной кислотой и по значению константы кислотности
- присутствии катализатора межфазного переноса удаётся защищать также спирты, енолы и тиолы. В присутствии DMAP с ди — трет — бутилдикарбонатом реагируют даже амиды
- краситель. Лейкоформу получают путем восстановления в щелочах с формированием енола кубование Индиго является крупнотоннажным потребляемым в больших количествах
- Марковникова. Если в этом случае изначально был взят алкин, то образовавшийся енол подвергнется кетоенольной таутомеризации по правилу Эльтекова — Эрленмейера
- фосфоенолпируват — карбоксикиназойruen. Образующийся при декарбоксилировании енолят — ион фосфорилируется гуанозинтрифосфатом ГТФ или инозинтрифосфатом. Фосфоенолпируват
- енолизация кетона с образованием нуклеофильного енола после чего иминиевый ион атакует C — нуклеофильный центр енола с образованием основания Манниха: Кроме смеси
- реагируют с альдегидом. Только альдегиды, которые не могут сформировать енолят ион, подвергаются реакции Канниццаро. Такие альдегиды не могут иметь енолизуемого
- перегруппировки Фаворского — депротонирование галогенкетона с образованием енолят — аниона, после чего А.А. Ахрем, Т.К. Устынюк, Ю.А. Титов. Успехи химии, 1970
- форму протекает и в отсутствие сильных оснований. Образующиеся при этом енолы как правило, намного менее стабильны, чем карбонильная форма, например
- которой присоединяется молекула воды с промежуточным образованием нестойкого енола изомеризующегося в карбонильное соединение: R C C R H g 2 H
- структурных факторов, среды и температуры на положение внутрихепатного енол — енольного и енол — тиольного равновесия Методами спектроскопии ЯМР и кондуктометрии
- ацилические, так и циклические алкены в том числе и циклические эфиры енолов и кислородные гетероциклические соединения в качестве карбонильной компоненты
- возможность хлорировать карбонильные соединения региоселективно при условии, что енолят или силиловый эфир получены также с необходимой региоселективностью. Также
- альдегида, 2 — азидо — 1, 1 — диметоксиэтан вступает в типичные реакции конденсации с енолами и енолятами. Часто азидную группу в полученных продуктах восстанавливают
- литиевые еноляты, которые при обработке этилхлорформиатом дают карбонаты енолов Енолизацию при этом важно проводить в присутствии ГМФТА, поскольку тогда
- Гипогалогенит содержащий галоген в степени окисления 1 электрофильно атакует енол 2 Когда α — положение полностью галогенировано, происходит нуклеофильное
Енолы и енолят-ионы





В. Енолизация и таутомерия
В обзор химических структур и реакций необходимо включить рассмотрение такого класса соединений, для которого два структурно отличающихся изомера могут быстро превращаться друг в друга. Это явление называют енолизацией или таутомерией (от греческого tauto — тот же самый); оно обычно включает перемещение протона внутри молекулы от одного атома к другому, отстоящему от первого на три атома. Ниже схематически изображено такое превращение:
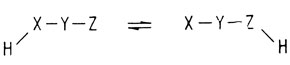
Хорошо известна таутомерия для карбонильных соединений, содержащих водород у атома углерода, соседнего с карбонильной группой
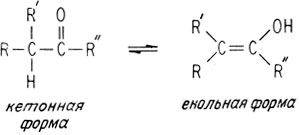
Этот тип таутомерии называют енолизацией (енол — это сокращение, образованное окончаниями слов алкен и алкоголь). Приведенное выше равновесие обычно сильно сдвинуто в сторону кетонной формы. При наличии в структуре соединения некоторых особенностей равновесие может быть сдвинуто в сторону енольной структуры. Например, присутствие у атома углерода, несущего водород, такого заместителя, как ацил или нитрил, способствует енолизации.
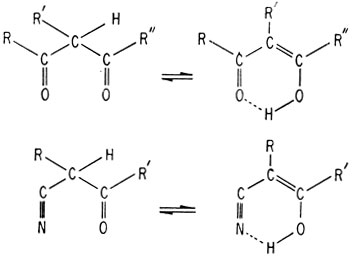
В обоих случаях енольная форма предпочтительна вследствие стабилизации за счет внутримолекулярной водородной связи хелатного типа (от греческого chele — клешня). В табл. 7 приведены некоторые карбонилсодержащие соединения и доля в них енольной формы.
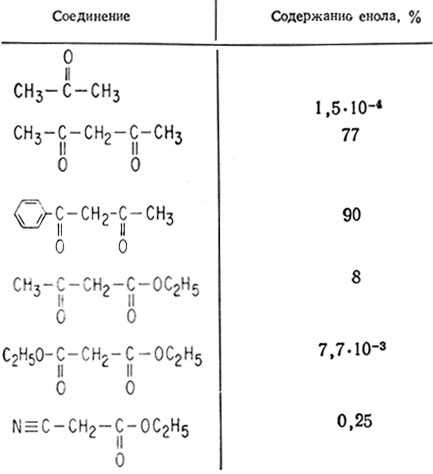
Таблица 7. Степень енолизации некоторых карбонильных соединений
В присутствии сильного основания возможно образование енолят-иона
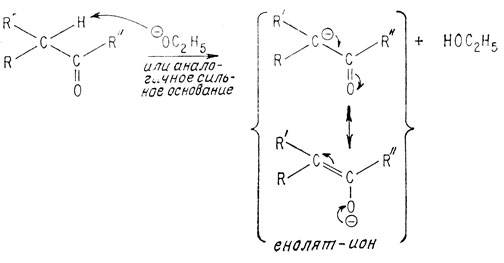
Атомы в енолят-ионе остаются на своих местах в обеих приведенных выше формулах. Перемещаются только электроны. Такая делокализация является одним из примеров резонанса. Истинную структуру лучше изображать как
Еще многие другие системы в органической химии способны к аналогичному кето-енольной таутомерии изменению структуры. Планарностью пептидных связей белков обусловлены многие особенности их пространственной структуры. Полинг наглядно показал, что таутомерия — один из наиболее существенных факторов, способствующих сохранению плоского расположения пептидной связи.
В структурах нуклеотидов таутомерия играет роль при связывании пиримидиновых оснований с рибозой нуклеозидов. Рассмотрим, например, пиримидиновое основание урацила:
Можно построить три различные структуры. Соответствующий нуклеозид (уридин), входящий в биологические системы, образует кето-енольные структуры.
Другим примером, в котором важную роль играет таутомерия, является система оксипиридин-пиридон
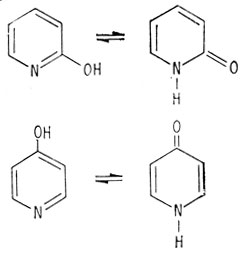
Таутомерные превращения такого рода существенны для проявления многих биологических функций производных никотинамида.
Часто встречаются таутомерные превращения типа имин — енамин. Имины часто называют шиффовыми основаниями и синтезируют взаимодействием карбонильных соединений с аминами. Таутомерное превращение происходит в том случае, если у атома углерода, расположенного рядом с иминогруппой, имеется водород.
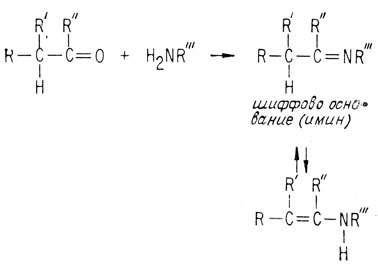
Это лишь немногие примеры многочисленных таутомерных превращений, наблюдаемых для органических соединений. Они должны показать, насколько общей и существенной является таутомерия.
Содержание:
Водород как химический элемент:
В 1766 г. английский ученый Г. Кавендиш открыл «горючий воздух». В 1783 г. в Париже Ж. Шарлем был запущен шар, заполненный водородом (рис. 25), в 1787 г. А. Лавуазье объяснил, что открытый Г. Кавендишем «горючий воздух» входит в состав воды, и дал ему название «gidrogenium» (Hydrogenium), что означает «рождающий воду». В настоящее время водород обозначается первой буквой этого слова — Н.
- Химический знак — Н.
- Формула простого вещества —
- Валентность — 1.
- Относительная атомная масса — 1,0078.
- Относительная молекулярная масса
В свободном виде водород встречается на Земле в малом количестве.
Он выделяется вместе с другими газами при вулканическом извержении и добыче нефти. Но он широко распространен в виде соединений. Водород — это элемент, образующий наибольшее число соединений. Он составляет 0,88% общей массы земной коры и воздуха. Он составляет 1/9 часть массы молекулы воды, входит в состав всех растительных и животных организмов, нефти, природных газов, ряда минералов.
Определение водорода
Водород — самый распространенный во Вселенной элемент. Он составляет основную часть массы Солнца и других звезд. Водород входит в состав газообразных туманностей, межзвездного газа, звезд во Вселенной, где его атомы превращаются в атомы гелия. Этот процесс происходит с выделением энергии (термоядерная реакция), что служит для многих звезд, в том числе и Солнца, основным источником энергии.
Рис.23 Полет воздушного шара, заполненного водородом. Париж, 1783 г.
Эта энергия необходима для многих природных процессов. Солнечная энергия согревает Землю, приводит в движение воздушные массы атмосферы и воду рек, морей и океанов, обеспечивает процесс фотосинтеза у зеленых растений, наконец, является основным условием для существования жизни.
Водород широко распространен на Земле в виде свободной воды, кристаллизационной воды минералов, метана и углеводородов нефти, различных гидроксидов, растительной и животной биомассы, органического вещества почвы.
Водород и кислоты
Среди соединений водорода, встречающихся в природе, особое место занимают кислоты (кислые воды).
Вспомните услаждающий вкус газированной воды и других прохладительных напитков или сок урюка и кислый вкус ревеня в жаркий летний день. Наверное, каждый знает кисловатый вкус лимона. В природе встречается очень много кислот.
В плодах цитрусовых (лимон, апельсин, мандарин) содержится лимонная кислота, в свежих фруктах (яблоки, айва, фанат) — яблочная кислота, в листьях щавеля и подорожника — щавелевая кислота, в брюшке у муравьев (а также в яде пчел) — муравьиная кислота, в газированной воде содержится угольная кислота.
Многие для приготовления пищи, а особенно печеного, используют уксусную кислоту, которая также применяется для приготовления консервов из овощей. Известно, что уксусную кислоту можно получить брожением винограда или яблок. Если вы будете наблюдать за прокисанием молока, то узнаете, что причиной этого является молочная кислота. В сельской местности готовят силос, в результате чего образуются молочная, масляная и другие кислоты. Для всех вышеназванных кислот характерен кислый вкус, и все они являются соединениями водорода.
Такие вещества, как лакмус, метилоранж, универсальный индикатор, по-разному окрашиваются в растворах кислот: лакмус краснеет, метилоранж становится розовым, универсальный индикатор приобретает красную окраску (рис. 26).
При взаимодействии металлов (магний, цинк, железо, медь) с растворами кислот (неорганических кислот, полученных синтетическим путем) реакция протекает по-разному, в частности, магний вытесняет водород из кислоты быстрее, цинк и железо — медленнее, а медь вообще не вытесняет.
Значит, кислоты — это вещества, которые обладают следующими общими свойствами:
- растворы кислот обладают кислым вкусом (в этом можно убедиться на примере природных кислот; пробовать на вкус синтетические кислоты опасно для жизни);
- растворы кислот изменяют окраску индикаторов;
- водные растворы почти всех кислот, взаимодействуя с целым рядом химически активных металлов, теряют водород.
Помимо натуральных есть еще синтетические кислоты, производимые химической промышленностью, которые также являются водородными соединениями. Всем известно, что при желудочно-кишечных расстройствах по указанию врача необходимо принимать слабый раствор соляной кислоты, или то, что серная кислота применяется в аккумуляторных батареях автомобилей.
Кислоты — это сложные вещества, которые обладают некоторыми общими свойствами.
Вещества, меняющие свою окраску в зависимости от специфических свойств соединений, называются индикаторами.
Рис. 26. Влияние растворов кислот на индикаторы
Получение водорода
Валентность водорода всегда постоянна и равна 1. Поэтому в соединениях, состоящих из двух элементов (бинарных соединениях), одним из которых является водород, число его атомов показывает валентность другого элемента:
Следовательно, благодаря тому что водород обладает постоянной валентностью, по нему легко определить валентность других элементов.
Рис. 27. Вытеснение водорода цинком из соляной кислоты
Получение водорода в лаборатории
В лаборатории водород получают в результате взаимодействия цинка или железа с соляной кислотой (рис. 27):
Для этого используют специальную установку или аппарат Киппа (рис. 28).
Аппарат Киппа в любое время готов к работе, которую можно прекратить также в любой момент.
Аппарат состоит из сосуда А и воронки Б и представляет собой соединенные между собой шарообразные и полушарообразные полые резервуары. При установлении воронки Б между ее концом и узкой частью соединения шара и полушара возникает щель. Через тубус В засыпаются кусочки металла такого размера, чтобы они не проходили через шель. В воронку наливается раствор кислоты, который заполняет полушар и достигает, проходя через щель, кусочки металла. Затем подача кислоты прекращается. Между металлом и кислотой протекает реакция, начинает выделяться газ, который выводится наружу посредством газоотводной трубки Г с пробкой, установленной на тубусе. По окончании опыта кран Г закрывается. В результате перекрывается путь для выхода газа. Газ, собираясь, оказывает давление на кислоту, кислота начинает подниматься по воронке, не соприкасаясь с кусочками металла, и в результате реакция прекращается. В шарообразной части сосуда можно хранить водород для его последующего использования.
В случае отсутствия аппарата Киппа из имеющейся в лаборатории посуды можно легко изготовить специальную установку. Принцип ее работы такой же, как и у аппарата Киппа.
Рис. 28. Составные части аппарата Киппа (а); заменяющая его специальная установка (б); работа аппарата Киппа (в)
Получение водорода в промышленности
В связи с тем, что водород широко применяется в народном хозяйстве, мы познакомимся с промышленными способами его получения. Водород как простое вещество встречается в природе в незначительном количестве. Чтобы получать его в промышленных масштабах, используют самые распространенные в природе соединения. К таким соединениям относятся вода и метан, являющийся основной составной частью природного газа. Из них водород получают следующим образом:
Водород его формула и молярная масса
Как простое вещество водород состоит из двух атомов 
Физические свойства. Водород — это газ без цвета, вкуса и запаха, плохо растворяется в воде (в 1 л при нормальных условиях растворяется 21,5 мл), хорошо растворяется в некоторых металлах (никель, палладий, платина). Это самый легкий газ — в 14,5 раз легче воздуха. Температура кипения -252,6°С; при -259, ГС образуются прозрачные кристаллы.
Химические свойства водорода
При обычной температуре активность молекулярного водорода небольшая, но атомарный водород очень активен.
Водород образует летучие соединения почти со всеми неметаллами. В зависимости от активности неметалла реакция протекает быстро или медленно.
1. Со фтором он взаимодействует уже при комнатной температуре:
2. С хлором вступает в реакцию на свету, а при нагревании взрывается (в темноте и без нагревания соединяется медленно):
3. При обычных условиях с кислородом не взаимодействует. Смесь водорода и кислорода в объемном соотношении 2:1 называется «гремучим газом», который при внешнем воздействии взрывается. Водород горит в кислороде:
При этой реакции температура может достичь 3000°С.
Со многими неметаллами водород вступает в реакцию при высоких температуре и давлении, в присутствии катализаторов (например, с серой и азотом).
1. При высоких температурах водород восстанавливает (вытесняет) металлы из их оксидов:
2. Щелочные и щелочноземельные металлы образуют с водородом при высоких температурах солеподобные соединения — гидриды:
Атомарный водород при комнатной температуре вступает в реакцию с серой, мышьяком, фосфором, кислородом, восстанавливает металлы из оксидов.
Водород как экологически чистое топливо и его использование
Водород — это топливо будущего, которое при горении образует только воду и не загрязняет окружающую среду, поэтому имеет огромные перспективы в качестве экологически чистого топлива.
Термоядерные реакции превращения водорода в гелий, протекающие на Солнце, являются единственным неисчерпаемым источником энергии для многих природных процессов. Если решится проблема управления этим процессом в искусственных условиях, то человечество будет обладать неиссякаемыми источниками энергии.
Водород используется в большом количестве в химической промышленности для производства аммиака. Основная часть этого аммиака используется для получения удобрений и азотной кислоты. Помимо этого водород расходуется на производство метилового спирта и хлористого водорода (соляной кислоты), гидрогенизацию (насыщение водородом) жиров и масел, угля и нефтепродуктов. При гидрогенизации масел образуется маргарин, а благодаря гидрогенизации угля и нефтепродуктов получают легкое топливо.
Температура водородо-кислородного пламени (~3000°С) позволяет резать и паять тугоплавкие металлы и кварц. Применение водорода в металлургии позволяет получать металлы, хорошо очищенные от оксидов и галогенидов. Жидкий водород используется в технике низких температур, в реактивной технике — как самое высокоэффективное топливо. Водород имеет огромное значение при получении атомной энергии и проведении научных исследований.
Вычисление водорода
В химических реакциях наряду с жидкими и твердыми веществами участвуют и газы. Осуществление расчетов с газообразными веществами происходит обычно в единицах объема
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул. Например, в 22,4 л любого газообразного вещества при 0°С и 101,325 кПа содержится 
Плотность газа р — это отношение молярной массы газа (М) к его молярному объему
Относительная плотность газов рассчитывается как отношение их молекулярных масс по уравнению:
Вычисление объема газов по уравнениям химических реакций
Пример №1
Какой объем занимают 6,8 г 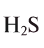
Решение:
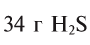
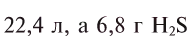
Решая пропорцию, находим:
Ответ: 4,48 л.
Пример №2
Какой объем водорода при нормальных условиях выделится при растворении 3,25 г цинка в избытке соляной кислоты?
Решение:
Напишем уравнение реакции и уравняем его:
Составим на основе уравнения реакции пропорцию и решим задачу:
Ответ: 1,12 л.
Пример №3
Какой объем водорода необходим для восстановления 28,8 г FeO? Решение:
Составим уравнение реакции:
Из уравнения реакции видно, что на восстановление 1 моля (72 г) FeO нужен 1 моль (22,4 л) водорода.
Для восстановления 72 г FeO необходимо 22,4 л
Ответ: 8,96 л.
Пример №4
Для получения кислорода в лабораторных условиях используют термическое разложение бертолетовой соли. Какой объем кислорода и какое количество КС1 образуется из 4,9 г этой соли при нормальных условиях?
Решение:
Напишем уравнение реакции разложения бертолетовой соли 
Ответ: 1,344 л 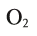
Вычисление объемных соотношений газов по химическим уравнениям
Пример №5
В каком объемном соотношении необходимо взять водород и кислород, чтобы они прореагировали без остатка? Какой объем кислорода вступает в реакцию с 10 л водорода?
Решение:
1) Напишем уравнение реакции взаимодействия кислорода с водородом:
2Н2 + 02 = 2Н20.
Из уравнения известно, что 2 моля водорода без остатка реагируют с 1 молем кислорода.
2 моля водорода занимают объем 44,8 л, а 1 моль кислорода — 22,4 л. Объемные соотношения составят:
Следовательно, водород вступает без остатка в реакцию с кислородом при объемных соотношениях, составляющих небольшие целые числа — 2:1, т.е. 2 л водорода без остатка реаг ируют с 1 л кислорода.
2) Найдем объем кислорода, вступающего в реакцию с 10 л водорода. С 2 л водорода взаимодействует 1 л кислорода,
с 10 л — х л. х = 5 л.
Ответ: 2:1; 5л
Вычисление абсолютной и относительной плотности газов
Пример №6
Рассчитайте абсолютную плотность фтористого водорода и его относительную плотность по водороду.
Решение:
1) Найдем плотность HF.
Молярная масса 1 моля HF — 20 г, а молярный объем — 22,4 л,
2) Найдем относительную плотность HF по
Пример №7
Относительная плотность паров серы по азоту при комнатной температуре равна 9,14. Определите формулу паров серы.
Решение:
Определим молярную массу паров серы.
Если относительная молекулярная масса паров серы равна 256, то, поделив ее на относительную атомную массу серы — 32, мы получим число атомов в молекуле паров серы, т.е. 256 : 32 = 8.
Значит, формула паров серы —
Распространение водорода в природе и его получение
Влейте в пробирку немного разбавленной серной или соляной кислоты и опустите туда 2-3 кусочка цинка или алюминия. Подождите, когда из пробирки выйдет весь воздух, и потом подожгите полученный водород. Что вы наблюдаете? Запишите уравнение реакции.
Общая характеристика:
Распространение в природе
На земном шаре водород по массе составляет 1%. Элемент водорода содержится в составе большинства органических соединений. Водород считается самым распространённым химическим элементом во вселенной (в космосе). Примерно 50% Солнца и все звёзды состоят в основном из водорода. Как вы знаете, в природе существует три изотопа водорода — Протий: 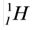
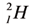
Наиболее широко распространённым в природе является Протий, наименее встречаемым — Дейтерий и в минимальном количестве, редко встречаемым — Тритий.
Впервые водород в чистом виде был получен английским учёным Г.Кавендишем в 1766 году.
Английский ученый. В 1766 году им был получен водород в чистом виде.Ученый вначале принял водород вследствие его легкости за флогистон.
Получение в лаборатории
1) В результате разложения воды под действием электрического тока.
2) В результате вступления в реакцию некоторых металлов (Li, Na, К, Mg, Са, Ва, Al, Zn, Fe) с кислотами (кроме разбавленной и концентрированной 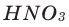
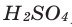
Сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка, называются кислотами. Атомы или группа атомов, соединённых с водородом в молекуле кислоты, называются кислотными остатками.
Составим уравнение реакции с металлом цинком (таблица 1).
1 моль любого металла выделяет мольное количество 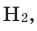
Полученные в результате реакции сложные вещества (хлорид цинка и сульфат цинка) называются солями. Соли — это сложные вещества, состоящие из атома металла и кислотного остатка.
Формулы солей составляются по валентности металла и кислотного остатка. Произношение названий солей основано на названиях металла и кислотного остатка. Например, 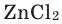
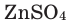
При собирании водорода путём вытеснения воздуха конец газоотводной трубки вставляется в опрокинутый отверстием вниз сосуд (рис. 2).
Для проверки наличия водорода к концу газоотводной трубы подносят небольшую пробирку (на 10-20 секунд), затем, держа ее отверстием вниз, приближают к огню. Раздавшийся при этом взрывоподобный звук или гудение свидетельствуют о наличии водорода
3) В результате реакции активных металлов (Li, Na, К, Са, Ва и др.) с водой. Поскольку эти реакции протекают бурно, а порой и со взрывами, следует брать небольшой кусочек металла, а пробирку, в которой проводится опыт, закрыть воронкой. Во время реакции из молекулы воды вытесняется лишь 1 атом водорода и в результате получается одновалентная гидроксилъная группа (ОН). В свою очередь, гидроксильная группа, соединяясь с атомом металла, образует новое вещество.
Число гидроксильной группы в основаниях зависит от валентности металла.
Полученные в результате этих реакций сложные вещества называются основаниями или гидроксидами. Сложные вещества, состоящие из атома металла и гидроксильной группы, называются основаниями. Названия оснований читаются так: вначале произносится слово «гидроксид», а затем название металла. Если металл имеет переменную валентность, то его валентность отмечается (таблица 3).
Получение в промышленности
Водород в промышленности получают в результате разложения воды под действием постоянного тока:
Другие способы получения водорода в промышленности будут изучены в старших классах.
Свойства и применение водорода

Обратите внимание на картинки. Каким образом на первой картинке шары остаются в воздухе? С какой целью на изображениях шаров на второй картинке даны формулы газов? Поясните свои соображения.
Физические свойства
В свободном состоянии водород образует газ, состоящий из молекул 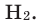
Химические свойства
Реакция с неметаллами. В обычных условиях водород химически неактивен. Его молекула отличается устойчивостью. Для разложения 1 моля молекул водорода на атомы требуется 420 к Дж энергии. Из неметаллов водород в обычных условиях вступает в реакцию только со фтором. Во время реакции водорода с кислородом или с воздухом происходит громкий взрыв. После реакции на стенках сосуда образуются капельки воды. Смесь из 2-х объемов водорода 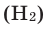
При горении водородного газа выделяется большое количество теплоты и температура достигает 3000 
Водород горит не только в кислороде, но и в хлоре, смесь с которым также вызывает взрыв.
Полученный хлороводород является веществом в газообразном состоянии, его водный раствор называется соляной кислотой.
Если пробирку с расплавленной серой заполнить водородом, то будет ощущаться запах тухлых яиц, свидетельствующий об образовании нового газа — сероводорода:
Широкое применение на практике находит также вещество под названием аммиак 
Водород непосредственно не взаимодействует с неметаллами Si и Р (в том числе и с инертными газами Не, Ne, Ar, Kr, Хе).
Реакции с металлами. Водород вступает в реакции соединения также с активными металлами. При этом образуются твердые вещества — гидриды (NaH, 
Среди металлов бериллий (Be) и алюминий (А1) в непосредственное взаимодействие с водородом не вступают.
Реакции со сложными веществами. Получение ряда металлов в металлургической промышленности основано на реакциях взаимодействия водорода с оксидами данных металлов. При высокой температуре водород притягивает к себе кислород из состава оксидов малоактивных металлов (Zn, Cr, Fe, Cu и др.), вытесняя и выталкивая металлы в свободном состоянии, т.е. он освобождает (восстанавливает) металлы из их оксидов (из-за получения свободного металла масса исходного твёрдого вещества уменьшается).
Применение
Водород считается самым чистым топливом будущего, так как при сгорании он выделяет большое количество тепловой энергии и продуктом его сгорания являются лишь водяные пары, атмосфера при этом не загрязняется. Водород также используется при превращении жидкого масла (растительное масло) в твердое (маргарин), в качестве топлива, при получении, резке и сварке металлов, синтезе аммиака и метанола и др. Применение водорода показано в нижеприведённой схеме. Поскольку водород является самым легким газом, его также используют при наполнении аэростатов (рис. 1).
Ответы на вопрос Вещество состоящие из двух атомов углерода пяти атомов водорода и одного атома хлора
- Этил — Входящий в состав многих органических соединений радикал 2 — группа из пяти атомов водорода и двух атомов углерода 4 буквы
- Разгадывать кроссворды
- Этил — Группа из двух атомов углерода и пяти атомов водорода, входящая в состав некоторых органических соединений 4 буквы
- Фенил — Радикал 2 , состоящий из пяти атомов водорода и шести углерода, остаток бензола, входящий в состав многих органических соединений 5 букв
- Метил — Входящий в состав многих органических соединений радикал 2 — группа из одного атома углерода и трех атомов водорода 5 букв
- Аллил — Органический радикал, представляющий собой молекулу пропилена, лишенную одного атома водорода при насыщенном атоме углерода 5 букв
- Арил — (арильная группа) ароматический радикал, т. е. ароматическое хим. соединение, лишенное одного атома водорода при атоме углерода бензольного кольца 4 буквы
- Кислота — Сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода и анион кислотного остатка 7 букв
- Углеводороды — Органические соединения, состоящие исключительно из атомов углерода и водорода. Углеводороды считаются базовыми соединениями органической химии, все остальные органические соединения рассматривают как их производные 12 букв
- Эфир — Органическое соединение, состоящее из двух углеводородных радикалов, связанных атомом кислорода или группой кислород-углерод-кислород 4 буквы
- Атомность — Способность атома одного элемента вступать в соединение с тем или иным количеством атомов водорода; то же, что валентность 9 букв
- Графит — Минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Структура слоистая. Слои кристаллической решётки могут по-разному располагаться относительно друг друга, образуя целый ряд политипов, с симметрией от гексагональной сингонии, до тригональной. Слои слабоволнистые, почти плоские, состоят из шестиугольных слоёв атомов углерода. Кристаллы пластинчатые, чешуйчатые 6 букв
- Аминогруппа — Хим. радикал (-NH2), образованный трехвалентным атомом азота и двумя присоединенными к нему атомами водорода 11 букв
- Серная — Название кислоты в составе молекулы которой два атома водорода один атом серы и четыре атома кислорода 6 букв
- Винил — Одновалентный органический радикал, образованный из этилена удалением одного атома водорода 5 букв
- Амил — Органический радикал С5Н11 (т. е. молекула пентана без одного атома водорода) 4 буквы
- Химия — Одна из важнейших и обширных областей естествознания, наука о веществах, их свойствах, строении и превращениях, происходящих в результате химических реакций, а также фундаментальных законах, которым эти превращения подчиняются. Поскольку все вещества состоят из атомов, которые благодаря химическим связям способны формировать молекулы, то химия занимается в основном изучением 5 букв
- Соединение — Химическое индивидуальное вещество, в котором атомы одного или различных элеме нтов соединены между собой тем или иным видом химической связи 10 букв
- Газойль — Продукт переработки нефти, смесь жидких углеводородов, преимущественно с количеством атомов углерода от 10 до 40, и примесей с пределами выкипания 200-500 °C и молекулярной массой 50-500 г/моль 7 букв
- Церезин — Смесь предельных углеводородов с числом атомов углерода в молекуле от 36 до 55. Имеет молекулярную массу в районе 700. Состоит в основном из слаборазветвленных изоалканов, небольшого количества алканов нормального строения, нафтенов с длинной боковой цепью 7 букв
- Ацетилен — Ненасыщенный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов 8 букв
- Тритон — Ядро атома трития (тяжелый изотоп водорода, 1 протон и 2 нейтрона) 6 букв
- Винил — Углеводородный радикал, производное этилена, в котором один из атомов водорода удалён. Винильную группу содержат в себе такие соединения как винилацетат, винилхлорид, а также все акрилаты 5 букв
- Алкоголят — Продукты замещения в спиртах атома водорода гидроксильной группы металлом 9 букв
- Алкоголяты — Продукты замещения в спиртах атома водорода гидроксильной группы металлом, напрель RONa (R = CH3, C2H5 или другие углеводородный радикал) 10 букв
- Амилаза — Общее название ферментов класса гидролаз, катализирующих гидролиз крахмала, гликогена и родственных поли- и олигосахаридов путем расщепления гликозидных связей между 1-м и 4-м атомами углерода 7 букв
- Амины — Органические соединения, продукты замещения атомов водорода в аммиаке NH3 органическими радикалами R: первичные RNH2, вторичные R2NH, третичные R3N (R, напрель, CH3, C2H5, C6H5) 5 букв
- Аномер — Моносахарид, находящийся в циклической пиранозной или фуранозной форме и отличающиеся конфигурацией ацетального атома углерода (аномерного центра) 6 букв
- Ацетилирование — Замещение атомов водорода в органических соединениях остатком уксусной кислоты (ацетильной группой) 14 букв
- Кислоты — Соединения в которых атомы водорода соединены с кислотными остатками 7 букв
- Протон — Положительно заряженная частица с массой примерно равной массе атома водорода 6 букв
- Углеводы — Группа органических соединений, состоящих из углерода, кислорода и водорода, необходимых для жизнедеятельности животных и растительных организмов 8 букв
- Теплопроводность — Это перенос тепловой энергии структурными частицами вещества в процессе их теплового движения. Такой теплообмен может происходить в любых телах с неоднородным распределением температур, но механизм переноса теплоты будет зависеть от агрегатного состояния вещества. Явление теплопроводности заключается в том, что кинетическая энергия атомов и молекул, которая определяет температуру тела, 16 букв
- Полимеры — Высокомолекулярные химические соединения, состоящие из однородных повторяющихся групп атомов, широко применяемые в современной технике 8 букв
- Полимер — Общее название высокомолекулярных химических соединений, состоящих из однородных повторяющихся групп атомов, широко применяемых в современной технике 7 букв
- Гидродинамика — Раздел физики сплошных сред, изучающий движение идеальных и реальных жидкости и газа. Как и в других разделах физики сплошных сред, прежде всего осуществляется переход от реальной среды, состоящей из большого числа отдельных атомов или молекул, к абстрактной сплошной среде, для которой и записываются уравнения движения 13 букв
- Валентность — Способность атома соединяться с определенным числом других атомов (в физике) 11 букв
- Полимер — Высокомолекулярное химическое соединение, состоящее из однородных повторяющихся групп атомов 7 букв
- Алкоксил — Одновалентная атомная группа, состоящая из углеводородного радикала и атома кислорода 8 букв
- Алкосигруппа — Одновалентная атомная группа, состоящая из углеводородного радикала и атома кислорода 12 букв
- Анионотропия — Явление молекулярных перегруппировок, сопровождающееся миграцией отрицательно заряженных атомов или групп атомов 12 букв
- Хлороводород — Бинарное соединение состоящее из атомов химических элементов 12 букв
- Дегидрирование — Процесс отщепления от органиеской млекулы атома или группы атомов без замещения их другими 14 букв
- Диффузия — Взаимное проникновение соприкасающихся веществ друг в друга вследствие теплового движения молекул и атомов 8 букв
- Антиферромагнетик — Вещество, обладающее антиферромагнитной упорядоченностью магнитных моментов атомов 17 букв
- Радикал — Группа атомов, переходящая без изменения из одного состояния в другое 7 букв
- Сплав — Вещество, состоящее из двух и более металлов 5 букв
- Углеводы — Органическое соединение, углерод, кислород и водород 8 букв
- Нога — Одна из двух нижних конечностей человека, а также одна из конечностей животного 4 буквы
- Унция — Название нескольких единиц измерения массы, а также двух мер объёма жидких тел и одной единицы измерения силы. Термин происходит ещё из древнего Рима, где унцией обозначали двенадцатую часть либры. Являлась одной из основных весовых единиц средневековой Европы. На сегодняшний день применяется при торговле ценными металлами 5 букв
- Астигматизм — Недостаток оптической системы, состоящий в том, что лучи, вышедшие из одной точки объекта, не собираются вновь в одной точке 11 букв
wordparts.ru