Вернуться в раздел: Отделение анестезиологии и реанимации
Имплантация спинальных (эпидуральных) порт-систем.
Методические рекомендации
Е.Ю.Гарбузов, С.В.Копцов
Хроническая боль – проблема, с которой, по данным ВОЗ, встречается треть населения Земли. Хронической называют длительно существующую (более 3 месяцев) боль, связанную с заболевания различной природы и локализации. По предложению Международной ассоциации по изучению боли [IASP, 1994] боль формулируется, как «неприятное сенсорное и эмоциональное ощущение (переживание), связанное с состоявшимся или потенциальным повреждением или описываемое в терминах такового».
По данным ВОЗ треть населения планеты страдает от хронической боли. Чаще всего людей беспокоит боль в спине, основной причиной которой являются дегенеративно-дистрофические изменения позвоночника – межпозвонковых дисков и дугоотростчатых суставов, с последующим вовлечением в процесс связок, мышц, сухожилий и фасций [1]. Факторами риска развития неспецифических болей в спине являются: трудоспособный возраст (период интенсивной рабочей нагрузки на позвоночник), избыточный вес, профессиональная деятельность (тяжелая физическая работа, неподвижная статическая нагрузка на позвоночник, вибрация, монотонный физический труд), аномалии развития скелета (асимметрия тела, спондилолиз, люмбализация) [2].
К не менее актуальной проблематике относится и онкологическая боль. По самой скромной оценке более 3,5 миллионов человек в мире ежедневно мучаются от раковой боли, а у 50% из них болевое ощущение оценивается, как сильное или очень сильное [3]. Основными причинами болевых ощущений при онкологических заболеваниях являются: сама опухоль, которая вызывает вовлечение болевых афферентов различных органов и тканей (поражение костей, мягких тканей, кожи, внутренних органов, окклюзию сосудов и органов пищеварительного тракта и др.). Во-вторых, осложнения опухолевого процесса (патологический перелом, некроз, изъязвление, воспаление, инфицирование тканей и органов, тромбозы). В третьих: последствия астенизации (пролежни, трофические язвы, запоры), и наконец, в четвертых: противоопухолевое лечение само становится источником сильнейших болевых реакций [4]
Современный подход к лечению болевых синдромов построен на так называемой «лестнице ВОЗ». Суть метода заключается в пошаговой стратегии назначении препаратов различных фармакологических групп и интервенционных методов лечения в зависимости от степени выраженности болевого синдрома [6]
Так на первой ступени, при лечении боли слабой интенсивности, назначают ненаркотические анальгетики. Прежде всего, это НПВП различных групп[5].
Неэффективность применяемой фармакотерапии на этом этапе, при усилении болевого синдрома до средней степени интенсивности, является показанием к переходу на более высокую ступень, т.е. подключение к проводимой терапии слабых опиоидов, к которым относят трамадол и кодеин [11].
В основном, эта стратегия применяется при онкологических заболеваниях.
При боли высокой интенсивности, происходит переход на третью ступень «лестницы ВОЗ», где используются сильнодействующие наркотические анальгетики — бупренорфин, морфин и фентанил, в виде инъекций и трансдермальных форм [7].
Использование всех вышеперечисленных фармакологических групп имеет ряд побочных эффектов, которые существенно ограничивают их применение. Так при использовании НПВС возникает высокий риск желудочно-кишечных кровотечений, агранулоцитоза, развития острой почечной и печёночной недостаточности, обострения бронхиальной астмы [8].
Таблетированные опиоиды, в частности, трамал, требуют частого приема (каждые 3,5-4 часа) и обладают неблагоприятным профилем безопасности (тошнота, рвота, запоры) [11]. Инъекционные опиоиды требуют такого же частого применения (причем инъекции сопровождаются болью). Использование трансдермальных форм характеризуется быстрым развитием толерантности, нарушениями сна, дневной активности пациента [10]
Кроме того, сложность назначения, хранения, учёта наркотических анальгетиков и приравненных к ним препаратов, заставляет искать альтернативные методы и средства лечения болевых синдромов. К подобным средствам справедливо можно отнести нейроаксиальные блокады: спинальные и эпидуральные [9].
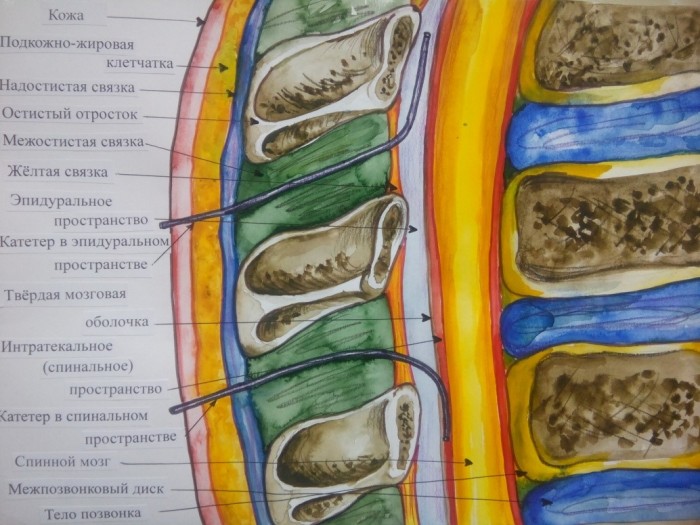
Регионарные методы обезболивания нашли широкое применение в хирургической практике как компоненты анестезии, а в дальнейшем, как эффективные методики послеоперационной аналгезии пациентов. Использование катетеров для введения местных анестетиков позволяет длительно блокировать болевую им пульсацию, идущую от периферии к центральным нервным структурам (Рис.1)
Рис.1 Анатомические структуры спины в разрезе, с эпидуральным и спинальным катетерами.
Однако, есть один недостаток этих методов: невозможность использования их вне стационара, так как выведенный наружу катетер является входными воротами инфекции даже при самом тщательном уходе за ним. Имплантируемые порт-системы, являются прекрасной альтернативой для частого и длительного введения лекарственных средств пациентам вне стационара. Использование порт-систем особенно целесообразно у пациентов с инкурабельными онкологическими заболеваниями, сопровождающимися тяжёлым болевым синдромом, который плохо купируется традиционными лекарствами.
Показания и противопоказания
Показания для постановки эпидуральных порт-систем:
- Выраженный болевой синдром, связанный с раздражением спинномозговых корешков, плохо купируемый медикаментозно, при неэффективности лечебных блокад и радиочастотной абляции (РЧА) нервных структур.
- Дегенеративный стеноз позвоночного канала с неврологической клиникой.
- Постгерпетическая и диабетическая нейропатия, не купируемая другими средствами.
- Фантомные боли в ампутированной конечности, не купируемые медикаментозно.
- Облитерирующие заболевания нижних конечностей.
Показания для постановки спинальных порт-систем:
- Выраженный болевой синдром у онкологических больных, при отсутствии эффекта от рутинной терапии, включающей наркотические анальгетики.
- Отказ пациента от консервативной терапии.
- Опиоид-индуцированная гипералгезия.
Противопоказания к применению спинальных (эпидуральных) порт-систем:
- Пациенты в агональном и предагональном состоянии.
- Отсутствие возможности соблюдения правил ухода за имплантированным устройством.
- Отказ пациента от постановки порт-системы.
- Воспалительный процесс в зоне проведения предполагаемой имплантации.
Материально-техническое обеспечение новой медицинской технологии
- Процедура должна проводиться в операционной с соблюдением правил асептики и антисептики.
- Во время вмешательства обязателен мониторинг витальных функций, включающий в себя пульсоксиметрию, неинвазивное измерение артериального давления, ЭКГ в двух отведениях.
- Местные анестетики, например, 2% раствор лидокаина и 0,75% раствор ропивакаина.
- Спинальная (эпидуральная) порт-система для имплантации.
Описание медицинской технологии
Процедура проводится в условиях операционной.
Накануне пациенту выполняется очистительная клизма. В день операции устанавливается периферический внутривенный катетер и проводится инфузия кристаллоидных растворов в объёме 500-1000 мл.
Имплантация порт-системы
Больной находится в положении на боку, с приведёнными к груди коленями, максимально согнутой спиной. Кожа спины обрабатывается антисептическими растворами по общепринятым хирургическим правилам. Операционное поле изолируется стерильным материалом.
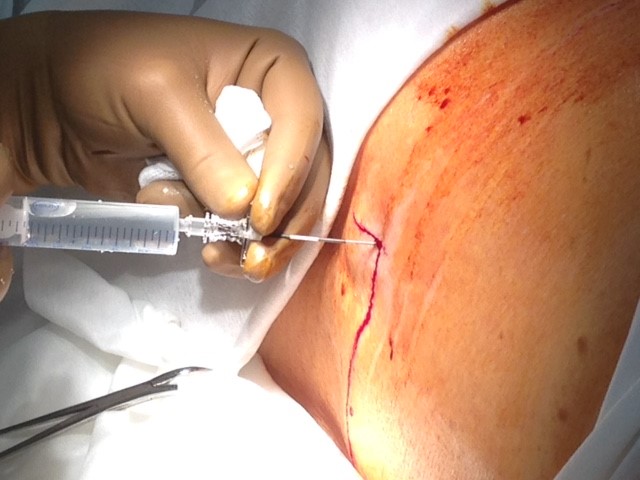
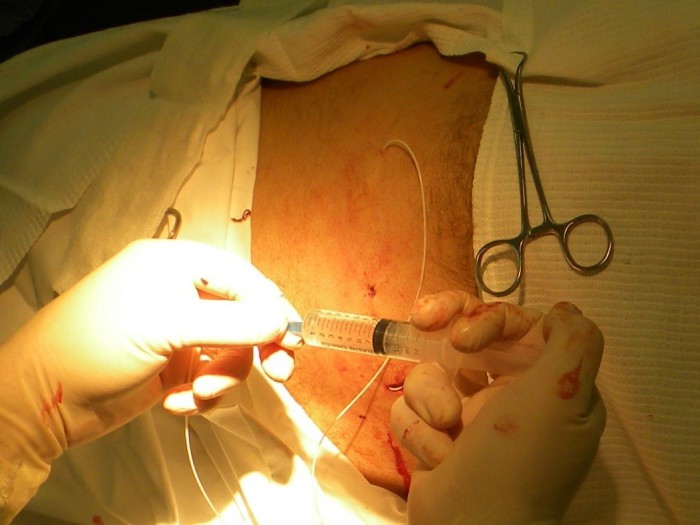
В предполагаемом месте пункции (обычно уровень L3 — L5 для спинальных и Th8-L5 для эпидуральных портов) вдоль остистых отростков под местной анестезией делается разрез кожи длиной 2-4 см. Кожа отсепаровывается и формируется карман для «держателя» катетера размером 2 см. Проводится пункция иглой Tuohy 18 G, входящей в набор порт-системы, на этом уровне. Эпидуральное пространство идентифицируется путем пробы «потери сопротивления», специальный шприц входит в набор порт-системы (Рис.2). Если целью постановки катетера является эпидуральное пространство, дальнейшее продвижение иглы прекращается. При катетеризации спинального пространства игла проводится далее, до момента появление ликвора в павильоне иглы.
Рис. 2. Пункция эпидурального пространства
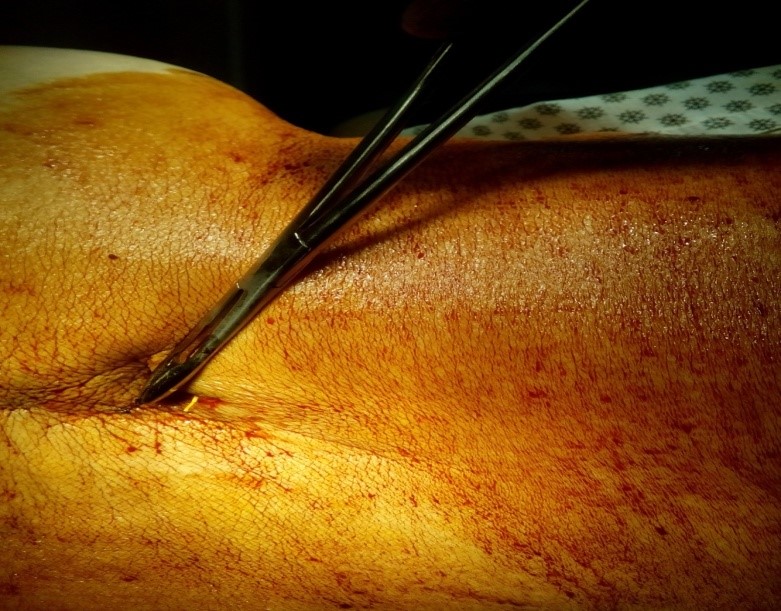
Через иглу Tuohy устанавливается полиуретановый катетер с металлическим мандреном. Катетер продвигается до тех пор, пока он не достигнет конца иглы. Производится заведение катетера с мандреном на глубину до 5 см в спинальное пространство ниже места пункции. Срез иглы Tuohy, при этом, должен быть направлен дистально. Для определения длины на катетере имеются метки, через каждые 5 см. При пункции эпидурального пространства направление введения катетера может быть разным (в зависимости от локализации источника болевого синдрома). Далее, металлический мандрен извлекается. Правильность положения конца катетера в спинальном пространстве определяется ликвореей из проксимального конца катетера. Игла Tuohy извлекается, придерживая катетер в фиксированном положении.
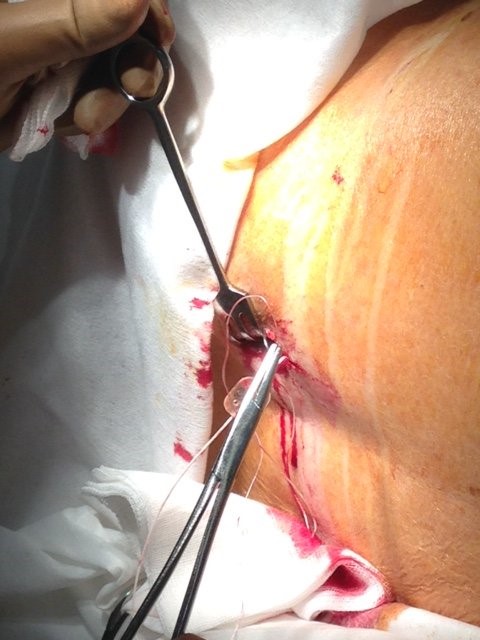
К месту выхода наружу одевается фиксатор (держатель) катетера, устройство, предотвращающее перегиб катетера. «Держатель» погружают в сформированный «карман» и пришивают за «ушко» к фасции при помощи швов (Рис. 3)
Рис. 3. Подшивание «держателя» катетера
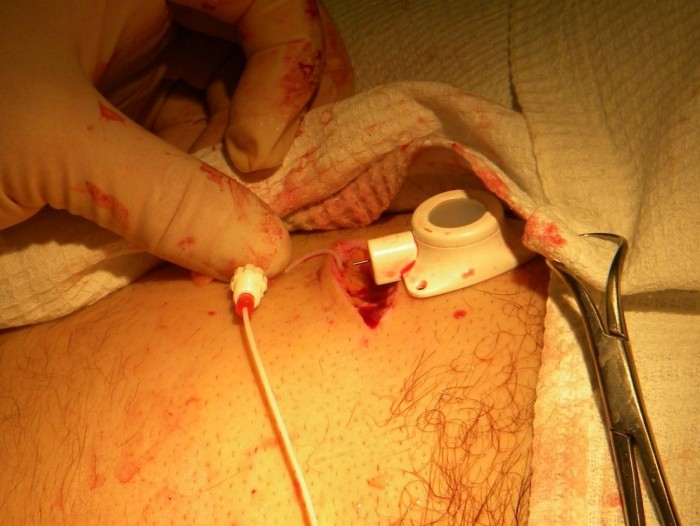
Далее, в месте пересечения задне-аксилярной линии и 11-12 ребра, в зоне имплантации камеры порт-системы осуществляется инфильтрация кожи и подлежащих тканей раствором местного анестетика для обезболивания. После этого производится разрез кожи и подкожно-жировой клетчатки длиной в 4-5 см. Тупым способом в подкожно-жировой клетчатке формируют «карман» для камеры, так чтобы она нижней поверхностью опиралась на основание ребра.
Проводится местная анестезия кожи от места выхода катетера на поверхность до места стояния камеры порт-системы. Катетер насаживается на металлический проводник – туннелизатор, которым в несколько приёмов, осуществляют проведение катетера через кожу к камере порт-системы (Рис. 4). Катетер обрезается ножницами под прямым углом на необходимую длину. При этом оставляют небольшой «люфт», рассчитанный на движение пациента (обычно 1-2 см).
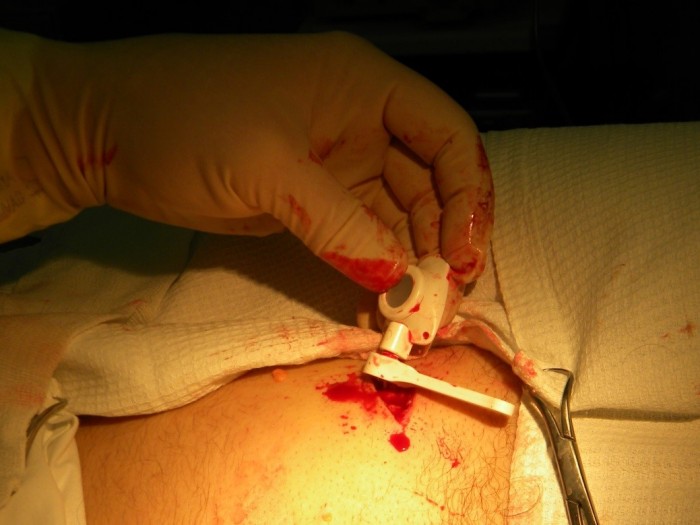
Соединительная муфта отодвигается проксимально по катетеру, его кончик вставляется в выходную канюлю камеры порта (Рис.5)
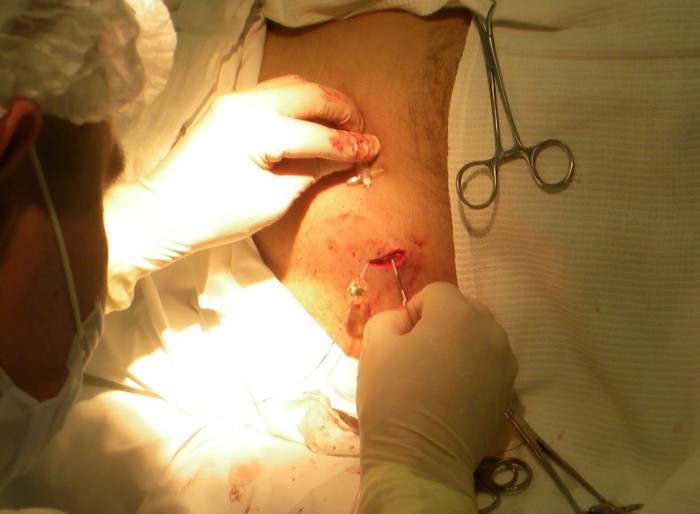 |  |
| Рис. 4. Проведение катетера к месту соединения | Рис. 5. Соединение катетера с камерой |
Затем присоединяется соединительная муфта и затягивается винтовым механизмом, сначала вручную, затем, с помощью ключа, входящего в набор (Рис.6)
Рис.6 Фиксация катетера с камерой порт-системы с помощью ключа
Необходимо, чтобы катетер был прочно фиксирован с камерой, но при этом, не был перетянут, то есть оставался проходим для применяемых препаратов. Проходимость порт-системы проверяют введением физиологического раствора в объёме 1-2 мл шприцом 10-20 мл, через прямую иглу Губера, входящую в набор. Раствор должен проходить под некоторым сопротивлением, в течение 10-20 секунд (Рис. 7)
Рис.7 Проверка проходимости катетера
При этом, проверяется герметичность системы на всех уровнях. Камера погружается в «карман», подшивается к окружающим тканям. При этом необходимо убедиться, что место разреза не приходится на мембрану камеры порт-системы. Швы на кожу. Асептическая повязка. Ушивание раны «держателя» катетера на спине. Наложение асептической повязки.
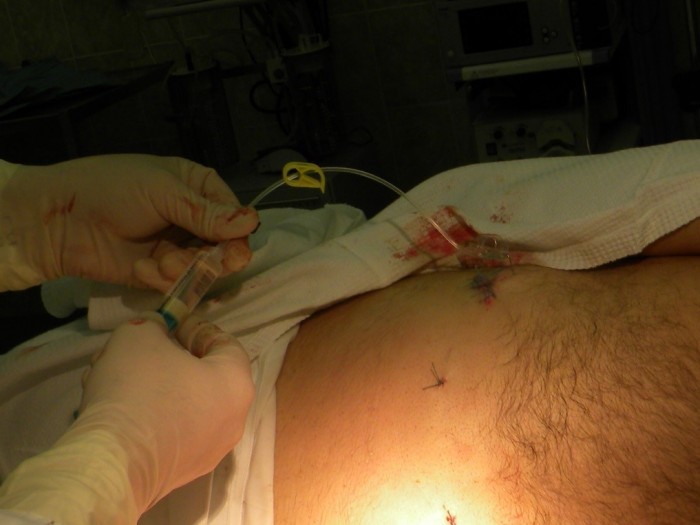
Проводится проба на идентификацию интратекального пространства, введением 2%- раствора лидокаина- 2,0 мл. При этом, отмечается незначительное снижение АД (САД и ДАД) на 10-20 мм.рт.ст., и эффект обезболивания, продолжающийся 1-2 часа (Рис.8)
Рис. 8 Проба на идентификацию интратекального пространства
Во время всей процедуры проводится инфузия кристаллоидных растворов 500 мл/час. После операции пациент наблюдается в течение часа на отделении, и в случае стабильного состояния транспортируется из стационара.
Эксплуатация порт-системы
При работе с порт-системами важно соблюдать принципы асептики и антисептики, чтобы предотвратить инфекционные осложнения и последующие нарушения функции ЦНС.
При осмотре места имплантации обращайте внимание на состояние кожных покровов, отсутствие признаков воспаления, с помощью пальпации исключите смещение камеры порт-системы.
Необходимо проводить измерение артериального давления и пульса на всех этапах эксплуатации: перед введением анестетика, через пять минут после введения анестетика при болюсном введении, через каждые 20 минут при инфузионном введении.
Кожу над камерой обрабатывают раствором кожного антисептика. В стерильных перчатках заполняется физиологическим раствором «г-образная» игла Губера с удлинителем. Удерживая камеру порта, перпендикулярно поверхности кожи, вводится подготовленная игла в мембрану камеры до ощущения упора в дно камеры, что сопровождается характерным металлическим звуком. Открыв зажим удлинителя иглы, вводится 1-2 мл раствора. Раствор, при этом, должен проходить с видимым сопротивлением, в течение 20-40 секунд. При эпидуральном введении у пациента может появиться ощущение «холодка» или «текущей воды», что говорит о правильном расположении катетера.
При эпидуральном положении катетера, есть опасность попадания его кончика в венозное сплетение, поэтому перед введением местного анестетика необходимо провести аспирационную пробу.
После промывки, осуществляется основная процедура — обезболивание, которое может проводиться в двух режимах: болюсно и с помощью эластомерной помпы, к примеру: Easypump фирмы BBraun (Германия). Для длительного обезболивания рекомендованные местные анестетики: лидокаин, ропивакаин. Для болюсного введения дозы препаратов в среднем составляют: для лидокаина 80 ±20 мг, наропина – 30 ± 10 мг при эпидуральном введении; при интратекальном использовании для лидокаина 20±5 мг и наропина 6±2 мг. При эксплуатации эластомерной помпы с блоком контроля скорости инфузии от 2 до 14 мл/час, проводится обезболивание пациентов при помощи препарата Наропин 0,2% – 200 мл. Скорость введения пациенты могут регулировать самостоятельно, согласно их ощущениям и индивидуальной переносимости местных анестетиков.
По окончанию процедуры «г-образную» иглу Губера с удлинителем перекрывают зажимом-клипсой, выход закрывают винтовой крышкой. «Крылышки» иглы фиксируют к коже пластырем, сверху накладывается стерильная повязка. Подобная игла может находиться в камере порт-системы без последующей замены 4-5 дней.
Возможные осложнения и способы их устранения
Закупорка порт-системы
В первую очередь необходимо убедиться, что зажим-клипса открыт и весь удлиннитель иглы проходим. При отсутствии проходимости, необходимо извлечь иглу и повторить попытку её введения рядом. Обращает на себя внимание необходимость пройти всю толщу мембраны камеры порт-системы, до момента появления упора, иначе введение препаратов будет невозможно.
Если пациент находится в кровати на спине, часто мягкий полиуретановый катетер придавливается в месте соединения с «держателем», поэтому, при отсутствии проходимости в этом случае, необходимо попросить пациента перевернуться на бок или сесть.
При отсутствии проходимости необходимо решать вопрос об удалении нефункционирующей порт-системы.
Нарушение целостности порт-системы
При использовании шприцов малого объёма (2-5 мл), в момент введения препаратов создаётся высокое давление в системе, и катетер может отсоединиться от камеры. Для предупреждений подобного осложнения необходимо использовать шприцы большего объёма (не менее 10 мл) и надёжно фиксировать иглу к коже пациента в момент болюсного введения препаратов.
Нарушение герметичности порт-системы
Многие пациенты, которым имплантируется порт-система, вынуждены находиться в постели вследствие основного заболевания. При малоподвижном образе жизни, существует опасность мацерации кожи в отлогих местах спины, вплоть до появления пролежней. Нарушение целостности кожных покровов может приводить к выпадению катетера, иногда и «держателя» с катетером (Рис. 9). В подобной ситуации, необходимо без промедления удалить порт-систему, чтоб предотвратить инфицирование эпидурального или спинального пространства.
Рис. 9. Нарушение герметичности порт-системы: выпадение катетера
Инфицирование порт-системы
Для предупреждения инфицирования порт-систем, необходимо на этапе планирования операции оценить тяжесть состояния самого пациента, возможность его и родственников правильно пользоваться имплантированным устройством, соблюдать правила асептики и антисептики.
Необходимо оценить состояние кожных покровов пациента.
Операция должна проводиться в асептических условиях операционной. При наличии неблагоприятных сопутствующих факторов, необходимо проводить антибиотикопрофилактику. В случае нарушения герметичности, отсутствии проходимости, появления признаков воспаления в проекции камеры и (или) «держателя» порт-системы, необходимо немедленно удалить порт-систему и проводить общепринятые меры, направленные на предупреждение генерализации процесса (хирургическая обработка ран, инфузионная и антибактериальная терапия).
Эффективность использования спинальной (эпидуральной) порт-системы
В работе проанализирован уровень анальгезии у 19 пациентов с различными, заболеваниями, которым были имплантированы спинальные (эпидуральные) порт-системы BBraun Celsite ST – 304 (Германия) на базе СПб ГБУЗ «Городская больница №40» (г. Сестрорецк). В дальнейшем, пациенты находились в амбулаторных условиях, с контрольными явками в стационар. Время проведения: 2014 — 2016. Средний возраст пациентов составил 65,5 ± 6,3 года. Женщин — 9 (47%), мужчин 10 (53%). Распределение по патологии: дегенеративно-дистрофическое заболевание позвоночника (ДДЗП) — 3 человека, постгерпетическая нейропатия — 1 человек, рак кишечника — 8 человек, рак поджелудочной железы — 4 человека, рак яичника — 2 человека, рак желудка — 1 человек
Оценку боли осуществляли по визуальной аналоговой шкале (ВАШ) от 0 до 10, где 0 — отсутствие болей, 10 — нестерпимая боль. На момент постановки порт системы у пациентов исследуемой группы уровень боли был 8±1 по ВАШ.
У 6-ти пациентов была проведена катетеризация эпидурального пространства, с заведением кончика катетера на 5 см краниальнее точки пункции (точка пункции Th10 – Th12). У 13-ти пациентов была проведена пункция на уровне L3-L5, с катетеризацией интратекального пространства и заведением кончика катетера каудальнее на 5 см.
При эксплуатации порт-систем у трёх пациентов болевой синдром был полностью купирован, у восьмерых снизился до приемлемых цифр: 3-4 балла по ВАШ, а у оставшихся восьмерых снизился до цифр 5-6 по ВАШ. Кроме того, не было ни одного пациента, испытывающего нестерпимую и очень сильную боль (8 -10 баллов по ВАШ), которая присутствовала до применения порт-систем у двух пациентов с раком поджелудочной железы.
Длительность болюсного обезболивания при эпидуральном введении была больше почти в два раза по сравнению со спинальным доступом. В свою очередь, болюсное введение анестетиков по сравнению с комбинированным путём было меньше в 3 и 4 раза при эпидуральном и спинальном пути введения соответственно. При использовании эластомерной помпы обезболивание на уровне 3-6 баллов по ВАШ осуществлялось в течение почти 12 часов, с дальнейшей необходимостью увеличения скорости введения или дополнительного болюсного введения. Значительной разницы в длительности анальгезии между спинальным и перидуральным введением с помощью эластомерной помпы – не выявлено.
При работе с порт-системами возникали сложности, связанные, в-основном, с эксплуатацией конструкции. Так у двух пациентов, с появлением пролежней на спине, произошло выпадение наружу «держателя» катетера, что потребовало удаления всей системы. У одного пациента в проекции камеры порта возник абсцесс, ещё у одного больного нарушилась проходимость порта, что в обоих случаях потребовало удаления всей конструкции.
Отмечается, что все побочные явления связаны с действием местных анестетиков на структуры спинного мозга, поскольку при нейроаксиальной анестезии происходит блокирование преганглионарных волокон симпатической нервной системы, что ведёт к снижению тонуса сосудов, депонированию части ОЦК в ёмкостных сосудах, снижению венозного возврата и уменьшению сердечного выброса. Кроме того, у большинства пациентов наблюдалась относительная гиповолемия на фоне основного заболевания, всё это приводило к гемодинамическим сдвигам в виде снижения артериального давления и уменьшения частоты сердечных сокращений. При этом, изменения гемодинамики во всех случаях носили мягкий и управляемый характер: наблюдалось спонтанное восстановление артериального давления через 20-30 минут, а в случае инфузионной поддержки — через 10 — 15 минут до исходных цифр. Моторный блок наблюдался при использовании малых доз анестетиков у 4-х пациентов со спинальными порт-системами. У двух больных отмечалась диарея, возможно, обусловленная основным заболеванием, но точно утверждать, как и опровергать эти данные не представляется возможным из-за малого количества наблюдений.
Случаев возникновения депрессии дыхания ни у одного из пациентов основной группы отмечено не было.
Заключение
- Имплантируемая спинальная (эпидуральная) порт-система обеспечивает, возможность быстрого и длительного обезболивания пациентов с выраженным болевым синдромом различного происхождения, как в стационаре, так и вне его.
- Имплантированная порт-система не обременительна для пациента. Она не только не ограничивает его образ жизни, но и способствует улучшению его качества, снижая болевые ощущения.
- Для использования порт-системы не требуются специальные медицинские знания, наличие сложного оборудования. Обучение работе с ней занимает несколько минут. Однако в дальнейшем, требуется эмпирически и индивидуально подбирать дозу, темп и скорость введения. Всё это даёт возможность пациенту и его родственникам активно влиять на ситуацию.
- При соблюдении правил ухода и рекомендованных дозировок препаратов порт-система безопасна для пациента. Материалы, из которых она изготовлена являются биологически инертными, не вызывают негативных реакций со стороны организма и не взаимодействуют с лекарственными препаратами.
- Предпочтение оказывается комбинированному пути введения анестетиков, с помощью эластомерной помпы, как базовой методике, дополняя её болюсным введением препарата по требованию.
Литература
- Алексеев В.В., Баринов А.Н., Кукушкин М.Л. и др. Боль: руководство для врачей и студентов / под ред. Н.Н. Яхно. – М., МедПресс, 2009. – 302 с.
- Данилов А.Б., Жаркова Т.Р. Хроническая радикулопатия: новые возможности терапии // Русский медицинский журнал. Специальный выпуск «Болевой синдром». – 2010; 18: 15–19.
- «Злокачественные новообразования в России в 2013 году. Заболеваемость и смертность» Под редакцией А. Д. Каприна, В. В. Старинского, Г. В. Петровой, Москва, 2015.
- Паллиативная помощь онкологическим больным. Пособие для врачей. – М., 2000.
- Agency for Health Care Policy and Research. Clinical practice guideline. Management of cancer pain. Available at: http://www.painresearch.utah.edu/cancerpain/guidelineF.html.
- Beaulieu P., Lussier D., Porreca F., Dickenson A. H. Pharmacology of pain. IASP Press 2010, 622 p.
- Jost L., Roila F. Management of cancer pain: ESMO Clinical Practice Guidelines Annals of Oncology 21 (Supplement 5): V.257–260. – 2010. URL: http://annonc.oxfordjournals.org/content/21/suppl_5/v257.full.pdf
- Nersesyan H, Slavin KV. Current approach to cancer pain management: availability and implications of different treatment options. The Clin. Risk Manag. 2007; 3: p. 381–400. URL: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2386360/pdf/tcrm-0303-381.pdf
- Nessa Coyle and Myra Glajchen. Pain Management in the Home: Using Cancer Patients as a Model // Practical Management of Pain / Benzon H.T. et al. 2014. 5th ed. Ch 78, 1040–1048. ISBN-10: 0323083404 ISBN-13: 978-0323083409
- Use of Opioid Analgesics in the Treatment of Cancer Pain: Evidence-based Recommendations from the EAPC / Caraceni A. et al. // Lancet Oncol. — 2012. Vol 13, No 2. P. 58–68. URL: http://www.moltenifarma.it/wp-content/uploads/2015/07/Linee-guida-EAPC.pdf
- Wool MS, Mor V. A multidimentional model for understanding cancer pain. Cancer Invest. 2005. Vol 23, No 8. P.727–734.
← Назад
В существующей федеральной нормативной базе отсутствуют официальные документы о порядке оказания и стандартах медицинской помощи при следующих вмешательствах: «катетеризация подключичной и других центральных вен» и «катетеризация подключичной и других центральных вен с использованием туннельного катетера» (кодовые номера А11.12.001 и A11.12.001.001 соответственно), предусмотренных приказом Минздрава России № 804н от 13.10.17 «Об утверждении номенклатуры медицинских услуг» (вступил в силу с 1 января 2018 г.). Отсутствие указанных выше документов исключает возможность правовой оценки правильности выполнения данной манипуляции, что может осложниться юридическими последствиями при развитии неблагоприятного исхода лечения.
Вместе с тем центральный венозный доступ является одним из немногих хирургических вмешательств, наиболее часто выполняемых врачом анестезиологом-реаниматологом, и эта манипуляция сопряжена с непреодолимым и сложно прогнозируемым риском развития тяжелых, а иногда и летальных осложнений. Для выхода из этой ситуации нам представляется целесообразным наличие локального нормативного документа, регламентирующего подходы к выполнению катетеризации подключичной и других центральных вен [1].
Авторами разработан и предлагается пакет документов, на основании которого возможно создание такого локального акта (стандартной операционной процедуры либо клинического протокола) в условиях системы менеджмента качества. Каждая медицинская организация может адаптировать его в зависимости от направления своей лечебной работы и характера оказываемой помощи, подготовки персонала и технического оснащения.
Из ст. 37 «Порядок оказания медицинской помощи и стандарты медицинской помощи» Федерального Закона № 323-ФЗ от 21.11.11 «Об основах охраны здоровья граждан в Российской Федерации» следует, что 1) медицинская помощь организуется и оказывается в соответствии с порядками оказания медицинской помощи, обязательными для исполнения на территории Российской Федерации, всеми медицинскими организациями, а также на основе стандартов медицинской помощи; 2) порядок оказания медицинской помощи и стандарты медицинской помощи утверждаются уполномоченным федеральным органом исполнительной власти; 3) порядок оказания медицинской помощи разрабатывается по отдельным ее видам, профилям, заболеваниям или состояниям (группам заболеваний или состояний).
Уполномоченным органом государственной власти по разработке стандартов является Минздрав России. Разработка проводилась и проводится в соответствии с требованиями, утвержденными приказом Минздрава России № 303 от 03.08.99 «О введении в действие отраслевого стандарта «протоколы ведения больных. Общие требования». Однако, как нами отмечалось ранее, в настоящее время отсутствуют федеральные нормативные документы, регламентирующие выполнение катетеризации подключичной и других центральных вен.
Ниже представлен перечень документов для создания локального нормативного акта, включающих рекомендуемую форму приказа о выполнении медицинской услуги: «катетеризация подключичной и других центральных вен», «катетеризация подключичной и других центральных вен с использованием туннельного катетера» и следующие приложения:
1. Приказ руководителя медицинской организации (приложение № 1).
2. Протокол получения информированного добровольного согласия на медицинское вмешательство (катетеризация подключичной и других центральных вен) (приложение № 2).
3. Протокол получения информированного добровольного отказа от медицинского вмешательства (катетеризация подключичной и других центральных вен) (приложение № 3).
4. Протокол катетеризации подключичной и других центральных вен (приложение № 4).
Приводим образец служебной инструкции по проведению вмешательств «катетеризация подключичной и других центральных вен» и «катетеризация подключичной и других центральных вен с использованием туннельного катетера» для врачей анестезиологов-реаниматологов, которая должна быть утверждена приказом руководителя медицинской организации.
Обеспечение доступа к сосудистому руслу является важнейшей задачей анестезиологии и реаниматологии. Постоянный доступ к сосудистому руслу позволяет вводить лекарственные средства и инфузионные среды, что дает возможность регулировать состояние жизненно важных органов и систем, осуществлять заместительную почечную терапию и реализовать прочие варианты экстренной помощи. Доступ к центральным венам позволяет получить важную информацию о состоянии кровообращения [1, 2—7].
Манипуляции «катетеризация подключичной и других центральных вен» и «катетеризация подключичной и других центральных вен с использованием туннельного катетера» (кодовые номера А11.12.001 и A11.12.001.001 соответственно) являются медицинскими услугами, предусмотренными приказом Минздрава России от № 804н 13.10.17 «Об утверждении номенклатуры медицинских услуг».
В соответствии с приказом Минздрава России № 541н от 23.07.10 «Об утверждении единого квалификационного справочника должностей руководителей, специалистов и служащих» определять показания к катетеризации центральных вен и проводить данную манипуляцию должен врач анестезиолог-реаниматолог.
Алгоритм действий врача анестезиолога-реаниматолога при принятии решения о проведении пункции и катетеризации подключичной и других центральных вен и катетеризации подключичной и других центральных вен с использованием туннельного катетера
1. Получение информированного добровольного согласия
В соответствии со ст. 20 «Информированное добровольное согласие на медицинское вмешательство и на отказ от медицинского вмешательства» Федерального закона РФ № 323-ФЗ от 21.11.11 «Об основах охраны здоровья граждан в Российской Федерации» перед проведением катетеризации подключичной и других центральных вен у пациента необходимо получить информированное добровольное согласие на данное медицинское вмешательство или на отказ от него.
В соответствии со ст. 54 «Права несовершеннолетних в сфере охраны здоровья» Федерального закона РФ № 323-ФЗ от 21.11.11 несовершеннолетние, больные наркоманией, в возрасте старше 16 лет и иные несовершеннолетние в возрасте старше 15 лет имеют право на информированное добровольное согласие на медицинское вмешательство или на отказ от него в соответствии с настоящим Федеральным законом, за исключением случаев оказания им медицинской помощи в соответствии с частями 2 и 9 ст. 20 Федерального закона РФ № 323-ФЗ от 21.11.11.
При получении информированного добровольного согласия на медицинское вмешательство гражданину необходимо в доступной для него форме объяснить цель и задачи проведения данной манипуляции и сообщить о риске медицинского вмешательства (ст. 20 Федерального закона РФ № 323-ФЗ от 21.11.11).
При отказе от медицинского вмешательства гражданину, одному из родителей или иному законному представителю лица в доступной для него форме должны быть разъяснены возможные последствия такого отказа.
Медицинское вмешательство без согласия гражданина, одного из родителей или иного законного представителя допускается в следующих случаях:
— если медицинское вмешательство необходимо по экстренным показаниям для устранения угрозы жизни человека и если его состояние не позволяет выразить свою волю или отсутствуют законные представители;
— в отношении лиц, страдающих заболеваниями, представляющими опасность для окружающих;
— в отношении лиц, страдающих тяжелыми психическими расстройствами;
— в отношении лиц, совершивших общественно опасные деяния (преступления);
— при проведении судебно-медицинской экспертизы и (или) судебно-психиатрической экспертизы.
Решение о медицинском вмешательстве без согласия гражданина, одного из родителей или иного законного представителя принимается в случаях, указанных в пунктах 1 и 2 части 9 ст. 20 Федерального закона РФ № 323-ФЗ от 21.11.11, принимается консилиумом врачей, а в случае, если собрать консилиум невозможно, — непосредственно лечащим (дежурным) врачом с внесением такого решения в медицинскую документацию пациента и последующим уведомлением должностных лиц медицинской организации (руководителя медицинской организации или руководителя отделения медицинской организации), гражданина, в отношении которого проведено медицинское вмешательство, одного из родителей или иного законного представителя лица, которое указано в части 2 ст. 20 Федерального закона РФ № 323-ФЗ от 21.11.11 и в отношении которого проведено медицинское вмешательство, либо судом в случаях и в порядке, которые установлены законодательством Российской Федерации.
2. Показания и противопоказания к установке центрального венозного катетера
Показания к катетеризации подключичной, внутренней яремной и бедренной вен неспецифичны. В связи с высоким риском ранних механических осложнений, обусловленных отсутствием визуального контроля за нахождением и продвижением иглы, катетеризация центральных вен должна выполняться по экстренным и неотложным показаниям (ст. 32 «Медицинская помощь» Федерального закона РФ № 323-ФЗ от 21.11.11), в условиях крайней необходимости (ст. 39 Уголовного кодекса Российской Федерации № 63-ФЗ от 13.06.96) и обоснованного риска (ст. 41 Уголовного кодекса РФ), когда опасность, угрожающая здоровью пациента, не может быть устранена иными способами (введение инфузионных растворов или вазоактивных препаратов через одну или несколько периферических вен, потребность в проведении экстренного гемодиализа, необходимость углубленного мониторинга гемодинамики и прочее, а риск отказа от данной манипуляции может превышать риск возможных осложнений и смертельного исхода по сравнению с таковым при катетеризации центральной вены) [1].
Показания: потребность во введении инфузионных сред или лекарственных препаратов при невозможности обеспечения требуемого объема, скорости, эффективности и безопасности инфузионной и/или медикаментозной терапии за счет катетеризации периферических вен и/или внутрикостного введения; контроль центрального венозного давления и прочие виды гемодинамического мониторинга (установка катетера Свана—Ганса, транспульмональная термодилюция и др.); проведение вазопрессорной терапии; проведение заместительной почечной терапии; проведение экстракорпоральных методов поддержки кровообращения и дыхания; эндокардиальная кардиостимуляция; парентеральное питание; введение гиперосмолярных и/или обладающих раздражающим действием на интиму кровеносных сосудов растворов; замена катетера [2, 3, 5, 6, 8].
Противопоказания: инфекционное поражение кожных покровов в области катетеризации; флеботромбоз или тромбофлебит магистральной вены, предполагаемой для центрального венозного доступа; синдром диссеминированного внутрисосудистого свертывания крови и прочие врожденные и приобретенные коагулопатии при высоком риске геморрагических осложнений [2, 3, 5, 6, 8].
Следует отметить, что данные о допустимых изменениях гемостаза относительны и не имеют высокого уровня доказательности [9—11].
В отдельно взятом случае, принимая решение о катетеризации в условиях коагулопатии, врач должен оценить индивидуальное отношение потенциальный риск—потенциальная польза. Риск осложнений может зависеть от опыта врача, точки доступа и типа/размера устанавливаемого катетера. В случае коагулопатии процедура должна выполняться наиболее опытным из присутствующих врачей. Правильнее всего использовать доступ, позволяющий осуществить сдавление сосуда. В этой ситуации бедренный доступ может нести меньший риск геморрагических осложнений. Катетеризацию бедренной вены необходимо выполнять ниже паховой складки.
Предлагаются следующие границы, при превышении которых катетеризация допустима лишь в связи с крайней необходимостью: концентрация тромбоцитов менее 50·109/л и/или активированное частичное тромбопластиновое время увеличено более чем на 30% по отношению к референсному значению, и/или показатель международного нормализованного соотношения превышает 1,8 и/или концентрация фибриногена менее 1 г/л [8, 9]. Следует с крайней осторожностью относиться к катетеризации на фоне дву- и трехкомпонентной антитромбоцитарной терапии. Необходимо помнить, что коррекция коагулопатии повышает риск таких осложнений, как тромбоз, передача трансмиссивных инфекций и развитие респираторного дистресс-синдрома [10]. В случае крайней необходимости выполнения центрального венозного доступа на фоне коагулопатии могут быть рассмотрены методики удаленного доступа PICC (Peripherally Inserted Central Venous Catheter, периферически имплантируемый центральный венозный катетер) и/или методика микропункции.
3. Техника катетеризации и выбор точки доступа
Венозный катетер, как правило, устанавливают в центральные вены (верхняя и/или нижняя полая) или в их крупные ветви через подключичную (подмышечную), внутреннюю яремную или бедренную вены. Техника выполнения пункции и требования к безопасности катетеризации широко представлены в различных источниках медицинских знаний [2, 3, 5, 6, 8]. Наиболее безопасным считается тот доступ, которым врач владеет лучше и в отношении которого у него наибольший практический опыт!
При выборе между различными точками доступа подключичную вену (ПКВ) рекомендуется катетеризировать, если ожидается пребывание катетера в венозном русле более 3—5 сут, что обусловлено значительно меньшим риском инфекционных осложнений и лучшим комфортом для пациента [7, 12].
Внутреннюю яремную вену (ВЯВ) рекомендуется катетеризировать, если требуется проведение эндокардиальной кардиостимуляции, установка катетера Свана—Ганца и, если предполагается, что катетер будет находиться в вене менее 3—5 сут. В остальном данный метод не имеет преимуществ перед катетеризацией ПКВ и характеризуется более высоким риском инфекционных осложнений, особенно у пациентов с дефицитом массы тела — индекс массы тела (ИМТ) менее 24 кг/м2 [12].
Катетеризация бедренной вены (БВ) часто осложняется флеботромбозами, поэтому ее следует рассматривать как запасной вариант на случай, если попытки катетеризации ПКВ и/или ВЯВ оказались неудачными или какая-либо медицинская технология подразумевает катетеризацию БВ. В связи с повышением риска инфекционных осложнений катетеризация БВ не рекомендуется у пациентов с избыточной массой тела (ИМТ более 28 кг/м2) [7, 8, 12].
Проведение катетеризации ПКВ и других центральных вен должно быть оформлено соответствующим протоколом (приложение № 4).
4. Верификация положения катетера
Внутривенное положение катетера может быть верифицировано несколькими методами.
1. Свободный обратный ток венозной крови (контроль газового состава крови и/или прямой контроль давления крови при оценке в динамике).
2. Рентгенологический метод верификации расположения катетера внутри сосуда и глубины его стояния эффективен, если катетер является рентгеноконтрастным. При обзорной рентгенографии в прямой проекции тень катетера должна находиться в проекции верхней или нижней полой вены. При наличии катетера в верхней полой вене его кончик должен находиться как минимум на 2 см выше верхней границы правого предсердия. Допускается положение катетеров, установленных через левые брахиоцефальные вены, в проекции левого венозного плечеголовного ствола (безымянная вена), а также более глубокое положение катетеров для гемодиализа (в проекции правого предсердия), что обусловлено потребностью в высокой скорости кровотока [12, 13].
3. Контроль с применением ультразвукового исследования (УЗИ) не может полностью устранить риск осложнений при катетеризации центральных вен, особенно в отсутствие должного опыта у оператора, при залегании вены на глубине более 2 см и сложных анатомических вариантах развития вен. Владение данным методом требует надлежащей подготовки и опыта оператора, а также круглосуточной прямой доступности соответствующего оборудования.
4. Рентгеновская компьютерная томография (РКТ) является самым эффективным способом верификации положения катетера. К сожалению, на сегодняшний день данное оборудование имеется в ограниченном числе медицинских организаций [2, 14—18].
Примечание 1. Использование УЗИ с целью мониторинга во время катетеризации ВЯВ повышает вероятность успеха, уменьшает число попыток катетеризации и снижает риск осложнений. Пункцию и катетеризацию ВЯВ (с учетом возможных ограничений и противопоказаний) следует выполнять в условиях предварительной визуализации вены и прилежащих анатомических структур с разметкой и/или прямого динамического контроля пункции, положения проводника и финального визуального подтверждения положения сегмента катетера, доступного для ультразвуковой визуализации [2, 16]. Использование контроля с применением УЗИ при катетеризации ПКВ и БВ не имеет убедительной доказательной базы [16, 18, 19].
Примечание 2. Ни один из представленных выше методов не является достаточно надежным. Выбор метода контроля зависит от клинической ситуации, наличия соответствующей аппаратуры и определяется лечащим врачом, выполняющим вмешательство, и администрацией медицинской организации. В настоящее время нет четко доказанных признаков перфорации купола плевральной полости и других осложнений в процессе самой пункции и катетеризации вены.
5. Осложнения катетеризации
Осложнения катетеризации центральных вен подразделяются на ранние и поздние; они не всегда могут быть исключены даже при должной осторожности и предусмотрительности. К ранним осложнениям относятся кровотечение из несдавливаемого сосуда с формированием гематомы, и/или гемоторакса, и/или кровопотери, пневмоторакс, аритмия (вероятный признак того, что конец катетера находится в желудочке сердца), воздушная эмболия. К поздним осложнениям катетеризации относятся инфекционные и тромботические осложнения. К редким осложнениям относятся гидроторакс, хилоторакс, перфорация центральных сосудов и/или камер сердца, тампонада перикарда, миграция катетера, узлообразование/миграция проводника и пр. [2, 3, 8, 10, 20—23]. Наиболее частыми осложнениями катетеризации ВЯВ являются непреднамеренная пункция сонной артерии с последующим образованием гематомы (до 8—10% без контроля с применением УЗИ), ПКВ — пневмоторакс (до 1—3%), а катетеризация БВ наиболее часто осложняется флеботромбозами [1, 4, 5, 7, 8, 20—22]. Частота осложнений катетеризации центральных вен увеличивается в 6 раз, если один и тот же врач выполняет подряд более 3 попыток на одном и том же сосуде [3, 4].
Согласие или отказ от катетеризации ПКВ и/или других центральных вен должны быть оформлены соответствующим протоколом (приложения № 2, 3).
6. Пути и способы снижения риска осложнений катетеризации центральных вен
Если ожидается, что катетер будет находиться в сосуде длительно, более 3—5 сут, и нет специальных показаний (эндокардиальная кардиостимуляция, кардиохирургические вмешательства, установка катетера Свана—Ганца и пр.), предпочтение следует отдавать ПКВ в связи с меньшим риском инфекционных осложнений [8, 12]. В связи с нарастающим риском стеноза подключичной вены не рекомендуется, чтобы катетер находился в ПКВ более 3 нед. В этой ситуации рекомендуется переустановка катетера или установка туннельного катетера в ВЯВ [9, 13]. Как во время выполнения пункции и катетеризации центральной вены, так и после установки катетера в венозное русло его положение должно быть верифицировано одним из доступных методов.
Для проведения гемодиализа с ожидаемой продолжительностью более 3 нед предпочтение следует отдавать временной катетеризации (по убывающей): правой ВЯВ, БВ, левой ВЯВ, ПКВ [16]. В случае временного доступа для гемодиализа с ожидаемой продолжительностью менее 3 нед с последующей установкой перманентного катетера через ВЯВ можно также рассмотреть возможность катетеризации ПКВ [8, 12].
При наличии технической возможности, специальной подготовки и должного опыта оператора для уменьшения частоты осложнений все попытки катетеризации яремной вены рекомендуется проводить под контролем с применением УЗИ [2, 3, 14—16, 18].
Запрещается предпринимать более 3 попыток пункции и/или катетеризации одной и той же центральной вены. В последующем разрешается еще 1 попытка пункции и/или катетеризации более опытным врачом (3+1). В отсутствие должного эффекта от дальнейших попыток следует отказаться и использовать альтернативные пути доступа к венозному руслу, например периферическую венесекцию, дистантный доступ. При неудачной попытке катетеризации ПКВ или ВЯВ проводить катетеризацию разрешается только при полном исключении развития пневмоторакса/гематомы на стороне манипуляции и не ранее чем через 6 ч.
В течение 6 ч после как удачной, так и неудачной попытки катетеризации ПКВ или ВЯВ следует в обязательном порядке выполнить рентгенологический контроль с применением УЗИ и/или РКТ для исключения гемо/пневмоторакса.
Примечание. Следует отметить, что чувствительность обзорной рентгенографии в прямой проекции при выявлении раннего пневмоторакса является низкой, составляя лишь 40—70%. В частности, это относится к выявлению так называемого малого и/или переднего пневмоторакса. В случае использования УЗИ опытным оператором чувствительность метода достигает 79—92% [2, 14, 15, 18, 23]. Чувствительность РКТ приближается к 100%.
Снижению риска осложнений катетеризации центральных вен способствуют постоянное наблюдение за состоянием катетера и окружающих его тканей; строгое соблюдение правил асептики и антисептики при установке и уходе за катетером; максимальное сокращение времени, в течение которого катетер находится в вене; обеспечение адекватного темпа трансфузии; правильная техника катетеризации, рациональная фиксация катетера [3, 8, 15, 19].
7. Ответственность за состояние катетера
При переводе пациента с катетером в центральной вене из структурных подразделений службы анестезиологии и реанимации для дальнейшего лечения в профильное отделение ответственность за состояние катетера несет лечащий врач профильного отделения (в соответствии со ст. 70 Федерального закона № 323-ФЗ РФ от 21.11.11).
В настоящее время отсутствуют утвержденные Минздравом России официальные правила и стандарты выполнения пункции и катетеризации подключичной и других центральных вен. Это означает, что дать правовую оценку правильности выполнения данной манипуляции не представляется возможным. Поэтому при развитии осложнений процедуры и неблагоприятном исходе лечения возможны юридические последствия.
Следует отметить, что в пособии «Предложения (практические рекомендации) по организации внутреннего контроля качества и безопасности медицинской деятельности в медицинской организации (стационаре)», изданном в ФГБУ «Центр мониторинга и клинико-экономической экспертизы» Росздравнадзора в 2015 г. большое практическое значение для решения обсуждаемой в статье проблемы имеет раздел 2.8. Хирургическая безопасность. Профилактика риска, связанного с оперативным вмешательством. Обращается особое внимание на наличие приказов главного врача по обеспечению профилактики риска, связанного с оперативными вмешательствами, наличие и исполнение алгоритма подготовки к оперативному вмешательству, включая объем обследования (в том числе отсутствие дублирования исследований), осмотр врачами-специалистами, оформление добровольного информированного согласия и наличие и использование хирургического чек-листа.
Следует отметить, что данные «Предложения» разработаны для реализации положений ГОСТ Р ИСО 9001—2015 «Системы менеджмента качества. Требования», идентичного международному стандарту (ISO 9001:2015 «Quality management systems Requirements» — IDT), утвержденного и введенного в действие приказом Министерства промышленности и торговли Российской Федерации, Федерального агентства по техническому регулированию и метрологии № 1391-ст. от 28.09.15 «Об утверждении национального стандарта».
Таким образом, предлагаемые авторами служебная инструкция и образцы распоряжений руководителя медицинской организации могут послужить основой для создания чек-листов или клинических протоколов выполнения медицинских услуг «катетеризация подключичной и других центральных вен» и «катетеризация подключичной и других центральных вен с использованием туннельного катетера» (кодовые номера А11.12.001 и A11.12.001.001 соответственно).
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Для корреспонденции: Сумин Сергей Александрович — д.м.н., проф., зав. каф. анестезиологии, реаниматологии и интенсивной терапии ФГБОУ ВО КГМУ Минздрава России, 305041, Курск. e-mail: ser-sumin@ya.ru.
Версия: Клинические протоколы 2006-2019 (Беларусь)
Профилактическое хирургическое вмешательство неуточненное (Z40.9)
Хирургия
Общая информация
Краткое описание
Приложение
к приказу
Министерства здравоохранения
Республики Беларусь
08 июня 2011 № 615
КЛИНИЧЕСКИЙ ПРОТОКОЛ
предоперационной диагностики, мониторирования и выбора метода анестезии
у пациентов в стационарных условиях
Диагностика (стационар)
ПРЕДОПЕРАЦИОННАЯ ДИАГНОСТИКА И МОНИТОРИРОВАНИЕ В СТАЦИОНАРНЫХ УСЛОВИЯХ
| Варианты анестезиологических пособий | Объемы оказания медицинской помощи | |||
|---|---|---|---|---|
| Диагностика (диагностика и мониторинг) | Лечение | |||
| при установлении диагноза (перед операцией) | в процессе лечения (во время анестезии) | необходимое (анестезия) | ||
| обязательная | дополнительная (по показаниям) | |||
| 1 | 2 | 3 | 4 | 5 |
| 1. Анестезиологическое обеспечение у пациентов, подвергающихся «малым» оперативным вмешательствам (внеполостные операции длительностью до 1 часа, без кровопотери) | Определение групп крови по системам АВО и резус Общий анализ крови Общий анализ мочи ЭКГ для лиц старше 40 лет Изучение истории болезни, медикаментозного лечения, анестезиологический анамнез Осмотр верхних дыхательных путей и расчет индекса трудной интубации Оценка физического состояния (класс по АSA), риск анестезии (по ААА) Составление плана анестезии и тактики ведения пациента в предоперационном периоде Назначение премедикации, документирование осмотра в истории болезни | Биохимическое исследование крови: общий белок, билирубин, мочевина, АлАТ, АсАТ, глюкоза, электролиты Коагулограмма: АЧТВ, протромбиновый тест (протромбиновое время, протромбиновое отношение, процент активности факторов протромбинового комплекса, МНО), тромбиновое время, фибриноген, D-димеры Определение параметров КОС Газы крови | Мониторинг должен осуществляться квалифицированным персоналом постоянно. В течение всех анестезий оцениваются: 1. оксигенация; 2. вентиляция; 3. гемодинамика; 4. температура тела. 1. Оксигенация. Обязательно: оценка цвета кожных покровов; определение концентрации кислорода во вдыхаемой смеси (FiO2); пульсоксиметрия. 2.Вентиляция. Обязательно оцениваются: экскурсия грудной клетки; аускультация дыхательных шумов; наблюдение за дыхательным мешком; количественный мониторинг объема вдыхаемого и выдыхаемого газа (при ИВЛ); количественное определение СО2 во вдыхаемом и выдыхаемом воздухе (при ИВЛ); при ИВЛ необходимо активировать тревогу дисконнекции. 3.Гемодинамика. Обязательно: пальпация пульса и аускультация сердца, ЧСС и АД через 5 минут; ЭКГ. 4. Температура мониторируется, если предполагаются значительные колебания температуры тела. | Ингаляционная анестезия (пациенты I-III классов ASA). Внутривенная анестезия с сохраненным спонтанным дыханием (пациенты I-Ш классов ASA). Регионарная анестезия (пациенты I-IV классов ASA). Многокомпонентная сбалансированная анестезия с ИВЛ (пациенты I-V классов ASA). Тотальная внутривенная анестезия с ИВЛ (пациенты I-V классов ASA). Профилактика тромбоэмболических осложнений (по показаниям): далтепарин 2500 МЕ подкожно за 1-2 часа до операции или надропарин 0,3 мл подкожно за 2 часа до операции, или эноксапарин 20 мг подкожно за 2 часа до операции, или бемипарин 2500 МЕ подкожно за 2 часа до операции, или фондапаринукс 2,5 мг подкожно 1 раз в сутки через 6 часов после операции ± компрессионный трикотаж или пневмокомпрессия. При спинальной или эпидуральной анестезии низкомолекулярные гепарины (далее-НМГ) вводятся за 10-12 часов до операции. |
| 2. Анестезиологическое обеспечение у пациентов, подвергающихся «стандартным» оперативным вмешательствам (относительно компенсированные пациенты, длительность операции до 3 часов, кровопотеря до 10% ОЦК) | Определение групп крови по системам АВО и резус Общий анализ крови Общий анализ мочи ЭКГ Биохимическое исследование крови: общий белок, билирубин, мочевина, АлАТ, АсАТ, глюкоза, электролиты Коагулограмма: АЧТВ, протромбиновый тест (протромбиновое время, протромбиновое отношение, процент активности факторов протромбинового комплекса, МНО), тромбиновое время, фибриноген, D-димеры Изучение истории болезни, медикаментозного лечения, анестезиологический анамнез Осмотр верхних дыхательных путей и расчет индекса трудной интубации Оценка физического состояния (класс по АSA), риск анестезии (по ААА) Составление плана анестезии и тактики ведения пациента Определение соответствующего назначения для предоперационного лечения Назначение премедикации, документирование осмотра в истории болезни | Определение параметров КОС Газы крови R-графия органов грудной полости ЭХО-КГ Оценка риска тромбоэмболических осложнений | Мониторинг должен осуществляться квалифицированным персоналом постоянно. В течение всех анестезий оцениваются: 1. оксигенация, 2. вентиляция, 3. гемодинамика, 4. температура. 1. Оксигенация. Обязательно: оценка цвета кожных покровов; определение концентрации кислорода во вдыхаемой смеси (FiO2); пульсоксиметрия. По оказаниям: КОС, газы крови. 2.Вентиляция. Обязательно оцениваются: экскурсия грудной клетки; аускультация дыхательных шумов; наблюдение за дыхательным мешком; количественный мониторинг объема вдыхаемого и выдыхаемого газа (при ИВЛ); количественное определение СО2 во вдыхаемом и выдыхаемом воздухе (при ИВЛ); при ИВЛ необходимо активировать тревогу дисконнекции. 3. Гемодинамика. Обязательно: пальпация пульса и аускультация сердца; ЭКГ; ЧСС и АД через 5 минут. По показаниям: инвазивное АД, ЦВД, ЦГД. 4. Температура: мониторинг температуры тела. 5. Почасовой диурез (по показаниям). 6. Внутричерепное давление (по показаниям). 7. Церебральная оксиметрия (по показаниям). 8. Нервно-мышечный блок (по показаниям). | Многокомпонентная сбалансированная анестезия с ИВЛ (пациенты I-V классов ASA). Тотальная внутривенная анестезия с ИВЛ (пациенты I-V классов ASA). Комбинированная анестезия (спинальная, эпидуральная анестезия плюс ИВЛ) — (пациенты I-IV классов ASA). Регионарная анестезия (внеполостные операции, пациенты I-IV классов ASA). Профилактика тромбоэмболических осложнений (по показаниям): далтепарин 2500 МЕ подкожно за 1-2 часа до операции или 5000 МЕ подкожно за 12 часов до операции или надропарин 0,3 мл подкожно за 2 часа до операции, или эноксапарин 20 мг подкожно за 2 часа до операции, или 40 мг подкожно за 12 часов до операции, или бемипарин 3500 МЕ подкожно за 2 часа до операции, или фондапаринукс 2,5 мг подкожно 1 раз в сутки через 6 часов после операции ± компрессионный трикотаж или пневмокомпрессия. При спинальной или эпидуральной анестезии НМГ вводятся за 10-12 часов. Интраоперационное применение систем конвекционного согревания пациентов и вводимых жидкостей (по показаниям). |
| 3. Анестезиологическое обеспечение у пациентов, подвергающихся «большим» оперативным вмешательствам (длительность операции более 3 часов, кровопотеря более 10% ОЦК, нейрохирургические, операции на сердце, средостении и магистральных сосудах) | Определение групп крови по системам АВО и резус Общий анализ крови Общий анализ мочи ЭКГ Биохимическое исследование крови: общий белок, билирубин, мочевина, трансаминазы, глюкоза, электролиты Коагулограмма: АЧТВ, протромбиновый тест (протромбиновое время, протромбиновое отношение, процент активности факторов протромбинового комплекса, МНО), тромбиновое время, фибриноген, D-димеры Рентгенография органов грудной полости Определение параметров КОС и газы крови Осмотр верхних дыхательных путей и расчет индекса трудной интубации Оценка физического состояния (класс по АSA), риск анестезии (по ААА) Оценка риска тромбоэмболических осложнений Составление плана анестезии и тактики ведения пациента Определение соответствующего назначения для предоперационного лечения Назначение премедикации, документирование осмотра в истории болезни | ЭХО-КГ Консультации профильных специалистов | Мониторинг должен осуществляться квалифицированным персоналом постоянно. В течение всех анестезий оцениваются: 1.оксигенация, 2. вентиляция, 3. гемодинамика, 4. температура. 1. Оксигенация. Обязательно: оценка цвета кожных покровов; определение концентрации кислорода во вдыхаемой смеси (FiO2); пульсоксиметрия. По показаниям: КОС, газы крови. 2. Вентиляция. Обязательно оцениваются: экскурсия грудной клетки; аускультация дыхательных шумов; наблюдение за дыхательным мешком; количественный мониторинг объема вдыхаемого и выдыхаемого газа (при ИВЛ); количественное определение СО2 во вдыхаемом и выдыхаемом воздухе (при ИВЛ); при ИВЛ необходимо активировать тревогу дисконнекции. 3.Гемодинамика. Обязательно: пальпация пульса и аускультация сердца; ЭКГ; ЧСС и АД через 5 минут. По показаниям: инвазивное АД, ЦВД, ЦГД. 4.Температура: мониторинг центральной температуры (обязательно). 5.Мониторинг почасового диуреза (обязательно). 6.Мониторинг нервно — мышечного блока (по показаниям). 7. Внутричерепное давление (по показаниям). 8. Церебральная оксиметрия (по показаниям). 9. Оценка глубины седации и анестезии (по показаниям). Данные протоколы могут быть расширены при наличии соответствующих показаний по заключению анестезиолога. | Многокомпонентная сбалансированная анестезия с ИВЛ (пациенты I-V классов ASA). Тотальная внутривенная анестезия (пациенты I-V классов ASA). Комбинированная анестезия (спинальная, эпидуральная анестезия плюс ИВЛ) — (пациенты I-IV классов ASA). Регионарная анестезия (внеполостные операции, пациенты I-IV классов ASA). Профилактика тромбоэмболических осложнений (по показаниям): Далтепарин 2500 МЕ подкожно за 1-2 часа до операции или 5000 МЕ подкожно за 12 часов до операции или Надропарин 0,3 мл подкожно за 2 часа до операции или Эноксапарин 20 мг подкожно за 2 часа до операции или 40 мг подкожно за 12 часов до операции или Бемипарин 3500 МЕ подкожно за 2 часа до операции или Фондапаринукс 2,5 мг подкожно 1 раз в сутки через 6 часов после операции ± компрессионный трикотаж или пневмокомпрессия При спинальной или эпидуральной анестезии НМГ вводятся за 10-12 часов Интраоперационное применение систем конвекционного согревания пациентов и вводимых жидкостей обязательно. |
Лечение (стационар)
НАИБОЛЕЕ ЧАСТО ИСПОЛЬЗУЕМЫЕ МЕТОДИКИ АНЕСТЕЗИИ В СТАЦИОНАРНЫХ УСЛОВИЯХ
| Методики анестезии | Диагностика (диагностика и мониторинг) | Лечение | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| при установлении диагноза (перед операцией) | в процессе лечения (во время анестезии) | необходимое (анестезия) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| обязательная | дополнительная (по показаниям) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ингаляционная анестезия с сохраненным спонтанным дыханием (не более 1 часа, пациенты I -II ASA) | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Премедикация: легкая: атропин 0,3-0,6 мг внутримышечно за 30 мин. ± диазепам 5-10 мг внутримышечно или внутрь за 30 мин. умеренная: атропин 0,3-0,6 мг внутримышечно за 30 мин. +диазепам 10 мг внутримышечно за 30 мин. или + мидазолам 1-2 мг внутривенно перед операцией + фентанил 50-100 мкг внутривенно перед операцией или + тримеперидин 20 мг внутримышечно за 30 мин. усиленная: атропин 0,3-0,6 мг внутримышечно за 30 мин. +диазепам 10 мг внутримышечно за 30 мин. или + мидазолам 1-2 мг внутривенно перед операцией + тримеперидин 20 мг внутримышечно за 30 мин. или + фентанил 50-100 мкг внутривенно перед операцией или + морфин 0,1 мг/кг внутримышечно за 30 мин. ± дроперидол 2,5-5 мг внутривенно перед операцией ± кеторолак 30 мг внутримышечно за 30 мин. или ± диклофенак 75 мг внутримышечно за 30 мин. Преоксигенация: 100% кислород через маску 2-3 мин Индукция: преиндукция — дополнительная седация/анальгезия: фентанил 1-2 мкг/кг внутривенно ± мидазолам 0,03-0,05 мг/кг внутривенно. Вводная анестезия: тиопентал-натрия 3-5 мг/кг или пропофол 2-2,5 мг/кг или кетамин 1-2 мг/кг или мидазолам 0,2-0,35 мг/кг или подача анестетиков через лицевую маску 35-100% кислород ± 0 — 65% закись азота + севофлюран — болюсная методика: поток свежего газа 4-8 л/мин., 100% О2, севофлюран 6-8% (менее 2 минут, до эффекта); пошаговая методика: поток свежего газа 4-8 л/мин., 100% О2, севофлюран 1% (с последующим увеличением на 1% каждые 4-5 вдохов до максимальной концентрации 6-8 (до эффекта); Поддержание анестезии: подача анестетиков через лицевую или ларингеальную маску 35-100 % кислород ± 0 — 65 % закись азота + севофлюран (суммарно до 1,5 МАК) до эффекта | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внутривенная анестезия с сохраненным спонтанным дыханием (не более 1 часа, пациенты I — II ASA) | Определяется принадлежностью пациента к группе в зависимости от характера оперативного вмешательства | Определяется принадлежностью пациента к группе в зависимости от характера оперативного вмешательства | Определяется принадлеж-ностью пациента к группе в зависимости от характера оперативного вмешательства | Премедикация: легкая: атропин 0,3-0,6 мг внутримышечно за 30 мин. ± диазепам 5-10 мг внутримышечно или внутрь за 30 мин. умеренная: атропин 0,3-0,6 мг внутримышечно за 30 мин. +диазепам 10 мг внутримышечно за 30 мин. или + мидазолам 1-2 мг внутривенно перед операцией + фентанил 50-100 мкг внутривенно перед операцией или + тримеперидин 20 мг внутримышечно за 30 мин. усиленная: атропин 0,3-0,6 мг внутримышечно за 30 мин. +диазепам 10 мг внутримышечно за 30 мин. или + мидазолам 1-2 мг внутривенно перед операцией + тримеперидин 20 мг внутримышечно за 30 мин. или + фентанил 50-100 мкг внутривенно перед операцией или + морфин 0,1 мг/кг внутримышечно за 30 мин. ± дроперидол 2,5-5 мг внутривенно перед операцией ± кеторолак 30 мг внутримышечно за 30 мин. или ± диклофенак 75 мг внутримышечно за 30 мин. Преоксигенация: 100% кислород через маску 2-3 минуты Индукция: преиндукция — дополнительная седация/анальгезия: фентанил 1-2 мкг/кг внутривенно ±мидазолам 0,03-0,05 мг/кг внутривенно Вводная анестезия: тиопентал-натрия 3-5 мг/кг или пропофол 2-2,5 мг/кг или кетамин 1-2 мг/кг внутривенно или мидазолам 0,2-0,35 мг/кг Поддержание анестезии мидазолам 0,05-0,1 мг/кг или пропофол 50-150 мкг/кг/мин. + фентанил 1-5 мкг/кг/час или кетамин 0,5-1мг/кг внутривенно ± дроперидол 0,02-0,04 мг/кг/час | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сбалансированная анестезия с ИВЛ | Определяется принадлежностью пациента к группе в зависимости от характера оперативного вмешательства | Определяется принадлежностью пациента к группе в зависимости от характера оперативного вмешательства | Определяется принадлежностью пациента к группе в зависимости от характера оперативного вмешательства | Премедикация: легкая: атропин 0,3-0,6 мг внутримышечно за 30 мин. ± диазепам 5-10 мг внутримышечно или внутрь за 30 мин. умеренная: атропин 0,3-0,6 мг внутримышечно за 30 мин. +диазепам 10 мг внутримышечно за 30 мин. или + мидазолам 1-2 мг внутривенно перед операцией + фентанил 50-100 мкг внутривенно перед операцией или + тримеперидин 20 мг внутримышечно за 30 мин. усиленная: атропин 0,3-0,6 мг внутримышечно за 30 мин. +диазепам 10 мг внутримышечно за 30 мин. или + мидазолам 1-2 мг внутривенно перед операцией + тримеперидин 20 мг внутримышечно за 30 мин. или + фентанил 50-100 мкг внутривенно перед операцией или + морфин 0,1 мг/кг внутримышечно за 30 мин. ± дроперидол 2,5-5 мг внутривенно перед операцией ± кеторолак 30 мг внутримышечно за 30 мин. или ± диклофенак 75 мг внутримышечно за 30 мин. Преоксигенация: 100% кислород через маску 2-3 мин. Индукция: преиндукция — дополнительная седация/анальгезия: фентанил 1-3 мкг/кг внутривенно ±мидазолам 0,03-0,05мг /кг внутривенно Вводная анестезия: тиопентал-натрия 3-5 мг/кг или пропофол 2-2,5 мг/кг или мидазолам 0,2-0,35 мг/кг или кетамин 1-2 мг/кг или 35-100% кислород +0 — 65% закись азота + севофлюран (суммарно до 3 МАК) до эффекта миорелаксант для интубации: сукцинилхолин 1,5 мг/кг или атракурий 0,5-0,6 мг/кг (пациенты не выше 2 баллов по ИТИ) или пипекурониум 0,06-0,08 мг/кг/(пациенты не выше 2 баллов по ИТИ) или рокуроний 0,6 мг/кг (пациенты не выше 2 баллов по ИТИ) или цисатракурий 0,15 мг/кг (пациенты не выше 2 баллов по ИТИ) Поддержание анестезии 35 — 100% кислород +0 — 65% закись азота + изофлуран или севофлюран (суммарно до 1,5 МАК) до эффекта +фентанил 1-10 мкг/кг/час ±дроперидол 0,02-0,05 мг/кг/час поддержание миорелаксации: атракурий 0,1-0,2 мг/кг или пипекурониум 0,01-0,015 мг/кг или рокуроний 0,1-0,2 мг/кг или цисатракурий 0,03 мг/кг Выход из анестезии. Прекратить подачу ингаляционных анестетиков и перейти на 100% кислород. Подача галогеновых анестетиков прекращается при ушивании подкожно-жировой клетчатки, закись азота — при наложении последних швов на кожу. Санация: тщательно санируется трахея и ротовая полость. Уход от миорелаксации (декураризация) по окончании оперативного вмешательства: устранить остаточную мышечную релаксацию (если присутствует сознание и частично восстановлена нейромышечная передача): атропин 0,015 мг/кг внутривенно + неостигмин 0,05% раствор 1-2 мл внутривенно. Экстубация: после восстановления адекватного спонтанного дыхания, сознания, защитных рефлексов и способности пациента выполнять команды. Профилактика тошноты и рвоты: метоклопрамид 10 мг внутривенно, дроперидол 0,625 мг внутривенно, ондансетрон 4 мг внутривенно. Технология низкопоточной и минимально-поточной анестезии. Проверить наркозно-дыхательный аппарат на возможность работы по низкому и минимальному потоку. Премедикация, индукция выполняются по вышеописанному протоколу сбалансированной анестезии с ИВЛ. Первый этап: денитрогенизация и насыщение галогенсодержащим анестетиком: поток 3-6 л/мин (O2: N2O, ≈FiO2 = 33% + галогенсодержащий анестетик до 1,5 суммарного МАК). Окончание первого этапа (точка эквилибрирования) достигается при выравнивании концентрации N2O и галогенсодержащего анестетика на вдохе и выдохе. Второй этап: переход к низкому потоку и поддержание анестезии. Низкий поток: поток свежего газа 1 л/мин. (O2 0.5 л/мин.: N2O 0,5 л/мин, ≈FiO2 = 35-45% + галогенсодержащий анестетик 0,8-1,5 суммарного МАК). Минимальный поток: поток свежего газа 0,5 л/мин (O2 0.3 л/мин, N2O 0,2 л/мин., ≈FiO2 = 35-45 % + галогенсодержащий анестетик 0,8-1,5 суммарного МАК). Изменение глубины анестезии на низком потоке: кратковременный переход на высокий поток с изменением концентрации анестетика до желаемой. По достижению цели – переход на низкий поток. При необходимости возможно внутривенное введение опиоидных анальгетиков и седативных лекарственных средств. Выход из анестезии: за 5-10 минут до предполагаемого окончания анестезии прекратить подачу N2O и анестетика и перейти на 100% кислород. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тотальная внутривенная анестезия с ИВЛ | Определяется принадлежностью пациента к группе в зависимости от характера оперативного вмешательства | Определяется принадлежностью пациента к группе в зависимости от характера оперативного вмешательства | Определяется принадлежностью пациента к группе в зависимости от характера оперативного вмешательства | Премедикация: легкая: атропин 0,3-0,6 мг внутримышечно за 30 мин. ± диазепам 5-10 мг внутримышечно или внутрь за 30 мин. умеренная: атропин 0,3-0,6 мг внутримышечно за 30 мин. +диазепам 10 мг внутримышечно за 30 мин. или + мидазолам 1-2 мг внутривенно перед операцией + фентанил 50-100 мкг внутривенно перед операцией или + промедол 20 мг внутримышечно за 30 мин. (усиленная): атропин 0,3-0,6 мг внутримышечно за 30 мин. диазепам 10 мг внутримышечно за 30 мин. или + мидазолам 1-2 мг внутривенно перед операцией + тримеперидин 20 мг внутримышечно за 30 мин. или + фентанил 50-100 мкг внутривенно перед операцией или + морфин 0,1 мг/кг внутримышечно за 30 мин. ± дроперидол 2,5-5 мг внутривенно перед операцией ± кеторолак 30 мг внутримышечно за 30 мин. или ± диклофенак 75 мг внутримышечно за 30 мин. Преоксигенация: 100% кислород через маску 2-3 минуты Индукция: преиндукция — дополнительная седация/анальгезия: фентанил 1-3 мкг/кг внутривенно ±мидазолам 0,03-0,05 мг /кг внутривенно Вводная анестезия: тиопентал-натрия 3-5 мг/кг или пропофол 2-2,5 мг/кг или мидазолам 0,2-0,35 мг/кг или кетамин 1-2 мг/кг миорелаксант для интубации: сукцинилхолин 1,5 мг/кг или атракурий 0,5-0,6 мг/кг (пациенты не выше 2 баллов по ИТИ) или пипекурониум 0,06-0,08 мг/кг/(пациенты не выше 2 баллов по ИТИ) или рокуроний 0,6 мг/кг (пациенты не выше 2 баллов по ИТИ) или цисатракурий 0,15 мг/кг (пациенты не выше 2 баллов по ИТИ) Поддержание анестезии 35-100% кислород + инфузия пропофола 4-12 мг/кг/час +фентанила 1-10 мкг/кг/час ± инфузия кетамина 0,4-1 мг/мин ±дроперидол 0,02-0,04 мг/кг/час поддержание миорелаксации: атракурий 0,1-0,2 мг/кг или пипекурониум 0,01-0,015 мг/кг или рокуроний 0,1-0,2 мг/кг или цисатракурий 0,03 мг/кг Выход из анестезии Перейти на 100% кислород. Санация: тщательно санируется трахея и ротовая полость. Уход от миорелаксации (декураризация): если позволяет хирургическое состояние, устранить остаточную мышечную релаксацию (если присутствует сознание и частично восстановлена нейро-мышечная передача): атропин 0,015 мг/кг внутривенно + неостигмин 0,05% раствор 1-2 мл внутривенно. Экстубация: после восстановления адекватного спонтанного дыхания, сознания, защитных рефлексов и способности пациента выполнять команды. Профилактика тошноты и рвоты: метоклопрамид 10 мг внутривенно, дроперидол 0,625 мг внутривенно, ондансетрон 4 мг внутривенно. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Спинальная (субарахноидальная) анестезия | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Премедикация: легкая: атропин 0,3-0,6 мг внутримышечно за 30 мин. +диазепам 5-10 мг внутримышечно или перорально за 30 мин. или мидазолам 1-2 мг внутривенно перед операцией умеренная: атропин 0,3-0,6 мг внутримышечно за 30 мин. +диазепам 10 мг внутримышечно за 30 мин. или мидазолам 1-2 мг внутривенно перед операцией + фентанил 50-100 мкг внутривенно перед операцией или + тримеперидин 20 мг внутримышечно за 30 мин. Методика анестезии. Катетеризация вены. Прегидратация 15-20 мл/кг (по показаниям). В строго асептических условиях пункция субарахноидального пространства ниже L2 — L3. Однократное введение раствора анестетика ± эпинефрин 5 мкг/мл (1:200000). Коррекция гипотонии путем постоянной внутривенной инфузии фенилэфрина 0,04-0,18 мг/мин. либо болюсных внутривенных введений фенилэфрина 0,05-0,1 мг. Местные анестетики для спинальной анестезии
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Эпидуральная анестезия | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Премедикация: (смотри «спинальная анестезия») Методика анестезии. Катетеризация вены. Прегидратация 15-20 мл/кг (по показаниям). В асептических условиях пункция эпидурального пространства и установка эпидурального катетера. Аспирационная проба. Введение тест дозы 3 мл 2% раствора лидокаина + эпинефрин 5 мкг/мл (1:200000). Однократное или постоянное введение анестетика через тонкий эпидуральный катетер (из расчета 1,2 — 1,4 мл/сегмент в грудном и 1,5 — 1,8 мл/сегмент в поясничном отделе) ± эпинефрин 5 мкг/мл (1:200000). Коррекция гипотонии путем постоянной внутривенной инфузии фенилэфрина 0,04-0,18 мг/мин. либо болюсных внутривенных введений фенилэфрина 0,05-0,1 мг. Асептическая наклейка. Местные анестетики для эпидуральной анестезии
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Каудальная анестезия | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Премедикация: — (смотри «спинальная анестезия») Методика анестезии: Катетеризация вены. В асептических условиях пункция крестцового эпидурального пространства. Однократное введение анестетика в крестцовый канал. Коррекция гипотонии путем постоянной внутривенно инфузии фенилэфрина 0,04-0,18 мг/мин либо болюсных внутривенно введений фенилэфрина 0,05-0,1 мг. Асептическая наклейка. Местные анестетики для каудальной анестезии
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Комбинированная анестезия (эпидуральная плюс общая анестезия с ИВЛ) | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности | Премедикация: — (смотри «спинальная анестезия») Методика анестезии: Катетеризация вены. В асептических условиях пункция эпидурального пространства. Аспирационная проба. Введение тест дозы 3 мл 2% лидокаина + эпинефрин 5 мкг/мл (1:200000). Однократное или постоянное введение анестетика через тонкий эпидуральный катетер ± эпинефрин 5 мкг/мл (1:200000). Коррекция гипотонии путем постоянной внутривенно инфузии фенилэфрина 0,04-0,18 мг/мин. либо болюсных внутривенно введений фенилэфрина 0,05-0,1 мг. Асептическая наклейка. Минимальный, но достаточный уровень общей анестезии с ИВЛ (смотри «сбалансированная анестезия с ИВЛ, тотальная внутривенная анестезия с ИВЛ»). Сегментарные границы, уровни расположения катетера, номинальные объемы анестетика для эпидуральной анестезии при хирургических операциях у взрослых
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Периферические регионарные блокады Прогнозирование трудной интубации, выбор метода обеспечения проходимости дыхательных путей, протокол быстрой последовательной индукции | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности Расчет ИТИ: тест Маллампати; открывание рта; сгибание/разгибание головы; клинические данные; выдвижение нижней челюсти; анамнез; тиромен-тальная дистанция | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности Ларингоскопия Консультация врача-оториноларинголога | Определяется принадлежностью пациента к группе 1, 2 или 3, в зависимости от характера оперативного вмешательства и его продолжительности Мониторинг должен осуществляться квалифицированным персоналом постоянно. В течение всех анестезий оцениваются: 1.оксигенация 2.вентиляция 3.гемодинамика 4.температура | Премедикация: — стандартная (смотри «спинальая анестезия») Методика анестезии: Катетеризация вены. Введение местного анестетика в область периферических нервов (однократно, либо инфузия через катетер). Коррекция гипотонии путем постоянной внутривенной инфузии фенилэфрина 0,04-0,18 мг/мин либо болюсных внутривенных введений фенилэфрина 0,05-0,1 мг. Асептическая наклейка. Блокада плечевого сплетения: (межлестничная, надключичная или подмышечная блокада): лидокаин 2% 25-35 мл (с эпинефрином 1:200 тыс. или без) или бупивакаин 0,5% — 25-30 мл, или ропивакаин 0,75% 10-40 мл, или левобупивакаин 0,25-0,5% — 50 — 200 мг Блокада бедренного нерва: лидокаин 2% 20-25 мл (с эпинефрином 1:200 тыс. или без) или бупивакаин 0,5% 15-20 мл, или ропивакаин 0,75% 10-30 мл. или левобупивакаин 0,25-0,5% — 50 — 200 мг Блокада седалищного нерва: лидокаин 2% 25-30 мл (с эпинефрином 1:200 тыс. или без) или бупивакаин 0,5% 20-25 мл, или ропивакаин 0,75% 10-30 мл. или левобупивакаин 0,25-0,5% — 50 — 200 мг Блокада запирательного нерва лидокаин 2% 10-15 мл (с эпинефрином 1:200 тыс. или без) или бупивакаин 0,5% 10-15 мл, или ропивакаин 0,75% 10-20 мл. или левобупивакаин 0,25-0,5% — 50 — 200 мг Блокада лучевого, срединного и локтевого нервов лидокаин 2% — 5 мл (с эпинефрином 1:200 тыс. или без) или бупивакаин 0,5% — 5 мл (на каждый нерв), или ропивакаин 0,75% 5 мл (на каждый нерв). или левобупивакаин 0,5% — 5,0 мл (на каждый нерв) ИТИ – 0. Трудности не ожидаются (стандартная интубация трахеи) ИТИ – 1-2. Возможна трудная интубация. Преоксигенация не менее 3-х минут 100% кислородом через герметичную маску. Индукция. Контрольная ларингоскопия при сохраненном дыхании. Интубация. При необходимости можно применить сукцинилхолин для облегчения ИТ. Подтвердить правильность установки трубки аускультативно и капнографически. ИТИ – 3-4. Высокая вероятность трудной интубации. Подготовить все необходимое для проведения трудной интубации трахеи (ИТ) и трудной вентиляции. Позвать на помощь коллег. Анестезия ротоглотки 10% лидокаином (спрей) или 4% раствором. В трахею ввести 4 мл 4% лидокаина. Преоксигенация не менее 3-х минут 100% кислородом через герметичную маску. Прямая ларингоскопия на фоне индукции пропофолом 2 мг/кг или седации мидазоламом 2,5 мг и фентанилом 0,05-0,1 мг при сохраненном спонтанном дыхании. При визуализации надгортанника не более 2-х попыток интубации. Если повторная попытка неэффективна — отказ от введения миорелаксантов. При сохранении спонтанного дыхания поддерживать проходимость дыхательных путей, вентиляцию 100% кислородом. Дождаться пробуждения пациента. Далее выполняется ИТ в сознании при помощи фиброскопа. Если применение фиброоптической интубации (далее-ФОИ) недоступно, тогда проводится локорегионарная анестезия дыхательных путей (далее-ЛРА ДП), затем ИТ через нос «вслепую» или ретроградная ИТ в сознании. Подтвердить правильность установки трубки аускультативно и капнографически. Альтернативой ИТ в сознании может служить ларингеально-масочная анестезия. Если не удается вентилировать пациента с помощью ларингеальной маски (ЛМ), при неадекватном спонтанном дыхании, методом выбора является транстрахеальная струйная вентиляция после пункции щитоперстневидной мембраны или экстренная трахеостомия. ИТИ 5 и более. Облигатная трудная ИТ. Показана ИТ в сознании любым способом. Применение миорелаксантов только после гарантированного обеспечения проходимости ДП. ФОИ в сознании — метод выбора. Альтернативой может служить ИТ в сознании через нос «вслепую» или ретроградная ИТ в условиях ЛРА ДП. Подтвердить правильность установки трубки аускультативно и капнографически. Альтернативой ИТ в сознании может служить ларингеально-масочная анестезия. Если не удается вентилировать пациента с помощью ЛМ, при неадекватном спонтанном дыхании, методом выбора является транстрахеальная струйная вентиляция после пункции щитоперстневидной мембраны или экстренная трахеостомия. Протокол быстрой последовательной индукции. Выполняется у пациентов с полным желудком, экстренных пациентов, беременных. Методика: постановка желудочного зонда – опорожнение желудка; внутривенно струйно вводится фамотидин (ранитидин) 20-40 мг или внутривенно медленно омепразол 40 мг. Преоксигенация не менее 3-х минут 100% кислородом через герметичную маску. Внутривенная индукция. Все лекарственные средства вводятся последовательно без ожидания эффекта: тиопентал-натрия 3-5 мг/кг или пропофол 2-2,5 мг/кг, или мидазолам 0,2-0,35 мг/кг, или кетамин 1-2 мг/кг ± фентанил 1-3 мкг/кг внутривенно + суксаметоний 1,5 мг/кг Выполнение приема Селика. Прямая ларингоскопия. Интубация трахеи, контроль положения трубки, раздувание манжетки | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Профилактика
ПЕРИОПЕРАЦИОННАЯ АНТИБИОТИКОПРОФИЛАКТИКА
| № | Типы операций | Виды ран и операций | Периоперационная антибиотикопрофилактика |
| 1 | 2 | 3 | 4 |
| 1. | Чистые хирургические операции, при которых не предполагается бактериальная контаминация тканей или использование имплантантов | Нетравматичные плановые операции без признаков воспаления, которые не затрагивают ротоглотку, дыхательные пути, желудочно-кишечный тракт или мочеполовую систему, а также ортопедические операции, первично закрытые раны (мастэктомия, струмэктомия, грыжесечение, флебэктомия, операции на мошонке, щитовидной железе, пластические операции), выполненные без дефектов хирургической техники и короткой продолжительности. | Не показана |
| 2. | Операции, в ходе которых рассекаются неинфицированные ткани, не вскрываются полые органы и не обнаруживаются признаки воспаления или инфекции, а также чистые хирургические операции с использованием имплантатов. | Экстренные операции, выполненные при отсутствии проявлений инфекции и без нарушений правил асептики. Плановые операции на желудочно-кишечном тракте или дыхательных путях, гинекологические вмешательства, урологические и пульмонологические – без признаков сопутствующей инфекции (ларингэктомия, аппендэктомия, холецистэктомия, трансуретральная простатэктомия), тупые травмы. Любые операции имплантации сосудистых протезов и протезов суставов, нейрохирургические и кардиохирургические операции, операции на молочной железе. | Цефазолин* 2 г внутривенно Цефуроксим *1,5 г внутривенно Амоксициллин/клавулановая кислота* 1,2 г внутривенно |
| 1 | 2 | 3 | 4 |
| 3. | Хирургические вмешательства с высоким риском развития послеоперационных гнойных осложнений области хирургического вмешательства. | Проникающие ранения, операционные раны с признаками негнойного воспаления, при значительном забросе содержимого желудочно-кишечного тракта, при наличии инфицированной мочи и желчи, операции на прямой кишке. Операции на заведомо инфицированных органах и тканях, наличие сопутствующей (или предшествующей) инфекции, вовлечение ротоглотки, желчевыводящих или дыхательных путей, раны при перфорации органов желудочно-кишечного тракта. Травматические раны с экссудативным нагноением, с выявленным септическим очагом, даже при отрицательных результатах бактериальных посевов, а также пролежни и инфицированные опухоли. Операции трансплантации органов и тканей. | Цефазолин* 2 г + метронидазол* 0,5 г внутривенно Цефуроксим *1,5 г+ метронидазол* 0,5 г внутривенно Амоксициллин/клавулановая кислота* 1,2 г внутривенно Эртапенем** 1 г внутривенно Ванкомицин*** 1 г внутривенно |
________________________
* Однократное внутривенное введение в разовой дозе за 30 минут до разреза обеспечивает адекватные концентрации в тканях в течение всего оперативного вмешательства. При длительности операции в 2 раза превышающей период полувыведения антибиотика вводится повторная доза антимикробного лекарственного средства. Проведение профилактической антибиотикотерапии в послеоперационном периоде не показано.
** Внутривенно в разовой дозе за 1 час до разреза в течение 30 минут (преимущественное использование при оперативных вмещательствах по повуду перфорации внутренних органов, на дыхательных путях и при трансплантации органов и тканей).
*** В стационарах с высокой частотой метициллинрезистентных стафилококков (далее-MRSA).
Информация
Источники и литература
- Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019
- www.minzdrav.gov.by
Прикреплённые файлы
Мобильное приложение «MedElement»
- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»
- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Ключевая информация: эпидуральный катетер по методу Раца
- Показания к проведению эпидуральной катетеризации по Рацу: Хроническая боль в спине и седалищная боль вследствие ущемления нервов, грыжи межпозвоночного диска, радикулопатии (заболевание корешков спинномозговых нервов), эндоскопический осмотр эпидурального пространства
- Пребывание в стационаре: 2 дня, 3 ночи (4 инъекции)
- Реабилитация: Ограничение веса: 1 неделя -10 кг, 4 недели — 20 кг, физиотерапия
- Анестезия: Только местное обезболивание
- Мобилизация: Спустя 1 час после операции
- Принятие душа возможно: через 1 день после операции
- Продолжительность нетрудотоспособности: 1 неделя
- Занятия активными видами спорта: Плавание или бег спустя 3 недели после операции
- Литература по эпидуральной катетерной терапии
Что такое эпидуральная катетаризация по методу Раца?

На изображении выше показан нижний край позвоночного столба. При помощи зонда трубка направляется через естественные отверстия в эпидуральное пространство (внутрь позвоночного канала). Под рентгеновским контролем для безопасности она направляется в центр локализации боли. Лекарства и обезболивающие вводится прямо в источник боли изнутри. © Viewmedica
Эпидуральный катетер по методу Раца— это инъекция (или серия инъекций) в позвоночник для лечения хронических болей в спине. Инъекция делается четыре раза в течение двух дней в стационаре.
Зачастую такая боль возникает по причине образования рубцовой ткани после хирургического вмешательства, грыжи межпозвоночного диска и заболеваний седалищного нерва.
Данное инъекционное лечение позволяет достичь быстрого и эффективного ослабления хронической боли и дискомфорта в поясничном отделе позвоночника без открытого хирургического вмешательства.
Заявление:
Медицинское сообщество все еще считает инновационное лечение по методу Раца экспериментальным. Утвержденные принципы эпидурального адгезиолизиса, ферментативной терапии рубцов и метода снижения осмотического давления являются предметами научных исследований и дискуссий.
Эпидуральная катетеризация по методу Раца является эффективным методом облегчения боли в пояснице и седалищной боли.
Показания к проведению эпидуральной катетеризации по методу Раца
Уменьшение размера грыжи межпозвоночного диска при помощи эпидурального катетера по методу Раца
Эпидуральная эндоскопия — это эффективный метод лечения грыжи межпозвоночного диска, находящейся на ранней стадии. Если место локализации грыжи приемлемо, ее размер может быть быстро уменьшен при помощи инфузии 10% солевого раствора в непосредственной близости от места расположения грыжи. Уменьшение объема и сжатие способствует ускорению естественного процесса восстановления, который в другом случае затянулся бы на несколько месяцев. Эпидуральная катетеризация в нашей клинике является эффективной альтернативой эндоскопическому либо микрохирургическому удалению «свежих» грыж. После тщательной диагностики мы предоставим Вам подробную информацию о возможностях эффективного индивидуального лечения грыжи межпозвоночного диска.
Существует несколько заболеваний, являющихся причиной сильной седалищной боли, отдающей в ногу или даже в стопу. Одна из самых важных причин грыжа поясничного отдела позвоночника. В таких случаях эпидуральная катетеризация по методу Раца может помочь снизить боль без хирургического вмешательства на позвоночнике. Главное преимущество при этом — отсутствие травм мягких тканей: эпидуральная катетеризация по методу Раца является надежным методом, не затрагивающим чувствительную область спинного мозга.
Специальный зонд вводится в позвоночный канал только через кожу и естественные разрезы у основания позвоночника.
Исследование эпидурального пространства спинного мозга с помощью эндоскопической диагностики
При помощи эпидурального катетера по методу Раца можно проводить не только качественное лечение, но и точную диагностику. В этом случае зонд может быть использован для управления инструментами, включая эндоскопические камеры диаметром в несколько миллиметров в пределах эпидурального пространства поясничного отдела позвоночника с целью визуального исследования причин болей в спине. Данный метод диагностики дает точное представление о расположении болезненного воспаления, межпозвоночной грыжи, стеноза позвоночного канала с защемления нервов.
Терминология эпидуральной катетеризации по методу Раца
Катетер Рац был изобретен в 1982 году американским анестезиологом профессором доктором Габором Рац (Prof. Dr. Gabor Racz). Катетер — это специальное медицинское приспособление, через которое зонд вводится в полость тела. Невролиз — это облегчение любого давления на нерв. Каудальный означает ближе к хвосту или к заднему концу тела. Эпидуральный означает внутри центральной нервной системы, составляющим элементом которой является спинной мозг. Кровеносные сосуды внутри этой полости отсутствуют.
Когда показана катетеризация по методу Раца»
- Острая боль при протузии или грыже межпозвоночного диска.
- Острая хроническая боль от раздражения нервных корешков
- Пост-нуклеотомический синдром – боль после операции
- Постоперационное рубцевание или фиброз
- Раздражение нервных корешков от механического воздействия
- Гипертрофирование тканей, окружающих спинной мозг либо костный артроз
Как врач может определить, подходит ли Вам лечение при помощи эпидурального катетера по методу Раца?
Эпидуральная катетеризация по методу Раца является признанным методом лечения радикулопатии, обусловленной поражением нервных корешков или хронической боли в спине. © Viewmedica.com
Данный метод лечения подходит лишь в случаях острой хронической боли. Для его проведения пациент должен иметь негативный опыт консервативного лечения болей в спине, составляющий не менее трех месяцев.
В некоторых случаях эпидуральный катетер по методу Раца может так же помочь после успешной микрохирургической операции по декомпрессии нервов, после которой могут остаться болезненные послеоперационные рубцы либо раздражения непосредственно вблизи спинного мозга.
Обследование МРТ подтвердит, либо опровергнет наличие раздражения нервных корешков. В целях безопасности инфильтрация должна быть проведена как минимум спустя шесть недель после последней эпидуральной инъекции.
Как проходит эпидуральная катетеризация по методу Раца
Как правило эпидуральная катетеризация по методу Раца проводится под местной анестезией. Пациент лежит на животе. Таким образом можно избежать рисков общего наркоза. Катетер остается в спинномозговом канале в течение двух дней, во время которых производится четыре введения медикаментов. В это время пациент может нормально двигаться и не ощущать боли. Гибкий катетер оснащен микроскопическим зондом, что помогает проводить точное освобождение и восстановление нервных корешков. Под местной анестезией он направляется к нужному месту по свободному пространству, которое окружает спинномозговой канал. Через введенный в позвоночный канал под рентгеновским контролем тонкий катетер к пораженному нервному корешку подаются специальные лекарственные растворы, обладающие рассасывающим, противовоспалительным и предотвращающим отечность действием.
В результате наступает контракция ткани, которая сдавливает нервный корешок. Таким образом, нагрузка на корешок снижается и устраняется основная причина возникновения боли.
Реабилитация после эпидурального катетера по методу Раца
- Избегать тяжелых нагрузок (максимум 10 кг) в течение одной недели
- В течение четырех недель разрешается поднимать максимум 20 кг.
- Избегать занятий спортом, в особенности оказывающих воздействие на позвоночник в течение трех месяцев (напр. гольф)
Справа налево: 1. Введение катетера в проблемное место. 2. Использование инфильтрации и медикаментов. 3. Обезвоженный и сжатый диск как результат инфильтрации при помощи 10% солевого раствора.
Процедура занимает 30-60 минут. Уже через час пациент может подняться. Однако нахождение в стационаре длится еще несколько дней. В течение этого времени проводится еще четыре аналогичных процедуры для введения медикаментов. Это необходимо для достижения максимальных результатов. При необходимости устранения дополнительной рубцовой ткани через несколько месяцев может потребоваться дополнительная инъекция.
Преимущества эпидурального катетера по методу Раца
В каких случаях Ваш специалист по заболеваниям позвоночника вынужден подобрать альтернативное лечение?
- Ревматизм
- Опухоли и неоплазмы
- Вертебральный перелом
- Стеноз позвоночного канала
- Дисфункция мочевых путей, половая дисфункция
- Заметная неврологическая симптоматика (онемение, паралич, упадок сил)
Информацию о тщательной диагностике и других преимущественно эндоскопических методах лечения Вы сможете получить, связавшись с нами.
Эпидуральный катетер по методу Раца — это процедура, во время которой уменьшается сама грыжа и таким образом снижается давление на нервные корешки. Катетер имеет специальную форму и материал, которые способствуют его продвижению без повреждения его окружающих тканей, что сводит риски осложнений до минимума. Данный метод подходит в случаях неудачного микрохирургического лечения (открытая хирургия позвоночника). В зависимости от обстоятельств при помощи введения различных химически активных веществ мы достигаем осмотический эффект и снимаем раздражение нервного волокна.
Область, окружающая позвоночник довольно чувствительна по причине высокой плотности ее нервной ткани.
Образование рубцов после открытой операции на спине может привести к хроническому воспалению и потере ее функций, что являет причиной новых проблем. В таких случаях образовавшиеся рубцы могут быть удалены путем дополнительного воздействия ферментами, ускоряющего заживление тканей спинного мозга и пораженных нервных корешков.
Возможности и границы эпидуральной катетеризации по методу Раца
Возможности: При помощи эпидурального катетера по методу Раца можно вылечить межпозвоночную грыжу, а так же другие заболевания позвоночника, когда физиотерапия и открытая операция не принесли желаемого результата.
Границы: Такие сложные структурные повреждения как, например, дегенерация позвоночного диска с костными шпорами (остеофит), стеноз позвоночного канала, спондилолистез, дегенерированные диски и др. требуют проведения малоинвазивного (эндоскопического) вмешательства. Если Вам необходима информация об эффективном малоинвазивном лечении, пожалуйста, свяжитесь с нами.
Рекомендации к малоинвазивному лечению
При наличии межпозвоночной грыжи зачастую возникают хронические боли и потеря функций нервов.
Осложнения и побочные эффекты эпидуральной катетеризации по методу Раца
Тщательное соблюдение гигиены имеет решающее значение для предотвращения осложнений после эпидуральной катетеризации по методу Раца.
Данные проблемы могут быть устранены при помощи инъекции 10% солевого раствора во время эпидуральной катетеризации по методу Раца. Данный метод способствует устранению жидкости из грыжи, тем самым уменьшая объем и давление на окружающие ткани нерва. Кроме того, данная процедура имеет противозастойный эффект болезненных воспалений нервных корешков. Стоит заметить, что существуют точные клинические доказательства того, что эпидуральный катетер по методу Раца является эффективным методом лечения радикулопатии, обусловленной поражением нервных корешков или хронической боли в спине.