
СТРУКТУРА
СВОЙСТВА

Твердость 4-4,5, у богатых иридием разностей — до 6-7. Обладает ковкостью. Излом крючковатый. Спайность обычно отсутствует. Уд. вес-15-19. Подмечена связь пониженного удельного веса с наличием пустот, занятых природными газами, а также включениями посторонних минералов. Обладает магнитностью, парамагнетик. Хорошо проводит электричество. Платина является одним из самых инертных металлов. Она нерастворима в кислотах и щелочах, за исключением царской водки. Платина также непосредственно реагирует с бромом, растворяясь в нём.
При нагревании платина становится более реакционноспособной. Она реагирует с пероксидами, а при контакте с кислородом воздуха — с щелочами. Тонкая платиновая проволока горит во фторе с выделением большого количества тепла. Реакции с другими неметаллами (хлором, серой, фосфором) происходят менее активно. При более сильном нагревании платина реагирует с углеродом и кремнием, образуя твёрдые растворы, аналогично металлам группы железа.
ЗАПАСЫ И ДОБЫЧА

Разведанные мировые запасы металлов платиновой группы составляют около 80 000 т и распределены, в основном, между ЮАР (87,5%), Россией (8,3%) и США (2,5%).
В России основными месторождениями металлов платиновой группы являются: Октябрьское, Талнахское и Норильск-1 сульфидно-медно-никелевые в Красноярском крае в районе Норильска (более 99% разведанных и более 94% оцененных российских запасов), Фёдорова Тундра (участок Большой Ихтегипахк) сульфидно-медно-никелевое в Мурманской области, а также россыпные Кондёр в Хабаровском крае, Левтыринываям в Камчатском крае, реки Лобва и Выйско-Исовское в Свердловской области. Крупнейшим платиновым самородком, найденным в России, является «Уральский гигант» массой 7860,5г, обнаруженный в 1904г. на Исовском прииске.
Самородную платину добывают на приисках, менее богаты рассыпные месторождения платины, которые разведываются, в основном, способом шлихового опробования.
Производство платины в виде порошка началось в 1805 году английским ученым У. Х. Волластоном из южноамериканской руды.
Сегодня платину получают из концентрата платиновых металлов. Концентрат растворяют в царской водке, после чего добавляют этанол и сахарный сироп для удаления избытка HNO3. При этом иридий и палладий восстанавливаются до Ir3+ и Pd2+. Последующим добавлением хлорида аммония выделяют гексахлороплатинат(IV) аммония (NH4)2PtCl6. Высушенный осадок прокаливают при 800—1000 °C
Получаемую таким образом губчатую платину подвергают дальнейшей очистке повторным растворением в царской водке, осаждением (NH4)2PtCl6 и прокаливанием остатка. Затем очищенную губчатую платину переплавляют в слитки. При восстановлении растворов солей платины химическим или электрохимическим способом получают мелкодисперсную платину — платиновую чернь.
ПРОИСХОЖДЕНИЕ

В экзогенных условиях в процессе разрушения коренных месторождений и пород образуются платиноносные россыпи. Большинство минералов подгруппы платины в этих условиях химически устойчивы. Платина в россыпях встречается в виде самородков, чешуек, пластин, лепёшек, конкреций, а также скелетных форм и губчатых выделений размером от 0,05 до 5 мм., иногда до 12 мм. Уплощенные и пластинчатые зёрна платины указывают на значительное удаление от коренных источников и переотложение. Дальность переноса платины в россыпях обычно не превышает 8 км., в косовых россыпях она больше. Палладистая и медистая разновидности платины в зоне гипергенеза могут «облагораживаться», теряя Pd, Cu, Ni. Содержание Cu и Ni, по А.Г. Бетехтину, в платине из россыпей может сокращаться более чем в 2 раза по сравнению с платиной коренного источника. В россыпях многих районов мира описаны новообразованная химически чистая платина и паладистая платина в виде натёчных форм радиально-лучистого строения.
ПРИМЕНЕНИЕ

Платина и её сплавы широко используются для производства ювелирных изделий.
Первые в мире платиновые монеты были выпущены и находились в обращении в Российской империи с 1828 по 1845 год. Чеканка началась с трехрублевиков. В 1829 г. «были учреждены платиновые дуплоны» (шестирублевики), а в 1830 г.— «квадрупли» (двенадцатирублевики). Были отчеканены следующие номиналы монет: достоинством 3, 6 и 12 рублей. Трехрублевиков было отчеканено 1 371 691 шт., шестирублевиков — 14 847 шт. и двенадцатирублевиков — 3474 шт.
Платина применялась при изготовлении знаков отличия за выдающиеся заслуги: из платины сделано изображение В. И. Ленина на советском ордене Ленина; из неё изготавливались советские орден «Победа», орден Суворова 1-й степени и орден Ушакова 1-й степени.
- С первой четверти XIX века применялась в России в качестве легирующей добавки для производства высокопрочных сталей.
- Платина применяется как катализатор (чаще всего в сплаве с родием, а также в виде платиновой черни — тонкого порошка платины, получаемой восстановлением её соединений).
- Из платины изготавливают сосуды и мешалки, используемые при варке оптических стёкол.
- Для изготовления стойкой химически и к сильному нагреву лабораторной посуды (тигли, ложки и др.).
- Для изготовления постоянных магнитов с высокой коэрцитивной силой и остаточной намагниченностью (сплав трёх частей платины и одной части кобальта ПлК-78).
- Специальные зеркала для лазерной техники.
- Для изготовления долговечных и стабильных электрических контактов в виде сплавов с иридием, например, контактов электромагнитных реле (сплавы ПлИ-10, ПлИ-20, ПлИ-30).
- Гальванические покрытия.
- Перегонные реторты для производства плавиковой кислоты, получение хлорной кислоты.
- Электроды для получения перхлоратов, перборатов, перкарбонатов, пероксодвусерной кислоты (фактически использование платины обуславливает все мировое производство перекиси водорода: электролиз серной кислоты — пероксодвусерная кислота — гидролиз — отгонка перекиси водорода).
- Нерастворимые аноды в гальванотехнике.
- Нагревательные элементы печей сопротивления.
- Изготовление термометров сопротивления.
- Покрытия для элементов СВЧ-техники (волноводы, аттенюаторы, элементы резонаторов).
Платина (англ. Platinum) — Pt
| Молекулярный вес | 195.08 г/моль |
| Происхождение названия | от испанского Platina, уменьшит. от plata — «серебро», т. е. серебрецо, серебришко |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/A.14-70 |
| Nickel-Strunz (10-ое издание) | 1.AF.10 |
| Dana (7-ое издание) | 1.2.1.1 |
| Dana (8-ое издание) | 1.2.1.1 | Hey’s CIM Ref | 1.82 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | стально-серый переходящий в тёмно-серый |
| Цвет черты | серо-белый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | нет |
| Твердость (шкала Мооса) | 4-4,5 |
| Прочность | ковкий |
| Излом | зазубренный, крючковатый |
| Плотность (измеренная) | 14 — 19 г/см3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | парамагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | изотропный |
| Цвет в отраженном свете | белый |
| Плеохроизм | не плеохроирует |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
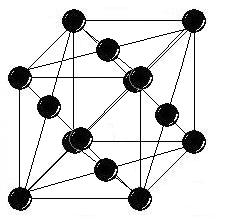
| Точечная группа | m3m (4/m 3 2/m) — изометрический гексаоктаэдрический |
| Пространственная группа | Fm3m |
| Сингония | кубическая |
| Параметры ячейки | a = 3.9231Å |
| Двойникование | общая по (111) |
mineralpro.ru
13.07.2016
Металлы платиновой группы (МПГ) относятся к группе драгоценных
металлов. Они характеризуются серебряным белым цветом, каталитическими свойствами,
дефицитом и высокой стоимостью. МПГ включают в себя следующие металлы: платина,
палладий, родий, рутений, иридий и осмий. Как правило, они встречаются в
полиметаллических месторождениях, которые также могут включать никель, медь,
хром, золото и другие металлы. МПГ являются химически стойкими, выдерживают
высокие температуры и обладают хорошей электропроводностью. Именно поэтому их
широко применяют в различных секторах: от автомобильной промышленности до
ювелирных изделий и производства лекарств. В данной работе я предлагаю
рассмотреть платину подробнее.
Платина была
известна и использовалась инками и чибча на территории Америки. В Европу попала
впервые только в XVIII веке. Причем тогда общество не оценило новый открытый химический
элемент из-за того, что технически его сплав с серебром было сложно отличить от
золота и в результате удавалось
изготавливать ювелирные подделки.
В России платина была впервые найдена на Урале, в Верх-Исетском округе,
в 1819 году. При промывке золотоносных пород в золоте заметили белые блестящие
зерна, которые не растворялись даже в самых сильных кислотах.
В 1823 году В.В. Любарский, Берг-пробирер лаборатории Петербургского
горного корпуса, исследовал эти зерна и установил, что загадочный «сибирский
металл принадлежит к особому роду сырой платины, содержащей знатное количество
иридия и осмия».
В 1824 году на Урале были открыты чисто платиновые россыпи. Эти месторождения
были исключительно богаты и сразу же вывели Россию на первое место в мире по добыче
платины.
В 1826 году, выдающийся инженер своего времени, П.Г. Соболевский
вместе с В.В. Любарским разработал простой и надежный способ получения ковкой
платины.
21 марта 1827 года в конференц-зале Петербургского горного
кадетского корпуса на многолюдном торжественном собрании Ученого комитета по горной
и соляной части были показаны изготовленные новым методом первые изделия из
русской платины – проволока, чаши, тигли, медали, слиток весом в 6 фунтов.
С 1828 года в России стали выпускать платиновые монеты 3-, 6- и
12-рублевого достоинства.
В 1843 году добыли уже 3500 кг платины. Это сказалось на цене, платина
стала дешевле.
1845 году по специальному указу, из-за боязни подделки и ввоза платиновых
монет из-за границы, вся платиновая монета в шестимесячный срок была изъята из
обращения.
В 1867 году царский указ упразднил государственную монополию на
платину и разрешил беспошлинный вывоз ее за границу. Воспользовавшись
благоприятной конъюнктурой, Англия скупила все запасы этого металла – более 16
тонн.
Перед первой мировой войной добыча платины в России составляла
90…95% от мировой добычи.
В мае 1918 года был создан Институт по изучению платины, влившийся
позже в Институт общей и неорганической химии АН СССР, носящий ныне имя
академика Н.С. Курнакова.
Рисунок 1 – Самородок из платины.
Иллюстрация: http://bigpicture.ru
Платина – химический элемент,10-й группы (по устаревшей классификации – побочной подгруппы
восьмой группы), 6-го периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 78; блестящий благородный металл серебристо-белого цвета; драгоценный металл, являющийся
биржевым товаром. Как правило, обозначается символом Pt, который происходит от
испанского слова plata – «серебро»; platina – уменьшительная форма, буквально «маленькое
серебро» или «серебришко».
Характеристика
платины:
—
цвет серовато–белый, блестящий;
—
радиус атома, нм 0.138;
—
параметры кристаллической решетки при 20 °С, нм а = 0.392;
—
плотность при 20 °С, кг/дм3 21.45;
— температура
плавления, °С 1773,5;
—
температура кипения, °С 4410;
—
удельная теплоемкость, Дж/(моль/К) 25.9;
—
теплопроводность при 25 °С, Вт/(м•К) 74.1;
—
удельное электросопротивление при 0 °С, мкОм•см 9.85;
—
твердость по Бринеллю, МПа 390–420;
—
модуль упругости, ГПа 173.
Химические
свойства
По химическим
свойствам платина похожа на палладий, но
проявляет бо́льшую химическую устойчивость. При комнатной температуре реагирует
с царской водкой:
Платина медленно
растворяется в горячей концентрированной серной кислоте и жидком броме. Она не
взаимодействует с другими минеральными и органическими кислотами. При
нагревании реагирует со щелочами и пероксидом натрия, галогенами (особенно в
присутствии галогенидов щелочных металлов):
Фторирование
платины при нормальным давлении и температуре 350–400 °C даёт фторид платины(IV):
При нагревании
платина реагирует с кислородом с образованием летучих оксидов. Выделены
следующие оксиды платины: черный PtO, коричневый PtO2,
красновато-коричневый PtO3, Pt2O3 и Pt3O4.
Металлическая
платина токсического действия на организм человека не оказывает, однако,
примеси, содержащиеся в платиновой черни (в первую очередь, теллур), ядовиты и
при попадании в желудочно-кишечный тракт возникают: некрозы участков слизистой
ЖКТ, зернистая дистрофия гепатоцитов, набухание эпителия извитых канальцев
почки, а также “общая интоксикация”.
Физические
свойства
Серовато-белый
пластичный металл. Платина – один из самых тяжёлых (плотность 21,09–21,45
г/см³; атомная плотность 6,62·1022 ат/см³) металлов. Твёрдость по
Бринеллю – 50 кгс/мм2 (по Моосу 3,5).
Кристаллическая
решётка кубическая гранецентрированная, а
= 0,392 нм, Z = 4, пространственная
группа Fm3m.
Металлы платиновой группы, как
правило, инертны. Платина, иридий и осмий являются довольно плотными металлами.
Для примера: платина на 11 % более плотная, чем золото. Палладий, родий и
рутений легче, но палладий имеет примерно такую же плотность, как серебро, и
первоначально эти металлы ошибочно принимали один за другой.
Кристаллизуется
в гранецентрированные кубические решетки. При воздействии на растворы солей
восстановителями металл может быть получен в виде “черни”, обладающей высокой
дисперсностью.
Платина
способна абсорбировать на поверхности некоторые газы, особенно водород и
кислород. Склонность к абсорбции значительно возрастает у металла, находящегося
в тонкодисперсном и коллоидном состоянии. Сильно поглощает кислород платиновая
чернь: 100 объемов кислорода на один объем платиновой черни.
Целебные свойства платины: Наночастицы металла
способны беспрепятственно проникать непосредственно в клетки тела и
положительно воздействовать на процессы жизнедеятельности. Наиглавнейшей
функцией платины по праву считается уничтожение свободных радикалов, замедляя,
таким образом, процесс преждевременного старения. Платина также входит в состав
некоторых препаратов, применяющихся для лечения онкологических заболеваний.
Платина
простое вещество
Платина легко
прокатывается и вытягивается в проволоку.
Платина является
одним из самых редких металлов: её среднее содержание в земной коре (кларк)
составляет 5·10−7 % по массе. Даже так называемая самородная платина
является сплавом, содержащим от 75 до 92 процентов платины, до 20 процентов
железа, а также иридий, палладий, родий, осмий, реже медь и никель.
Основная часть
месторождений платины (более 90 %) заключена в недрах пяти стран. К этим
странам относятся ЮАР (Бушвелдский комплекс), США, Россия, Зимбабве, Китай.
Платина – тугоплавкий и химически стойкий элемент, поэтому сплавы на
её основе характеризуются высокими механическими свойствами и коррозионной
стойкостью. Платина уступает золоту и серебру по ковкости и пластичности.
Применение присадок в данном случае обусловлено необходимостью снизить высокую
температуру плавления платины, улучшить ковкость, повысить пластичность и
износостойкость.
Платина легко
поддается обработке давлением (ковке, прокатке, волочению). Отличается
повышенной химической стойкостью: растворяется только в горячей «царской водке»,
цианистом калии и расплавленных щелочах. В отдельности ни одна из кислот на
этот металл не воздействует. Платина не окисляется на воздухе даже при сильном
накаливании, а при остывании сохраняет свой естественный цвет.
получение
Самородную платину добывают на приисках, менее богаты рассыпные месторождения платины, которые разведываются, в основном, способомшлихового опробования.
Производство платины в виде порошка началось в 1805 году английским ученым У. Х. Волластоном из южноамериканской руды.
Сегодня платину получают из концентрата платиновых металлов. Концентрат растворяют в царской водке, после чего добавляют этанол и сахарный сироп для удаления избытка HNO3. При этом иридий и палладий восстанавливаются до Ir3+ и Pd2+. Последующим добавлением хлорида аммония выделяют гексахлороплатинат(IV) аммония (NH4)2PtCl6. Высушенный осадок прокаливают при 800–1000 °C:
Получаемую таким образом губчатую платину подвергают дальнейшей очистке повторным растворением в царской водке, осаждением (NH4)2PtCl6 и прокаливанием остатка. Затем очищенную губчатую платину переплавляют в слитки. При восстановлении растворов солей платины химическим или электрохимическим способом получают мелкодисперсную платину – платиновую чернь.
нахождение в природе
В природе платина
встречается чаще в самородном состоянии, в виде зерен и чешуек различной
величины, редко в виде крупных самородков. Самородная платина представляет
собой минералы, включающие в свой состав кроме платины железо, иридий, родий,
палладий, медь, никель и поликсен. Поликсен не имеет постоянного состава и
является источником добычи многих металлов. Платиновые руды, которые также
являются источником получения платины и платиновых металлов, в природе
распространены мало.
Изотопы: природная платина встречается в виде смеси из шести изотопов: 190Pt
(0,014 %), 192Pt (0,782 %), 194Pt (32,967 %), 195Pt
(33,832 %), 196Pt (25,242 %), 198Pt (7,163 %). Один из
них слабо радиоактивен (190Pt, альфа-распад в 186Os,
период полураспада 6,5·1011 лет). Предсказывается существование
очень слабой радиоактивности ещё двух природных изотопов платины: альфа-распад 192Pt→188Os и двойной бета-распад 198Pt→198Hg, однако пока экспериментально
эти распады не зарегистрированы; установлено лишь, что периоды полураспада превышают
соответственно 4,7×1016 лет и 3,2×1014 лет.
использование
Важнейшие области применения платины–химическая и нефтеперерабатывающая
промышленность. В качестве катализаторов различных реакций используется около
половины всей потребляемой платины. В химической промышленности платину
используют в процессе производства азотной кислоты (по оценочным данным на эти
цели ежегодно идет 10-20 % мирового потребления платины).
В нефтеперерабатывающей промышленности с помощью платиновых
катализаторов на установках каталитического риформинга получают высокооктановый
бензин, ароматические углеводороды и технический водород из бензиновых и
лигроиновых фракций нефти.
В автомобильной промышленности платину также используют каталитические
свойства этого металла–для дожигания и обезвреживания выхлопных газов, с целью
оснащения автомобилей специальными устройствами по очистке выхлопных газов от
вредных примесей.
Применение в технике
Важнейшими областями применения платины стали химическая и нефтеперерабатывающая
промышленность. В качестве катализаторов различных реакций сейчас используется
около половины всей потребляемой платины.
Платина – лучший катализатор реакции окисления аммиака до окиси
азота NO в одном из главных процессов производства азотной кислоты.
Платиновые катализаторы используют при синтезе витаминов и некоторых
фармацевтических препаратов.
Платиновые катализаторы ускоряют многие другие практически важные
реакции: гидрирование жиров, циклических и ароматических углеводородов,
олефинов, альдегидов, ацетилена, кетонов, окисление SO2 в SO3
в сернокислотном производстве.
С помощью платиновых катализаторов на установках каталитического
риформинга получают высокооктановый бензин, ароматические углеводороды и
технический водород из бензиновых и лигроиновых фракций нефти.
Автомобильная промышленность использует каталитические свойства
этого металла – для дожигания и обезвреживания выхлопных газов.
Платина незаменима для современной электротехники, автоматики и телемеханики,
радиотехники и точного приборостроения. Из нее делают электроды топливных
элементов.
Из сплава платины с родием делают фильеры для производства стеклянного
волокна.
Платина и ее сплавы в химическом машиностроении служат превосходным
коррозионно стойким материалом. Аппаратура для получения многих особо чистых
веществ и различных фтор содержащих соединений изнутри покрыта платиной, а
иногда и целиком сделана из нее.
Платина и ее сплавы также применяются для изготовления:
— специальных зеркал для лазерной техники;
— нагревательных элементов печей сопротивления;
— анодных штанг для защиты от коррозии корпусов подводных лодок;
— нерастворимых анодов в гальванотехнике;
— гальванические покрытия;
— постоянных магнитов с высокой коэрцитивной силой и остаточной намагниченностью
(сплав платина–кобальт ПлК-78).
— электродов для получения перхлоратов, перборатов, перкарбонатов,
пероксодвусерной кислоты (фактически, использование платины обуславливает все
мировое производство перекиси водорода).
Применение платины в медицине
Незначительная часть платины идет в медицинскую промышленность. Из
платины и ее сплавов изготавливают хирургические инструменты, которые, не
окисляясь, стерилизуются в пламени спиртовой горелки. Сплавы платины с
палладием, серебром, медью, цинком, никелем служат отличным материалом для зубных
протезов.
Инертность платины к любым соединениям, ее электропроводимость и
неаллергенность позволяют активно использовать ее в биомедицине как компонент
электростимуляторов, катетеров и другого медицинского оборудования.
Определенные платиновые комплексы используются в химиотерапии и
показывают хорошую деятельность антиопухоли для небольшого количества опухолей.
Применение платины в ювелирном деле
Ежегодно мировая ювелирная промышленность потребляет около 50 тонн
платины. Большинство платиновых ювелирных предметов торговли содержат 95%
чистой платины. В ней минимум примесей, поэтому она настолько чистая, что не
тускнеет, не меняет цвет и сохраняет блеск на долгие годы.
Яркий блеск платины лучше всего отражает истинное сияние бриллиантов,
является прекрасной оправой для драгоценных камней и сочетается с натуральными
желтыми оттенками золота. Благодаря чистоте она не раздражает кожу, так как в
отличие от некоторых других металлов не содержит аллергенных примесей.
Самой важной чертой платины является прочность. Ювелирные изделия из
серебра и золота могут износиться, и их придется отдавать в ремонт, чтобы
заменить износившуюся часть новым металлом. Изделия из платины не изнашиваются,
они практически неподвластны времени.
Заключение
И так, в данной работе мы рассмотрели платину,как
элемент,как простое вещество,разобрали её свойства, так же применение и получение.
Выяснили, что из всех
платиновых металлов наибольшее применение имеет платина.
Платина и её
сплавы используются для изготовления аппаратуры для некоторых химических
производств. Около 25% Pt расходуется в электротехнике, радиотехнике,
автоматике, телемеханике, медицине. Применяется платина и как антикоррозионное
покрытие.
Выяснили, что
платина один из наиболее редких элементов встречается в самородном виде, в виде
сплавов и соединений.
Список
литературы
1.
Бузланов Г. Ф.,
«Производство и применение металлов платиновой группы в промышленности», М.,
1961г
2.
Металлы платиновой группы. [Электронный ресурс]
// Информационно-аналитический центр «Минерал».–Режим доступа: http://www.mineral.ru/Facts/russia/131/286/index.html
3.
Неограническая химия. Под ред. акад. Ю.Д.Третьякова. Том
3. Химия переходных элементов.. – Москва: Академия, 2004. – 368 с. – ISBN 5-7695-1436-1.
4.
Погодин С.А. Благородные металлы // Книга для
чтения по неорганической химии. Пособие для учащихся. Ч. II. – М.: Просвещение,
1975. – С. 206–221.
