Разбор частей речи
Далее давайте разберем морфологические признаки каждой из частей речи русского языка на примерах. Согласно лингвистике русского языка, выделяют три группы из 10 частей речи, по общим признакам:
1. Самостоятельные части речи:
- существительные (см. морфологические нормы сущ. );
- глаголы:
-
- причастия;
- деепричастия;
- прилагательные;
- числительные;
- местоимения;
- наречия;
2. Служебные части речи:
- предлоги;
- союзы;
- частицы;
3. Междометия.
Ни в одну из классификаций (по морфологической системе) русского языка не попадают:
- слова да и нет, в случае, если они выступают в роли самостоятельного предложения.
- вводные слова: итак, кстати, итого, в качестве отдельного предложения, а так же ряд других слов.
Морфологический разбор существительного
План морфологического разбора существительного
Пример:
«Малыш пьет молоко.»
Малыш (отвечает на вопрос кто?) – имя существительное;
- начальная форма – малыш;
- постоянные морфологические признаки: одушевленное, нарицательное, конкретное, мужского рода, I -го склонения;
- непостоянные морфологические признаки: именительный падеж, единственное число;
- при синтаксическом разборе предложения выполняет роль подлежащего.
Морфологический разбор слова «молоко» (отвечает на вопрос кого? Что?).
- начальная форма – молоко;
- постоянная морфологическая характеристика слова: среднего рода, неодушевленное, вещественное, нарицательное, II -е склонение;
- изменяемые признаки морфологические: винительный падеж, единственное число;
- в предложении прямое дополнение.
Приводим ещё один образец, как сделать морфологический разбор существительного, на основе литературного источника:
«Две дамы подбежали к Лужину и помогли ему встать. Он ладонью стал сбивать пыль с пальто. (пример из: «Защита Лужина», Владимир Набоков).»
Дамы (кто?) — имя существительное;
- начальная форма — дама;
- постоянные морфологические признаки: нарицательное, одушевленное, конкретное, женского рода, I склонения;
- непостоянная морфологическая характеристика существительного: единственное число, родительный падеж;
- синтаксическая роль: часть подлежащего.
Лужину (кому?) — имя существительное;
- начальная форма — Лужин;
- верная морфологическая характеристика слова: имя собственное, одушевленное, конкретное, мужского рода, смешанного склонения;
- непостоянные морфологические признаки существительного: единственное число, дательного падежа;
- синтаксическая роль: дополнение.
Ладонью (чем?) — имя существительное;
- начальная форма — ладонь;
- постоянные морфологические признаки: женского рода, неодушевлённое, нарицательное, конкретное, I склонения;
- непостоянные морфо. признаки: единственного числа, творительного падежа;
- синтаксическая роль в контексте: дополнение.
Пыль (что?) — имя существительное;
- начальная форма — пыль;
- основные морфологические признаки: нарицательное, вещественное, женского рода, единственного числа, одушевленное не охарактеризовано, III склонения (существительное с нулевым окончанием);
- непостоянная морфологическая характеристика слова: винительный падеж;
- синтаксическая роль: дополнение.
(с) Пальто (С чего?) — существительное;
- начальная форма — пальто;
- постоянная правильная морфологическая характеристика слова: неодушевленное, нарицательное, конкретное, среднего рода, несклоняемое;
- морфологические признаки непостоянные: число по контексту невозможно определить, родительного падежа;
- синтаксическая роль как члена предложения: дополнение.
Морфологический разбор прилагательного
Имя прилагательное — это знаменательная часть речи. Отвечает на вопросы Какой? Какое? Какая? Какие? и характеризует признаки или качества предмета. Таблица морфологических признаков имени прилагательного:
- начальная форма в именительном падеже, единственного числа, мужского рода;
- постоянные морфологические признаки прилагательных:
-
- разряд, согласно значению:
-
- — качественное (теплый, молчаливый);
- — относительное (вчерашний, читальный);
- — притяжательное (заячий, мамин);
- степень сравнения (для качественных, у которых этот признак постоянный);
- полная / краткая форма (для качественных, у которых этот признак постоянный);
- непостоянные морфологические признаки прилагательного:
-
- качественные прилагательные изменяются по степени сравнения (в сравнительных степенях простая форма, в превосходных — сложная): красивый-красивее-самый красивый;
- полная или краткая форма (только качественные прилагательные);
- признак рода (только в единственном числе);
- число (согласуется с существительным);
- падеж (согласуется с существительным);
- синтаксическая роль в предложении: имя прилагательное бывает определением или частью составного именного сказуемого.
План морфологического разбора прилагательного
Пример предложения:
Полная луна взошла над городом.
Полная (какая?) – имя прилагательное;
- начальная форма – полный;
- постоянные морфологические признаки имени прилагательного: качественное, полная форма;
- непостоянная морфологическая характеристика: в положительной (нулевой) степени сравнения, женский род (согласуется с существительным), именительный падеж;
- по синтаксическому анализу — второстепенный член предложения, выполняет роль определения.
Вот еще целый литературный отрывок и морфологический разбор имени прилагательного, на примерах:
Девушка была прекрасна: стройная, тоненькая, глаза голубые, как два изумительных сапфира, так и заглядывали к вам в душу.
Прекрасна (какова?) — имя прилагательное;
- начальная форма — прекрасен (в данном значении);
- постоянные морфологические нормы: качественное, краткое;
- непостоянные признаки: положительная степень сравнения, единственного числа, женского рода;
- синтаксическая роль: часть сказуемого.
Стройная (какая?) — имя прилагательное;
- начальная форма — стройный;
- постоянные морфологические признаки: качественное, полное;
- непостоянная морфологическая характеристика слова: полное, положительная степень сравнения, единственное число, женский род, именительный падеж;
- синтаксическая роль в предложении: часть сказуемого.
Тоненькая (какая?) — имя прилагательное;
- начальная форма — тоненький;
- морфологические постоянные признаки: качественное, полное;
- непостоянная морфологическая характеристика прилагательного: положительная степень сравнения, единственное число, женского рода, именительного падежа;
- синтаксическая роль: часть сказуемого.
Голубые (какие?) — имя прилагательное;
- начальная форма — голубой;
- таблица постоянных морфологических признаков имени прилагательного: качественное;
- непостоянные морфологические характеристики: полное, положительная степень сравнения, множественное число, именительного падежа;
- синтаксическая роль: определение.
Изумительных (каких?) — имя прилагательное;
- начальная форма — изумительный;
- постоянные признаки по морфологии: относительное, выразительное;
- непостоянные морфологические признаки: множественное число, родительного падежа;
- синтаксическая роль в предложении: часть обстоятельства.
Морфологические признаки глагола
Согласно морфологии русского языка, глагол — это самостоятельная часть речи. Он может обозначать действие (гулять), свойство (хромать), отношение (равняться), состояние (радоваться), признак (белеться, красоваться) предмета. Глаголы отвечают на вопрос что делать? что сделать? что делает? что делал? или что будет делать? Разным группам глагольных словоформ присущи неоднородные морфологические характеристики и грамматические признаки.
Морфологические формы глаголов:
- начальная форма глагола — инфинитив. Ее так же называют неопределенная или неизменяемая форма глагола. Непостоянные морфологические признаки отсутствуют;
- спрягаемые (личные и безличные) формы;
- неспрягаемые формы: причастные и деепричастные.
Морфологический разбор глагола
- начальная форма — инфинитив;
- постоянные морфологические признаки глагола:
-
- переходность:
-
- переходный (употребляется с существительными винительного падежа без предлога);
- непереходный (не употребляется с существительным в винительном падеже без предлога);
- возвратность:
-
- возвратные (есть -ся, -сь);
- невозвратные (нет -ся, -сь);
- вид:
-
- несовершенный (что делать?);
- совершенный (что сделать?);
- спряжение:
-
- I спряжение (дела-ешь, дела-ет, дела-ем, дела-ете, дела-ют/ут);
- II спряжение (сто-ишь, сто-ит, сто-им, сто-ите, сто-ят/ат);
- разноспрягаемые глаголы (хотеть, бежать);
- непостоянные морфологические признаки глагола:
-
- наклонение:
-
- изъявительное: что делал? что сделал? что делает? что сделает?;
- условное: что делал бы? что сделал бы?;
- повелительное: делай!;
- время (в изъявительном наклонении: прошедшее/настоящее/будущее);
- лицо (в настоящем/будущем времени, изъявительного и повелительного наклонения: 1 лицо: я/мы, 2 лицо: ты/вы, 3 лицо: он/они);
- род (в прошедшем времени, единственного числа, изъявительного и условного наклонения);
- число;
- синтаксическая роль в предложении. Инфинитив может быть любым членом предложения:
-
- сказуемым: Быть сегодня празднику;
- подлежащим :Учиться всегда пригодится;
- дополнением: Все гости просили ее станцевать;
- определением: У него возникло непреодолимое желание поесть;
- обстоятельством: Я вышел пройтись.
Морфологический разбор глагола пример
Чтобы понять схему, проведем письменный разбор морфологии глагола на примере предложения:
Вороне как-то Бог послал кусочек сыру… (басня, И. Крылов)
Послал (что сделал?) — часть речи глагол;
- начальная форма — послать;
- постоянные морфологические признаки: совершенный вид, переходный, 1-е спряжение;
- непостоянная морфологическая характеристика глагола: изъявительное наклонение, прошедшего времени, мужского рода, единственного числа;
- синтаксическая роль в предложении: сказуемое.
Следующий онлайн образец морфологического разбора глагола в предложении:
Какая тишина, прислушайтесь.
Прислушайтесь (что сделайте?) — глагол;
- начальная форма — прислушаться;
- морфологические постоянные признаки: совершенный вид, непереходный, возвратный, 1-го спряжения;
- непостоянная морфологическая характеристика слова: повелительное наклонение, множественное число, 2-е лицо;
- синтаксическая роль в предложении: сказуемое.
План морфологического разбора глагола онлайн бесплатно, на основе примера из целого абзаца:
— Его нужно предостеречь.
— Не надо, пусть знает в другой раз, как нарушать правила.
— Что за правила?
— Подождите, потом скажу. Вошел! («Золотой телёнок», И. Ильф)
Предостеречь (что сделать?) — глагол;
- начальная форма — предостеречь;
- морфологические признаки глагола постоянные: совершенный вид, переходный, невозвратный, 1-го спряжения;
- непостоянная морфология части речи: инфинитив;
- синтаксическая функция в предложении: составная часть сказуемого.
Пусть знает (что делает?) — часть речи глагол;
- начальная форма — знать;
- постоянные морфологические признаки: несовершенный вид, невозвратный, переходный, 1-го спряжения;
- непостоянная морфология глагола: повелительное наклонение, единственного числа, 3-е лицо;
- синтаксическая роль в предложении: сказуемое.
Нарушать (что делать?) — слово глагол;
- начальная форма — нарушать;
- постоянные морфологические признаки: несовершенный вид, невозвратный, переходный, 1-го спряжения;
- непостоянные признаки глагола: инфинитив (начальная форма);
- синтаксическая роль в контексте: часть сказуемого.
Подождите (что сделайте?) — часть речи глагол;
- начальная форма — подождать;
- постоянные морфологические признаки: совершенный вид, невозвратный, переходный, 1-го спряжения;
- непостоянная морфологическая характеристика глагола: повелительное наклонение, множественного числа, 2-го лица;
- синтаксическая роль в предложении: сказуемое.
Вошел (что сделал?) — глагол;
- начальная форма — войти;
- постоянные морфологические признаки: совершенный вид, невозвратный, непереходный, 1-го спряжения;
- непостоянная морфологическая характеристика глагола: прошедшее время, изъявительное наклонение, единственного числа, мужского рода;
- синтаксическая роль в предложении: сказуемое.
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Пероксид водорода | |||
| Другие имена Dioxidane | |||
| Идентификаторы | |||
| Количество CAS |
| ||
| 3D модель ( JSmol ) |
| ||
| ЧЭБИ |
| ||
| ЧЭМБЛ |
| ||
| ChemSpider |
| ||
| ECHA InfoCard | 100.028.878 | ||
| Номер ЕС |
| ||
| IUPHAR / BPS |
| ||
| КЕГГ |
| ||
| PubChem CID |
| ||
| Номер RTECS |
| ||
| UNII |
| ||
| Номер ООН | 2015 г. (> 60% раствор.) 2014 г. (20–60% раствор) 2984 (8–20% раствор) | ||
| Панель управления CompTox ( EPA ) |
| ||
| ИнЧИ
| |||
| Улыбки
| |||
| Характеристики | |||
| Химическая формула | Н 2 О 2 | ||
| Молярная масса | 34,0147 г / моль | ||
| Появление | Очень светло-голубой цвет; бесцветный в растворе | ||
| Запах | немного острый | ||
| Плотность | 1,11 г / см 3 (20 ° C, 30% (вес / вес) раствор) 1,450 г / см 3 (20 ° C, чистый) | ||
| Температура плавления | -0,43 ° С (31,23 ° F, 272,72 К) | ||
| Точка кипения | 150,2 ° С (302,4 ° F, 423,3 К) (разлагается) | ||
| Растворимость в воде | Смешиваемый | ||
| Растворимость | растворим в эфире , не растворим в спирте в петролейном эфире | ||
| журнал P | -0,43 | ||
| Давление газа | 5 мм рт. Ст. (30 ° C) | ||
| Кислотность (p K a ) | 11,75 | ||
| Магнитная восприимчивость (χ) | −17,7 · 10 −6 см 3 / моль | ||
| Показатель преломления ( n D ) | 1,4061 | ||
| Вязкость | 1,245 с P (20 ° C) | ||
| Дипольный момент | 2,26 D | ||
| Термохимия | |||
| Теплоемкость ( C ) | 1,267 Дж / (г · К) (газ) 2,619 Дж / (г · К) (жидкость) | ||
| Std энтальпия | −187.80 кДж / моль | ||
| Фармакология | |||
| Код УВД | A01AB02 ( ВОЗ ) D08AX01 ( ВОЗ ), D11AX25 ( ВОЗ ), S02AA06 ( ВОЗ ) | ||
| Опасности | |||
| Паспорт безопасности | ICSC 0164 (> 60% раствор.) | ||
| Пиктограммы GHS |    | ||
| Сигнальное слово GHS | Опасность | ||
| Формулировки опасности GHS | H271 , H302 , H314 , H332 , H335 , H412 | ||
| Меры предосторожности GHS | P280 , P305 + 351 + 338 , P310 | ||
| NFPA 704 (огненный алмаз) | 3 3 OX | ||
| точка возгорания | Не воспламеняется | ||
| Смертельная доза или концентрация (LD, LC): | |||
| LD 50 ( средняя доза ) | 1518 мг / кг 2000 мг / кг (перорально, мышь) | ||
| ЛК 50 ( средняя концентрация ) | 1418 частей на миллион (крыса, 4 часа) | ||
| LC Lo ( самый низкий опубликованный ) | 227 частей на миллион (мышь) | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
| PEL (Допустимо) | TWA 1 ppm (1,4 мг / м 3 ) | ||
| REL (рекомендуется) | TWA 1 ppm (1,4 мг / м 3 ) | ||
| IDLH (Непосредственная опасность) | 75 частей на миллион | ||
| Родственные соединения | |||
| Родственные соединения | Вода Озон Гидразин Дисульфид водорода Дифторид кислорода | ||
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| | |||
| Ссылки на инфобоксы | |||
Перекись водорода — это химическое соединение с формулой H
2О
2. В чистом виде это очень бледно-голубая жидкость , немного более вязкая, чем вода . Он используется как окислитель , отбеливающий агент и антисептик , обычно в виде разбавленного раствора (3–6% по весу) в воде для потребительского использования и в более высоких концентрациях для промышленного использования. Концентрированная перекись водорода, или « высокопробная перекись », при нагревании разлагается со взрывом и использовалась в качестве топлива в ракетной технике .
Перекись водорода представляет собой реактивную форму кислорода и простейшую перекись , соединение, имеющее одинарную связь кислород-кислород . Он медленно разлагается под воздействием света и быстро в присутствии органических или реакционноспособных соединений. Обычно его хранят со стабилизатором в слабокислом растворе в темной бутылке, чтобы блокировать свет. Перекись водорода содержится в биологических системах, в том числе в организме человека. Ферменты, которые используют или разлагают перекись водорода, классифицируются как пероксидазы .
Характеристики
Температура кипения H
2О
2было экстраполировано как 150,2 ° C (302,4 ° F), что примерно на 50 ° C (90 ° F) выше, чем у воды. На практике перекись водорода будет подвергаться взрывоопасному термическому разложению при нагревании до этой температуры. Его можно безопасно перегонять при более низких температурах и пониженном давлении.
Состав
Структура и размеры H 2 O 2 в газовой фазе
Структура и размеры H 2 O 2 в твердой (кристаллической) фазе
Перекись водорода ( H
2О
2) — неплоская молекула с (скрученной) симметрией C 2 ; Впервые это показал Поль-Антуан Жигер в 1950 году с помощью инфракрасной спектроскопии . Хотя связь O-O является одинарной связью , молекула имеет относительно высокий барьер вращения 386 см -1 (4,62 кДж / моль ) для вращения между энантиомерами через транс- конфигурацию и 2460 см -1 (29,4 кДж / моль). через конфигурацию cis . Предполагается, что эти барьеры возникают из-за отталкивания между неподеленными парами соседних атомов кислорода и диполярных эффектов между двумя связями O – H. Для сравнения, вращательный барьер для этана составляет 1040 см -1 (12,4 кДж / моль).
Двугранный угол приблизительно 100 ° между двумя связями O – H делает молекулу хиральной . Это самая маленькая и простая молекула, проявляющая энантиомерию . Было высказано предположение, что энантиоспецифические взаимодействия одного, а не другого, возможно, привели к амплификации одной энантиомерной формы рибонуклеиновых кислот и, следовательно, к происхождению гомохиральности в мире РНК .
Молекулярные структуры газообразного и кристаллического H
2О
2существенно отличаются. Это различие объясняется эффектами водородной связи , которая отсутствует в газообразном состоянии. Кристаллы H
2О
2являются тетрагональными с пространственной группой D4
4П 4 1 2 1 .
Водные растворы
В водных растворах перекись водорода отличается от чистого вещества из-за эффектов водородной связи между водой и молекулами перекиси водорода. Перекись водорода и вода образуют эвтектическую смесь с понижением температуры замерзания до –56 ° C; чистая вода имеет точку замерзания 0 ° C, а чистая перекись водорода -0,43 ° C. Температура кипения тех же смесей также ниже среднего значения обеих точек кипения (125,1 ° C). Это происходит при 114 ° C. Эта температура кипения на 14 ° C выше, чем у чистой воды, и на 36,2 ° C ниже, чем у чистой перекиси водорода.
Фазовая диаграмма из H
2О
2и вода: область над синей линией жидкая. Пунктирными линиями отделяются твердо-жидкие фазы от твердо-твердой фазы.
| H 2 O 2 (по массе ) | Плотность (г / см 3 ) | Темп. (° C) |
|---|---|---|
| 3% | 1,0095 | 15 |
| 27% | 1,10 | 20 |
| 35% | 1.13 | 20 |
| 50% | 1,20 | 20 |
| 70% | 1,29 | 20 |
| 75% | 1,33 | 20 |
| 96% | 1,42 | 20 |
| 98% | 1,43 | 20 |
| 100% | 1,45 | 20 |
Сравнение с аналогами
Пероксид водорода имеет несколько структурных аналогов со связями H m -X-X-H n (вода также показана для сравнения). Он имеет самую высокую (теоретическую) температуру кипения из этой серии (X = O, N, S). Его точка плавления также довольно высока, сравнима с точкой плавления гидразина и воды, при этом только гидроксиламин кристаллизуется значительно легче, что свидетельствует об особенно сильной водородной связи. Дифосфан и сероводород демонстрируют только слабую водородную связь и имеют небольшое химическое сходство с перекисью водорода. Конструктивно все аналоги имеют аналогичные перекошенные структуры из-за отталкивания между соседними неподеленными парами .
| Имя | Формула | Молярная масса (г / моль) | Точка плавления (° C) | Точка кипения (° C) |
|---|---|---|---|---|
| Пероксид водорода | ХУХ | 34.01 | -0,43 | 150,2 * |
| Воды | HOH | 18.02 | 0,00 | 99,98 |
| Сероводород | HSSH | 66,15 | -89,6 | 70,7 |
| Гидразин | H 2 NNH 2 | 32,05 | 2 | 114 |
| Гидроксиламин | NH 2 OH | 33,03 | 33 | 58 * |
| Дифосфан | H 2 PPH 2 | 65,98 | -99 | 63,5 * |
Открытие
Александр фон Гумбольдт сообщил об одном из первых синтетических пероксидов, пероксиде бария , в 1799 году как побочном продукте его попыток разложить воздух. Девятнадцать лет спустя Луи Жак Тенар понял, что это соединение может быть использовано для получения ранее неизвестного соединения, которое он описал как eau oxygénée («кислородсодержащая вода»), впоследствии известного как перекись водорода. Сегодня термин «кислородсодержащая вода» может появляться на розничной упаковке, относящейся к смесям, содержащим либо воду и перекись водорода, либо воду и растворенный кислород. Это может привести к травмам, если пользователь неправильно поймет разницу.
В улучшенной версии процесса Тенара использовалась соляная кислота с последующим добавлением серной кислоты для осаждения побочного продукта сульфата бария . Этот процесс использовался с конца 19 века до середины 20 века.
Тенар и Жозеф Луи Гей-Люссак синтезировали пероксид натрия в 1811 году. Примерно в то же время стало известно об отбеливающем действии пероксидов и их солей на натуральные красители , но первые попытки промышленного производства пероксидов потерпели неудачу. Первый завод по производству перекиси водорода был построен в 1873 году в Берлине . Открытие синтеза перекиси водорода электролизом с серной кислотой привело к появлению более эффективного электрохимического метода. Впервые он был коммерциализирован в 1908 году в Вайсенштайне , Каринтия , Австрия. Процесс антрахинона , который до сих пор используется, был разработан в 1930 году немецким производителем химикатов IG Farben в Людвигсхафен . Повышенный спрос и усовершенствование методов синтеза привели к увеличению годового производства пероксида водорода с 35 000 тонн в 1950 году до более 100 000 тонн в 1960 году и до 300 000 тонн к 1970 году; к 1998 году он достиг 2,7 миллиона тонн.
Ранние попытки получить чистый перекись водорода не увенчались успехом. Безводный пероксид водорода впервые был получен вакуумной перегонкой .
Определение молекулярной структуры перекиси водорода оказалось очень трудным. В 1892 году итальянский физико-химик Джакомо Каррара (1864–1925) определил его молекулярную массу по понижению температуры замерзания , что подтвердило, что его молекулярная формула — H 2 O 2 . По крайней мере, полдюжины гипотетических молекулярных структур соответствовали имеющимся данным. В 1934 году английский физик-математик Уильям Пенни и шотландский физик Гордон Сазерленд предложили молекулярную структуру перекиси водорода, очень похожую на принятую в настоящее время.
Ранее, пероксид водорода был получен промышленным способом гидролиза из персульфат аммония , который сам по себе был получен электролизом раствора бисульфата аммония ( NH
4HSO
4) в серной кислоте :
Производство
Сегодня перекись водорода производится почти исключительно с помощью антрахинонового процесса , который немецкая химическая компания BASF разработала и запатентовала в 1939 году. Он начинается с восстановления антрахинона (такого как 2-этилантрахинон или производное 2-амила) до соответствующего антрагидрохинона. обычно путем гидрирования на палладиевом катализаторе . Затем в присутствии кислорода антрагидрохинон подвергается автоокислению : лабильные атомы водорода гидроксильных групп переходят на молекулу кислорода, давая перекись водорода и регенерируя антрахинон. В большинстве промышленных процессов окисление достигается путем пропускания сжатого воздуха через раствор антрагидрохинона, затем перекись водорода извлекается из раствора, а антрахинон возвращается в цикл для последовательных циклов гидрирования и окисления.
Итоговая реакция процесса, катализируемого антрахиноном, следующая:
- ЧАС
2+ O
2→ H
2О
2
Экономичность процесса во многом зависит от эффективной рециркуляции экстракционных растворителей, катализатора гидрирования и дорогостоящего хинона .
Контейнер-цистерна ISO для перевозки перекиси водорода
Цистерна, предназначенная для перевозки перекиси водорода по железной дороге.
Другие источники
Небольшие, но обнаруживаемые количества перекиси водорода могут быть получены несколькими способами. Небольшие количества образуются при электролизе разбавленной кислоты вокруг катода, где выделяется водород, если вокруг него барботируют кислород. Его также получают, подвергая воду воздействию ультрафиолетовых лучей от ртутной лампы или электрической дуги , помещая ее в сосуд, прозрачный для ультрафиолета (например, кварцевый). Его можно обнаружить в ледяной воде после сжигания направленного на него потока газообразного водорода, а также на плавучем льду. Быстро охлаждающий влажный воздух, продуваемый искровым разрядником с температурой около 2000 ° C, дает заметные количества.
Коммерчески жизнеспособный процесс производства перекиси водорода непосредственно из окружающей среды вызывает интерес в течение многих лет. Трудно достичь эффективного прямого синтеза, поскольку реакция водорода с кислородом термодинамически способствует образованию воды. Разработаны системы прямого синтеза, в большинстве из которых используются мелкодисперсные металлические катализаторы, подобные тем, которые используются для гидрирования органических субстратов. Ни один из них еще не достиг точки, когда их можно было бы использовать для синтеза в промышленном масштабе.
Доступность
Перекись водорода обычно доступна в виде раствора в воде. Потребителям он обычно доступен в аптеках в концентрации 3 и 6 мас.% . Концентрации иногда описываются с точки зрения объема произведенного газообразного кислорода; Один миллилитр 20-объемного раствора при полном разложении образует двадцать миллилитров газообразного кислорода. Для лабораторного использования наиболее распространены 30 мас.% Растворы. Также доступны коммерческие сорта от 70% до 98%, но из-за способности растворов, содержащих более 68% перекиси водорода, полностью преобразовываться в пар и кислород (при этом температура пара увеличивается по мере увеличения концентрации выше 68%) эти сорта потенциально гораздо более опасны и требуют особого ухода в специально отведенных местах для хранения. Покупатели обычно должны разрешить проверку коммерческими производителями.
В 1994 году мировое производство H
2О
2составляла около 1,9 миллиона тонн и выросла до 2,2 миллиона в 2006 году, большая часть из которых имела концентрацию 70% или меньше. В этом году объем 30% H
2О
2продается по цене около 0,54 доллара США / кг , что эквивалентно 1,50 доллара США / кг (0,68 доллара США / фунт ) на «100% -ной основе».
Перекись водорода содержится в поверхностных и подземных водах, а также в атмосфере . Он образуется при освещении или естественном каталитическом действии веществ, содержащихся в воде. Морская вода содержит от 0,5 до 14 мкг / л перекиси водорода, пресная вода от 1 до 30 мкг / л и воздух от 0,1 до 1 части на миллиард.
Реакции
Разложение
Перекись водорода разлагается с образованием воды и кислорода с Д Н о из -2884,5 кДж / кг и Δ S 70,5 Дж / (моль · К):
- 2 ч
2О
2→ 2 H
2О + О
2
Скорость разложения увеличивается с повышением температуры, концентрации и pH ( H
2О
2нестабильны в щелочных условиях), с холодными, разбавленными и кислыми растворами, показывающими лучшую стабильность. Разложение катализируется различными окислительно-восстановительными ионами или соединениями, включая большинство переходных металлов и их соединений (например, диоксид марганца (MnO 2 ), серебро и платину ). Ионы некоторых металлов, например Fe2+
или Ti3+
, может вызвать разложение по другому пути с образованием свободных радикалов, таких как гидроксильный радикал (HO • ) и гидропероксил (HOO • ). Неметаллические катализаторы включают йодид калия (KI), который реагирует особенно быстро и составляет основу демонстрации зубной пасты для слона . Перекись водорода также может биологически разлагаться ферментом каталазой . При разложении перекиси водорода выделяется кислород и тепло; это может быть опасно, поскольку пролитие перекиси водорода высокой концентрации на горючее вещество может вызвать немедленный пожар.
Окислительно-восстановительные реакции
Окислительно-восстановительные свойства перекиси водорода зависят от pH, поскольку кислотные условия усиливают действие окислителей, а основные условия усиливают действие восстановителей . Поскольку перекись водорода проявляет амбивалентные окислительно-восстановительные свойства, одновременно являясь окислителем или восстановителем, ее окислительно-восстановительные свойства непосредственно зависят от pH.
В кислых растворах H
2О
2является мощным окислителем , более сильным, чем хлор , диоксид хлора и перманганат калия . При использовании для мытья лабораторной посуды раствор перекиси водорода и серной кислоты называют раствором Пираньи .
ЧАС
2О
2является источником гидроксильных радикалов ( • OH), которые обладают высокой реакционной способностью. ЧАС
2О
2используется в осциллирующих реакциях Бриггса – Раушера и Брея – Либхафски .
В кислых растворах Fe2+
окисляется до Fe3+
(перекись водорода действует как окислитель):
- 2 Fe2+
(водн.) + H
2О
2+ 2 часа+
(водн.) → 2 Fe3+
(водн.) + 2 H
2О (л)
и сульфит ( SO2-
3) окисляется до сульфата ( SO2-
4). Однако перманганат калия восстанавливается до Mn.2+
кислотным H
2О
2. Однако в щелочных условиях некоторые из этих реакций меняются; например, Mn2+
окисляется до Mn4+
(как MnO
2).
В основных растворах перекись водорода является сильным восстановителем и может восстанавливать различные неорганические ионы. Когда H
2О
2действует как восстановитель, также образуется газообразный кислород . Например, перекись водорода восстанавливает гипохлорит натрия и перманганат калия , что является удобным методом получения кислорода в лаборатории:
- NaOCl + H
2О
2→ O
2+ NaCl + H
2О - 2 КМно
4+ 3 часа
2О
2→ 2 MnO
2+ 2 КОН + 2 Н
2O + 3 O
2
Органические реакции
Перекись водорода часто используется в качестве окислителя . Показательно окисление тиоэфиров до сульфоксидов :
- Ph -S-CH
3+ H
2О
2→ Ph -S (O) -CH
3+ H
2О
Щелочная перекись водорода используется для эпоксидирования электронодефицитных алкенов, таких как производные акриловой кислоты , и для окисления алкилборанов до спиртов , второй стадии гидроборирования-окисления . Он также является основным реагентом в процессе окисления Дакина .
Предшественник других пероксидных соединений
Перекись водорода — это слабая кислота, образующая гидропероксид или пероксидные соли со многими металлами.
Он также превращает оксиды металлов в соответствующие пероксиды. Например, при обработке перекисью водорода хромовая кислота ( CrO
3и H
2ТАК
4) образует синий пероксид CrO ( O
2)
2.
Этот тип реакции используется в промышленности для получения пероксоанионов. Например, реакция с бурой приводит к образованию пербората натрия , отбеливателя, используемого в моющих средствах для стирки:
- Na
2B
4О
7+ 4 часа
2О
2+ 2 NaOH → 2 Na
2B
2О
4(ОЙ)
4+ H
2О
ЧАС
2О
2превращает карбоновые кислоты (RCO 2 H) в пероксикислоты (RC (O) O 2 H), которые сами используются в качестве окислителей. Перекись водорода реагирует с ацетоном с образованием перекиси ацетона и с озоном с образованием триоксидана . Перекись водорода образует устойчивые аддукты с мочевиной ( перекись водорода — мочевина ), карбонатом натрия ( перкарбонат натрия ) и другими соединениями. Кислотно-основной аддукт с оксидом трифенилфосфина является полезным «носителем» для H
2О
2 в некоторых реакциях.
Перекись водорода является одновременно окислителем и восстановителем. Окисление перекиси водорода гипохлоритом натрия дает синглетный кислород . Чистая реакция иона трехвалентного железа с перекисью водорода — это ион двухвалентного железа и кислород. Это происходит через одноэлектронное окисление и гидроксильные радикалы. Это используется в некоторых окислениях органической химии, например, в реактиве Фентона . Требуется только каталитическое количество иона железа, поскольку пероксид также окисляет двухвалентное железо до иона трехвалентного железа. Чистая реакция пероксида водорода и перманганата или диоксида марганца представляет собой ион марганца; однако, пока перекись не израсходована, некоторые ионы марганца повторно окисляются, чтобы сделать реакцию каталитической. Это составляет основу обычных монотопливных ракет.
Биологическая функция
Перекись водорода образуется в организме человека и других животных как недолговечный продукт биохимических процессов и токсичен для клеток . Токсичность возникает из-за окисления белков , мембранных липидов и ДНК ионами перекиси. Класс биологических ферментов, называемых супероксиддисмутазой (СОД), развивается почти во всех живых клетках как важный антиоксидантный агент. Они способствуют диспропорционирования из супероксида в кислород и пероксид водорода, который затем быстро разлагается под действием фермента каталазы на кислород и воду.
- 2 O—
2+ 2 часа+
→ O
2+ H
2О
2 - 2 Н 2 О 2 → О 2 + 2 Н 2 О
Пероксисомы — это органеллы, обнаруженные практически во всех эукариотических клетках. Они участвуют в катаболизме из очень длинноцепочечных жирных кислот , разветвленные жирные кислоты цепи , D — аминокислоты , полиамины и биосинтез плазмалогены , простых эфиров фосфолипидов критические для нормальной функции головного мозга млекопитающих и легких. При окислении они производят перекись водорода в следующем процессе, катализируемом флавинадениндинуклеотидом (FAD):
Каталаза , другой пероксисомальный фермент, использует эту H 2 O 2 для окисления других субстратов, включая фенолы , муравьиную кислоту , формальдегид и спирт , посредством реакции перекисного окисления:
таким образом устраняя ядовитую перекись водорода в процессе.
Эта реакция важна для клеток печени и почек, где пероксисомы нейтрализуют различные токсические вещества, попадающие в кровь. Некоторое количество этанола, который пьют люди, таким образом окисляется до ацетальдегида . Кроме того, когда в клетке накапливается избыток H 2 O 2 , каталаза превращает его в H 2 O посредством этой реакции:
Другой источник перекиси водорода — это разложение аденозинмонофосфата, в результате которого образуется гипоксантин . Затем гипоксантин окислительно катаболизируется сначала до ксантина, а затем до мочевой кислоты , и реакция катализируется ферментом ксантиноксидазой :
Разложение гипоксантина через ксантин до мочевой кислоты с образованием перекиси водорода.
Разложение гуанозинмонофосфата дает ксантин в качестве промежуточного продукта, который затем таким же образом превращается в мочевую кислоту с образованием пероксида водорода.
Яйца морского ежа вскоре после оплодотворения спермой вырабатывают перекись водорода. Затем он быстро диссоциирует на радикалы ОН · . Радикалы служат инициатором радикальной полимеризации , которая окружает яйца защитным слоем полимера .
У жука-бомбардира есть устройство, которое позволяет ему стрелять в врагов едкими и зловонными пузырями. Жук производит и хранит гидрохинон и перекись водорода в двух отдельных резервуарах в задней части брюшка. Когда ему угрожает опасность, жук сокращает мышцы, которые заставляют два реагента по трубкам с клапанами попадать в смесительную камеру, содержащую воду и смесь каталитических ферментов. В сочетании, реагенты подвергаются бурной экзотермической химической реакции , повышение температуры до около температуры кипения от воды . Кипящая жидкость с неприятным запахом частично превращается в газ ( мгновенное испарение ) и выбрасывается через выпускной клапан с громким хлопком.
Перекись водорода — сигнальная молекула защиты растений от патогенов .
Перекись водорода играет роль сигнальной молекулы в регуляции широкого спектра биологических процессов. Это соединение является основным фактором, вовлеченным в свободнорадикальную теорию старения , основанную на том, насколько легко перекись водорода может разлагаться на гидроксильный радикал и как побочные продукты супероксидного радикала клеточного метаболизма могут реагировать с окружающей водой с образованием перекиси водорода. Эти гидроксильные радикалы, в свою очередь, легко реагируют и повреждают жизненно важные компоненты клетки, особенно митохондрии . По крайней мере, в одном исследовании также пытались связать производство перекиси водорода с раком. Эти исследования часто цитировались в заявлениях о мошенничестве.
Количество перекиси водорода в биологических системах можно определить с помощью флуорометрического анализа .
Использует
Отбеливание
Около 60% мирового производства перекиси водорода используется для отбеливания целлюлозы и бумаги . Второе крупное промышленное применение является производством натрия перкарбонат и натрий пербората , которые используются в качестве мягких отбеливателей в стиральных моющих средствах . Перкарбонат натрия, который представляет собой аддукт карбоната натрия и перекиси водорода, является активным ингредиентом в таких средствах для стирки, как OxiClean и стиральный порошок Tide . При растворении в воде он выделяет перекись водорода и карбонат натрия. Сами по себе эти отбеливатели эффективны только при температуре стирки 60 ° C (140 ° F) или выше и поэтому часто используются вместе с активаторами отбеливания , которые облегчают очистку. при более низких температурах.
Производство органических соединений
Он используется в производстве различных органических пероксидов с дибензоилпероксид быть высоким примером объема. Он используется при полимеризации , как отбеливающий агент для муки и как средство от прыщей. Пероксикислоты , такие как перуксусная кислота и мета-хлорпероксибензойная кислота, также производятся с использованием перекиси водорода. Пероксид водорода использовался для создания взрывчатых веществ на основе органических пероксидов , таких как пероксид ацетона .
Дезинфицирующее средство
Кожа вскоре после воздействия 35% H
2О
2
Контактные линзы замачивают в 3% растворе перекиси водорода. В корпусе находится каталитический диск, который со временем нейтрализует перекись водорода.
Перекись водорода используется в некоторых процессах очистки сточных вод для удаления органических примесей. В глубокой переработке окисления , то реакция Фентона дает высокую реактивную гидроксильный радикал (ОН ·). Это разрушает органические соединения, включая те, которые обычно являются устойчивыми, такие как ароматические или галогенированные соединения . Он также может окислять соединения на основе серы, присутствующие в отходах; что полезно, так как обычно уменьшает их запах.
Перекись водорода может использоваться для стерилизации различных поверхностей, включая хирургические инструменты, и может использоваться в виде пара ( VHP ) для стерилизации помещений. H 2 O 2 демонстрирует эффективность широкого спектра действия против вирусов, бактерий, дрожжей и бактериальных спор. В целом, большая активность рассматривается в отношении грам-положительных , чем грамотрицательных бактерий; однако присутствие каталазы или других пероксидаз в этих организмах может повысить толерантность в присутствии более низких концентраций. Более низкие уровни концентрации (3%) будут работать против большинства спор; более высокие концентрации (от 7 до 30%) и более длительное время контакта улучшают спорицидную активность.
Перекись водорода рассматривается в качестве экологически безопасной альтернативы хлора основанное отбеливатели, так как он деградирует с образованием кислорода и воды , и это в целом признаны безопасными в качестве противомикробного агента по США за продуктами и лекарствами (FDA).
Для лечения угрей можно использовать перекись водорода , хотя перекись бензоила является более распространенным методом лечения.
Ниша использует
Перекись водорода находит различное бытовое применение, в первую очередь в качестве чистящего и дезинфицирующего средства.
- Обесцвечивание волос
Разбавленный H
2О
2(от 1,9% до 12%), смешанный с водным раствором аммиака , использовался для обесцвечивания человеческих волос . Обесцвечивающее свойство химического вещества дало название фразе « пероксидный блондин ». Перекись водорода также используется для отбеливания зубов . Его можно найти в большинстве отбеливающих зубных паст. Перекись водорода показала положительные результаты в отношении параметров светлоты зубов и цветового оттенка. Он действует путем окисления цветных пигментов на эмали, где оттенок зуба может стать светлее. Перекись водорода можно смешать с пищевой содой и солью, чтобы приготовить домашнюю зубную пасту.
- Удаление пятен крови
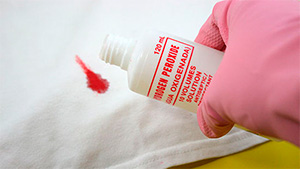
Перекись водорода вступает в реакцию с кровью как отбеливающее средство, поэтому, если пятно крови свежее или не слишком старое, обильное нанесение перекиси водорода, при необходимости более чем одного применения, полностью отбеливает пятно. Примерно через две минуты после нанесения кровь должна быть полностью удалена.
- Пропеллент
Ракетно-ленточная двигательная установка на основе перекиси водорода, используемая в реактивном ранце
Высококонцентрированный H
2О
2называется «перекисью высокой пробы» (HTP). Он может использоваться либо как монотопливо (не смешанный с топливом), либо как компонент окислителя в двухкомпонентной ракете . При использовании в качестве монотоплива используется преимущество разложения перекиси водорода с концентрацией 70–98% на водяной пар и кислород. Пропеллент закачивается в реакционную камеру, где катализатор, обычно серебряный или платиновый экран, вызывает разложение, производя пар с температурой выше 600 ° C (1100 ° F), который выталкивается через сопло , создавая тягу . ЧАС
2О
2монотопливо производит максимальный удельный импульс ( I уд ) 161 с (1,6 кН · с / кг). Перекись была первым основным монотопливом, принятым для использования в ракетах. Гидразин в конечном итоге заменил одноразовые двигатели с перекисью водорода, в первую очередь из-за увеличения удельного импульса вакуума на 25%. Гидразин (токсичный) и перекись водорода (менее токсичный [ПДК ACGIH 0,01 и 1 ppm соответственно]) являются единственными двумя монотопливами (кроме холодных газов), которые получили широкое распространение и используются для двигателей и силовых установок. Белл Ракетный пояс , реактивная система управления для X-1 , X-15 , Centaur , Mercury , Литтл Джо , а также генераторы газовые турбо-насос для Х-1, Х-15, Юпитер, Редстоун и Викинг использовали перекись водорода , как монотопливо.
В качестве двухкомпонентного топлива H
2О
2разлагается для сжигания топлива в качестве окислителя. В зависимости от топлива можно достичь удельных импульсов до 350 с (3,5 кН · с / кг). Перекись, используемая в качестве окислителя, дает несколько более низкий I sp, чем жидкий кислород, но она плотная, способная храниться, некриогенная и ее легче использовать для приведения в действие газовых турбин для создания высокого давления с использованием эффективного замкнутого цикла . Он также может быть использован для регенеративного охлаждения ракетных двигателей. Перекись очень успешно используется в качестве окислителя в ракетных двигателях Второй мировой войны немецких (например , Т-STOFF , содержащий оксихинолин стабилизатор, и для Walter HWK 109-500 Starthilfe RATO внешне гондолы системы бустера монотоплива, и для Walter HWK 109-509 ракеты моторная серия, используемая для Me 163 B), наиболее часто используемая с C-Stoff в самовоспламеняющейся гиперголической комбинации, а также для недорогих пусковых установок British Black Knight и Black Arrow .
В 1940-х и 1950-х годах турбина , разработанная Hellmuth Walter KG, использовала перекись водорода для использования на подводных лодках, когда они находились под водой; Было обнаружено, что он слишком шумный и требует слишком большого обслуживания по сравнению с дизель-электрическими системами. Некоторые торпеды использовали перекись водорода в качестве окислителя или топлива. В качестве возможных причин гибели ГМС » Сидон» и российской подводной лодки » Курск» была названа ошибка оператора при использовании торпед на основе перекиси водорода . Компания SAAB Underwater Systems производит Torpedo 2000. Эта торпеда, используемая ВМС Швеции , приводится в действие поршневым двигателем, приводимым в движение HTP в качестве окислителя, и керосином в качестве топлива в двухкомпонентной топливной системе.
- Светящиеся палочки
Перекись водорода реагирует с некоторыми сложными диэфирами , такими как сложный эфир фенилоксалата (циалум), с образованием хемилюминесценции ; это приложение чаще всего встречается в виде светящихся палочек .
- Садоводство
Некоторые садоводы и пользователи гидропоники рекомендуют использовать слабый раствор перекиси водорода в поливочных растворах. Его спонтанное разложение высвобождает кислород, который способствует развитию корней растений и помогает лечить корневую гниль (гибель корней клеток из-за недостатка кислорода) и множество других вредителей.
Для обычных поливов используется концентрация около 0,1%, которую можно увеличить до одного процента для противогрибкового действия. Испытания показывают, что листва растений может спокойно переносить концентрации до 3%.
- Рыбоводство
Перекись водорода используется в аквакультуре для борьбы со смертностью от различных микробов. В 2019 году FDA США одобрило его для борьбы с сапролегниозом у всех холодноводных рыб и всех сеголетков и взрослых холодноводных и теплокровных рыб, для борьбы с заболеванием внешней колонны у теплокровных рыб и для борьбы с Gyrodactylus spp. у разводимых пресноводных лососевых. Лабораторные испытания, проведенные рыбоводами, показали, что обычную перекись водорода в домашних условиях можно безопасно использовать для обеспечения кислородом мелких рыб. Пероксид водорода выделяет кислород в результате разложения, когда он подвергается воздействию катализаторов, таких как диоксид марганца .
Безопасность
Нормы различаются, но низкие концентрации, такие как 5%, широко доступны и легальны для использования в медицинских целях. Большинство безрецептурных растворов перекиси не подходят для приема внутрь. Более высокие концентрации могут считаться опасными и обычно сопровождаются паспортом безопасности (SDS). В высоких концентрациях перекись водорода является агрессивным окислителем и разъедает многие материалы, в том числе кожу человека. В присутствии восстановителя высокие концентрации H
2О
2 будет бурно реагировать.
Потоки перекиси водорода с высокой концентрацией, обычно выше 40%, следует рассматривать как опасные из-за того, что концентрированная перекись водорода соответствует определению окислителя DOT в соответствии с правилами США, если выбрасывается в окружающую среду. ЕРА подотчетное количество (RQ) для D001 опасных отходов составляют 100 фунтов (45 кг), или около 10 галлонов США (38 л), концентрированной перекиси водорода.
Перекись водорода следует хранить в прохладном, сухом, хорошо вентилируемом помещении и вдали от легковоспламеняющихся или горючих веществ. Его следует хранить в контейнере, состоящем из нереактивных материалов, таких как нержавеющая сталь или стекло (также могут быть подходящими другие материалы, включая некоторые пластмассы и алюминиевые сплавы). Поскольку он быстро разрушается под воздействием света, его следует хранить в непрозрачном контейнере, а фармацевтические препараты обычно поставляются в коричневых бутылках, которые блокируют свет.
Пероксид водорода в чистом или разбавленном виде может представлять несколько рисков, главный из которых состоит в том, что он образует взрывоопасные смеси при контакте с органическими соединениями. Отгонка перекиси водорода при нормальном давлении очень опасна. Он также вызывает коррозию, особенно в концентрированном виде, но даже домашние растворы могут вызывать раздражение глаз, слизистых оболочек и кожи. Проглатывание растворов перекиси водорода особенно опасно, так как при разложении в желудке выделяется большое количество газа (в десять раз больше объема 3% раствора), что приводит к вздутию живота. Вдыхание более 10% может вызвать сильное раздражение легких.
При значительном давлении пара (1,2 кПа при 50 ° C) пары пероксида водорода потенциально опасны. По данным US NIOSH, предел немедленной опасности для жизни и здоровья (IDLH) составляет всего 75 ppm. Управление по безопасности и гигиене труда США (OSHA) установило допустимый предел воздействия 1,0 ppm, рассчитанный как 8-часовое средневзвешенное значение по времени (29 CFR 1910.1000, таблица Z-1). Перекись водорода также была классифицирована Американской конференцией государственных промышленных гигиенистов (ACGIH) как «известный канцероген для животных, влияние которого на человека неизвестно». На рабочих местах, где существует риск воздействия опасных концентраций паров, следует использовать постоянные мониторы перекиси водорода. Информацию об опасностях, связанных с перекисью водорода, можно получить в OSHA и в ATSDR.
Неблагоприятное воздействие на раны
Исторически перекись водорода использовалась для дезинфекции ран, отчасти из-за ее низкой стоимости и быстрой доступности по сравнению с другими антисептиками . Теперь считается, что он препятствует заживлению и вызывает рубцевание , поскольку разрушает вновь образованные клетки кожи . Одно исследование показало, что только очень низкие концентрации (0,03% раствор, это разбавление типичного 3% перекиси в 100 раз) могут вызвать заживление, и только если не применять повторно. Было обнаружено, что 0,5% раствор препятствует заживлению. Хирургическое использование может привести к образованию газовой эмболии . Несмотря на это, он по-прежнему используется для обработки ран во многих странах, а в Соединенных Штатах он широко используется в качестве основного антисептика для оказания первой помощи.
Воздействие на кожу разбавленных растворов перекиси водорода вызывает отбеливание или обесцвечивание кожи из-за микроэмболии, вызванной пузырьками кислорода в капиллярах.
Использование в альтернативной медицине
Практики альтернативной медицины выступают за использование перекиси водорода при различных состояниях, включая эмфизему , грипп , СПИД и, в частности, рак . Нет никаких доказательств эффективности, и в некоторых случаях она оказалась фатальной.
Эта практика требует ежедневного потребления перекиси водорода перорально или путем инъекций и основана на двух предписаниях. Во-первых, перекись водорода вырабатывается организмом естественным путем для борьбы с инфекцией; во-вторых, патогены и опухоли человека (см. гипотезу Варбурга ) анаэробны и не могут выжить в богатой кислородом среде. Поэтому считается, что прием внутрь или инъекция перекиси водорода убивает болезнь, имитируя иммунный ответ в дополнение к увеличению уровня кислорода в организме. Это делает практику похожей на другие методы лечения кислородом, такие как озонотерапия и гипербарическая кислородная терапия .
Как эффективность, так и безопасность терапии перекисью водорода с научной точки зрения сомнительны. Перекись водорода вырабатывается иммунной системой, но под тщательным контролем. Клетки, называемые фагоцитами, поглощают патогены, а затем используют перекись водорода для их уничтожения. Перекись токсична как для клетки, так и для патогена, поэтому содержится в специальном отсеке, называемом фагосомой . Свободная перекись водорода повреждает любую ткань, с которой сталкивается, из-за окислительного стресса , процесса, который также был предложен как причина рака. Утверждения о том, что терапия перекисью водорода увеличивает клеточный уровень кислорода, не подтверждены. Ожидается, что введенные количества обеспечат очень мало дополнительного кислорода по сравнению с кислородом, доступным при нормальном дыхании. Также трудно повысить уровень кислорода вокруг раковых клеток внутри опухоли, так как кровоснабжение обычно плохое, и такая ситуация известна как гипоксия опухоли .
Большие пероральные дозы перекиси водорода в концентрации 3% могут вызвать раздражение и образование волдырей во рту, горле и животе, а также боль в животе, рвоту и диарею.
Внутривенное введение перекиси водорода было связано с несколькими смертельными случаями. Американское онкологическое общество утверждает , что «не существует никаких научных доказательств того, что перекись водорода является безопасным, эффективным и полезным для лечения рака.» Кроме того, эта терапия не одобрена FDA США.
Исторические происшествия
- 16 июля 1934 года в Куммерсдорфе , Германия, топливный бак, содержащий экспериментальную монотопливную смесь, состоящую из перекиси водорода и этанола, взорвался во время испытания, в результате чего погибли три человека.
- Во время Второй мировой войны врачи в немецких концлагерях экспериментировали с использованием инъекций перекиси водорода при убийстве людей.
- В апреле 1992 года произошел взрыв на заводе по производству перекиси водорода в Джарри во Франции из-за технического сбоя компьютеризированной системы управления, в результате которого погиб один человек и был полностью разрушен завод.
- Несколько человек получили легкие травмы после разлива перекиси водорода на борту рейса между американскими городами Орландо и Мемфис 28 октября 1998 года.
- России подводная лодка К-141 Курск плавал выполнить упражнение стрельбы торпеды на Петра Великий , в расстоянии Кирова -класса крейсера . 12 августа 2000 года в 11:28 по местному времени (07:28 UTC) при подготовке к запуску торпед произошел взрыв . Единственное достоверное сообщение на сегодняшний день состоит в том, что это произошло из-за отказа и взрыва одной из торпед «Курска», работающей на перекиси водорода. Считается, что ПВТ , форма высококонцентрированной перекиси водорода, используемой в качестве топлива для торпеды, просочился через контейнер, поврежденный ржавчиной или во время процедуры погрузки на сушу, где не было зарегистрировано происшествие с одной из торпед, случайно коснувшихся земли. . Судно погибло со всех сторон. Похожий инцидент стал причиной гибели HMS Sidon в 1955 году.
- 15 августа 2010 года на 54-м этаже 1515 Broadway на Таймс-сквер в Нью-Йорке произошел разлив около 30 галлонов США (110 л) чистящей жидкости. Разлив, который, по словам представителя пожарной службы Нью-Йорка, был вызван перекисью водорода, перекрыл Бродвей между Западной 42-й и Западной 48-й улицами, поскольку пожарные машины отреагировали на опасную ситуацию. Сообщений о травмах не поступало.
Смотрите также
- Реагент FOX , используемый для измерения уровня перекиси водорода в биологических системах.
- Халькогенид водорода
- Retr0bright , процесс с использованием перекиси водорода для восстановления пожелтевших предметов, таких как пластиковые корпуса компьютеров и игровые приставки .
использованная литература
Примечания
Библиография
- Я. Драбович; и другие. (1994). Г. Капоцци; и другие. (ред.). Синтез сульфонов, сульфоксидов и циклических сульфидов . Чичестер, Великобритания: Джон Вили и сыновья. С. 112–6. ISBN 978-0-471-93970-2.
- Н. Н. Гринвуд; А. Эрншоу (1997). Химия элементов (2-е изд.). Оксфорд, Великобритания: Баттерворт-Хайнеманн.Отличное описание свойств и химии H
2О
2. - Дж. Марч (1992). Высшая органическая химия (4-е изд.). Нью-Йорк: Вили. п. 723.
- В. Т. Гесс (1995). «Пероксид водорода». Энциклопедия химической технологии Кирка-Отмера . 13 (4-е изд.). Нью-Йорк: Вили. С. 961–995.
внешние ссылки
- Перекись водорода в Периодической таблице видео (Ноттингемский университет)
- Паспорт безопасности материала
- Агентство ATSDR по регистрации токсичных веществ и заболеваний: часто задаваемые вопросы
- Международная карта химической безопасности 0164
- Карманный справочник NIOSH по химической опасности
- Технологическая схема производства перекиси водорода автоокислением антрагидрохинона
- Справочник по перекиси водорода от Rocketdyne
- ИК-спектроскопическое исследование J. Phys. Chem.
Перекись водорода имеет широкую сферу действия, помогает справляться с различными проблемами. Несмотря на универсальность и эффективность этого средства, стоит знать, как правильно и в каких случаях его нужно использовать, чтобы не нанеси вред организму.
Содержание:
-
Как использовать раствор
-
Нужно ли смывать пероксид водорода
-
Нужно ли разбавлять перекись водорода
-
Можно ли принимать раствор внутрь
-
Можно ли вводить перекись водорода внутривенно
-
Как обрабатывать перекисью водорода раны
-
Как красить волосы перекисью водорода
-
Можно ли капать в уши перекись водорода
-
Можно ли чистить зубы содой с перекисью водорода
-
Как выводить пятна раствором
-
Как вывести грибок ногтей перекисью водорода
Как использовать раствор
Перекись водорода представляет собой жидкость прозрачного цвета, которая обладает окислительным и отбеливающим действием. Благодаря этим свойствам средство может убивать микробы, грибки и прочие вредные микроорганизмы. Перекись может наноситься на проблемный участок тела или же любую поверхность. Особенности применения зависят от конкретного случая.
Нужно ли смывать пероксид водорода
После нанесения перекиси водорода на какую-либо поверхность или же участок тела человека, через определенное время ее нужно смыть теплой водой.
Нужно ли разбавлять перекись водорода
Чтобы не спровоцировать появление аллергической реакции в виде раздражения или сыпи, лучше всего разбавлять перекись водорода в небольшом количестве воды, особенно если речь идет о полоскании ротовой полости.
Можно ли принимать раствор внутрь
Перекись отлично проявляет себя при наружном использовании, но принимать ее внутрь не рекомендуется. Проникая в организм, средство может нанести существенный вред внутренним органам либо тканям, что может привести к серьезным заболеваниям. При большом попадании перекиси водорода внутрь, на слизистой оболочке желудка могут появиться волдыри, начаться тошнота, рвота и болезненные ощущения в области живота.
Можно ли вводить перекись водорода внутривенно
От приема средства внутривенно также стоит отказаться, поскольку могут возникнуть необратимые реакции и можно нанести существенный вред здоровью человека.
Как обрабатывать перекисью водорода раны
В первую очередь перекись водорода ценится благодаря своему лечебному действию. Ее часто применяют для обработки ран. Раствор можно наносить на небольшие ранки, что позволит убрать омертвевшие ткани, препятствовать распространению микробов и остановить кровь. Перекись в таком случае можно использовать разово. При частом использовании можно приостановить распространение полезных бактерий, принимающих участие в затягивании ран.
При инфекционном акне раствором можно обрабатывать пораженные участки, что ускорит процесс затягивания.
Как красить волосы перекисью водорода
Раствором можно красить волосы. Особенно хорошо закрашивает отросшие темные корни на обесцвеченных волосах. Необходимо промокнуть корни раствором и оставить на 30 минут, после чего хорошо промыть под теплой водой.
Также средство эффективно при постепенном осветлении волом. Для этого понадобится взять воду и перекись водорода в одинаковом количестве, добавить в разбрызгиватель. Затем нужно распылять раствор на пряди и равномерно распределять с помощью расчески. Дождаться, пока полностью впитается. Если периодически проводить такие манипуляции, то можно будет заметить, как пряди начнут светлеть.
Можно ли капать в уши перекись водорода
Капли эффективны при наличии ушной инфекции, а также при закупорке уха. Но при наличии подобных проблем не стоит полагаться на одну перекись водорода, а нужно сообщить об этом специалисту, иначе проблема может только обостриться.
Сера в ушах не относится к инфекции, но может привести к появлению закупорок. В таком случае можно использовать пару капель перекиси водород и оливкового масла. Полученным раствором закапывать уши. После процедуры можно немного промыть уши под теплой водой.
Некоторые заверяют, что если капать в уши 2-3 капли раствора, то это поможет избавиться от микробов гриппа и вирусных заболеваний.
Можно ли чистить зубы содой с пероксидом водорода
Перекись водорода используется для отбеливания зубы. Для этого необходимо полоскать ротовую полость средством на протяжении 20-30 секунд, после чего выплюнуть.
На основе перекиси водорода можно в домашних условиях сделать зубную пасту. Для этого понадобится смешать ее с пищевой содой.
Регулярное проведение подобных процедур позволит сделать зубы более белыми. К тому же, зубная паста на основе соды и перекиси позволяет бороться с неприятным запахом изо рта.
Как выводить пятна раствором
Пероксид водорода активно используется хозяйками в быту. Она помогает удалять любые пятна со столешниц, кафеля и других поверхностей в доме. Это не только очистит дом, но и позволит предотвратить появление и размножение вредных микробов.
Перекись поможет избавиться от известнякового налета. Для этого нужно распрыскать раствор на необходимый участок, оставить на 2-3 часа, после чего смыть губкой с мылом.
На плитке собирается много грязи и появляются пятна, которые со временем очень тяжело удаляются. Перекись позволит убрать плесень и освежить внешний вид плитки. Для этого необходимо смешать средство с мукой, чтобы по консистенции напоминало пасту. Полученным раствором обработать керамическую поверхность и оставить на всю ночь. С утра помыть поверхность, после чего вся грязь исчезнет.
Как вывести грибок ногтей перекисью водорода
Пероксид водорода водорода также поможет тем, кто страдает грибком ногтей и стоп, поскольку средство обладает противогрибковым действием. Потребуется взять воду и перекись в равных количествах и распылять раствор на проблемные участки на ногах. К такому способу можно также прибегать в целях профилактики грибка.
Опубликовано: 27 Октября 2020
Автор
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Перекись водорода – незаменимый антисептик
Понятие и особенности

История появления
Перекись водорода появилась в начале XIX века, ее открыл практически в чистом виде химик Луис Тенар (Франция, 1818 год) в результате химической реакции пероксида бария с серной кислотой. В те времена она называлась «окисленной водой». Промышленное производство пероксида по методу французского химика началось полвека спустя (Берлин, 1873 год), но срок годности его был довольно короткий, поэтому его должны были использовать почти сразу же после получения. Широкое применение пероксид водорода нашел лишь 100 лет спустя, когда советский ученый Волькенштейн открыл его в безопасном виде.
Перекись водорода применялась во время Второй Мировой войны при изготовлении военной техники. Также, в зависимости от концентрации, начала использоваться в промышленных целях (например, в качестве отбеливающего средства), в фармакологии (антисептик).
Применением перекиси водорода в лечебных целях занимался в начале прошлого века американский врач Уильям Дуглас, после чего она стала широко применяться в медицине.
Применение
На сегодняшний день данный химический реактив, благодаря своим окислительным свойствам, нашел свое применение практически во всех областях промышленности:
— в целлюлозно-бумажной (для отбелки механических и химических масс, для изготовления бумаги);
— в текстильной (в качестве отбеливателя различных тканей, мехов);
— в химической (в качестве окислителя);
— в горнодобывающей (для добычи золота, урана);
— в нефтедобывающей и нефтеперерабатывающей;
— в сельском хозяйстве (для обработки сельскохозяйственных культур);
— в рыбном хозяйстве (для лечения рыб);
— в пищевой (для дезинфекции и стерилизации);
— в косметологии (как очищающее и отбеливающее средство, для приготовления краски для волос);
— в стоматологии (для отбеливания зубов);
— в быту (для поддержания чистоты);
— в ракетно-космической промышленности (для изготовления ракетного топлива);
— в медицине и фармакологии.
Применение перекиси водорода в медицине
Несмотря на вышеупомянутый перечень отраслей, перекись водорода нашла свое самое большое применение в медицине, особенно в хирургии, как антисептическое, дезинфицирующее, дезодорирующее средство.
Перекись может быть использована как наружно, так и внутренне, но самый безопасный и эффективный способ применения– это наружное. Для внутреннего применения в качестве профилактики от многих болезней используют только слабоконцентрированный 3% раствор перекиси и не более одного раза в день.
Так как перекись водорода в организме человека вырабатывается лейкоцитами и гранулоцитами, то она необходима для нормального обмена веществ. Основная задача перекиси – укрепить иммунную систему организма, разрушая злокачественные клетки (микробы). Перекись нужно использовать только на поврежденных участках кожи: при обработке и лечении гнойных ран, порезов, царапин, травм и т.д. Она обезоруживает поверхность кожи, препятствует появлению гноя на ней, тем самым способствует ее быстрому заживлению. Поэтому первая помощь при повреждении кожи — обработака переоксидом водорода.
В медицине перекись используют при лечении:
— аллергии;
— хронического бронхита;
— герпеса;
— гипертонии;
— гриппа;
— инсульта;
— опухолей (также и злокачественных);
— болезни Паркинсона;
— артроза;
— рассеянного склероза;
— болезней кожи;
— чесотки;
— кариеса;
— невралгии и многое др.
Перекись водорода является незаменимым антисептиком при чистке крови, а также для лечения инфекционных заболеваний.
Опасно! Несмотря на то, что перекись водорода нетоксичена и неопасна, при попадании концентрированного раствора на кожу, слизистую оболочку глаз или дыхательные пути может вызвать ожог. Первая помощь – промыть обильно холодной водой и обратиться к врачу. Следует помнить, что самолечение перекисью водорода может быть опасно для здоровья.
Купить перекись водорода
Магазин химических реактивов в Москве розница “Prime Chemicals Group” – это огромный выбор лабораторного оборудования и химических реактивов по доступным ценам. Купить перекись водорода 37% под заказ или перекись водорода цена (50%) всего за 52 руб.
Интернет-магазин «Прайм Кемикалc Групп» — лучший помощник по приобретению и доставке химических реактивов для любой лаборатории научного и медицинского учреждения.
Синонимы, аналоги
Статьи
ИНСТРУКЦИЯ
по медицинскому применению лекарственного препарата
Перекись водорода
Торговое наименование препарата
Перекись водорода
Международное непатентованное наименование
Водорода пероксид
Лекарственная форма
Раствор для местного и наружного применения
Состав
Активное вещество:
Перекись водорода медицинская — от 7,5 до 11 г
в зависимости от фактического содержания водорода пероксида в исходной субстанции эквивалентно содержанию водорода пероксида — 3 г (от 30 до 40 %)
Вспомогательные вещества:
Натрия бензоат — 0,05 г
Вода очищенная — до 100 мл
Описание
Бесцветная прозрачная жидкость без запаха.
Фармакотерапевтическая группа
Антисептическое средство
Код АТХ
D08AX01
Фармакодинамика:
Антисептическое средство из группы антиоксидантов. При контакте водорода перекиси с повреждённой кожей или слизистыми оболочками высвобождается активный кислород при этом происходит механическое очищение и инактивация органических веществ (протеины кровь гной). Антисептическое действие не является стерилизующим при его применении происходит лишь временное уменьшение количества микроорганизмов. Обильное пенообразование способствует тромбообразованию и остановке кровотечений из мелких сосудов.
Показания:
Воспалительные заболевания слизистых оболочек гнойные раны капиллярное кровотечение из поверхностных ран носовые кровотечения.
Для дезинфекции и дезодорирования: стоматит ангина тонзиллит гинекологические заболевания.
Противопоказания:
гиперчувствительность к компонентам препарата.
С осторожностью:
Декомпенсированные заболевания печени и почек гипертиреоз герпетиформный дерматит.
Беременность и лактация:
Препарат не имеет противопоказаний для применения во время беременности и в период лактации.
Способ применения и дозы:
Для наружного применения используют 1-3 % раствор для полоскания полости рта и горла нанесения на слизистые оболочки — 025 % раствор ( 3% раствор разводят водой в соотношении 1:11).
Поврежденные участки кожи или слизистой оболочки обрабатывают ватным или марлевым тампоном смоченным раствором препарата. Тампоны следует держать пинцетом. Возможно струйное орошение раневой поверхности.
Побочные эффекты:
Жжение в момент обработки раны аллергические реакции.
Передозировка:
Симптомы: раздражение верхних дыхательных путей (ожог ларинго- бронхоспазм); при попадании внутрь — раздражение слизистых оболочек желудочно-кишечного тракта гемолиз гемоглобинурия; летальная доза — около 3 г.
Лечение: промывание желудка 05 % раствором натрия тиосульфата растворами натрия гидрокарбоната внутривенно натрия тиосульфат 30 % — до 300 мл.
Взаимодействие:
Раствор перекиси водорода нестабилен в щелочной среде в присутствии солей металлов сложных радикалов некоторых оксидантов а также на свету и в тепле.
Особые указания:
Не рекомендуется использовать препарат под окклюзионные повязки.
Следует избегать попадания в глаза!
Не применять для орошения полостей!
Обработка раны раствором перекиси водорода не гарантирует от заражения столбняком и др. раневой инфекцией.
3 % раствор применяют внутрь в токсикологической практике в качестве антидота (в комбинации с 3 % раствором уксусной кислоты) при отравлении калия перманганатом.
Влияние на способность управлять трансп. ср. и мех.:
Не влияет.
Форма выпуска/дозировка:
Раствор для местного и наружного применения 3%.
Упаковка:
По 40 100 мл во флаконы из стекла или во флаконы- капельницы из стекла с винтовой горловиной укупоренные пробками полиэтиленовыми и крышками навинчиваемыми или крышками с прокладками
По 40 мл 100 мл в бутылки для лекарственных средств из полиэтилена высокого или низкого давления укупоренные навинчиваемыми пластмассовыми крышками с прокладками или со специальной насадкой.
Каждый флакон флакон-капельницу вместе с инструкцией по применению помещают в пачку из картона.
Допускается флаконы стеклянные по 40 мл и 100 мл вместе с равным количеством инструкций по применению упаковывать в коробки из картона с перегородками или решетками из картона гофрированного.
Допускается флаконы из полиэтилена по 40 мл и 100 мл вместе с равным количеством инструкций упаковывать в пленку полиэтиленовую термоусадочную или в коробки из картона.
По 500 мл 1000 мл во флаконы из укупоренные навинчиваемыми пластмассовыми крышками с прокладками (для стационара).
По 12 флаконов по 500 мл по 8 флаконов по 1000 мл вместе с равным количеством инструкций по применению упаковывают в пленку полиэтиленовую термоусадочную или в коробки из гофрокартона (для стационара).
Условия хранения:
В защищенном от света месте при температуре не выше 25 0 С.
Хранить в недоступном для детей месте.
Срок годности:
2 года.
Не применять препарат по истечении срока годности указанного на упаковке.
Условия отпуска
Без рецепта
Производитель
Общество с ограниченной ответственностью «ЮжФарм» (ООО «ЮжФарм»), 353360 Краснодарский край, Крымский район, ст. Троицкая, нефтепромплощадка, Россия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
ООО «ЮжФарм»
Перекись водорода р-р — Южфарм — цена, наличие в аптеках
Указана цена, по которой можно купить Перекись водорода р-р — Южфарм в Москве. Точную цену в Вашем городе Вы получите после перехода в службу онлайн заказа лекарств:
apteka.ru
planetazdorovo.ru
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)







![Перекись водорода как правильно пишется { displaystyle { ce {2NH4HSO4 -> [{электролиз}] (NH4) 2S2O8 + H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db83ccf805527a7d814cc0443fd02e172764a05b)
![Перекись водорода как правильно пишется { Displaystyle { ce {(NH4) 2S2O8 + 2H2O -> [гидролиз] 2 (NH4) HSO4 + H2O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ce4047f30e3c22e3987663c1f4a6f4b12e125ee)




![Перекись водорода как правильно пишется { Displaystyle { ce {R-CH2-CH2-CO-SCoA + O2 -> [{ ce {FAD}}] R-CH = CH-CO-SCoA + H2O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c81784a048a5c7ac9b29e369eaef884fdf03642f)

![Перекись водорода как правильно пишется { displaystyle { ce {H2O2 -> [{ ce {CAT}}] {1 / 2O2} + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/df4f002a0680eb6c0668474a565b44dd6b1f7ff9)