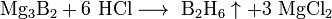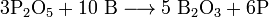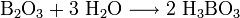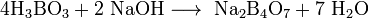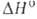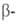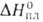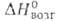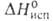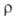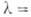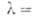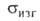Бор — элемент главной подгруппы третьей группы, второго периода периодической системы химических элементов, с атомным номером 5. Обозначается символом B (лат. Borium). В свободном состоянии бор — бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество. Известно более 10 аллотропных модификаций бора, образование и взаимные переходы которых определяются температурой, при которой бор был получен.
История и происхождение названия
Впервые получен в 1808 году французскими физиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Х. Дэви электролизом расплавленного B2O3.
Нахождение в природе
Среднее содержание бора в земной коре 4 г/т. Несмотря на это, известно около 100 собственных минералов бора; в «чужих» минералах он почти не встречается. Это объясняется прежде всего тем, что у комплексных анионов бора (а именно в таком виде он входит в большинство минералов) нет достаточно распространенных аналогов. Почти во всех минералах бор связан с кислородом, а группа фторсодержащих соединений совсем малочисленна. Элементарный бор в природе не встречается. Он входит во многие соединения и широко распространён, особенно в небольших концентрациях; в виде боросиликатов и боратов, а также в виде изоморфной примеси в минералах входит в состав многих изверженных и осадочных пород. Бор известен в нефтяных и морских водах (в морской воде 4,6 мг/л), в водах соляных озёр, горячих источников и грязевых вулканов.
Основные минеральные формы бора:
Боросиликаты: датолит CaBSiO4OH, данбурит CaB2Si2O8
Бораты: бура Na2B4O7 • 10H2O, ашарит MgBO2(OH), гидроборацит (Ca, Mg)B2O11 • 6H2O, иниоит Ca2B6O11 • 13H2O, калиборит KMg2B11O19 • 9H2O.
Так же различают несколько типов месторождений бора:
1. Месторождения боратов в магнезиальных скарнах:
— людвигитовые и людвигито-магнетитовые руды;
— котоитовые руды в доломитовых мраморах и кальцифирах;
— ашаритовые и ашарито-магнетитовые руды.
2. Месторождения боросиликатов в известковых скарнах (датолитовые и данбуритовые руды);
3. Месторождения боросиликатов в грейзенах, вторичных кварцитах и гидротермальных жилах (турмалиновые концентрации);
4. Вулканогенно-осадочные:
— борные руды, отложенные из продуктов вулканической деятельности;
— переотложенные боратовые руды в озёрных осадках;
— погребённые осадочные боратовые руды.
5. Галогенно-осадочные месторождения:
— месторождения боратов в галогенных осадках;
— месторождения боратов в гипсовой шляпе над соляными куполами.
Физические свойства
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду углерода, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
В природе бор находится в виде двух изотопов 10В (20 %) и 11В (80 %).
10В имеет очень высокое сечение поглощения тепловых нейтронов, поэтому 10В в составе борной кислоты применяется в атомных реакторах для регулирования реактивности.
Химические свойства
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором.
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3.
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой.
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов. Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты Н3ВО3.
Оксид бора B2O3 — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты.
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO33-), а тетрабораты.
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)×10-4 % бора, в костной ткани (1,1—3,3)×10-4 %, в крови — 0,13 мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза — 4 г.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.
Источник: Википедия
Другие заметки по химии
Бор химический элемент
| Бор / Borium (B) | |
|---|---|
| Атомный номер | 5 |
| Внешний вид простого вещества |  |
| Свойства атома | |
| Атомная масса (молярная масса) | 10,811 а.е.м. (г/моль) |
| Радиус атома | 98 пм |
| Энергия ионизации (первый электрон) | 800,2(8,29) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s2 2p1 |
| Химические свойства | |
| Ковалентный радиус | 82 пм |
| Радиус иона | 23 (+3e) пм |
| Электроотрицательность (по Полингу) | 2,04 |
| Электродный потенциал | — |
| Степени окисления | 3 |
| Термодинамические свойства простого вещества | |
| Плотность | 2,34 г/см³ |
| Молярная теплоёмкость | 11,09 Дж/(K·моль) |
| Теплопроводность | 27,4 Вт/(м·K) |
| Температура плавления | 2573 K |
| Теплота плавления | 23,60 кДж/моль |
| Температура кипения | 3931 K |
| Теплота испарения | 504,5 кДж/моль |
| Молярный объём | 4,6 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | ромбоэдрическая |
| Параметры решётки | a=10,17; α=65,18 Å |
| Отношение c/a | 0,576 |
| Температура Дебая | 1250 K |
| B | 5 |
| 10,811 | |
| [He]2s22p1 | |
| Бор | |
Бор— элемент главной подгруппы третьей группы, второго периода периодической системы химических элементов Д.И.Менделеева, с атомным номером 5. Обозначается символом B (Borium). В свободном состоянии бор— бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество. Известно более 10 аллотропных модификаций бора, образование и взаимные переходы которых определяются температурой, при которой бор был получен.
История и происхождение названия химического элемента Бор
Впервые получен в 1808 году французскими физиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Х. Дэви электролизом расплавленного B2O3.
Получение
Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических синтезов.
1. Метод металлотермии (чаще восстановление магнием или натрием):
2. Термическое разложение паров бромида бора на раскаленной (1000—1200°C) танталовой проволоке в присутствии водорода:
Физические свойства
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду углерода, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
Химические свойства
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химический бор довольно инертен и при комнатной температуре взаимодействует только со фтором:

При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором— фосфид BP, с углеродом— карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов с кислотой:
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты 
Оксид бора 
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты— бораты (содержащие анион BO33-), а тетрабораты, например:
Применение
Элементарный бор
Бор (в виде волокон) служит упрочняющим веществом многих композиционных материалов.
Также бор часто используют в электронике для изменения типа проводимости кремния.
Бор применяется в металлургии в качестве микролегирующего элемента, значительно повышающего прокаливаемость сталей.
Соединения бора
Карбид бора применяется в компактном виде для изготовления газодинамических подшипников.
Пербораты / пероксобораты (содержат ион [B2(O2)2(OH)4]2—) Технический продукт содержит до 10,4% «активного кислорода», на их основе производят отбеливатели, «не содержащие хлор» («персиль», «персоль» и др.).
Отдельно также стоит указать на то что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кроме нитрида углерода, алмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Сплав бора с магнием (диборид магния MgB2) обладает, на данный момент, рекордно высокой критической температурой перехода в сверхпроводящее состояние среди сверхпроводников первого рода. Появление вышеуказанной статьи стимулировало большой рост работ по этой тематике.
Борная кислота (H3BO3) широко применяется в атомной энергетике в качестве поглотителя нейтронов в ядерных реакторах типа ВВЭР (PWR) на «тепловых» («медленных») нейтронах. Благодаря своим нейтронно-физическим характеристикам и возможности растворяться в воде, применение борной кислоты делает возможным плавное (не ступенчатое) регулирование мощности ядерного реактора путем изменения ее концентрации в теплоносителе— так называемое «борное регулирование».
Бороводороды и борорганические соединения
Ряд органических производных бора (бороводороды) являются чрезвычайно эффективными ракетными топливами (диборан(B2H4), пентаборан, тетраборан и др.), а некоторые полимерные соединения с водородом и углеродом являются чрезвычайно стойкими к химическим воздействиям и высоким температурам, например широко известный пластик Карборан-22.
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)•10 – 4% бора, в костной ткани (1,1—3,3)•10 – 4%, в крови— 0,13мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза— 4г.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.
Бор, Borum, В (5)
Природные соединения бора (Boron, франц. Воге, нем. Bor), главным образом нечистая бура, известны с раннего средневековья. Под названиями тинкал, тинкар или аттинкар (Tinkal, Tinkar, Attinkar) бура ввозилась в Европу из Тибета; она употреблялась для пайки металлов, особенно золота и серебра. В Европе тинкал назывался чаще боракс (Воrax) от арабского слова bauraq и персидского — burah. Иногда боракс, или борако, обозначал различные вещества, например соду (нитрон). Руланд (1612) называет боракс хризоколлой — смолой, способной «склеивать» золото и серебро. Лемери (1698) тоже называет боракс «клеем золота» (Auricolla, Chrisocolla, Gluten auri). Иногда боракс обозначал нечто вроде «узды золота» (capistrum auri). В Александрийской эллинистической и византийской химической литературе борахи и борахон, а также в арабской (bauraq) обозначали вообще щелочь, например bauraq arman (армянский борак), или соду, позже так стали называть буру.
В 1702 г. Гомберг, прокаливая буру с железным купоросом, получил «соль» (борную кислоту), которую стали называть «успокоительной солью Гомберга» (Sal sedativum Hombergii); эта соль нашла широкое применение в медицине. В 1747 г. Барон синтезировал буру из «успокоительной соли» и натрона (соды). Однако состав буры и «соли» оставался неизвестным до начала XIX в. В «Химической номенклатуре» 1787 г. фигурирует название horacique асid (борная кислота). Лавуазье в «Таблице простых тел» приводит (radical boracique). В 1808 г. Гей-Люссаку и Тенару удалось выделить свободный бор из борного ангидрида, нагревая последний с металлическим калием в медной трубке; они предложили назвать элемент бора (Вога) или бор (Воге). Дэви, повторивший опыты Гей-Люссака и Тенара, тоже получил свободный бор и назвал его бораций (Boracium). В дальнейшем у англичан это название было сокращено до Boron. В русской литературе слово бура встречается в рецептурных сборниках XVII — XVIII вв. В начале XIX в. русские химики называли бор буротвором (Захаров, 1810), буроном (Страхов,1825), основанием буровой кислоты, бурацином (Севергин, 1815), борием (Двагубский, 1824). Переводчик книги Гизе называл бор бурием (1813). Кроме того, встречаются названия бурит, борон, буронит и др.
БОР (от позднелат. borax — бура; лат. Borum) В, хим. элемент
III гр. периодич. системы, ат. н. 5, ат. м. 10,811. Прир. бор состоит из
двух стабильных изотопов — 10В (19,57%) и 11В
(80,43%).
Поперечное сечение захвата тепловых нейтронов 10B 3*10-25
м2, 11В 4*10-32 м2. Конфигурация
внеш. электронной оболочки 2s22р; степень окисления + 3, редко
+ 2; энергия ионизации при последоват. переходе от В° к В5+
соотв.
8,29811, 25,156, 37,92, 259,30 и 340,13 эВ; атомный радиус 0,097 нм, ковалентный
0,088 нм, металлический 0,091 нм, ионный В3+ 0,025 нм (координац.
число 4).
Содержание бора в земной коре 5*10-3% по массе, в воде океанов
— 4,6 мг/л. В природе в своб. виде не встречается. Важнейшие минералы —
бура Na2B4O7*10Н2О, кернит
Na2B4O7*4HaO. На земной пов-сти
бор мигрирует и концентрируется в рассолах озер и морей. Главные осадочные
бо-ратные месторождения находятся в СССР, США, ГДР. Мировые запасы бора ок.
100 млн. т.
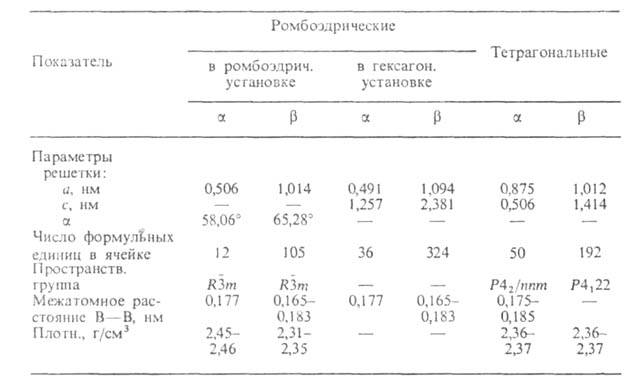
Свойства. Бор — бесцв., серое или красное кристаллическое либо
темное аморфное в-во. Известно более 10 алло-тропных модификаций бора, св-ва
важнейших приведены в таблице. Образование той или иной модификации и их
взаимные переходы определяются т-рой, при к-рой получают бор: при 600-800°С
образуется аморфный продукт (плотн. 2,35 г/см3;
перехода аморфный
модификация 5,02 кДж/моль), до 1000°С-
модификация (красные кристаллы), до 1200°С-
ромбоэдрическая (наиб, устойчивая форма), до 1500 °С — тетрагональные модификации.
Расплав обычно кристаллизуется в
модификацию, в к-рую переходят и все остальные формы выше 1500°С. В интервале
1000-1500°С можно одновременно получить смесь разл. модификаций. Кристаллич.
решетки всех модификаций бора построены из икосаэдров В12 — полиэдрич.
электронодефицитных структур, содержащих наряду с двухэлектронными двухцентровыми
хим. связями В—В многоцентровые двух-электронные связи.
Ниже приводятся св-ва р-ромбоэдрич. бора: т. пл. 2074°С, т. кип. 3658°С;
С° 11,09Дж/(моль-К);
50,2 кДж/моль,
560кДж/моль (О К),
512кДж/моль; S°298 5,90 Дж/(моль*К) [для газа 153,2 ДжДмоль
• К)]; ур-ние температурной зависимости давления пара lg p (атм) = = 7,239-28,840/T(1781-2152
К); температурный коэф. линейного расширения (4,8-7,0)*10-6_К-1
(293-1300 К); теплопроводность при 300 К 2,6-10-3 Вт/(м*К);
дебаевская т-ра 1220 К;
(0,7-4,0)*109 МОм*м (88 К), 105 МОм*м (200 К), 0,05
МОм*м (500 К). Бор — полупроводник р-типа; ширина запрещенной зоны по данным
электрич. и оптич. измерений соотв. 1,42 и 1,53 эВ; дырочная проводимость
55*104, электронная 104 м2/(В*с); постоянная
Холла 7*10-3 м3/Кл (298 К); концентрация собств.
носителей тока 5*1014(433 К) и 9*1019 м-3П073
К). Бор диамагнитен, магн. восприимчивость — 0,78*10-9 (298 К).
Для монокристаллов показатель преломления 3,44 (при длине волны
0,45мкм), коэф. поглощения 10-2 м-1 (при
1,3-3,8 мкм).
По твердости бор занимает второе (после алмаза) место среди всех в-в:
твердость по Моосу 9,3, по Виккерсу 274,4 ГПа, по Кнупу 2460; микротвердость
30,4 ГПа. Модуль Юнга 282,2 ГПа (для борного волокна 411,6 ГПа);
147 МПа (293 К), 882 МПа (1273 К) (для борного волокна 13,7 ГПа при 1330-1890
К); линейный коэф. сжимаемости 1,8*10-7 (303 К), объемный 3*10-7
(293 К). Бор очень хрупок, в пластич. состояние переходит выше 2000 °С.
Химически бор довольно инертен (особенно кристаллический). К-ты, не являющиеся
окислителями, с бором не реагируют, конц. HNO3 и царская водка
окисляют его до борной кислоты Н3ВО3. При
сплавлении со щелочами на воздухе либо при взаимод. с расплавл. Na2O2
или смесью KNO3 и Na2CO3 бор образует бораты.
С Н2 он непосредственно не взаимод., бороводороды получают
косвенным путем. Выше 1200°С бор реагирует с N2 (а также с NH3),
давая бора нитрид BN. В р-циях с F2 (ок. 20 °С), с С12
(ок. 400 °С), с Вг2 (ок. 600 °С), с 12 (ок. 700 °С)
образует тригалогениды ВНа13 (см. Бора трифторид, Бора трихлорид)-бесцв.
дымящие
на воздухе летучие соед., к-рые легко гидролизуются водой, склонны к образованию
комплексных соед. типа Н[ВНа14]. Для трибромида ВВr3
т. пл. -46°С, т. кип. 89,8°С; плотн. 2,65 г/см3. Для трииодида
В13 т. пл. 49,8°С, т. кип. 210°С (с разл.); плотн. 3,3 г/см3.
Известны также низшие галогениды В2На14, В4На14,
В8На18, содержащие в молекуле связи В—В. Выше 500°С
бор реагирует с газообразными HF и НС1 с выделением Н2.
С серой ок. 600°С, а также в атмосфере H2S или CS2
при 930°С бор образует сульфид B2S3 (т. пл. 310°С;
плотн. 1,55 г/см3), с Se выше 700°С — селенид B2Se3,
с Р и As выше 900°С — соотв. фосфиды (ВР, В5Р) и арсениды (BAs,
B6As), отличающиеся высокой хим. и термин стойкостью.
ХАРАКТЕРИСТИКА КРИСТАЛЛИЧЕСКИХ МОДИФИКАЦИЙ БОРА
ВР и BAs (т. пл. выше 2000°С) — высокотемпературные полупроводники.
При взаимод. бора (или В2О3) с С выше 2000°С получают
бора
карбиды В12С3 и В13С2,
с Si выше 1000°С — силициды B6Si (т. разл. 1864°С), B4Si
(т. разл. 1345°С), B3Si и В125i — кристаллич. в-ва,
не разлагаемые водой и р-рами щелочей и к-т; применяются как огнеупоры
и материалы регулирующих и защитных устройств ядерных реакторов. С большинством
металлов при высоких т-рах бор образует бориды.
Получение. Буру и кернит разлагают H2SO4
при 100°С, нерастворимый остаток отфильтровывают. Фильтрат охлаждают до
15 °С, при этом выпадают кристаллы Н3ВО3; к-ту обезвоживают
ок. 235°С с образованием В2О3. Аморфный бор получают
восстановлением В2О3магнием, Na, Са, Zn, К или Fe,
кристаллический — восстановлением галогенидов бора (в осн. ВС13
или BF3) водородом или разложением галогенидов и гидридов бора
(в осн. В2Н6) при 1000-1500°С. Бор получают также
электролизом расплава Na[BF4] или K[BF4] (образуются
при взаимод. соотв. NaOH или КОН либо солей Na или К с Н [BF4]),
чистый кристаллический (менее 0,05% примесей) — разложением ВВr3
на танталовой или вольфрамовой нити ок. 1300°С в присут. Н2
или разложением В2Н6 и В13 при 700-1000°С.
Высокой степени чистоты (10-3-10-4% примесей) достигают
зонной плавкой или вытягиванием монокристаллов из расплава.
Определение. Осн. метод выделения бора из смеси — отгонка в виде
борнометилового эфира В(ОСН3)3 из кислых р-ров. Эфир
гидролизуют до Н3ВО3, к-рую титруют щелочью в присут.
маннита. Гравиметрически бор определяют в виде Са(ВО,)2, образующегося
при взаимод. В(ОСН3)3 с Са(ОН)2, флуориметрически
— по фиолетово-синему окрашиванию с хинали зарином или диаминоантраруфином,
а также при помощи куркумина. Качественно бор обнаруживают по буро-красному
окрашиванию куркумовой бумаги или по зеленому окрашиванию пламени при сгорании
В(ОСН3)3.
Применение. Бор — компонент коррозионностойких и жаропрочных сплавов,
напр. ферробора — сплава Fe с В (10-20%). Небольшая добавка бора (1-3-10
%) значительно повышает мех. св-ва стали, сплавов цветных металлов и обусловливает
мелкозернистость их структуры. Бором насыщают пов-сть стальных изделий (борирование)
с целью улучшения их коррозионных и мех. св-в. Его используют в кач-ве
упрочнителя композиционных материалов (в виде волокон), как полупроводник
для изготовления терморезисторе в, счетчиков тепловых нейтронов, преобразователей
тепловой энергии в электрическую. Бор и его сплавы применяют также как нейтронопоглощающие
материалы для изготовления регулирующих стержней ядерных реакторов. Мировое
произ-во бора (без СССР) в виде соединений 2,4 млн. т (1980). Ок. 50% получаемых
искусственных и прир. соед. бора используют в произ-ве стекла, ок.. 30%-при
получении моющих ср-в, ок. 4-5%-для произ-ва эмалей, глазурей, гербицидов,
металлургич. флюсов.
Бор был открыт в 1808 Ж. Гей-Люссаком и Л. Тенаром и независимо от них-Г.
Дэви.
===
Исп. литература для статьи «БОР»: Бор, его соединения и сплавы, под ред Г. В. Самсонова,
К., 1960; Немодрук А. А., Каралова 3. К., Аналитическая химия бора 5B10,811,
M., 1964; Цагарейшвили Г. В., ТавадзеФ. Н., Полупроводниковый бор. М..
1978. Н.Т.Кузнецов.
Страница «БОР» подготовлена по материалам химической энциклопедии.
Еще по теме:
- Бор — Неорганическая химия, Б.В.Некрасов

-
БОР1, -а, предл. о бо́ре, в бору́, мн. боры́, м. Сосновый лес, растущий на сухом возвышенном месте. Вдали дремучий бор качают ветры с шумом. Пушкин, Осгар. 108 Нас окружает со всех сторон сплошной вековой бор. Куприн, На глухарей.
◊
С бору да с сосенки — случайно, откуда попало, без разбору.
Сыр-бор загорелся (или
горит)
откуда или
из-за чего
см.
сырой. -
БОР2, -а, м. Химический элемент, входящий в состав многих минералов.
[От лат. borax]
-
БОР3, -а, м. Стержень с укрепленной в нем стальной, алмазной или карборундовой головкой.
[От нем. Bohr — бурав]
Источник (печатная версия): Словарь русского языка: В 4-х
т. / РАН,
Ин-т лингвистич.
исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.;
Полиграфресурсы,
1999;
(электронная версия): Фундаментальная
электронная
библиотека
- Бор:
Бор (лес) — хвойный лес.
Бор (элемент) — химический элемент.
Бор (скандинавская мифология) — один из скандинавских богов-прародителей, отец Одина.
Бор (растение) (лат. Milium) — род растений семейства злаки.
Бор (волна) — аномально высокая приливная волна в устьях рек (см. Солитон).
Бор, или Префиксное дерево — структура данных.
Бор (футбольный клуб) — сербский футбольный клуб из города Бор.
Бор (платформа) — железнодорожная платформа на Приморском направлении Октябрьской железной дороги.
Бор (судно) — одномачтовое судно.
Бор — кратер на видимой стороне Луны.
Источник: Википедия
-
БОР1, а, о бо́ре, в бору́, мн. ы́, о́в, м. Большой, густой хвойный лес. Сосновый б. ◊
С бору да с со́сенки или
с бору по со́сенке (поговорка)
— откуда попало, без разбора.Откуда сыр бор загорелся (т. е. сырой бор; поговорка)
— из-за чего затеялось дело, отчего начался переполох. -
БОР2, а, мн. нет, м. [иностр.] (хим.). Одно из простых химических веществ, входящих в состав многих минералов.
-
БОР3, а; м. [от нем. Bohrer — бурав] (мед.). Стальное сверло с мелкими острыми нарезками, употр. в зубоврачебном деле. ◊
Бормашина (спец.)
— аппарат для высверливания частей зуба.
Источник: «Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940);
(электронная версия): Фундаментальная
электронная
библиотека
-
бор I
1. лес с преобладанием одного вида хвойных деревьев (чаще всего сосны) ◆ Сосновый, пронизанный солнцем бор вызывал тихое умиление в душе уставшего фельдшера, до того воевавшего на знойном степном пыльном юге. Василь Быков, «Болото», 2001 г. (цитата из НКРЯ)
-
бор II
1. хим. химический элемент с атомным номером 5, обозначается химическим символом B, неметалл ◆ Зола — калийно-фосфорно-известковое удобрение — включает большое количество микроэлементов (бор, марганец, железо, серу, цинк, кобальт, молибден, медь) Анатолий Савченко, «Как хороши, как свежи эти розы…» // «Homes & Gardens» (цитата из НКРЯ)
2. хим. простое вещество, неметалл, очень твёрдые тёмно-серые кристаллы ◆ Если самая уязвимая деталь замка — дужка изготовлена из сверхпрочного сплава стали и бора, значит, перед вами действительно стоящая вещь. «Мужское хозяйство: Посторонним вход воспрещён» // «Автопилот» (цитата из НКРЯ)
-
бор III
1. приспособление для бурения, сверления
-
бор IV
1. ботан. род растений семейства злаков ()
-
бор V
1. геогр. большая приливная волна, возникающая в устьях некоторых рек и узких заливов и движущаяся с высокой скоростью против течения реки в виде водяного вала с опрокидывающимся гребнем
-
Бор
1. город в России (Нижегородская область)
Источник: Викисловарь
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: скоропись — это что-то нейтральное, положительное или отрицательное?
Ассоциации к слову «бор»
Синонимы к слову «бор»
Предложения со словом «бор»
- Сначала окружающие поля, всё же присыпанные, в отличие от дороги, лёгким не растаявшим снегом, сменились тёмными сосновыми борами, потом и сама дорога из мощёной плавно перешла в грунтовую, и основательно изъезженную.
- – Наш жирный боров заблаговременно, как у нас говорят в народе, сделал ноги, оставив на произвол судьбы как рейхстаг, так и самого фюрера.
- Справа начинается уже тёмный бор, а слева девушка смотрит на просторы на низком берегу, на кустики и уходящие в бесконечную даль протоки небольших речных стариц.
- (все предложения)
Цитаты из русской классики со словом «бор»
- Это — воспоминание о первой прогулке в сосновом бору.
- К счастию — вот и одинокий огонек станции на опушке гудящего бора.
- Баржи стали против большого села, прислонившегося к сосновому бору.
- (все
цитаты из русской классики)
Понятия со словом «бор»
-
Ле́нточные бо́ры — сосновые леса, лишайниковые, зеленомошные и травяные, тянущиеся вдоль рек полосами шириной 5—40 км, располагаясь на песчаных древнеаллювиальных отложениях.
Подробнее: Ленточный бор
-
Подгру́ппа бо́ра — химические элементы 13-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы III группы).
-
Бор — народное название соснового леса, произрастающего на хорошо дренированных песчаных, супесчаных и легкосуглинистых почвах, в отличие от тех сосновых лесов, которые произрастают на болотах. На более плодородных супесчаных и суглинистых почвах боры в своём составе могут иметь две или три лесообразующие породы, например сосна с елью, сосна с дубом, сосна с липой и лещиной. В Толковом словаре В. И. Даля бор — это «сосновый или еловый лес по сухой почве, по возвышенности».
- (все понятия)
Смотрите также
-
Сначала окружающие поля, всё же присыпанные, в отличие от дороги, лёгким не растаявшим снегом, сменились тёмными сосновыми борами, потом и сама дорога из мощёной плавно перешла в грунтовую, и основательно изъезженную.
-
– Наш жирный боров заблаговременно, как у нас говорят в народе, сделал ноги, оставив на произвол судьбы как рейхстаг, так и самого фюрера.
-
Справа начинается уже тёмный бор, а слева девушка смотрит на просторы на низком берегу, на кустики и уходящие в бесконечную даль протоки небольших речных стариц.
- (все предложения)
- лес
- сосняк
- ельник
- березняк
- кедрач
- (ещё синонимы…)
- сосенка
- сосна
- отбор
- борозда
- собор
- (ещё ассоциации…)
- сосновый
- дремучий
- еловый
- вековой
- кедровый
- (ещё…)
- Склонение
существительного «бор» - Разбор по составу слова «бора»
- Как правильно пишется слово «бор»
| Бор | |
|---|---|
| Тёмно-коричневое или чёрное вещество | |
 Элементарный бор | |
| Название, символ, номер | Бор / Borum (B), 5 |
| Атомная масса (молярная масса) | [10,806; 10,821]а. е. м. (г/моль) |
| Электронная конфигурация | [He] 2s2 2p1 |
| Радиус атома | 98 пм |
| Ковалентный радиус | 82 пм |
| Радиус иона | 23 (+3e) пм |
| Электроотрицательность | 2,04 (шкала Полинга) |
| Степени окисления | -3;0;+3 |
| Энергия ионизации (первый электрон) | 800,2(8,29) кДж/моль (эВ) |
| Плотность (при н. у.) | 2,34 г/см³ |
| Температура плавления | 2 348 K (2075 °C) |
| Температура кипения | 4 138 K (3865 °C) |
| Уд. теплота плавления | 23,60 кДж/моль |
| Уд. теплота испарения | 504,5 кДж/моль |
| Молярная теплоёмкость | 11,09 Дж/(K·моль) |
| Молярный объём | 4,6 см³/моль |
| Структура решётки | ромбоэдрическая |
| Параметры решётки | a=10,17; α=65,18 Å |
| Отношение c/a | 0,576 |
| Температура Дебая | 1250 K |
| Теплопроводность | (300 K) 27,4 Вт/(м·К) |
| Номер CAS | 7440-42-8 |
Бор (B, лат. borum) — химический элемент 13-й группы, второго периода периодической системы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе III группы, или к группе IIIA) с атомным номером 5. Бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество. Известно более 10 аллотропных модификаций бора, образование и взаимные переходы которых определяются температурой, при которой бор был получен.

История и происхождение названия
Впервые получен в 1808 году французскими химиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Хэмфри Дэви электролизом расплавленного B2O3.
Название элемента произошло от арабского слова бурак (араб. بورق) или персидского бурах (перс. بوره), которые использовались для обозначения буры.
Нахождение в природе
Среднее содержание бора в земной коре составляет 4 г/т. Несмотря на это, известно около 100 собственных минералов бора; в «чужих» минералах он почти не встречается. Это объясняется, прежде всего, тем, что у комплексных анионов бора (а именно в таком виде он входит в большинство минералов) нет достаточно распространённых аналогов. Почти во всех минералах бор связан с кислородом, а группа фторсодержащих соединений совсем малочисленна. Элементарный бор в природе не встречается. Он входит во многие соединения и широко распространён, особенно в небольших концентрациях; в виде боросиликатов и боратов, а также в виде изоморфной примеси в минералах входит в состав многих изверженных и осадочных пород. Бор известен в нефтяных и морских водах (в морской воде 4,6 мг/л), в водах соляных озёр, горячих источников и грязевых вулканов.
Основные минеральные формы бора:
- Боросиликаты: датолит CaBSiO4OH, данбурит CaB2Si2O8
- Бораты: бура Na2B4O7·10H2O, ашарит MgBO2(OH), гидроборацит (Ca, Mg)B6O11·6H2O, иниоит Ca2B6O11·13H2O, калиборит KMg2B11O19·9H2O.
Также различают несколько типов месторождений бора:

Образец датолита. Дальнегорское боросиликатное месторождение
- Месторождения боратов в магнезиальных скарнах:
- людвигитовые и людвигито-магнетитовые руды;
- котоитовые руды в доломитовых мраморах и кальцифирах;
- ашаритовые и ашарито-магнетитовые руды.
- Месторождения боросиликатов в известковых скарнах (датолитовые и данбуритовые руды);
- Месторождения боросиликатов в грейзенах, вторичных кварцитах и гидротермальных жилах (турмалиновые концентрации);
- Вулканогенно-осадочные:
- борные руды, отложенные из продуктов вулканической деятельности;
- переотложенные боратовые руды в озёрных осадках;
- погребённые осадочные боратовые руды.
- Галогенно-осадочные месторождения:
- месторождения боратов в галогенных осадках;
- месторождения боратов в гипсовой шляпе над соляными куполами.
Крупнейшее месторождение России находится в Дальнегорске (Приморье). Оно относится к боросиликатному типу. В этом одном компактном месторождении сосредоточено не менее 3 % всех мировых запасов бора. На действующем при месторождении горно-химическом предприятии выпускается боросодержащая продукция, которая удовлетворяет потребности отечественной промышленности. При этом 75 % продукции идёт на экспорт в Корею, Японию и Китай.
Получение
- Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических синтезов.
-
- B2H6 → t 2B + 3H2
- Метод металлотермии (чаще восстановление магнием или натрием):
-
- B2O3 + 3Mg ⟶ 3MgO + 2B
-
- KBF4 + 3Na ⟶ 3NaF + KF + B
- Термическое разложение паров бромида бора на раскалённой (1000—1200 °C) вольфрамовой проволоке в присутствии водорода (метод Ван-Аркеля):
-
- 2BBr3 + 3H2 →W 2B + 6HBr
Физические свойства

Сечения захвата нейтронов изотопами 10B (верхняя кривая) и 11B (нижняя кривая).
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
У бора — самый высокий предел прочности на разрыв 5,7 ГПа.
Изотопы бора
Основная статья: Изотопы бора
В природе бор находится в виде двух изотопов 10B (19,8 %) и 11B (80,2 %).
10B имеет очень высокое сечение захвата тепловых нейтронов, равное 3837 барн (для большинства нуклидов это сечение близко к единицам или долям барна), причём при захвате нейтрона образуются два нерадиоактивных ядра (альфа-частица и литий-7), очень быстро тормозящиеся в среде, а проникающая радиация (гамма-кванты) при этом отсутствует, в отличие от аналогичных реакций захвата нейтронов другими нуклидами:
- 10B + n → 11B* → α + 7Li + 2,31 МэВ.
Поэтому 10B в составе борной кислоты и других химических соединений применяется в атомных реакторах для регулирования реактивности, а также для биологической защиты от тепловых нейтронов. Кроме того, бор применяется в нейтрон-захватной терапии рака.
Кроме двух стабильных, известно ещё 12 радиоактивных изотопов бора, из них самым долгоживущим является 8B с периодом полураспада 0,77 с.
Происхождение
Все изотопы бора возникли в межзвёздном газе в результате расщепления тяжелых ядер космическими лучами, или при взрывах сверхновых.
Химические свойства

Ионы бора окрашивают пламя в зелёный цвет
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
-
- 2B + 3F2 ⟶ 2BF3↑
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
-
- 4B + 3O2 ⟶ 2B2O3
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
-
- Mg3B2 + 6HCl ⟶ B2H6↑ + 3MgCl2
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
-
- 3SiO2 + 4B ⟶ 3Si + 2B2O3
-
- 3P2O5 + 10B ⟶ 5B2O3 + 6P
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. Растворяется в расплаве смеси гидроксида и нитрата калия:
-
- 2B + 2KOH + 3KNO3 →ot 2KBO2 + 3KNO2 + H2O
В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты H3BO3.
Оксид бора B2O3 — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
-
- B2O3 + 3H2O ⟶ 2H3BO3
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO33−), а тетрабораты, например:
-
- 4H3BO3 + 2NaOH ⟶ Na2B4O7 + 7H2O
В 2014 г. исследователями из Германии был получен бис(диазаборолил) бериллия, в котором атомы бериллия и бора образуют двухцентровую двухэлектронную связь (2c-2e), впервые полученную и нехарактерную для соседних элементов в Периодической таблице.
Применение
Элементарный бор
Бор (в виде волокон) служит упрочняющим веществом многих композиционных материалов.
Также бор часто используют в электронике в качестве акцепторной добавки для изменения типа проводимости кремния.
Бор применяется в металлургии в качестве микролегирующего элемента, значительно повышающего прокаливаемость сталей.
Бор применяется и в медицине при бор-нейтронозахватной терапии (способ избирательного поражения клеток злокачественных опухолей).
Соединения бора
Карбид бора применяется в компактном виде для изготовления газодинамических подшипников.
Пербораты / пероксобораты (содержат ион [B2(O2)2(OH)4]2−) [B4O12H8]−) применяются как окислительные агенты. Технический продукт содержит до 10,4 % «активного кислорода», на их основе производят отбеливатели, не содержащие хлор («персиль», «персоль» и др.).
Отдельно также стоит указать на то, что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кроме алмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Сплав бора с магнием (диборид магния MgB2) обладает, на данный момент, рекордно высокой критической температурой перехода в сверхпроводящее состояние среди сверхпроводников первого рода. Появление вышеуказанной статьи стимулировало большой рост работ по этой тематике.
Борная кислота (B(OH)3) широко применяется в атомной энергетике в качестве поглотителя нейтронов в ядерных реакторах типа ВВЭР (PWR) на «тепловых» («медленных») нейтронах. Благодаря своим нейтронно-физическим характеристикам и возможности растворяться в воде применение борной кислоты делает возможным плавное (не ступенчатое) регулирование мощности ядерного реактора путём изменения её концентрации в теплоносителе — так называемое «борное регулирование».
Борная кислота применяется также в медицине и ветеринарии.
Нитрид бора, активированный углеродом, является люминофором со свечением от синего до жёлтого цвета под действием ультрафиолета. Обладает самостоятельной фосфоресценцией в темноте и активируется органическими веществами при нагреве до 1000 °C. Изготовление люминофоров из нитрида бора, состава BN/C не имеет промышленного назначения, но широко практиковалось химиками-любителями в первой половине XX века.
Боросиликатное стекло — стекло обычного состава, в котором заменяют щелочные компоненты в исходном сырье на окись бора (B2O3).
Фторид бора BF3 при нормальных условиях является газообразным веществом, используется как катализатор в оргсинтезе, а также как рабочее тело в газонаполненных детекторах тепловых нейтронов благодаря захвату нейтронов бором-10 с образованием ядер лития-7 и гелия-4, ионизирующих газ (см. реакцию выше).
Бороводороды и борорганические соединения
Ряд производных бора (бороводороды) являются эффективными ракетными топливами (диборан B2H6, пентаборан, тетраборан и др.), а некоторые полимерные соединения бора с водородом и углеродом стойки к химическим воздействиям и высоким температурам (как широко известный пластик Карборан-22).
Боразон и его гексагидрид
Нитрид бора (боразон) подобен (по составу электронов) углероду. На его основе образуется обширная группа соединений, в чём-то подобных органическим.
Так, гексагидрид боразона (H3BNH3, похож на этан по строению) при обычных условиях твёрдое соединение с плотностью 0,78 г/см3, содержит почти 20 % водорода по массе. Его могут использовать водородные топливные элементы, питающие электромобили.
Биологическая роль
Основная статья: Биологическая роль бора
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)⋅10−4 % бора, в костной ткани (1,1—3,3)⋅10−4 %, в крови — 0,13 мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза — 4 г. ЛД₅₀ ≈ 6 г/кг массы тела.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.