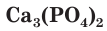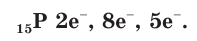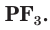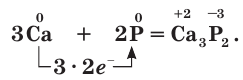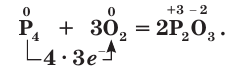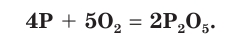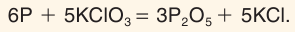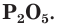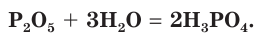Фосфор (греч. phos — свет + phoros — несущий) — химический элемент, принадлежащий к Vа группе и 3 периоду. Простое желтоватое вещество,
легко воспламеняющееся и светящееся.
Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.
Природные соединения
В природе фосфор встречается в виде следующих соединений:
- 3Ca3(PO4)2*CaCO3*Ca(OH,F)2 — фосфорит
- Ca10(PO4)6(F,Cl,OH)2 — апатит
Получение
В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Ca3(PO4)2 + SiO2 + C → (t) CaSiO3 + P + CO
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый
фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до
P2.
- Реакции с неметаллами
- Реакции с металлами
- Реакция с водой
- Реакция с щелочами
- Восстановительные свойства
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
4P + 3O2 → 2P2O3 (недостаток кислорода)
4P+ 5O2 → 2P2O5 (избыток кислорода)
Схожим образом происходит взаимодействие фосфора и хлора.
2P + 3Cl2 → 2PCl3 (недостаток хлора)
2P + 5Cl2 → 2PCl5 (избыток хлора)
P + S → P2S3
Реакции с водородом крайне затруднена. Тем не менее, в ходе разложения фосфидов металлов можно получить ядовитый газ — фосфин — боевое
отравляющее вещество.
Ca3P2 + H2O → Ca(OH)2 + PH3↑
2P + 3Ca → Ca3P2 (фосфид кальция)
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество
является и окислителем, и восстановителем).
P + H2O → (t) PH3 + H3PO4
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования.
P + LiOH + H2O → LiH2PO2 + PH3↑ (LiH2PO2 — гипофосфит лития)
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя.
KClO3 + P → KCl + P2O5
Оксид фосфора V — P2O5
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Получение
P + O2 → P2O5
Химические свойства
- Кислотные свойства
- Дегидратационные свойства
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту.
P2O5 + 3H2O = 2H3PO4
P2O5 + H2O = HPO3 (при недостатке воды)
Реагирует с основными оксидами и основаниями, образуя соли фосфорной кислоты. Какая именно получится соль — определяет соотношение основного
оксида/основания и кислотного оксида.
P2O5 + Na2O → Na3PO4
6KOH + P2O5 = 2K3PO4 + 3H2O (фосфат калия, избыток щелочи — соотношение 6:1)
4KOH + P2O5 = 2K2HPO4 + H2O (гидрофосфат калия, незначительный избыток кислотного оксида — соотношение 4:1)
2KOH + P2O5 = 2KH2PO4 + H2O (дигидрофосфат калия, избыток кислотного оксида — соотношение 2:1)
Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
HClO4 + P2O5 → HPO3 + Cl2O7 (HPO3 — метафосфорная кислота)
HNO3 + P2O5 → HPO3 + N2O5
Фосфорные кислоты
Существует несколько кислородсодержащих фосфорных кислот:
- Ортофосфорная кислота — H3PO4 (трехосновная кислота, соли — фосфаты PO43-)
- Метафосфорная кислота — HPO3 (одноосновная кислота, соли — метафосфаты PO3—)
- Фосфористая — H3PO3 (двухосновная кислота, соли — фосфиты HPO32-)
- Фосфорноватистая — H3PO2 (одноосновная кислота, соли гипофосфиты — H2PO2— )
Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
CuSO4 + H3PO2 + H2O → Cu + H2SO4 + H3PO4
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Получение
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора,
взаимодействия оксида фосфора V с водой.
Ca3(PO4)2 + H2SO4 → CaSO4 + H3PO4
P2O5 + H2O → H3PO4
PCl5 + H2O → H3PO4 + HCl
Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
P + HNO3 + H2O → H3PO4 + NO
Химические свойства
- Кислотные свойства
- Реакции с солями
- Реакции с металлами
- Дегидратация
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные
соли (фосфаты, гидрофосфаты и дигидрофосфаты).
3K2O + H3PO4 = 2K3PO4 + 3H2O
3KOH + H3PO4 = K3PO4 + 3H2O
2KOH + H3PO4 = K2HPO4 + H2O
KOH + H3PO4 = KH2PO4 + H2O
Реакции идут, если выделяется газ, выпадает осадок или образуется слабый электролит (вода). Например, характерный осадок
желтого цвета — фосфат серебра — образуется в результате реакции с нитратом серебра.
AgNO3 + H3PO4 → Ag3PO4 + HNO3
В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
K2CO3 + H3PO4 → K3PO4 + H2O + CO2
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
Mg + H3PO4 → Mg3(PO4)2 + H2↑
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
H3PO4 → (t) HPO3 + H2O
Соли фосфорной кислоты
Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
Фосфаты являются хорошими удобрениями, которые повышают урожайность. Перечислим наиболее значимые:
- Фосфоритная мука — Ca3(PO4)2
- Простой суперфосфат — смесь Ca(H2PO4)2*H2O и CaSO4
- Двойной суперфосфат — Ca(H2PO4)2*H2O
- Преципитат — CaHPO4*2H2O
- Костная мука — продукт переработки костей домашних животных Ca3(PO4)2
- Аммофос — в основном состоит из моноаммонийфосфата — NH4H2PO4
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Элемент: фосфор (Phosphorus)
Химический символ: P
Порядковый номер: 15
Год открытия: 1669 (признан элементом А.Лавуазье в 1777)
Стандартная атомная масса: 30.973761998(5
Температура плавления: 317.3 К (белый), 860 К (красный)
Температура кипения: 553 К (белый)
Плотность при стандартных условиях: 1.83 г/cм3(белый), 2.2-2.34 г/cм3(красный), 2.36 г/cм3(фиолетовый), 2.69 г/cм3(черный)
Число стабильных изотопов: 1
Кристаллическая решётка: зависит от аллотропной модификации
Начнем с истории
В истории химических элементов фосфор занимает совершенно уникальное место. Как-никак, а это первый химический элемент, который имеет точную дату открытия. Удивительно, но эту дату мы знаем точнее, чем даты рождения и смерти его первооткрывателя, немецкого алхимика Хеннига Бранда, который родился где-то около 1630 года, а умер то ли около 1692, то ли около 1710… Зато мы точно знаем, что в 1669 году этот человек, сначала бывший солдатом во время Тридцатилетней войны, но благоразумно решивший, что быть врачом и алхимиком безопаснее, решился на попытку добыть философский камень из мочи. Ибо другие варианты, видимо, уже были исчерпаны до него. Ну и гомеопатический принцип подобия (впрочем, гомеопатии-то как раз тогда не было еще): в золото может превращать нечто золотистого цвета. А что плохо пахнет – ну так можно несколько дней отстоять, чтобы запах ушел. Потом эту мочу можно кипятить до состояния пасты. Тоже желтого цвета. Вот как раз нагревая эту пасту (фактически, кипятя ее несколько часов), у Бранда внезапно получилось некоторое белое вещество, похожее на воск, которое ярко светилось в темноте.
Картина Джозефа Райта «Алхимик, открывающий фосфор» (1771 год), предположительно описывающая открытие фосфора Хеннигом Брандом.
Так был открыт phosphorus mirabilis, «чудесный носитель света». Или белый фосфор. 14 октября 1680 года датируется получение фосфора тем же способом Робертом Бойлем. В российских источниках пишется, что это открытие было независимым, однако мы знаем, что сначала Бранд попытался сохранить свой рецепт в тайне, но затем продал его некоему Д. Краффту из Дрездена, который встречался с Робертом Бойлем… В общем, пошло-поехало, и секрет белого фосфора растекся по Европе. Кстати, именно Бойль использовал впервые белый фосфор, 13-й химический элемент, известный человечеству, для того, чтобы зажечь деревянные палочки с серными наконечниками – предтечи современных спичек.
Роберт Бойль
Нужно сказать, что именно фосфор часто становится первым элементом, на котором знакомятся с аллотропией – существованием разных форм простого вещества одного и того же химического элемента. Но сначала – немного об исторически первой аллотропной модификации.
Свечение белого фосфора
Белофосфорные штудии: собака Баскервилей, спичечная забастовка и запрещенное оружие
И давайте сразу же сделаем лирическое отступление, точнее – отступление литературное.
Я хочу раз и навсегда, закрыть тему белого фосфора и литературного произведения, из которого о нем все узнают, а потом на уроках химии тыкают пальцем и гыгычут: смотрите, какой тупой был Конан Дойл, а на химических олимпиадах просят найти, где же великий автор ошибся.
Итак, внимание, три цитаты:
«Это была собака исполинских размеров, черная, как уголь, и такого ужасного вида, который, наверное, никогда не представлялся глазам человеческим. Из пасти вырывалось пламя, глаза сверкали огнем, как раскаленные угли, морда, загривок и грудь сверкали точно объятые пламенем».
«Это была не чистокровная ищейка и не чистокровный мастиф, а, видимо, помесь – поджарый, страшный пес величиной с молодую львицу. Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте.
– Фосфор, – сказал я.
– Да, и какой-то особый препарат, – подтвердил Холмс, потянув носом.
Без запаха, чтобы у собаки не исчезло чутье».
«А вот эта паста в жестянке – тот самый светящийся состав, которым он смазывал своего пса. Его натолкнуло на эту мысль не что иное, как легенда о чудовищной собаке Баскервилей, и он решил разделаться таким способом с сэром Чарльзом».
В журнале «Иностранная литература» публикуется«лингвистическое» исследование некоего Давида Иоффе, где он возмущенно пишет:
«Но «фосфор» в русском переводе – это ошибка переводчика. По-английски фосфор (химический элемент) – phosphorus, что можно проверить в любом словаре, xоть англо-русском, xоть русско-английском. В оригинале же «Собаки Баскервилей» фигурирует не phosphorus, а phosphor».
И далее с превосходством знатока говорится, что phosphor по-английски означает любой люминофор, форсфоресцирующее вещество, а Конан-Дойл, безусловно, знал об опасности белого фосфора.
И все тут вроде бы ясно, если бы не одно но: в оригинале (я не нашел изначальный Strand Magasine, но нашел с десяток других изданий), везде из уст Ватсона звучит: «“Phosphorus,” I said».
Так что же, Конан-Дойл не знал об опасности белого фосфора?
Нет, конечно. Лондонский врач в 1901 году не мог не помнить события 1888 года, когда на Лондонской спичечной фабрике вспыхнула забастовка.
На этой немного ужасающей иллюстрации Томаса Мюттера середины XIX века под убранными художниками щеками девушки мы видим заболевание, которое сейчас не встретишь: «фосфорная челюсть». Или, если быть точным – фосфорный некроз челюсти. В XIX веке это было профессиональное заболевание сотрудников спичечных фабрик, поскольку эти люди работали с белым фосфором, токсичной аллотропной модификацией этого простого вещества. Спички с белым фосфором просуществовали недолго: только в 1830 году их придумал француз Шарль Сориа, а в 1836 году усовершенствовал венгр Янош Ирини, сделав их более безопасными. Уже в 1855 году швед Йохан Лундстрем придумал «шведские» спички с красным фосфором, но вплоть до 1910-х годов спички с белым фосфором пользовались популярностью (в первую очередь – у производителей, поскольку они были дешевле), а рабочие спичечных фабрик получали вот такой вот некроз челюсти.
2 июля 1888 года после увольнения одной из работниц Лондонской спичечной фабрики началась забастовка работниц, сопровождавшаяся демонстрацией. Это событие вошло в мировую историю и культуру настолько, что в 1960-х годах был даже поставлен мьюзикл «Девочки-спичечницы» (The Matchgirls) по следам тех событий.
Шум поднялся знатный, и администрации фабрики в итоге пришлось-таки пойти на уступки, сотрудницам даже выделили специальные чистые комнаты для приема пищи – ведь именно прямое попадание белого фосфора в рот во время еды и приводило к некрозу челюсти. А Анни Безант продолжила борьбу против спичек с белым фосфором. И, в итоге, в 1901 году (году начала выхода «Собаки Баскервилей» в журнале) фабрика, производящая белофосфорные спички была закрыта, в 1908 году Палата общин Великобритании приняла акт, запрещающий использование белого фосфора в спичках после 31 декабря 1910 года.
Однако никто из пытавшихся разобраться в ситуации, не увидел следующего предложения, не очень точно переводившегося на русский. Вот точные слова Холмса: «A cunning preparation of it». То есть, Ватсон, в простоте своей говорит: «Это типа фосфор?», на что химик-Холмс поправляет: «Нет, какое-то хитрое соединение его». Он сразу намекает, что тут – некое производное фосфора, точно не пахнущее, а вероятно, и не токсичное, но сохранившее способность к свечению.
Ну и раз мы заговорили о белом фосфоре, то для того, чтобы закрыть эту тему, скажем, что именно белый фосфор лежит в основе одного из самых опасных типов зажигательных боеприпасов, которые сейчас запрещены к применению, если от них могут пострадать гражданские (а это происходит почти всегда, ибо белый фосфор горит с температурой 1300 градусов, ядовит и прочая, и прочая, и прочая). Правда, США и Израиль их не подписали – и фосфорные боеприпасы, к сожалению, применялись и в Афганистане, и в Газе, и даже на Донбассе, хотя США и Израиль тут ни при чем.
Применение фосфорной бомбы авиацией США во Вьетнаме
Все цвета фосфора
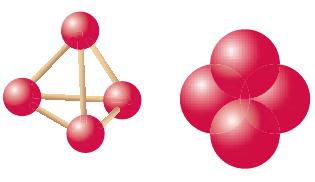
Но вернемся к нашим аллотропам. Помимо белого (он же жёлтый – если неочищенный), который представляет молекулы P4,нам известны:
Белый фосфор
Молекула белого фосфора
Красный фосфор, образующийся из белого нагреванием до 300 градусов. Самая часто используемая форма фосфора.
Красный фосфор
Структура красного фосфора
Фиолетовый фосфор, он же моноклинный фосфор, он же металлический фосфор Хитторфа. Получен в 1865 году немецким химиком Йоханном Вильгельмом Хитторфом нагреванием в запаянной трубке красного фосфора до 530 градусов.
Вильгельм Хитторф
В ампуле слева – красный, справа – фиолетовый фосфор
Структура фиолетового фосфора
Черный фосфор получается нагреванием белого под давлением в 12 000 атмосфер.
Черный фосфор
Структура черного фосфора
Фосфорен– двумерный аллотроп фосфора, аналог графена. Как и графен, его можно получить, оторвав скотчем один молекулярный слой от черного фосфора.
Способ получения фосфорена
Синий фосфор– еще один «двумерный» фосфор, который сумели получить только в 2016 году методом молекулярно-пучковой эпитаксии.
Наностержни P12– и такое бывает!
Дифосфор– молекулы P2, содержащие тройную связь. Аналог молекулярного азота до недавнего времени можно было получить только в экстремальных условиях, однако в 2006 году химики сумели вытащить двухатомную молекулу фосфора при нормальных условиях из комплексов вольфрама и ниобия.
Фосфор – жизнь…
Насколько распространены и важны для нас минералы фосфора говорит сам за себя один факт: далеко не один город назван в их честь. Но, конечно, Апатиты – это самый известный. Без фосфорных удобрений невозможно сельское хозяйство. Без пищевой добавки Е338, она же – ортофосфорная кислота, не получится Кока-Кола… Да что говорить, АТФ, он же аденозинтрифосфат – универсальный источник энергии в нашем организме.
АТФ
За открытие механизма его синтеза в нашем организме Пол Бойер и Джон Уокер (не путать с виски!) получили в 1997 году Нобелевскую премию по химии… Огромное количество статей, книг и научных конференций посвящено химии этой молекулы (а также ее варианту АДФ – аденозиндифосфату и АМФ – аденозинмонофосфату). Не будем уже говорить и о том, что в носителе генетической информации, дезоксирибонуклеиновой кислоте, нуклеотиды – «буквы» генетического кода, химической связью соединены через остатки фосфорной кислоты (а две цепочки ДНК друг с другом удерживает уже водородная связь)…
Структура ДНК
Так что фосфор не зря включают, наряду с углеродом, водородом, азотом и кислородом в число пяти важнейших элементов для жизни. Однако…
Фосфор – смерть…
Говоря о соединениях фосфора, нельзя не сказать и о военном применении содержащих фосфор веществ. Собственно говоря, про сам белый фосфор мы уже сказали. Но после Солсбери, шпилей и «новичка» никак нельзя не упомянуть и вершину химического оружия – то, что часто называют «нервно-паралитическими газами», хотя в нормальном состоянии почти все эти вещества – жидкости.
Первое фосфорорганическое вещество (ФОВ), которое действует на нервную систему, было создано в 1936 году в гитлеровской Германии. Как водится – случайно. Группа Герхарда Шредера (кстати, в итоге дожившего до 1990 года), работала над созданием инсектицидов (напомним, что печально знаменитый «Циклон Б» создавался Фрицем Габером тоже не для газовых камер, а для сельского хозяйства). Шрадер при взаимодействии хлорокиси фосфора с диметиламином, этанолом и цианистым калием синтезировал этиловый эфир диметиламида цианофосфорной кислоты, «вещество 9/91». Эффективность нового инсектицида была убойной, он получил товарное название «табун».
Табун
В январе 1937 года при работе с табуном произошёл несчастный случай: банка с жидкостью оказалась неплотно закрытой, и капля табуна упала на лабораторный стол. В лаборатории находились сам Шрадер и его лаборант. В течение нескольких минут после разлива у обоих развилось головокружение и спёртость дыхания, сопровождавшиеся резким сужением зрачка (классическая триада отравлением ФОВ). На выздоровление у ученых ушло три недели, но ещё раньше они поспешили исполнить закон об обороне от мая 1935 года и сообщить куда надо о том, что инсектицид способен эффективно убивать не только насекомых – с описанием клинической картины. Вместо выговора за несоблюдение техники безопасности Шрадер получил новую лабораторию и 50 тысяч марок за открытие нового способа умерщвления себе подобных. Он с энтузиазмом взялся за работу – и уже очень скоро было готово новое вещество, которое было в 10 раз токсичнее табуна. Его назвали акронимом по буквам фамилий исследователей: Schrader, Ambros, Gerhard Ritter, von der Linde. Получился зарин.
Зарин
А там и нобелевские лауреаты подтянулись. В 1939 году Рихарду Куну присудили премию 1938 года за работы с витаминами. В тот год химик уже мог даже не надеяться подержать в руках заветный приз. После присуждения Нобелевской премии мира 1935 года немецкому журналисту Карлу фон Осецкому «за борьбу с милитаризмом в Германии», Адольф Гитлер запретил своим подданным принимать эту награду. Впрочем, в 1949 году в Стокгольме Куна чествовали как ни в чем не бывало.
Рихард Кун
Надо сказать, что наш герой удивительно легко отделался во время существования Третьего рейха. Был обласкан чинами, общался с верхушкой рейха. Сказали избавиться от коллабораторов-евреев — перестал с ними работать. Дали команду разработать отравляющие вещества — а что тут такого? Так что, если бы Германия решилась применить созданный Куном в 1944 году зоман (фосфорорганическое боевое отравляющее вещество, «прадедушка “Новичка”»), кто знает, не оказался бы Кун вместо Стокгольма в 1949 году в Нюрнберге в 1945-м…
Да-да, вы не ослышались – тот самый «новичок» (если он действительно был удачен и существовал) – является самым совершенным потомком фосфорорганических отравляющих веществ, которые повсеместно запрещены как химическое оружие, но по-прежнему применяются как инсектициды. Дихлофос знаете? То-то же!
Текст: Алексей Паевский
Фосфор — элемент 3-го периода и VA-группы Периодической системы, порядковый номер 15. Электронная формула атома [10Ne]3s23p3, устойчивая степень окисления в соединениях +V.
Электроотрицательность фосфора (2,32) значительно ниже, чем у типичных неметаллов, и немного выше, чем у водорода. Образует различные кислородсодержащие кислоты, соли и бинарные соединения, проявляет неметаллические (кислотные) свойства. Большинство фосфатов нерастворимы в воде.
В природе — тринадцатый по химической распространенности элемент (шестой среди неметаллов), встречается только в химически связанном виде. Жизненно важный элемент.
Недостаток фосфора в почве восполняется введением фосфорных удобрений — главным образом суперфосфатов.
Аллотропные модификации фосфора


Красный фосфор состоит из полимерных молекул Pn разной длины. Аморфный, при комнатной температуре медленно переходит в белый фосфор. При нагревании до 416 °С возгоняется (при охлаждении пара конденсируется белый фосфор). Нерастворим в органических растворителях. Химическая активность ниже, чем у белого фосфора. На воздухе загорается только при нагревании.
Применяется как реагент (более безопасный, чем белый фосфор) в неорганическом синтезе, наполнитель ламп накаливания, компонент намазки коробка при изготовлении спичек. Не ядовит.
Белый фосфор состоит из молекул Р4. Мягкий как воск (режется ножом). Плавится и кипит без разложения (tпл 44,14 °С, tкип 287,3 °С, р 1,82 г/см3). Окисляется на воздухе (зеленое свечение в темноте), при большой массе возможно самовоспламенение. В особых условиях переводится в красный фосфор. Хорошо растворим в бензоле, эфирах, сероуглероде. Не реагирует с водой, хранится под слоем воды. Чрезвычайно химически активен. Проявляет окислительно-восстановительные свойства. Восстанавливает благородные металлы из растворов их солей.
Применяется в производстве Н3Р04 и красного фосфора, как реагент в органических синтезах, раскислитель сплавов, зажигательное средство. Горящий фосфор следует гасить песком (но не водой!). Чрезвычайно ядовит.
Уравнения важнейших реакций фосфора:
Получение в промышленности фосфора
— восстановление фосфорита раскаленным коксом (песок добавляют для связывания кальция):
Ca3(PО4)2 + 5С + 3SiО2 = 3CaSiO3 + 2Р + 5СО (1000 °С)
Пар фосфора охлаждают и получают твердый белый фосфор.
Красный фосфор готовят из белого фосфора (см. выше), в зависимости от условий степень полимеризации n (Pn) может быть различной.
Соединения фосфора
Фосфин РН3. Бинарное соединение, степень окисления фосфора равна — III. Бесцветный газ с неприятным запахом. Молекула имеет строение незавершенного тетраэдра [: Р(Н)3] (sр3-гибридизация). Мало растворим в воде, не реагирует с ней (в отличие от NH3). Сильный восстановитель, сгорает на воздухе, окисляется в HNО3 (конц.). Присоединяет HI. Применяется для синтеза фосфорорганических соединений. Сильно ядовит.
Уравнения важнейших реакций фосфина:
Получение фосфина в лаборатории:
СазP2 + 6НСl (разб.) = ЗСаСl + 2РНз
Оксид фосфора (V) P2O5. Кислотный оксид. Белый, термически устойчивый. В твердом и газообразном состояниях димер Р4О10 со строением из четырех тетраэдров [O=Р(O)3], связанных по трем вершинам (Р — О-P). При очень высоких температурах мономеризуется до P2O5. Существует также стеклообразный полимер (Р205)п. Чрезвычайно гигроскопичен, энергично реагирует с водой, щелочами. Восстанавливается белым фосфором. Отнимает воду у кислородсодержащих кислот.
Применяется как весьма эффективный дегидратирующий агент для осушения твердых веществ, жидкостей и газовых смесей, реагент в производстве фосфатных стекол, катализатор полимеризации алкенов. Ядовит.
Уравнения важнейших реакций оксида фосфора +5:
Получение: сжигание фосфора в избытке сухого воздуха.
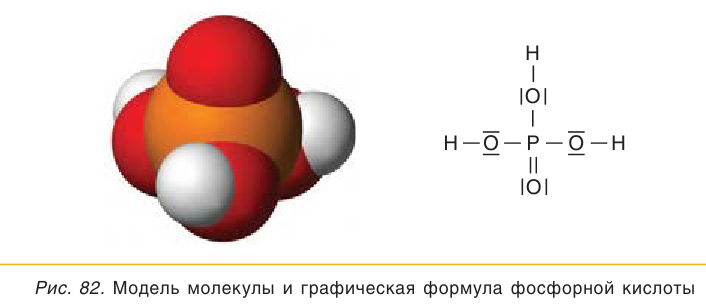
Ортофосфорная кислота Н3Р04. Оксокислота. Белое вещество, гигроскопичное, конечный продукт взаимодействия P2O5 с водой. Молекула имеет строение искаженного тетраэдра [Р(O)(OН)3] (sр3-гибридизадия), содержит ковалентные σ-связи Р — ОН и σ, π-связь Р=O. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворяется в воде (548 г/100 г Н20). Слабая кислота в растворе, нейтрализуется щелочами, не полностью — гидратом аммиака. Реагирует с типичными металлами. Вступает в реакции ионного обмена.
Качественная реакция — выпадение желтого осадка ортофосфата серебра (I). Применяется в производстве минеральных удобрений, для осветления сахарозы, как катализатор в органическом синтезе, компонент антикоррозионных покрытий на чугуне и стали.
Уравнения важнейших реакций ортофосфорной кислоты:
Получение фосфорной кислоты в промышленности:
кипячение фосфоритной руды в серной кислоте:
Ca3(PO4)2 + 3H2SO4 (конц.) = 2Н3РО4 + 3CaSO4
Ортофосфат натрия Na3PO4. Оксосоль. Белый, гигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Реагируется в растворе с цинком и алюминием.
Вступает в реакции ионного обмена.
Качественная реакция на ион РО43-
— образование желтого осадка ортофосфата серебра(I).
Применяется для устранения «постоянной» жесткости пресной воды, как компонент моющих средств и фотопроявителей, реагент в синтезе каучука. Уравнения важнейших реакций:
Получение: полная нейтрализация Н3Р04 гидроксидом натрия или по реакции:
Гидроортофосфат натрия Na2HPO4. Кислая оксосоль. Белый, при умеренном нагревании разлагается без плавления. Хорошо растворим в воде, гидролизуется по аниону. Реагирует с Н3Р04 (конц.), нейтрализуется щелочами. Вступает в реакции ионного обмена.
Качественная реакция на ион НРО42-— образование желтого осадка ортофосфата серебра (I).
Применяется как эмульгатор при сгущении коровьего молока, компонент пищевых пастеризаторов и фотоотбеливателей.
Уравнения важнейших реакций:
Получение: неполная нейтрализация Н3Р04 гидроксидом натрия в разбавленном растворе:
2NaOH + Н3РО4 = Na2HPO4 + 2H2O
Дигидроортофосфат натрия NaH2PO4. Кислая оксосоль. Белый, гигроскопичный. При умеренном нагревании разлагается без плавления. Хорошо растворим в воде, анион Н2Р04 подвергается обратимой диссоциации. Нейтрализуется щелочами. Вступает в реакции ионного обмена.
Качественная реакция на ион Н2Р04 — образование желтого осадка ортофосфата серебра(1).
Применяется в производстве стекла, для защиты стали и чугуна от коррозии, как умягчитель воды.
Уравнения важнейших реакций:
Получение: неполная нейтрализация H3PО4 едким натром:
Н3РО4 (конц.) + NaOH (разб.) = NaH2PO4 + H2O
Ортофосфат кальция Са3(PO4)2— Оксосоль. Белый, тугоплавкий, термически устойчивый. Нерастворим в воде. Разлагается концентрированными кислотами. Восстанавливается коксом при сплавлении. Основной компонент фосфоритных руд (апатиты и др.).
Применяется для получения фосфора, в производстве фосфорных удобрений (суперфосфаты), керамики и стекла, осажденный порошок — как компонент зубных паст и стабилизатор полимеров.
Уравнения важнейших реакций:
Фосфорные удобрения
Смесь Са(Н2Р04)2 и CaS04 называется простым суперфосфатом, Са(Н2Р04)2 с примесью СаНР04 — двойным суперфосфатом, они легко усваиваются растениями при подкормке.
Наиболее ценные удобрения — аммофосы (содержат азот и фосфор), представляют собой смесь аммонийных кислых солей NH4H2PO4 и (NH4)2HPO4.
Хлорид фосфора (V) PCI5. Бинарное соединение. Белый, летучий, термически неустойчивый. Молекула имеет строение тригональной бипирамиды (sp3 d-гибридизация). В твердом состоянии димер P2Cl10 с ионным строением РСl4+[РСl6]—. «Дымит» во влажном воздухе. Весьма реакционноспособный, полностью гидролизуется водой, реагирует со щелочами. Восстанавливается белым фосфором. Применяется как хлорагент в органическом синтезе. Ядовит.
Уравнения важнейших реакций:
Получение: хлорирование фосфора.
Содержание:
Фосфор — химический элемент и простое вещество:
В периодической системе химических элементов неметалл фосфор Р расположен в третьем периоде в VA-группе. Рассмотрим свойства этого химического элемента и образуемых им простых веществ более подробно.
Фосфор в природе
Из-за высокой химической активности фосфор в природе в свободном виде не встречается. В почве и в горных породах он содержится в виде солей фосфорной кислоты — фосфатов. Так, фосфат кальция
Фосфор поступает в организмы человека и животных с растительной пищей и продуктами питания. Растения, в свою очередь, усваивают фосфор из почвы.
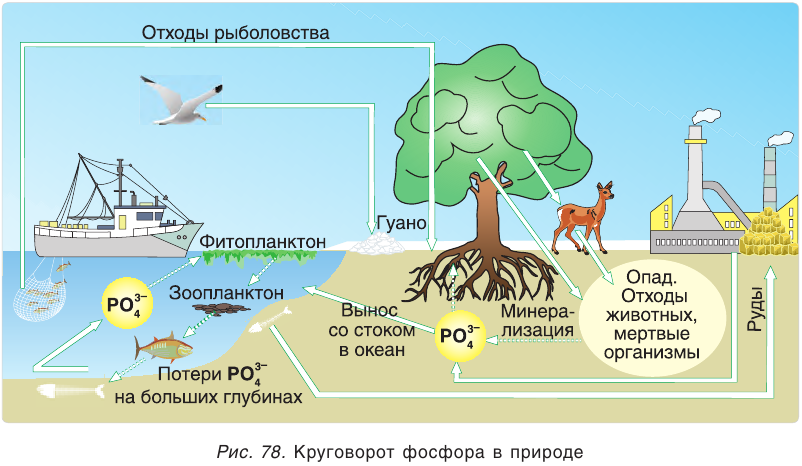
При гниении остатков животных и растений фосфор возвращается в почву. Так осуществляется круговорот фосфора в природе (рис. 78).
Строение атомов фосфора
В атоме фосфора имеется 15 электронов, которые располагаются на трех электронных слоях:
На внешнем электронном слое у атомов фосфора, так же как и у атомов азота, имеется по 5 электронов. В соединениях с металлами и водородом фосфор проявляет степень окисления, равную –3, например в фосфиде кальция 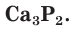
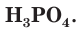
Строение и физические свойства простых веществ
Фосфор образует несколько аллотропных модификаций, которые называются белым, красным и черным фосфором.
Белый фосфор состоит из молекул 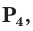
Белый фосфор впервые был получен из мочи алхимиком Хённигом Брандтом в 1669 г. в виде массы, светящейся в темноте. Отсюда произошло и название этого элемента (фосфор в переводе с греческого означает «светоносный»).
На свету и при нагревании до 300 °С без доступа воздуха белый фосфор превращается в порошок, цвет которого может быть от красно-бурого до красного и фиолетового (красный фосфор). Красный фосфор не летуч, не растворим в воде, не ядовит.
Красный и черный фосфор, с которым вы подробнее познакомитесь в курсе химии 11-го класса, имеют сложную структуру.
Химические свойства фосфора
Химически фосфор достаточно активен — непосредственно соединяется со многими простыми веществами с выделением большого количества теплоты. При этом фосфор проявляет как окислительные, так и восстановительные свойства.
Окислительные свойства фосфора проявляются при его взаимодействии с наиболее активными металлами. При этом образуются фосфиды:
Восстановительные свойства фосфора проявляются при его взаимодействии с кислородом. Но у разных модификаций фосфора химическая активность различна. Например, белый фосфор при комнатной температуре легко окисляется на воздухе с образованием оксида фосфора(III):
Окисление белого фосфора сопровождается свечением. Белый и красный фосфор при поджигании загораются и горят ослепительно ярким пламенем (рис. 80) с образованием белого дыма оксида фосфора(V):
Применение фосфора
Фосфор используют в производстве фосфорной кислоты и фосфорных удобрений, полупроводниковых материалов как компонент покрытий стальных изделий и т. д. (рис. 81). Белый фосфор применяют для изготовления трассирующих боеприпасов как дымообразующее и зажигательное средство, красный фосфор — основной компонент смеси для спичечных коробков.
Современные спички, зажигающиеся при трении о специальную поверхность, были изобретены в Швеции в 1855 г. На боковые поверхности спичечного коробка наносят массу, состоящую из красного фосфора, оксида железа(III) Fe2O3, соединений сурьмы и марганца с примесью измельченного стекла и клея. В состав спичечной головки входят хлорат калия KClO3, сера, наполнители и клей. При трении спичечной головки о фосфорные намазки происходит воспламенение:
- Фосфор образует несколько аллотропных модификаций — белый, красный и черный фосфор.
- Белый фосфор — сильно ядовитое вещество.
- Фосфор проявляет восстановительные свойства в реакции с кислородом и окислительные — в реакциях с активными металлами.
Кислородсодержащие соединения фосфора
Среди неорганических соединений фосфора наибольшее значение имеют его оксиды, фосфорная кислота 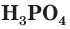
Оксиды фосфора
В зависимости от условий окисления фосфора можно получить оксид фосфора(III) 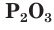
Оксид фосфора(V) представляет собой твердое, белое порошкообразное вещество, которое обладает способностью отнимать воду у многих веществ.
Оксид фосфора(V) используется в химических лабораториях и промышленности в качестве лучшего осушающего и отнимающего воду (дегидратирующего) средства.
При растворении оксида фосфора(V) в воде образуется фосфорная кислота 
Оксид фосфора(III) и оксид фосфора(V) обладают кислотными свойствами: взаимодействуют с водой, осно Ђвными оксидами и основаниями. С продуктами этих реакций вы познакомитесь в 11-м классе.
Фосфорная кислота и ее соли
В молекуле 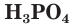
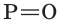
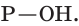
Фосфорная кислота 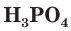
Фосфорная кислота проявляет все свойства, характерные для кислот: изменяет окраску индикаторов, реагирует с металлами, расположенными в ряду активности до водорода, основными оксидами, основаниями и солями.
С водой фосфорная кислота смешивается в любых соотношениях.
Соли фосфорной кислоты называются фосфатами. Большинство этих солей, кроме фосфатов щелочных металлов и аммония, нерастворимы в воде.
Применение фосфорной кислоты и фосфатов
В промышленности, в коммунальном хозяйстве и в быту фосфорную кислоту и ее соли применяют для замедления коррозии металлов, умягчения воды, борьбы с накипью и изготовления различных моющих средств. Пропитка древесины самой кислотой и ее солями делает дерево негорючим. На этой основе сейчас производят огнезащитные краски, негорючие фосфодревесные плиты, негорючий фосфатный пенопласт и другие строительные материалы. Фосфаты широко используются как фосфорные удобрения.
В пищевой промышленности небольшие добавки фосфорной кислоты заметно улучшают вкусовые качества мармелада, лимонадов и сиропов.
Более подробно со свойствами фосфорной кислоты H3PO4 и ее солей вы познакомитесь в курсе химии 11-го класса.
- К наиболее распространенным соединениям фосфора относятся оксиды, фосфорная кислота и ее соли.
- Слабая фосфорная кислота в растворах диссоциирует обратимо.
- Фосфорная кислота проявляет все свойства, характерные для кислот: изменяет окраску индикаторов, реагирует с металлами, расположенными в ряду активности до водорода, основными оксидами, основаниями и солями.
Минеральные удобрения
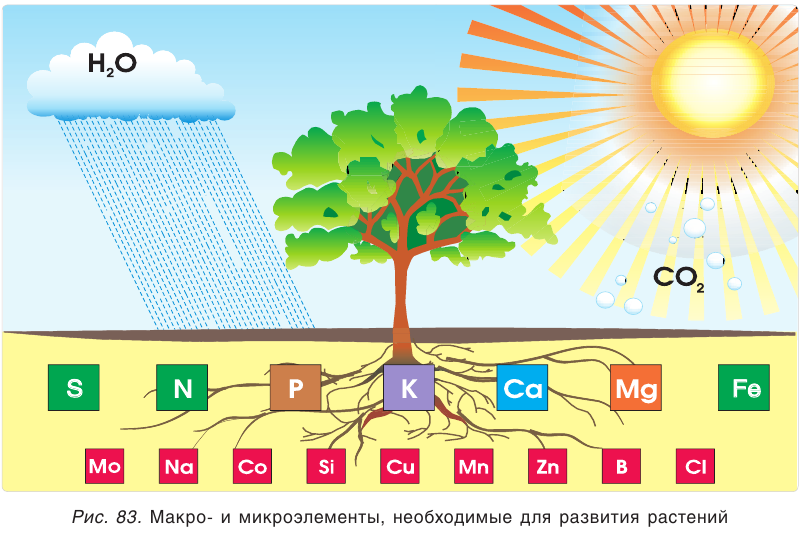
К важнейшим химическим элементам, необходимым для развития растений, относятся азот, фосфор и калий. Кроме названных, для жизнедеятельности растений важны и другие химические элементы: сера, магний, железо и кальций. Эти семь элементов называют макроэлементами. Кроме них, растениям в очень небольших количествах нужны марганец, кремний, бор, медь, цинк, молибден и др. — их называют микроэлементами (рис. 83).
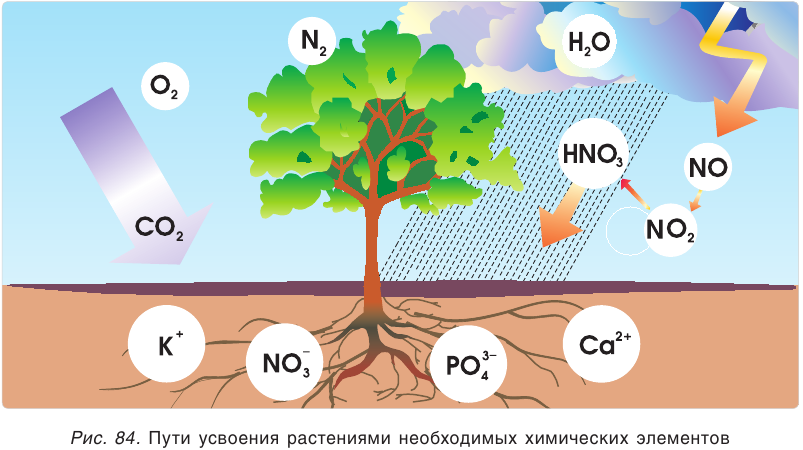
Растения получают необходимые элементы из почвы в виде растворимых соединений. Например, азот растения усваивают либо в виде нитратиона 

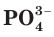
Удобрения — это вещества, которые содержат химические элементы, необходимые для питания растений, их вносят в почву для повышения урожайности.
Азотные удобрения
Атомы азота входят в состав аминокислот и белков. Но непосредственно из воздуха азот могут усваивать только особые бактерии, которые живут в клубеньках корешков бобовых растений (гороха, фасоли, клевера, люпина, чечевицы) (рис. 85). Все другие растения потребляют азот из солей аммония или нитратов. Каждую осень человек собирает урожай, а значит, забирает из почвы соединения азота, из-за чего почва теряет свою плодородность, поэтому ее необходимо удобрять.
Азотные удобрения делятся на две группы: минеральные и органические. К минеральным азотным удобрениям относятся: сульфат аммония 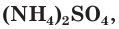

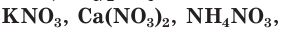
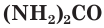
Органические азотные удобрения — это навоз, компост (удобрение, получаемое из органических остатков в результате их биологического разложения), помет и зеленые удобрения на основе бобовых растений. Помимо азота, они содержат и другие элементы, необходимые для питания растений.
В большом количестве высококонцентрированные азотные удобрения в Беларуси производятся на ОАО «Гродно Азот» (рис. 86).
Важно знать, что избыточное внесение в почву азотных удобрений приводит к тому, что нитраты попадают в пищевые продукты, загрязняя их и делая непригодными к употреблению. Содержание нитратов в овощах, фруктах и других продуктах не должно превышать предельно допустимой концентрации. При использовании экологически чистых продуктов человек в сутки потребляет нитраты массой 100—200 мг, из них 60—70 % — с овощами, а 10—20 % — с водой.
Фосфорные удобрения
В качестве фосфорных удобрений чаще всего используют кальциевые соли фосфорной кислоты. Одно из распространенных фосфорных удобрений — измельченная горная порода фосфорит (фосфоритная мука), основным компонентом которого является фосфат кальция 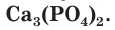
Фосфорные удобрения повышают урожайность сельскохозяйственных культур, придают растениям зимостойкость и устойчивость к неблагоприятным климатическим условиям, способствуют быстрому созреванию урожая в районах с коротким вегетационным периодом.
Калийные удобрения
В качестве калийного удобрения чаще всего используют хлорид калия KCl, встречающийся в составе различных горных пород (см. § 15).
Важным калийным удобрением является также зола растений, в которой калий находится в виде карбоната калия (поташа) 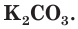
При внесении минеральных удобрений в почву необходимо учитывать состав почвы и ее кислотность, нормы и сроки внесения удобрений, а также погодные условия.
- Удобрения — это вещества, которые содержат химические элементы, необходимые для питания растений; их вносят в почву для повышения урожайности.
- К важнейшим химическим элементам, необходимым для развития растений, относятся азот, фосфор и калий.
ФОСФОР (Phosphorus) – химический элемент 15(Va) группы Периодической системы, атомный номер 15, атомная масса 30,974. Известно 23 изотопа фосфора 24P –46P, среди них один стабильный 31P и только он встречается в природе. Период полураспада изотопа 30P 2,55 минуты; это первый радиоактивный изотоп, полученный искусственно в 1934 Фредериком и Ирен Жолио-Кюри.
Возможно, что фосфор в элементарном виде был получен еще в 12 в. арабским алхимиком Алхид Бехилом при перегонке мочи с глиной и известью, об этом свидетельствует древний алхимический манускрипт, хранящийся в Парижской библиотеке. Однако открытие фосфора обычно приписывается разорившемуся гамбургскому купцу Хеннигу Бранду. Предприниматель занимался алхимией, чтобы получить философский камень и эликсир молодости, с помощью которых можно было бы легко поправить свое материальное положение. После упаривания 50–60 ведер мочи (он брал ее в солдатских казармах) в течение двух недель и последующего сильного прокаливания сухого остатка с углем и песком в реторте, Бранду удалось в 1669 сконденсировать выделяющиеся пары под водой и получить небольшое количество желтого вещества. Оно светилось в темноте и поэтому было названо Брандом «холодным огнем» (kaltes Feuer). Современники Бранда назвали это вещество фосфором из-за его способности светиться в темноте (др. греч. jwsjoroV). Вообще, с древних времен «фосфорами» называли все вещества, способные испускать свет в темноте. Так, широко известен «болонский фосфор» – сульфид бария.
В 1682 Бранд опубликовал результаты своих исследований, и сейчас он справедливо считается первооткрывателем элемента № 15. Фосфор явился первым элементом, открытие которого документально зафиксировано, и его первооткрыватель известен.
Интерес к новому веществу был грандиозный, и Бранд этим пользовался – он демонстрировал фосфор только за деньги или обменивал небольшие его количества на золото. Несмотря на многочисленные усилия, осуществить свою заветную мечту – получить золото из свинца с помощью «холодного огня» — гамбургский купец так и не смог, и поэтому вскоре он продал рецепт получения нового вещества некоему Крафту из Дрездена за двести талеров. Новому хозяину удалось сколотить на фосфоре значительно бóльшее состояние – с «холодным огнем» он разъезжал по всей Европе и демонстрировал его ученым, высокопоставленным и даже королевским особам, например, Роберту Бойлю, Готфриду Лейбницу, Карлу Второму. Хотя способ приготовления фосфора держался в строжайшем секрете, в 1682 его удалось получить Роберту Бойлю, но и он сообщил свою методику только на закрытом заседании Лондонского королевского общества. Способ Бойля был предан огласке уже после его смерти, в 1692.
Долгое время фосфор не считали простым веществом, и только в 1770-х годах французский химик Антуан Лоран Лавуазье в своих работах, посвященных исследованию состава воздуха, смог твердо установить, что фосфор является элементарным веществом.
Фосфор в природе и его промышленная добыча.
Содержание фосфора в земной коре оценивается в 8 10–2% по массе. Фосфор – одиннадцатый по распространенности элемент на Земле и входит в двадцатку наиболее распространенных элементов Солнечной системы. Элемент № 15 обнаружен во многих типах метеоритов (каменных и каменно-железных) и на Луне. Например, в железных метеоритах содержание фосфора колеблется в диапазоне 0,02–0,94%(масс.), а в различных образцах лунного грунта оно составляет 0,05–0,32%(масс.). Несмотря на то, что геологи классифицируют фосфор, как элемент-примесь (в породах большей части земной коры его содержание составляет всего 0,1%), он является породообразующим, так как некоторые породы слагаются почти полностью из фосфатных минералов. В свободном состоянии фосфор на земле не встречается и существует в литосфере почти в высшей степени окисления, в виде ортофосфат-иона PO43–. Известно более двухсот минералов, содержащих фосфор в значительных (более 1%) количествах. Фосфатные месторождения обычно подразделяются на три группы: апатитовые месторождения, осадочные фосфориты и месторождения гуано.
Апатиты – разновидность фосфоритов, они могут быть как магматического, так и морского (осадочного) происхождения. Название это было дано группе минералов около двухсот лет назад, и в переводе с греческого означает «обманчивый» (apátán), изначально так называли минерал, который часто путали с аквамарином, аметистом или оливином. Апатитовые минералы представлены фторапатитом Ca5(PO4)3F (промышленно наиболее значимый), гидроксиапатитом Ca5(PO4)3(OH) и хлорапатитом Ca5(PO4)3Cl, франколитом (разновидность карбонатапатита) (Ca,H2O)10(F,OH)2(PO4,CO3)6, вилькеитом Ca10(OH)2(PO4,SiO4,SO4)6, пироморфитом Pb10Cl2(PO4,AsO4)6 и многими другими. Наиболее крупные месторождения магматического апатита находятся в России, странах Южной Африки (щелочной комплекс Палабора), Уганде и Бразилии. Крупнейшее в мире магматическое месторождение апатита – Хибинский массив нефелиновых сиенитов – залегает на Кольском полуострове, близ Кировска. Он был открыт в 1926 группой ученых под руководством академика А.Е.Ферсмана.
Большая часть мировых запасов фосфора приходится на морские (осадочные) фосфориты и продукты их выветривания. Предполагается, что они океанического происхождения. В прибрежных регионах пояса пассатов на протяжении долгого периода происходило отложение фосфатов вследствие различных органических и неорганических процессов. Концентрация фосфоритов в месторождении увеличивалась в результате медленной аккумуляции фосфатов из окружающей среды. Крупнейшими месторождениями осадочных фосфоритов владеют Марокко (70% от мировых запасов фосфатов) и Западная Сахара, США, Китай, Тунис, Казахстан.
Гуано (исп. guano) – естественные отложения, образующиеся при разложении костей и экскрементов морских птиц (больших бакланов, олушей и пеликанов), залежи гуано иногда достигают ста миллионов тонн. Гуано известно с незапамятных времен, еще в 200 до н.э. древние карфагеняне использовали птичий помет в качестве удобрения. В конце 19 – начале 20 в. были открыты «Птичьи острова» Перу, названные так из-за большого числа (около 20 млн.) обитающих там морских птиц. В те времена перуанское правительство получало реальные доходы за счет привлечения большого числа туристов к «Птичьим островам» и от продажи огромных количеств гуано в качестве удобрения. В последние сорок лет, вследствие деятельности перуанских рыбаков, популяции гуанопроизводящих птиц резко сократились (в 4 раза), так что некоторые из перуанских «Птичьих островов» сейчас вообще пустуют. Крупнейшие месторождения гуано расположены вдоль побережий Африки, Южной Америки, Калифорнии, Сейшельских островов. Сильно разложившееся гуано состоит преимущественно из монетита CaHPO4 и витлокита b-Ca3(PO4)2.
Мировая добыча (2002) фосфатов составляет 135 млн. тонн ежегодно. Крупнейшим в мире производителем фосфатов являются США (26% от мировой добычи). Разработки ведутся во Флориде (формация Боун-Велли), Северной Каролине, Айдахо и Юте. Королевство Марокко (вместе с Западной Сахарой) – второй по величине производитель фосфатной руды (17,3%) и крупнейший экспортер. Фосфориты разрабатываются в трех районах: Курибге, Юссуфии и Бен-Герире. Основное месторождение (Khouribga) находится в 120 км к югу от Касабланки. Общие запасы фосфоритов в Марокко составляют 64 млрд. тонн, разведанные 10 млрд. тонн (60% от разведанных в мире запасов). На третьем месте по добыче – Китай (16,7%), на четвертом – Россия (10,5%). Основным источником фосфорного сырья в России являются апатито-нефелиновые руды на Кольском полуострове. За более чем семьдесят лет, прошедших с момента открытия месторождения, добыто свыше 570 млн. тонн апатитового концентрата. Сейчас в пределах Хибинского массива разведано 10 месторождений, суммарные запасы которых составляют 3,6 млрд. тонн, а в целом на Кольском полуострове запасы руды составляют около 20 млн. тонн. Учитывая, что за все прошедшее время было добыто неполных полтора миллиарда тонн, запасов апатита России должно хватить еще на много лет.
Обычно промышленным считается такое месторождение, которое дает не менее 6000 тонн фосфатной породы с 1 га. В открытых карьерах фосфат добывается скребковыми экскаваторами. Сначала удаляются наносы песков и пустая порода, а затем извлекают фосфатную руду. От карьеров до обогатительных фабрик руда может подаваться (на расстояния в несколько км) по стальным трубам в виде водной пульпы.
В морской воде весь неорганический фосфор находится только в виде ортофосфат-аниона. Средняя концентрация фосфора в морской воде очень мала и составляет 0,07 мг Р/литр. Высоко содержание фосфора в районе Андаманских островов (около 12 мкмоль/л). Общее океаническое количество фосфора оценивается в 9,8·1010 тонн.
В атмосфере Земли фосфор отсутствует полностью.
Свойства простого вещества и промышленное получение фосфора.
Вопрос аллотропии фосфора сложен и до конца не решен. Обычно выделяют три модификации простого вещества – белую, красную и черную. Иногда их еще называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных трех. Существует аморфный фосфор различных цветов и оттенков – от ярко-красного до фиолетового и коричневого.
Белый фосфор (желтый фосфор, тетрафосфор) P4, наиболее активная, летучая, всесторонне изученная и, в тоже время, метастабильная форма простого вещества. В чистом виде это бесцветное стекловидное вещество, сильно преломляющее свет. Белый фосфор обладает специфическим чесночным запахом, жирен на ощупь, мягок и легко режется ножом. Промышленный продукт может быть от соломенно-желтого до коричневого-красного и коричневого цветов. Как заметную примесь содержит красный фосфор, мышьяк, следы углеводородов и смол. Температура плавления чистого вещества 44,1° С, температура кипения 280° С (разл.), плотность 1823 кг/м3 (293К). Белый фосфор практически нерастворим в воде, но растворим при комнатной температуре в неполярных органических растворителях: бензоле (3,7 г на 100 г C6H6), тетрахлорметане (1,27 г на 100 г CCl4), диэтиловом эфире (1,39 г на 100 г Et2O). Хорошими растворителями для него являются жидкие аммиак и диоксид серы, а наилучшим – сероуглерод, в 100 г которого растворяется более 1000 г белого фосфора.
Есть две полиморфные модификации белого фосфора. При обычных температурах устойчива альфа-форма, она имеет кубическую решетку с очень большой элементарной ячейкой, содержащей 56 молекул P4.
Тетрафосфор химически очень активен, в мелкодисперсном состоянии
P4 + 5O2 = P4O10.
Белый фосфор хранят, режут и плавят под слоем воды, что вполне безопасно.
Фосфор загорается в атмосфере хлора с образованием смеси хлоридов:
P4 + 6Cl2 = 4PCl3
P4 + 10Cl2 = 4PCl5.
При взаимодействии с бромом и иодом дает тригалогениды, во фторе сгорает с образованием пентафторида. При нагревании с растворами щелочей белый фосфор диспропорционирует с образованием фосфина (с примесью водорода) и соли фосфиновой (фосфорноватистой) кислоты:
2P4 + 3Ba(OH)2 + 6H2O = 2PH3 + 3Ba(H2PO2)2
Белый фосфор довольно сильный восстановитель – вытесняет медь, свинец, ртуть и серебро из растворов их солей:
P4 + 10CuSO4 + 16H2O = 4H3PO4 + 10Cu + 10H2SO4.
Именно поэтому при отравлении белым фосфором рекомендуется выпить сильно разбавленный раствор медного купороса.
При слабом нагревании фосфор окисляется серой, тионилхлоридом, а взаимодействие его с твердыми KClO3, KMnO4, KIO3 может приобретать взрывной характер.
В темноте можно наблюдать холодное зеленоватое свечение белого фосфора, обусловленное протекающей разветвленной цепной реакцией окисления паров фосфора. На результатах исследования этого процесса советским физико-химиком Н.Н.Семеновым в 1920-х была создана теория разветвленных цепных реакций. Семенов ввел понятия верхнего и нижнего пределов воспламенения и области, ограниченной ими – полуострова воспламенения, за пределами которого реакция окисления паров фосфора не является разветвленной.
Белый фосфор чрезвычайно ядовит, доза в 0,05–0,1 г смертельна для человека. Он способен аккумулироваться в организме и вызывать некроз костных тканей (особенно челюстей).
Черный фосфор – термодинамически наиболее устойчивая и химически наименее активная форма элемента. Впервые получен в 1914 в виде кристаллической модификации высокой плотности (2690 кг/м3) американским физиком Перси Уильямом Бриджменом из белого фосфора при давлении 2·109 Па (20 тысяч атмосфер) и температуре 200° С. Это черное полимерное вещество, нерастворимое ни в одном из растворителей. В отличие от белого фосфора черный фосфор практически невозможно поджечь. По некоторым своим характеристикам он напоминает графит, например, является проводником. Есть данные о существовании трех кристаллических модификаций черного фосфора. Кроме того описан аморфный черный фосфор. При температуре 220–230° С и давлении 13 000 атмосфер белый фосфор практически мгновенно превращается в черную кристаллическую форму. В более мягких условиях образуется аморфное вещество.
Красный фосфор – недостаточно изученная форма простого вещества. Есть сообщения о его существовании в кристаллической форме, но полностью структура не установлена, однако доказано его полимерное строение. Аморфный красный фосфор был открыт в 1847 в Швеции профессором химии Антоном Риттером фон Кристелли Шреттером – он нагревал белый фосфор в запаянной ампуле в атмосфере оксида углерода(II) при 500° С. Обычный продажный препарат грубодисперсен и окрашен в пурпурный цвет. Значения плотности красного фосфора, в зависимости от способа получения, лежат в интервале 2000–2400 кг/м3. По своей реакционной способности аморфный фосфор значительно уступает белому: воспламеняется при более высоких температурах, не светится в темноте, не взаимодействует с растворами щелочей. Красный фосфор нелетуч, не растворяется ни в одном растворителе, а только в расплавах свинца и висмута. В отличие от белого он неядовит, во влажном воздухе постепенно окисляется с образованием смеси фосфорных кислот. Медленным окислением красного фосфора объясняется его кажущаяся гигроскопичность.
При кристаллизации фосфора из расплавленного свинца в 1865 немецкий физик Иоганн Вильгельм Гитторф получил кристаллы фиолетового фосфора (фосфор Гитторфа). Сейчас точно установлена его структура. На основании косвенных данных предполагают, что фосфор Гитторфа – крупнокристаллическая модификация красного фосфора.
В результате нагревания любой модификации фосфора при атмосферном давлении получается пар, состоящий из тетраэдрических молекул P4. При температурах выше 800° С начинается заметная диссоциация тетрафосфора с образованием молекул P2. Степень дальнейшего распада с образованием атомного пара даже при температурах порядка 2000° С не превышает нескольких процентов. При конденсации паров фосфора или затвердевании его расплава всегда образуется метастабильная белая модификация.
На протяжении ста лет с момента открытия Бранда единственным источником элементарного фосфора являлась моча. В 1743 Марграф усовершенствовал метод извлечения элемента из мочи, предложив добавлять поташ к сухому остатку после ее перегонки. Гамбургский алхимик и другие исследователи смогли получить фосфор потому, что в сухом остатке содержится до 10% фосфата натрия, который при температурах 800–1000° С способен восстанавливаться углем. К концу 18 в. мочу заменили кости. В 1769 Юхан Ган доказал, что в костях содержится большое количество фосфора. В 1771 Карл Шееле разработал способ получения фосфора из костяной золы путем обработки ее серной кислотой и восстановления образовавшихся кислых фосфатов углем при нагревании. В 1829 Фридрих Вёлер получил белый фосфор, нагревая костяную муку со смесью кремнезема, глины и угля. Протекающая при этом реакция легла в основу современного промышленного получения фосфора. В те времена способ Вёлера широкого распространения не получил, так как процесс проходил при высокой температуре, недоступной тогда в промышленности, поэтому еще долгое время фосфор получали по способу Шееле. Первый завод по производству фосфора был построен в Германии в 1834. В России производство фосфора было организовано молодым коммерсантом Евграфом Тупициным в декабре 1871. Завод был построен на речке Данилихе, в Перми и насчитывал двенадцать корпусов. Фосфор получали из костей, и он был значительно дешевле иностранного. Большая часть фосфора, потреблявшегося тогда в России, производилось на заводе Тупицина, хотя существовало много мелких фосфорных фабрик: в Вологде, Калуге, Боровичах и других городах. Значительный успех в процессе производства фосфора был достигнут английским инженером Джеймсом Рэдманом, который запатентовал процесс получения белого фосфора в электропечах. Несмотря на многие технологические трудности, в 1891 в Англии и Франции началось промышленное производство фосфора по методу Рэдмана. До внедрения в Европе электротермического метода, Российская Империя занимала третье место в мире по производству фосфора, но потом из крупного экспортера превратилась в импортера, так как английский фосфор был дешевле отечественного, получаемого из костей.
Сейчас электротермический способ является основным в производстве фосфора. Химическая составляющая процесса основана на реакции Вёлера, сырьем служит фосфат кальция (фосфоритовый концентрат). Его нагревают в смеси с кварцевым песком и коксом в электрической печи при температуре около 1300° С. Сначала диксид кремния вытесняет фосфорный ангидрид из фосфата, который затем восстанавливается углеродом до элементного фосфора. Процесс можно описать двумя уравнениями реакций:
2Ca3(PO4)2 + 6SiO2 = 6CaSiO3 + P4O10
P4O10 + 10C = 10CO + P4.
Или суммарно:
2Ca3(PO4)2 + 6SiO2 + 10C = 6CaSiO3 + 10CO + P4.
Соединения фосфора. С некоторой долей условности можно сказать, что в своих многочисленных соединениях фосфор может находиться в следующих степенях окисления: –3, –1 и от 0 до +5. Если принять, что в фосфине (PH3) фосфор находится в низшей степени окисления –3, то все нечетные степени окисления получаются за счет последовательного добавления к фосфору атомов кислорода, каждый из которых оттягивает на себя по два электрона. Кроме того, возможность образования связей P–P в некоторых веществах приводит к появлению степеней окисления +2 и +4.
Примеры:
P–3: фосфин PH3, триэтилфосфин P(C2H5)3;
P–1: триэтилфосфиноксид PO(C2H5)3 и диметилхлорфосфин P(CH3)2Cl;
P0: простое вещество;
P+1: фосфиновая и диэтилфосфиновая кислоты:
P+2: гиподифосфористая кислота и ее производные:
P+3: фосфоновые, алкилфосфоновые кислоты и их производные:
P+4: гипофосфорная кислота и ее производные:
P+5: фосфорные кислоты и их производные:
Важнейшие неорганические соединения фосфора:
Фосфин PH3 (фосфористый водород), бесцветный газ с характерным запахом чеснока. Чистый фосфин загорается на воздухе только при 150° С, но обычно в качестве примеси он содержит следы более активного дифосфина (P2H4) и поэтому самовоспламеняется на воздухе при комнатной температуре. При окислении фосфина образуется фосфорная кислота:
PH3 + 2O2 = H3PO4.
Фосфористый водород растворяется в воде с образованием нейтрального раствора. Фосфин проявляет слабые основные свойства. Протонируется (присоединяет протон) (с образованием иона PH4+) только наиболее сильными кислотами:
PH3 + HI = PH4I.
Образующиеся соли фосфония термически неустойчивы и разлагаются водой.
Фосфин можно получить растворением белого фосфора в щелочи, действием растворов минеральных кислот на фосфиды металлов или термическим разложением фосфоновой кислоты:
Mg3P2 + 3H2SO4(р-р)= 2PH3 + 3MgSO4
4H3PO3 = PH3 + H3PO4.
«Блуждающие огни», возникающие иногда на болотах, являются следствием самовоспламенения фосфина, образующегося за счет биохимического восстановления органических фосфорных эфиров.
Фосфин применяется в синтезе фосфорорганических соединений и высокочистого фосфора.
Фосфористый водород – чрезвычайно ядовитый газ. Летальный исход наблюдается после получасового пребывания в атмосфере с концентрацией 0,05 мг/л PH3.
Фосфиновая кислота (устар. фосфорноватистая) H3PO2, бесцветные кристаллы, расплывающиеся на воздухе и хорошо растворимые в воде, Тпл 26,5° С. В промышленности получается при кипячении белого фосфора с водной суспензией шлама Ca(OH)2 или Ba(OH)2. Образовавшийся гипофосфит кальция обрабатывают сульфатом натрия или раствором серной кислоты с целью получения гипофосфита натрия или свободной кислоты, которые являются товарными продуктами.
Фосфиновая кислота образует только монозамещенные соли (исключение K2HPO2). Cпектроскопически доказано наличие равновесия:
При нагревании фосфорноватистая кислота разлагается с образованием сложной смеси продуктов.
Кислота и ее соли широко применяются в качестве восстановителей (например, при никелировании), антиоксидантов алкидных смол, стабилизаторов при проведении многих реакций полимеризации.
Оксид фосфора(III) (фосфористый ангидрид) P4O6. Бесцветное, кристаллическое, очень ядовитое вещество с неприятным запахом. Тпл 23,8° С. Структуру его легко можно представить, исходя из строения белого фосфора:
Получают его при неполном окислении элементного фосфора и затем очищают от примесей путем перекристаллизации из сероуглерода.
P4O6 разлагается при нагревании, с водой образует фосфоновую кислоту, бурно реагирует с галогенами, легко присоединяет серу:
P4O6 + 6H2O = 4H3PO3
3P4O6 + 12Br2 = 8POBr3 + P4O10
P4O6 + 4S = P4O6S4.
Фосфоновая кислота H3PO3 – бесцветное кристаллическое сильно гигроскопичное вещество, Тпл 74° С. Хорошо растворяется в воде, получается при взаимодействии трихлорида фосфора с водой или безводной щавелевой кислотой:
PCl3 + 3H2C2O4 = H3PO3 + 3CO2+ 3CO
+ 3HCl
.
Фосфоновая (чаще ее называют фосфористой) двухосновна, так как один атом водорода связан с фосфором, хотя есть доказательства существования равновесия, сильно сдвинутого вправо:
P(OH)3« H2PO3H.
Не существует трехзамещенных фосфитов металлов, но получены трехзамещенные органические эфиры – P(OC2H5)3.
При нагревании раствора кислоты образуется водород и фосфорная кислота.
Фосфоновая кислота и ее соли находят ограниченное применение в качестве восстановителей.
Трихлорид фосфора PCl3 – жидкость с резким неприятным запахом, дымящая на воздухе. Ткип 75,3° С, Тпл –40,5° С. В промышленности его получают пропусканием сухого хлора через суспензию красного фосфора в PCl3. Хорошо растворяется во многих органических растворителях, практически нацело гидролизуется водой:
PCl3 + 3H2O = H3PO3 + 3HCl.
Находит широкое применение в органическом синтезе.
Пентахлорид фосфора PCl5 – светло-желтое с зеленоватым оттенком кристаллическое вещество с неприятным запахом. Кристаллы имеют ионное строение [PCl4+][PCl6–]. Твозг 159° С. Получается при взаимодействии PCl3 с хлором или S2Cl2:
PCl3 + Cl2 = PCl5
3PCl3 + S2Cl2 = PCl5 + 2PSCl3.
Гидролизуется водой до триоксихлорида:
PCl5 + H2O = POCl3 + 2HCl
Находит широкое применение при получении других соединений фосфора и в органическом синтезе.
Оксид фосфора(V) (фосфорный ангидрид) P2O5. Известно несколько полиморфных модификаций пентаоксида фосфора, наибольшее значение из них имеет так называемая Н-форма и именно она производится промышленностью при сжигании фосфора в избытке сухого воздуха. Н-форма – белый кристаллический, чрезвычайно гигроскопичный порошок, возгоняющийся при 359° С. При поглощении влаги из воздуха превращается в сложную смесь метафосфорных кислот, но при взаимодействии с избытком теплой воды превращается в фосфорную кислоту:
P4O10 + 6H2O = 4H3PO4.
Фрагмент его «алмазоподобной» структуры можно легко получить из такового для P4O6:
Фосфорный ангидрид – наиболее сильный из известных осушающих агентов. Благодаря этому имеет широкое применение в лабораторной практике. Он дегидратирует концентрированную серную, азотную, хлорную и другие кислоты, а также многие органические соединения:
4HNO3 + P4O10 = 2N2O5 + 4HPO3
2H2SO4 + P4O10 = 2SO3 + 4HPO3.
На практике дегидратирующая способность P4O10 осложняется образованием на его поверхности плотной пленки фосфорных кислот. Частично этого можно избежать, используя смесь фосфорного ангидрида со стекловатой.
Оксид фосфора(V) – конденсирующий и дегидратирующий агент в органическом и неорганическом синтезе. Катализатор (нанесенный на кизельгур) полимеризации изобутилена.
Ортофосфорная кислота, часто называемая просто фосфорной, H3PO4. Бесцветные кристаллы, расплывающиеся на воздухе. Тпл 38,5° С. Впервые фосфорная кислота была описана в 1680 Робертом Бойлем, который установил, что водный раствор продуктов сгорания фосфора обладает кислыми свойствами. В промышленности фосфорную кислоту получают двумя способами: растворением фосфорного ангидрида в воде («сухой» процесс) и обработкой апатитового концентрата 85–90%-ой серной кислотой («мокрый» процесс):
Ca10(PO4)6F2 + 10H2SO4 + 20H2O = 6H3PO4 + 2HF + 10CaSO4·2H2O.
Второй способ более экономичен, и большая часть кислоты (для получения удобрений) производится именно так, но чистую H3PO4 получают первым способом.
Фосфорная кислота трехосновная, однако константа диссоциации по третьей ступени очень мала (К3 = 4,4·10–13), поэтому в водном растворе она титруется (см. ТИТРОВАНИЕ) только до гидрофосфата, т.е. как двухосновная. Образует одно-, двух- и трехзамещенные неорганические фосфаты.
Фосфорная кислота находит широкое применение в металлургии – для чистки, травления и электрополировки поверхностей металлов. Разбавленная кислота используется в качестве «преобразователя ржавчины», так как образует на поверхности железа и стали нерастворимую пленку кислого фосфата железа, предохраняющую металл от коррозии. Используется и как связующий агент во многих строительных материалах. Пищевая кислота применяется при изготовлении безалкогольных напитков и многих других пищевых продуктов.
Фосфаты аммония придают огнестойкость древесине. Фосфаты кальция и натрия широко используются в пищевой промышленности (разрыхлители теста, стабилизаторы молочных продуктов), являются компонентами зубных паст и чистящих средств. Кроме того, одна из самых важных областей применения фосфатов щелочных металлов – приготовление буферных систем, самой известной из которых является смесь KH2PO4 и Na2HPO4.
Биохимия фосфора и его значение в питании человека.
Жизнь не может существовать без фосфора, этот элемент необходим как субмикроскопическим частицам – вирусам, так и высокоорганизованным живым системам – животным и человеку.
Фосфор – шестой по содержанию элемент в организме человека после кислорода, водорода, углерода, азота и кальция. Количество фосфора составляет 1–1,5% от массы тела.
Можно выделить несколько важнейших функций, выполняемых соединениями фосфора в организме человека:
Рост и поддержание целостности костной ткани и зубов. В костях содержится примерно 85% от общего количества фосфора (в виде гидроксиапатита) в организме.
Участие в катаболических и анаболических реакциях. Особенно важны содержащие фосфор коферменты – низкомолекулярные вещества небелковой природы, действующие в составе ферментов и необходимые при специфических каталитических превращениях. Некоторые коферменты многим хорошо известны – это аденозинтрифосфат (АТФ), никотинамидадениндинуклеотидфосфат (НАДФ), флавинмононуклеотид (ФМН), пиридоксальфосфат, тиаминпирофосфат, кофермент А и другие. Каждый кофермент выполняет определенную функцию в клетке. Напрмер, гидролиз АТФ до АДФ – реакция, при сопряжении с которой потенциально эндергонические реакции(с поглощением энергии) превращаются в экзергонические (с выделением энергии), что необходимо при осуществлении важнейших биохимических процессов.
Служит предшественником в синтезе фосфолипидов – эфиров фосфорной кислоты и липидов (содержат остатки глицерина или сфигнозина, жирных кислот и фосфорной кислоты). Фосфолипиды обладают интересной особенностью – растворяются как в воде (за счет фосфата), так и в масле (за счет углеводородного остатка жирной кислоты) и эта характерная черта делает их важным компонентом клеточных мембран, так как такая структура оболочки позволяет проникать внутрь клетки (или из нее) как водо-, так и жирорастворимым питательным веществам.
Служит предшественником в синтезе ДНК и РНК. Эти носители генетической информации были впервые выделены в 1869 Мишером и названы им нуклеином. Мишер установил содержание значительного количества фосфора в нуклеине. ДНК и РНК представляют собой двухцепочечные спирализованные полимерные молекулы. Остов их образован остатками пентоз (дезоксирибозы для ДНК и рибозы для РНК) и фосфата. Важность фосфора в сохранении целостности РНК и ДНК была подтверждена на опытах с фагами (вирусами, заражающими клетки бактерий), меченными радиофосфором. Их назвали фагами-самоубийцами, так как по мере распада радиоактивного фосфора, структура нуклеиновой кислоты повреждалась настолько, что это становилось летальным для вируса.
Участвует (около 1% P в организме) в создании буферной емкости жидкостей и клеток тела. И этим все сказано.
Во всех живых организмах элемент № 15 находится исключительно в виде ортофосфат-аниона или органических эфиров фосфорной кислоты (фактически в виде неорганического фосфата), поэтому, наряду с термином «фосфор», при обсуждении биологической роли элемента, часто используют понятие «неорганический фосфат».
Значение фосфатов в питании человека огромно. Практически весь фосфор усваивается организмом человека в виде неорганических фосфатов, в среднем всасывается около 70% потребляемого с пищей фосфора. Суточная потребность в элементе для беременных и кормящих женщин составляет 1500 мг, для детей 2–6 лет 800 мг, детей 10–12 лет – 1200 мг, взрослого человека 800 мг.
В силу распространенности фосфатов в природе, обычный дневной рацион взрослого человека содержит фосфора в 7–10 раз больше суточной потребности в нем, поэтому встречаться со случаями недостаточного поступления этого элемента в организм приходится очень редко. Важнее правильное сочетание в рационе кальция и фосфора, ведь образование костной ткани связано с обоими этими элементами. Замечено, что если организм испытывает недостаток кальция, то, как правило, тут же обнаруживается переизбыток фосфора, и наоборот. Детальные исследования позволили установить, что оптимальная суточная норма фосфора, поступающего с продуктами питания, эквивалентна таковой для кальция, то есть пища должна содержать одинаковые количества по массе фосфора и кальция (исключение – норма для грудных детей). Ниже приводятся некоторые примеры содержания фосфора и кальция в обычной пище:
| Продукт | Ca, мг/100г | P, мг/100г | Ca/P |
| Жареная говядина | 12 | 250 | 0,05 |
| Цельное молоко | 118 | 93 | 1,26 |
| Вареная фасоль | 50 | 37 | 1,35 |
| Жареная треска | 31 | 274 | 0,11 |
| Пшеничный хлеб | 84 | 254 | 0,33 |
| Картофель | 7 | 53 | 0,13 |
| Яблоки | 7 | 10 | 0,70 |
| Яйцо куриное | 54 | 205 | 0,26 |
Известны и некоторые заболевания, связанные с избытком неорганического фосфата в пище.
Применение фосфора и его соединений. Удобрения.
Область применения соединений фосфора огромна и не представляется возможным дать всеохватывающий ее обзор. Определение А.Е.Ферсмана: «Фосфор – элемент жизни…» находит повсеместное подтверждение. Фосфор – элемент не только биологической жизни, но и повседневной, действительно, фосфорсодержащие соединения используются в сельском хозяйстве, медицине, фармакологии, научных исследованиях, пищевой и химической промышленности, строительстве, металлургии, технике и, наконец, в повседневном быту. Такая ситуация была не всегда, и на протяжении долгого времени после открытия Бранда фосфор оказывался замешанным во многих скверных историях, все началось со спекуляций самого Бранда и его последователей. Далее «таинственные» вспыхивающие надписи на стенах в храмах и «чудо самовоспламенения свечей». Долгое время бытовали предрассудки и суеверия, связанные с «блуждающими» огнями, возникающими иногда над болотами и являющимися следствием самовоспламенения фосфина.
Большинство (80–90%) добываемой фосфатной руды идет на получение удобрений. В 1799 было доказано, что фосфор необходим для нормальной жизнедеятельности растений. Накапливаясь в биомассе, фосфор исчезает из почвы. Ежегодно мировой урожай уносит с полей несколько миллионов тонн фосфора, наряду с азотом и калием, поэтому необходимо возобновление его ресурсов в плодородном слое. В древние времена люди удобряли почву навозом, костями и гуано. Первое искусственное фосфорное удобрение – суперфосфат – было получено в Англии в 1839 Лаузом, а в 1842 там же было организовано его первое промышленное производство. В России первое предприятие по производству суперфосфата появилось в 1868. Сейчас его получают, обрабатывая апатит серной кислотой:
Ca10(PO4)6F2 + 7H2SO4 = 3Ca(H2PO4)2 + 7CaSO4 + 2HF.
Побочно получающийся сульфат кальция не отделяют.
Более ценный продукт – двойной суперфосфат, так как в нем содержится в три раза больше фосфора по массе, его получают обработкой апатита фосфорной кислотой:
Ca10(PO4)6F2 + 14H3PO4 +10H2O = 10Ca(H2PO4)2·H2O +2HF.
Доля производства удобрений, содержащих в своем составе только один фосфор, падает, и все больше производится комплексных удобрений, содержащих два или три питательных элемента. Большая часть фосфорных удобрений, производимых в России, приходится на аммофос, диаммофос и азофоску. Ежегодное мировое производство фосфорных удобрений на начало 21 в. составило 41 млн. тонн, а суммарное количество всех удобрений – 190 млн. тонн. Основными производителями фосфорных удобрений являются Марокко, США и Россия, а основными потребителями – страны Азии, Латинской Америки и Западной Европы.
Необходимый состав вносимого удобрения и его эффективность зависят от характеристик почвы, например, рН, но растворимость фосфатных удобрений определяет время, за которое происходит его усвоение растениями, и долю усвоенного фосфора, которая обычно мала и составляет около 20%.
Юрий Крутяков