1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
В Фосфат калия представляет собой неорганическое соединение, образованное тремя ионами калия K+ и фосфат-ион PO43-. Его химическая формула — K3PO4. Это бесцветное или белое кристаллическое твердое вещ
Содержание:
- Состав
- Номенклатура
- Свойства
- Физическое состояние
- Молекулярный вес
- Температура плавления
- Плотность
- Растворимость
- pH
- Химические свойства
- Другие свойства
- Функция фосфата в организме человека
- Получение
- Приложения
- Как основа в реакциях органической химии
- Как катализатор
- В сельском хозяйстве
- В медицинских приложениях
- Как слабительное
- В ветеринарии
- При получении ДНК
- В различных приложениях
- Отрицательный аспект для использования в сельском хозяйстве
- Ссылки
В Фосфат калия представляет собой неорганическое соединение, образованное тремя ионами калия K+ и фосфат-ион PO43-. Его химическая формула — K3PO4. Это бесцветное или белое кристаллическое твердое вещество. Он хорошо растворяется в воде, образуя щелочные растворы, то есть со многими ионами ОН.–отсюда щелочной pH.
Ион фосфата выполняет важную функцию в клетках, связанную с хранением энергии. Фосфат калия широко используется в реакциях органической химии, где он может действовать как основание, то есть принимать протоны H+. Он также может действовать как катализатор или ускоритель некоторых реакций.
Его использовали для уменьшения нападения некоторых насекомых на растения пшеницы, поскольку он делает их более устойчивыми к ним. Однако было замечено, что он способствует выделению метана (CH4), парниковый газ, из микрокультуры риса.
Он использовался как слабительное, для увеличения продолжительности местной анестезии, для остановки кариеса и для улучшения покрытия поверхностей, среди прочего.
Состав
Фосфат калия состоит из трех катионов калия K.+ и фосфат-анион PO43-.
Фосфат-ион PO43- Он состоит из одного атома фосфора (P) и четырех атомов кислорода (O), где фосфор имеет степень окисления +5, а кислород — валентность -2.
Номенклатура
- Фосфат калия
- Фосфат калия
- Трехосновный фосфат калия
- Ортофосфат калия
Свойства
Физическое состояние
Бесцветное или белое кристаллическое твердое вещество.
Молекулярный вес
212,27 г / моль
Температура плавления
1340 ºC
Плотность
2,564 г / см3
Растворимость
Хорошо растворим в воде: 106 г / 100 г воды при 25 ° C. Нерастворим в этаноле.
pH
Раствор с 1% К3PO4 он имеет pH 11,5-12,3.
Химические свойства
При растворении в воде фосфат калия разделяется на три катиона калия K+ и фосфат-анион PO43-. Фосфатный анион забирает протон из воды, и образуется гидрофосфатный анион HPO.42-. Последний, в свою очередь, забирает другой протон из воды и становится анионом дигидрофосфата H2PO4–.
PO43- + H2O ⇔ HPO42- + ОН-
HPO42- + H2O ⇔ H2PO4– + ОН–
По мере образования ионов ОН– водный раствор становится щелочным.
Другие свойства
Помимо безводной формы (без воды), он имеет несколько гидратированных форм; это означает, что молекула K3PO4 он может сопровождаться одной или несколькими молекулами воды в кристаллической структуре.
По этой причине он может образовывать, например, моногидрат K3PO4.ЧАС2Или тригидрат K3PO4.3H2Или гептагидрат и нонагидрат.
Функция фосфата в организме человека
Фосфат-ион PO43- это самый распространенный анион внутри клеток, который играет важную роль в хранении энергии.
Ион фосфата также участвует в формировании и питании костей и зубов, так как он регулирует концентрацию кальция в сыворотке крови и в многочисленных реакциях передачи энергии в клетке.
Получение
Фосфат калия можно получить, исходя из реакции между хлоридом калия KCl и фосфатом аммония (NH4)3PO4.
Хлорид калия + фосфат аммония → фосфат калия + хлорид аммония
3 KCl + (NH4)3PO4 → K3PO4 + 3 NH4Cl
Приложения
Как основа в реакциях органической химии
Калий K фосфат3PO4 Он использовался в различных реакциях органической химии. Например, он используется в синтезе ацетиленов из дибромированных соединений.
В этом синтезе происходит дегидробромирование (отщепление водорода и брома), где K3PO4 безводное твердое вещество (без воды) действует как мягкое основание и забирает два протона из молекулы, два атома брома удаляются и получается соответствующий ацетилен.
C6ЧАС5-CHBr-CH2Br + 2 К3PO4 → С6ЧАС5-C≡CH + 2 KBr + 2 К2HPO4
Как катализатор
K3PO4 служит катализатором в различных реакциях органической химии. Например, его использовали в виде твердого вещества для получения биодизельного топлива из отработанного масла для жарки.
Биодизель — это топливо, подобное дизельному, но полученное из натуральных жиров или масел, используемых или нет.
Фосфат калия оказался более эффективным в качестве катализатора или ускорителя этой реакции, чем фосфат натрия Na.3PO4 и оксид кальция CaO.
В сельском хозяйстве
K3PO4 Его использовали для обработки растений пшеницы и придания им устойчивости к определенным вредителям.
Некоторые исследователи обрабатывали проростки пшеницы фосфатом калия, и оказалось, что он вызывает устойчивость к тле. Diuraphis noxia, насекомое, которое нападает на эти растения.
После нанесения разбавленного раствора К3PO4 На проростках наблюдали меньшую выраженность симптомов, вызываемых этими насекомыми, и уменьшение количества питающихся ими тлей.
В медицинских приложениях
Фосфат калия используется для изменения анестезирующего действия лидокаина, местного анестетика. Местный анестетик — это лекарство, которое при нанесении на определенную область тела вызывает потерю чувствительности к боли в этой области.
Было обнаружено, что K3PO4 позволяет продлить местную анестезию лидокаином.
Как слабительное
Фосфат калия увеличивает текучесть кишечного содержимого, поскольку он помогает удерживать воду в кишечнике, что косвенно вызывает сокращение кишечной мышцы.
В ветеринарии
K3PO4 Он используется у животных с диабетическим кетоацидозом (осложнение диабета) для лечения гипофосфатемии (слишком мало фосфата в крови).
Однако при чрезмерном приеме он может вызвать гипокальциемию (низкий уровень кальция в крови), гиперфосфатемию (избыток фосфата в крови), непроизвольное сокращение мышц, минерализацию мягких тканей и почечную недостаточность.
При получении ДНК
Фосфат калия используется в качестве буфера для очистки ДНК в генетических лабораториях.
ДНК — это белок, содержащийся в клетках и содержащий всю генетическую информацию, необходимую для развития и функционирования живых существ.
Выделяя ДНК, ученые углубляются в изучение того, как передаются унаследованные признаки, поэтому фосфат калия очень полезен.
В различных приложениях
Калий K фосфат3PO4 это служит:
- как диетическая добавка,
- для замены электролита,
- как буфер, то есть как химическая система, позволяющая контролировать уровень ионов ОН– или водород H+ в водном растворе,
- для замедления или подавления кариеса,
- как ингибитор коррозии и противообрастающий агент,
- в качестве средства для обработки поверхности и покрытия,
- как антифриз,
- в чистящих средствах.
Отрицательный аспект для использования в сельском хозяйстве
Некоторые исследователи обнаружили, что добавление K3PO4 микрокультура риса увеличивает выброс метана (CH4) в атмосферу. Метан — это газ, который способствует парниковому эффекту и повышает температуру на нашей планете.
Ссылки
- НАС. Национальная медицинская библиотека. (2019). Фосфат калия. Получено с pubchem.ncbi.nlm.nih.gov.
- Panciera, D.L. (2012). Гидравлическая терапия при эндокринных и метаболических нарушениях. Добавки с фосфором. При расстройствах жидкости, электролита и кислотно-щелочного баланса в практике мелких животных (четвертое издание). Восстановлено с sciencedirect.com.
- Шенави-Халил, С. и др. (2012). Синтез ацетиленов дегидробромированием с использованием твердого безводного фосфата калия в качестве основания в условиях фазового переноса. Письма о тетраэдрах, том 53, выпуск 18, 2012 г., страницы 2295-2297. Восстановлено с sciencedirect.com.
- Guan, G. et al. (2009). Трикалия фосфат как твердый катализатор для производства биодизеля из отработанного кулинарного жира. Технология переработки топлива, Том 90, Выпуск 4, 2009 г., страницы 520-524. Восстановлено с sciencedirect.com.
- Кульками, М.А. (2012). Механистический подход к быстрому синтезу α-гидроксифосфонатов без использования растворителей с использованием фосфата калия в качестве катализатора. Comptes Rendus Chimie, том 16, выпуск 2, 2013 г., страницы 148-152. Восстановлено с sciencedirect.com.
- Venter, E. et al. (2014). Фосфат калия вызывает толерантность к российской пшеничной тле (Diuraphis noxia, Homoptera: Aphididae) в пшенице. Crop Protection Vol 61, июль 2014 г., страницы 43-50. Восстановлено с sciencedirect.com.
- Бонтури, Н. и др. (2013). Цитрат натрия и фосфат калия в качестве альтернативных адсорбционных буферов при гидрофобной и ароматической тиофильной хроматографической очистке плазмидной ДНК от нейтрализованного лизата. Журнал хроматографии B, тома 919-920, 2013, страницы 67-74. Восстановлено с sciencedirect.com.
- Конрад, Р. и Клозе, М. (2005). Влияние калийно-фосфорных удобрений на производство и выбросы метана и его 13C-стабильный изотопный состав микромира риса. Биология и биохимия почвы, том 37, выпуск 11, 2005 г., страницы 2099-2108. Восстановлено с sciencedirect.com.
- Лиде, Д. (редактор) (2003). CRC Справочник по химии и физике. 85th CRC Press.
- Smokefoot. (2019). Фосфат калия. Восстановлено с en.wikipedia.org

Особенности добавки, физические и химические свойства
ГОСТом 31687-2012 закреплено общепринятое название данной пищевой добавки – калия фосфаты. В международной классификации она наиболее известна, как Е340. К другим наименованием данного вещества относятся: Potassium phosphates – международное название, ортофосфаты калия, монофосфаты калия пищевые, калий фосфорнокислый, Monokaliumphosphat – немецкое название, phosphate de monopotassium – французское имя.
Такое вещество относится к группе антиоксидантов и представляет собой соли калия и ортофосфорной кислоты. Эта синтетическая добавка получается при реакции ортофосфорной кислоты с хлоридом калия или его карбонатом. После этого происходит ее очистка и кристаллизация, либо выпаривание.
Существует три разновидности фосфатов калия: 1-замещенный калий фосфорнокислый Е340 (I) с молекулярной формулой KH2PO4, ортофосфат калия 2-замещенный Е340 (II) водной и безводной формы с химическими формулами K2HPO4 и K2HPO4-H2O соответственно, и фосфат калия 3-замещенный Е340 (III), обладающий молекулярной формулой K3HPO4. Причем последняя форма практически не используется при производстве продуктов питания.
Фосфаты калия обычно обладают белым цветом, кристаллической, порошкообразной или гранулированной формой. В некоторых ипостасях способны хорошо впитывать в себя влагу из воздуха, хорошо растворяются в воде, но практически не растворимы в этаноле и других жидкостях. Данная пищевая добавка не имеет запаха, но обладает кисловатым привкусом.
Чаще всего применяется данное вещество в качестве эмульгатора, стабилизатора и регулятора кислотности. Также зачастую его используют как фиксатор цвета и влагоудерживающего элемента.
Основные производители и расфасовка продукта
Производят данную пищевую добавку Е340 как в России, так и за рубежом. В Российской Федерации выпуском такого синтетического вещества занимается ОАО «Реатэкс», зарегистрированное в Москве и основанное на базе опытного завода имени Костандова в 1929 году.
Из зарубежных представителей можно выделить китайскую компанию из города Дзянгин Mingzhi Phosphate Chemical Co Ltd.
Независимые эксперты из экологической группы «Кедр» считают фосфаты калия вредными канцерогенами, хотя официальные источники опровергают эту информацию. По мнению Минздрава и СанПиН пищевая добавка Е340 является безопасной для жизни и здоровья человека.

- пропитанные, или же непропитанные многослойные бумажные пакеты;
- мешки для продуктов;
- другая упаковка: навивные картонные барабаны.
Перед упаковыванием такую пищевую добавку расфасовывают в полиэтиленовые водонепроницаемые мешки. Максимальный вес мешков с фосфатами калия составляет двадцать пять килограмм.
Использование фосфатов калия
Разрешена пищевая добавка Е340 к употреблению не только в Российской Федерации, а также в странах Евросоюза, Соединенных Штатах Америки, Австралии, Канаде и Великобритании.
Максимально безопасной дозой вещества является семьдесят миллиграммов продукта в сутки на каждый килограмм человеческого веса.
Применяются ортофосфаты калия в тех же качествах, что и фосфаты натрия, активно проявляя свои антиоксидантные свойства, усиливая при этом действия других антиокислителей.
Фосфаты калия применяются для производства различных продуктов питания, при этом демонстрируя различные свойства:
- для ликеров, кондитерских изделий и газированных безалкогольных напитков, таких как спрайт, фанта, пепси-кола, добавка Е340 является усилителем вкуса и регулятором кислотности;
- для овощей зеленого окраса, особенно тех, которые подвергаются воздействию высоких температур, используется как стабилизатор цвета;
- при изготовлении сахара проявляет свойства осветлителя и отбеливателя;
- при пастеризации и стерилизации молока используется как стабилизатор, повышая их термоустойчивые качества;
- при изготовлении плавленого сыра применяется в качестве соли-плавителя;
- востребован как отвердитель при консервации фруктов и овощей;
- применяется как источник калия в жидких дрожжах, закваске для приготовления ржаного хлеба, а также в напитках, предназначенных для спортивного питания;
- в сахарной пудре, яичном порошке, сухих сливках и других похожих на них продуктах, используется в качестве разрыхлителя;
- проявляет влагоудерживающие и связующие свойства при изготовлении мясного и рыбного фаршей, различных колбас;
- в производстве мороженого выступает как эмульгатор.

В составе продуктов обычно содержится не больше тридцати граммов данного вещества.
Используется добавка Е340 и в других сферах промышленности:
- фармацевтической – в составе различных лекарственных препаратов;
- бытовой химии – компонент шампуней, мыл и других моющих жидкостей, а также для смягчения воды;
- косметической – входит в состав зубных паст;
- микробиологической – применяется в выращивании грибов плесени, для последующего производства пенициллина;
- при получении каучука – компонент электролитов при эмульсионной полимеризации;
- при производстве удобрений.
Полезные и опасные свойства пищевой добавки Е340
Опасна или полезна такая добавка определенно сказать невозможно. Она настолько же вредна, насколько и безопасна. Для человеческого организма в нормальных дозах ее употребление не вызовет никаких отклонений, в то время как превышение нормы приводит к неприятным для здоровья последствиям.
Фосфаты калия намного мягче, чем другие представители данной подгруппы воздействуют на слизистые оболочки кишечника и желудка. При умеренном потреблении способствует регулированию кислотно-щелочного баланса в организме. В то же время ее переизбыток в нем ведет к разрушению полезной микрофлоры кишечника, расстройствам желудочно-кишечного тракта, диарее.
Пищевая добавка Е340 обладает мочегонным эффектом, нормализует водно-солевой баланс в организме, стабилизирует артериальное давление, улучшает работу сердечно-сосудистой системы.
Соотношение кальция и фосфора в организме составляет где-то 2 к 1. Они взаимосвязаны друг с другом и находятся оба в большом количестве в костях и зубах. Давно известно разрушительное воздействие на зубную эмаль ортофосфорной кислоты. Ее же калийные соли, наоборот, предотвращают развитие кариеса и способствуют укреплению костей.
Однако нарушение баланса кальция и фтора, при увеличении первого, часто является причиной остеопороза. Ученые университета штата Иллинойс в Америке связывают сильную хрупкость костей у детей и подростков с употреблением ими повышенных доз пепси-колы или других сладких газированных напитков. А в этих продуктах содержание фосфатов значительно велико.
Также злоупотребление данной пищевой добавкой и отклонение ее норм в большую сторону приводит к образованию атеросклеротических бляшек, за счет повышения уровня холестерина в крови. Это в свою очередь является причиной возникновения почечной недостаточности и инфарктов.
В заключение
Фосфаты калия – это синтетическая пищевая добавка, выступающая в качестве стабилизатора, эмульгатора, отбеливателя и антиоксиданта при производстве продуктов питания. На упаковках тех продуктов, в состав которых она входит, находится маркировка Е340. Данное вещество не считается опасным для здоровья человека и в допустимых дозах даже приносит пользу. Но ее злоупотребление чревато неприятными негативными последствиями, особенно в детском и подростковом возрасте. Не стоит переусердствовать сладкими газированными напитками и быстрорастворимым кофе, в которых фосфатов калия содержится очень большое количество.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Фосфат калия
Характеристики и физические свойства фосфата калия
Фосфат калия образует кристаллогидраты различного состава: K3PO4×nH2O, где n = 1½, 3, 7, 9 и т.д.
Рис. 1. Фосфат калия. Внешний вид.
Основные характеристики фосфата калия приведены в таблице ниже:
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Растворимость в воде (20 o С), г/100 мл
Получение фосфата калия
Лабораторные способы получения фосфата калия предполагают действие ортофосфорной кислоты на соли калия (1) или гидроксид калия (2):
Химические свойства фосфата калия
Фосфат калия – это средняя соль, образованная сильным основанием – гидроксидом калия (KOH) и слабой кислотой – ортофосфорной (H3PO4). В водном растворе гидролизуется. Гидролиз протекает по аниону (теоретически возможны вторая и третья ступень). Наличие анионов ОН — свидетельствует о щелочном характере среды.
3K + + PO4 3- + HOH ↔ HPO4 2- + 3K + + OH — ;
Для фосфата калия характерны все свойства солей:
— взаимодействие с сильными минеральными кислотами
— взаимодействие с солями, в результате которого одним из продуктов реакции является нерастворимое в воде соединение
— разложение при нагревании
Применение фосфата калия
Фосфат калия нашел применение во многих отраслях народного хозяйства. Так, его используют в мыловарении в качестве одного из компонентов жидких моющих средств; в пищевой промышленности фосфат калия известен как добавка Е340, выступающая как регулятор кислотности, стабилизатор и влагоудерживающий агент.
Примеры решения задач
Рассчитаем количество вещества фосфата калия (молярная масса – 212 г/моль):
Согласно уравнению реакции n(K3PO4) :n(P2O5) = 2:1 . Тогда количество моль оксида фосфора (V) будет равно:
Найдем массу образовавшегося оксида фосфора (V) (молярная масса – 284 г/моль):
Рассчитаем количество вещества фосфата калия (молярная масса – 212 г/моль):
Согласно уравнению реакции n(K3PO4) :n(Li3PO4) = 2:2 . Тогда количество моль фосфата лития будет равно:
Найдем массу образовавшегося фосфата лития (молярная масса – 94 г/моль):
Пищевая добавка E 340: чашечка кофе с фосфатами калия
Рекламные ролики взахлеб рассказывают о чарующем аромате растворимого кофе.
Если бы производители честно указали на упаковке состав продукта, на первое место надо было бы поставить пищевую добавку E 340. Именно этого вещества в напитке едва ли не больше, чем кофейных зерен.
Название продукта
Название вещества калия фосфаты закреплено в ГОСТ 31687-2012.
В европейскую кодификацию добавок антиоксидант внесен под индексом Е 340 (Е–340).
Международный синоним — Potassium phosphates.
- пищевые монофосфаты калия;
- ортофосфат калия;
- калий фосфорнокислый;
- Monokaliumphosphat (немецкие);
- phosphate de monopotassium (французские).
Тип вещества
Пищевая добавка входит в группу антиоксидантов (подгруппа фосфаты).
Калия фосфаты — это калиевые соли ортофосфорной кислоты. Под общим названием понимают:
- калий фосфорнокислый 1-замещенный E 340 (i), формула KH2PO4;
- 2-замещенный E 340 (ii), водная и безводная формы, формула K2HPO4 или K2HPO4∙H2O;
- 3-замещенный Е 340 (iii), водный и безводный, формула K3HPO4.
Последнюю форму в пищевой промышленности используют крайне редко.
Получают антиоксидант путем нейтрализации ортофосфорной кислоты карбонатом или хлоридом калия с заключительной очисткой и кристаллизацией (или выпариванием).
Добавка Е 340 является синтетической.
Стандартной упаковкой для калия фосфатов служат:
- трехслойные бумажные мешки (пропитанные или непропитанные);
- продуктовые мешки;
- альтернативная тара (например, картонные навивные баpaбаны).
Пищевая добавка должна быть предварительно помещена в мешок-вкладыш из полиэтилена.
Максимальный вес одной упаковочной единицы 25 кг.
Применение
Добавка E 340 разрешена к применению в России и странах ЕАЭС, США, Канаде, Австралии, Великобритании, государствах ЕС.
Безопасной суточной дозой считается 70 мг/кг веса человека.
Применение фосфатов калия аналогично фосфатам натрия (Е 339). Вещество предотвращает окисление и усиливает действие других антиоксидантов.
Читать еще: Кетчуп в рационе ребенка: польза и вред
Пищевую добавку Е 340 включают в состав различных продуктов благодаря широкому ряду технологических функций:
- регулятор кислотности, улучшитель вкуса в газированных напитках (пепси-кола, спрайт и подобные), ликерах, кондитерских изделиях;
- стабилизатор окраски в зеленых овощах, подвергающихся термической обработке, за счет поддержания нейтрального уровня pH (7–7,5 единиц);
- отбеливатель при производстве сахара;
- в пастеризованном и стерилизованном молоке для повышения устойчивости к нагреванию;
- соль-плавитель при изготовлении плавленых сыров;
- отвердитель в консервированных овощах, фруктах;
- источник калия в закваске для ржаного хлеба, жидких дрожжах, напитках для спортивного питания;
- разрыхлитель в сухих сливках, яичном порошке, сахарной пудре и подобных продуктах;
- связующий и влагоудерживающий агент в колбасах, фарше мясном и рыбном;
- эмульгатор при изготовлении мороженого.
В состав продуктов добавку Е 340 вводят в небольшом количестве (от 1 до 30 г).
Больше всего фосфатов калия в растворимом кофе и газированных напитках.
Другие области использования:
- косметическая (зубные пасты);
- фармацевтика (в составе лекарств для профилактики и лечения гипофосфатемии);
- микробиология (выращивание плесневых грибов для последующего получения пенициллина);
- производство удобрений;
- бытовая химия (жидкие моющие средства);
- производство каучуков (только Е 340(iii)).
Польза и вред
Однозначно признать добавку E 340 полезной или вредной нельзя. По степени воздействия на здоровье человека эти понятия стоят в одном ряду:
- Пищевая добавка Е 340 мягче действует на слизистую оболочку желудка, чем другие представители подгруппы. При употрeблении малой дозы может регулировать кислотно-щелочной баланс. Избыточное употрeбление вызывает диарею, разрушительно действует на микрофлору кишечника.
- Фосфаты калия имеют легкое мочегонное действие. За счет регулирования жидкости в тканях нормализуют артериальное давление, стабилизируют работу сердца и сосудов.
- В организме человека соотношение фосфора и кальция примерно 1:2. Оба макроэлемента находятся преимущественно в зубах и костях и функционально связаны между собой. В отличие от ортофосфорной кислоты, разрушающей зубную эмаль, фосфаты калия препятствуют развитию кариеса. В то же время нарушение соотношения фтора и кальция в сторону увеличения первого, может спровоцировать развитие остеопороза. Американские ученые (университет штата Иллинойс) связывают хрупкость костей у подростков с употрeблением большого количества пепси-колы и подобных напитков. Именно в этих продуктах содержится больше всего синтетических фосфатов.
Превышение допустимой нормы потрeбления добавки E 340 провоцирует образование кальциевых бляшек на стенках сосудов, повышает риск инфарктов и почечной недостаточности.
Основной источник ликопина — красные томаты и томатная паста. Подробнее об этом пищевом красителе читайте здесь.
Ищите вкусное и полезное мороженое? Читайте нашу статью, здесь описан очень хороший вариант.
Основные производители
В России на производстве фосфатов калия и других солей ортофосфорной кислоты специализируется ОАО «Реатэкс» (г. Москва). Предприятие было создано на базе Опытного завода имени Л. Костандова, основанного в 1929 году.
Из зарубежных производителей ключевым игроком на рынке пищевых фосфатов калия, соответствующих стандарту ЕС, является китайская компания Mingzhi Phosphate Chemical Co., Ltd. (г. Дзянгин).
Специалисты группы «Кедр» (независимая экологическая экспертиза) считают пищевую добавку Е 340 канцерогеном.
Официальных данных на этот счет нет. СанПин и Минздрав признают добавку полностью безопасной.
Пока ведутся споры, потребителю стоит позаботиться о здоровье. От утренней чашечки кофе отказываться не стоит (желательно выбрать натуральный продукт!). А вот газированные напитки из рациона лучше исключить.
Фосфат калия
Средняя соль ортофосфорной кислоты H3PO4 и гидроксида калия KOH. Пищевая добавка с индексом Е340, принадлежит к группе эмульгаторов, регуляторов pH и веществ против слеживания.
Читать еще: 8 простых правил похудения после родов без вреда ребенку
Синонимы
Ортофосфат калия, трикалийфосфат, калий фосфорнокислый
Формула
Свойства фосфата калия
Физические свойства
Химические свойства
- В водных растворах гидролизуется по аниону:
Раствор имеет щелочную реакцию.
- При взаимодействии с кислотами образует кислые соли:
- Вступает в реакции обмена с образованием нерастворимых фосфатов:
Последняя реакция является качественной реакцией на растворимые фосфаты щелочных металлов и аммония. При добавлении раствора нитрата серебра AgNO3 выпадает осадок фосфата серебра Ag3P04 желтого цвета. А калий можно определить окрашиванию пламени в фиолетовый цвет.
Получение фосфата калия
Лабораторные способы получения
Фосфат калия получают взаимодействием фосфорной кислоты с гидроксидом или карбонатом калия:
Получение фосфата калия в промышленности
В промышленности фосфат калия получают в два этапа.
Сначала взаимодействием поташа K2CO3 с фосфорной кислотой H3PO4 получают гидрофосфат калия K2HP04:
а затем взаимодействием едкого кали KOH с полученным гидрофосфатом калия K2HP04 получают фосфат калия K3PO4:
После охлаждения нейтрализованных растворов до 34°С фосфат калия кристаллизуется в виде K3PO4·7H2O. Он плавится при 47,5°С. Чтобы получить безводный фосфат калия, кристаллогидрат прокаливают при температуре выше 250°С.
Применение
Фосфат калия в быту используют как составную часть жидкого мыла и других чистящех средств, так как он прекрасно отмывает жир и смягчает воду, переводя соли жесткости в нерастворимые фосфаты:
Фосфат калия добавляют в зубную пасту. В медицине фосфат калия применяют как вспомогательное вещество для предотвращения слеживания порошков.
В пищевой промышленности он известен как пищевая добавка Е340(iii). Фосфат калия используют в качестве эмульгатора, стабилизатора, влагоудерживающего агента. Добавляют его в газированные напитки, растворимый кофе, плавленные сыры и хлебобулочные изделия, правда чаще применяют гидрофосфат (пищевая добавка Е340(i)) и дигидрофосфат калия (пищевая добавка Е340(ii)).
Пример решения задачи
Сколько фосфата калия получится при реакции 200 г гидрофосфата калия с едким кали?
Ортофосфат калия
Ортофосфат калия — неорганическое соединение, соль щелочного металла калия и ортофосфорной кислоты с формулой K3PO4, бесцветные гигроскопичные кристаллы, растворимые в воде, образует кристаллогидраты.
Содержание
- Нейтрализация избытком гидроксида или карбоната калияортофосфорной кислоты:
- Действием избытка гидроксида калия на кислые фосфаты калия:
Физические свойства
Ортофосфат калия образует бесцветные гигроскопичные кристаллы кубической сингонии, прострaнcтвенная группа F m3, параметры ячейки a = 0,811 нм, Z = 4.
Хорошо растворяется в воде, водный раствор имеет сильнощелочную реакцию из-за гидролиза по аниону.
Не растворяется в этаноле.
Образует кристаллогидраты вида K3PO4•n H2O, где n = 1½, 3, 7, 9, которые плавятся в кристаллизационной воде при 203, 156,5, 47,5 и -6,6°С соответственно.
Химические свойства
- Кристаллогидрат теряет воду при нагревании в вакууме:
- Раствор имеет сильнощелочную реакцию и реагирует с алюминием:
- Вступает в обменные реакции:
Применение
- Применяется как компонент жидких моющих средств (мыл, шампуней) для умягчения воды.
- Как компонент электролитов при получении каучуков методом эмульсионнойполимеризации.
- Регулятор кислотности, эмульгирующая соль, влагоудерживающий агент, стабилизатор, синергист антиоксидантов, питание для дрожжей.
- Пищевая добавка Е340.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М .: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л. : Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М .: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0
Wikimedia Foundation . 2010 .
Смотреть что такое «Ортофосфат калия» в других словарях:
третичный ортофосфат калия — ортофосфорнокислый калий … Cловарь химических синонимов I
Читать еще: Борщ вегетарианский
Ортофосфат хрома(III) — Общие Систематическое наименование Ортофосфат хрома(III) Традиционные названия Фосфорнокислый хром Химическая формула CrPO4 Физические свойства … Википедия
Ортофосфат меди(II) — Ортофосфат меди(II) … Википедия
Ортофосфат марганца(II) — Общие Систематическое наименование Ортофосфат марганца(II) Традиционные названия Фосфорнокислый марганец Химическая формула Mn3(PO4)2 Физические свойства … Википедия
Ортофосфат свинца(II) — Общие Систематическое наименование Ортофосфат свинца Традиционные названия Фосфорнокислый свинец Химическая формула Pb3(PO4)2 Физические свойства … Википедия
Дихромат калия — У этого термина существуют и другие значения, см. хромпик. Дихромат калия … Википедия
Перманганат калия — Перманганат калия … Википедия
Манганат калия — Общие Систематическое наименование Манганат калия Химическая формула K2MnO4 Эмпирическая формула K2MnO4 Физические свойства … Википедия
Купрат(III) калия — Общие Систематическое наименование Купрат(III) калия Химическая формула KCuO2 Физические свойства Состояние (ст. усл.) синие кристаллы … Википедия
Сульфат хрома(III)-калия — Общие … Википедия
Фосфаты калия — полезные реактивы для сельского хозяйства и промышленности
Фосфаты калия — неорганические вещества, соли ортофосфорной кислоты. Различают три основных вида:
1. ортофосфат калия, калий фосфорнокислый 3-замещенный K3PO4;
2. калий фосфорнокислый 2-замещенный K2HPO4;
3. калий фосфорнокислый 1-замещенный KH2PO4.
Все эти фосфаты получают химической реакцией ортофосфорной кислоты с гидроокисью калия или его карбонатом.
Внешний вид — мелкокристаллический прозрачный или белый порошок. Водорастворимый, практически не растворяется в этиловом спирте. Водный раствор имеет щелочную реакцию, наиболее сильную у ортофосфата.
Фосфаты калия образуют кристаллогидраты; вступают в химические реакции обменного типа, водные растворы реагируют с металлами. Нагревание кристаллогидратов приводит к их обезвоживанию.
Работа с порошкообразными фосфатами требует применения мер предосторожности, так как их пыль может вызывать раздражение кожи и слизистых оболочек. Работы с большими объемами вещества проводят в помещении, снабженном принудительной вентиляцией; работники должны использовать индивидуальные средства защиты. Лабораторные опыты лучше всего проводить в вытяжном шкафу.
Соли ортофосфорной кислоты играют большую роль в функционировании нашего организма. Они отвечают за метаболизм, обмен веществ, получение энергии, поддерживают правильный кислотно-щелочной баланс, важны для работы почек; участвуют в ферментативных реакциях. Легко всасываются и выводятся. Но передозировка может вызвать диарею.
Применение
• Для производства высококачественных, водорастворимых, легко усваиваемых растениями удобрений, богатых калием и фосфором. Особенно эффективны фосфаты на кислых почвах. Входят в состав регуляторов роста растений, средств для проращивания семян и увеличения урожайности, пестицидов.
• Для приготовления растворов для гидропоники.
• В пищепроме все фосфаты калия идут как пищевая добавка под кодом Е340. Ее используют как регулятор кислотности, влагоудерживающий агент, эмульгатор, стабилизатор, усилитель действия антиоксидантов. Она способствует сохранению зелеными овощами своей натуральной окраски при термообработке. Ее добавляют при изготовлении выпечки, молочных, мясных и рыбных продуктов, плавленых сыров, безалкогольных напитков, бульонов, соусов, растворимого кофе, для питания дрожжей и т.д. Применяется при выпуске пекарских порошков, спирта, лимонной кислоты, сахара, глутамата натрия, вина, крахмала, ферментных препаратов.
• В химпроме — компонент растворов для бурения, составов против коррозии, красителей. Используются для синтеза метафосфатов (солей метафосфорной кислоты), пирофосфатов (солей пирофосфорной кислоты), других солей калия.
• Умягчитель в моющих средствах, например в шампунях и мылах. Реагент против кариеса — в зубных пастах.
• Сырье в фармакологической промышленности, например в производстве стрептомицина.
• В медицинской практике — лекарство против гипофосфатемии.
• Калий фосфорнокислый однозамещенный используется в качестве буферного раствора.
• Входят в состав электролитов в производстве каучука.
• В радиоэлектронике применяются на предприятиях по производству сегнето- и пьезоэлектриков.
Важно знать родителям о здоровье:
FitoSpray для похудения (Фитоспрей)

05 01 2022 11:54:21
Фитостеролы в продуктах питания

04 01 2022 17:47:37
Фитотерапевт
Фитотерапевт Фитотерапевт Я, Ирина Гудаева — травница, массажист, ведущая семинаров по созданию натуральной косметики и курса « Практическое травоведение»…
03 01 2022 6:54:15
Fitvid

02 01 2022 20:22:33
Фониатр

30 12 2021 7:33:31
Форель

29 12 2021 12:35:36
Формула идеального веса
Формула идеального веса Калькулятор нормы веса Вес 65 кг относится к категории Норма для взрослого человека с ростом 170 см . Эта оценка основана на…
26 12 2021 20:52:14
Формулы расчета идеального веса

25 12 2021 12:35:13
Фосфатида аммонийные соли

24 12 2021 20:31:36
Фототерапия новорожденных

23 12 2021 19:11:50
Фототерапия новорожденных при желтухе
22 12 2021 12:36:13
Французская диета

21 12 2021 9:38:50
Фрукт Кумкват — что это такое?

20 12 2021 1:55:19
Фруктовая диета

18 12 2021 6:51:17
Фруктоза при диабете
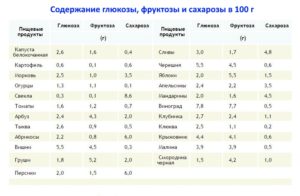
15 12 2021 20:16:54
Фрукт свити – польза и вред

12 12 2021 9:58:49
Фрукты и ягоды

11 12 2021 18:15:49
Фтизиатр
09 12 2021 23:34:56
Фтор в организме человека

08 12 2021 1:10:53
Боли в спине после рождения ребёнка

05 12 2021 0:21:45
Фунчоза: польза и вред

04 12 2021 3:46:12
Фундук

03 12 2021 8:47:44
Галактоза

29 11 2021 8:12:44
Галанга

28 11 2021 8:22:34
Галега лекарственная

27 11 2021 4:10:40
Боли в суставах при беременности
24 11 2021 17:12:23
Гастрит и изжога

23 11 2021 2:24:14
Где находится ключица у человека на фото?
20 11 2021 18:50:35
Еще:
Родителям -1 :: Родителям -2 :: Родителям -3 :: Родителям -4 :: Родителям -5 :: Родителям -6 :: Родителям -7 :: Родителям -8 :: Родителям -9 :: Родителям -10 :: Родителям -11 :: Родителям -12 :: Родителям -13 :: Родителям -14 :: Родителям -15 :: Родителям -16 :: Родителям -17 :: Родителям -18 :: Родителям -19 :: Родителям -20 :: Родителям -21 :: Родителям -22 :: Родителям -23 :: Родителям -24 :: Родителям -25 :: Родителям -26 :: Родителям -27 :: Родителям -28 :: Родителям -29 :: Родителям -30 :: Родителям -31 :: Родителям -32 :: Родителям -33 :: Родителям -34 :: Родителям -35 :: Родителям -36 :: Родителям -37 :: Родителям -38 :: Родителям -39 :: Родителям -40 :: Родителям -41 :: Родителям -42 :: Родителям -43 :: Родителям -44 :: Родителям -45 :: Родителям -46 :: Родителям -47 :: Родителям -48 :: Родителям -49 :: Родителям -50 :: Родителям -51 :: Родителям -52 :: Родителям -53 :: Родителям -54 :: Родителям -55 :: Родителям -56 :: Родителям -57 :: Родителям -58 :: Родителям -59 :: Родителям -60 :: Родителям -61 :: Родителям -62 :: Родителям -63 :: Родителям -64 :: Родителям -65 :: Родителям -66 :: Родителям -67 :: Родителям -68 :: Родителям -69 :: Родителям -70 :: Родителям -71 :: Родителям -72 :: Родителям -73 :: Родителям -74 :: Родителям -75 :: Родителям -76 :: Родителям -77 :: Родителям -78 :: Родителям -79 :: Родителям -80 :: Родителям -81 :: Родителям -82 :: Родителям -83 :: Родителям -84 :: Родителям -85 :: Родителям -86 :: Родителям -87 :: Родителям -88 :: Родителям -89 :: Родителям -90 :: Родителям -91 :: Родителям -92 :: Родителям -93 :: Родителям -94 :: Родителям -95 :: Родителям -96 :: Родителям -97 :: Родителям -98 :: Родителям -99 :: Родителям -100 :: Родителям -101 :: Родителям -102 :: Родителям -103 :: Родителям -104 :: Родителям -105 :: Родителям -106 :: Родителям -107 :: Родителям -108 :: Родителям -109 :: Родителям -110 :: Родителям -111 :: Родителям -112 :: Родителям -113 :: Родителям -114 :: Родителям -115 :: Родителям -116 :: Родителям -117 :: Родителям -118 :: Родителям -119 :: Родителям -120 ::
Оставить комментарий (facebook):
Комментировать через ВКонтакте:

