фосфат кальция неорганическая и третичная соль, химическая формула которой Ca3(РО4)2. Формула утверждает, что состав этой соли составляет 3: 2 для кальция и фосфата, соответственно. Это можно увидеть непосредственно на нижнем изображении, где показан катион Ca2+ и анион ПО43-. На каждые три КА2+ Есть два ПО43- взаимодействуя с ними.
С другой стороны, фосфат кальция относится к ряду солей, которые варьируются в зависимости от соотношения Ca / P, а также от степени гидратации и pH. На самом деле существует много типов фосфатов кальция, которые существуют и могут быть синтезированы. Однако, буквально следуя номенклатуре, фосфат кальция относится только к трикальцию, упомянутому выше..
Все фосфаты кальция, включая Са3(РО4)2, Они однотонные с легкими сероватыми тонами. Они могут быть зернистыми, мелкими, кристаллическими и иметь размеры частиц около микрометров; и даже были получены наночастицы этих фосфатов, с помощью которых были разработаны биосовместимые материалы для костей..
Эта биосовместимость связана с тем, что эти соли находятся в зубах и, короче, в костных тканях млекопитающих. Например, гидроксиапатит представляет собой кристаллический фосфат кальция, который, в свою очередь, взаимодействует с аморфной фазой той же соли.
Это означает, что существуют аморфные и кристаллические фосфаты кальция. По этой причине разнообразие и множество вариантов не удивительны при синтезе материалов на основе фосфатов кальция; материалы, свойства которых исследователи интересуются каждый день во всем мире, чтобы сосредоточиться на восстановлении костей.
индекс
- 1 Структура фосфата кальция
- 1.1 Аморфный фосфат кальция
- 1.2 Остальная часть семьи
- 2 Физические и химические свойства
- 2.1 Имена
- 2.2 Молекулярный вес
- 2.3 Физическое описание
- 2.4 Вкус
- 2.5 Точка плавления
- 2.6 Растворимость
- 2.7 Плотность
- 2.8 Показатель преломления
- 2.9 Стандартная энтальпия тренировки
- 2.10 Температура хранения
- 2,11 рН
- 3 Обучение
- 3.1 Нитрат кальция и гидрофосфат аммония
- 3.2 Гидроксид кальция и фосфорная кислота
- 4 использования
- 4.1 В костной ткани
- 4.2 Биокерамические цементы
- 4.3 Врачи
- 4.4 Другое
- 5 ссылок
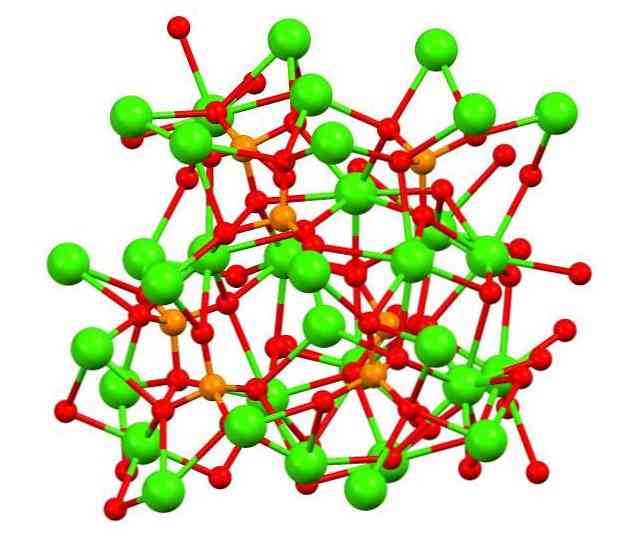
Структура фосфата кальция
Верхнее изображение показывает структуру трехосновного каликофосфата в странном минерале whitlockite, который может содержать магний и железо в качестве примесей.
Хотя на первый взгляд это может показаться сложным, необходимо уточнить, что модель предполагает ковалентное взаимодействие между атомами кислорода фосфатов и металлическими центрами кальция.
В порядке представления это действительно, однако, взаимодействия являются электростатическими; катионы Са2+ привлекаются к анионам ПО43- (Са2+— O-PO33-). Имея это в виду, понятно, почему на изображении кальций (зеленые сферы) окружен отрицательно заряженными атомами кислорода (красные сферы).
Когда есть так много ионов, это не оставляет симметричное расположение или образец видимым. Ca3(РО4)2 Принимает при низких температурах (Т3(РО4)2 (β-TCP, для его сокращения на английском языке).
С другой стороны, при высоких температурах он превращается в полиморф α-Ca3(РО4)2 (α-TCP), элементарная ячейка которого соответствует моноклинной кристаллической системе. При еще более высоких температурах также может образовываться полиморф α’-Ca3(РО4)2, который имеет гексагональную кристаллическую структуру.
Аморфный фосфат кальция
Кристаллические структуры были упомянуты для фосфата кальция, который следует ожидать от соли. Однако он способен демонстрировать неупорядоченные и асимметричные структуры, связанные в большей степени с типом «кальциево-фосфатного стекла», чем с кристаллами в строгом смысле его определения..
Когда это происходит, говорят, что фосфат кальция имеет аморфную структуру (ACP, аморфный фосфат кальция). Некоторые авторы указывают на этот тип структуры как ответственный за биологические свойства Ca3(РО4)2 в костных тканях, возможна его репарация и биомиметизация.
Благодаря выяснению его структуры с помощью ядерного магнитного резонанса (ЯМР) было обнаружено присутствие ионов ОН— и HPO42- в АШП. Эти ионы образуются при гидролизе одного из фосфатов:
ПО43- + H2О HPO42- + Огайо—
В результате истинная структура АШП становится более сложной, состав ее ионов которой представлен формулой: Ca9(РО4)6-х(HPO4)х(ОН)х. «Х» указывает на степень гидратации, так как если х = 1, то формула будет такой: Ca9(РО4)5(HPO4) (ОН).
Различные структуры, которые могут иметь PCA, зависят от молярных отношений Ca / P; то есть относительного количества кальция и фосфата, которые изменяют весь их результирующий состав.
Остальная часть семьи
На самом деле фосфаты кальция представляют собой семейство неорганических соединений, которые, в свою очередь, могут взаимодействовать с органической матрицей..
Другие фосфаты получают «просто» путем замены анионов, которые сопровождают кальций (ПО43-, HPO42-, H2ПО4—, Огайо—), а также тип примесей в твердом теле. Таким образом, до одиннадцати или более фосфатов кальция, каждый со своей структурой и свойствами, могут возникать естественным или искусственным путем..
Ниже приведены некоторые фосфаты и их соответствующие структуры и химические формулы:
-Водород кальций фосфат дигидрат, CaHPO4H 2H2O: моноклинный.
-Кальция дигидрофосфат моногидрат, Ca (H)2ПО4)2∙ H2O: триклиника.
-Безводный кислый фосфат, Ca (H)2ПО4)2: триклиника.
-Ocalcium гидрофосфат (OCP), Ca8H2(РО4)6: триклиника Является предшественником в синтезе гидроксиапатита.
-Гидроксиапатит, Ca5(РО4)3ОН: гексагональный.
Физико-химические свойства
имена
-Кальций фосфат
-Трикальцийфосфат
-Трикальций дифосфат
Молекулярный вес
310,74 г / моль.
Физическое описание
Это белое твердое вещество без запаха.
аромат
безвкусный.
Точка плавления
1670 ºK (1391 ºC).
растворимость
-Практически нерастворим в воде.
-Нерастворим в этаноле.
-Растворим в разбавленной соляной кислоте и азотной кислоте.
плотность
3,14 г / см3.
Показатель преломления
1629
Стандартная энтальпия тренировки
4126 ккал / моль.
Температура хранения
2-8 ºC.
pH
6-8 в водной суспензии 50 г / л фосфата кальция.
обучение
Нитрат кальция и гидрофосфат аммония
Существует множество способов получения или образования фосфата кальция. Одна из них состоит из смеси двух солей Ca (NO)3)2H 4H2О и (NH4)2HPO4, предварительно растворенный в абсолютном спирте и воде соответственно. Одна соль обеспечивает кальций, а другая фосфат.
Из этой смеси осаждается АСР, который затем подвергается нагреву в сушильном шкафу при 800 ° С и в течение 2 часов. В результате этой процедуры получается β-Ca3(РО4)2. При тщательном контроле температуры, перемешивания и времени контакта может происходить образование нанокристаллов.
Для образования полиморфа α-Ca3(РО4)2 необходимо нагревать фосфат выше 1000 ° С. Этот нагрев проводится в присутствии других ионов металлов, которые в достаточной степени стабилизируют этот полиморф, чтобы использовать его при комнатной температуре; то есть он остается в стабильном мета-состоянии.
Гидроксид кальция и фосфорная кислота
Фосфат кальция также может быть образован путем смешивания растворов гидроксида кальция и фосфорной кислоты с кислотно-щелочной нейтрализацией. После полдня созревания в маточных растворах и их надлежащей фильтрации, промывки, сушки и просеивания получают гранулированный порошок аморфного фосфата, ACP.
Это ACP продукт реакции высоких температур, превращающийся по следующим химическим уравнениям:
2CA9(HPO4) (ПО4)5(ОН) => 2Ca9(P2О7)0,5(РО4)5(ОН) + Н2О (при Т = 446,60 ° С)
2CA9(P2О7)0,5(РО4)5(ОН) => 3Ca3(РО4)2 + 0,5Н2О (при Т = 748,56 ° С)
Таким образом, β-Ca получается3(РО4)2, его наиболее распространенный и стабильный полиморф.
приложений
В костной ткани
Ca3(РО4)2 Это основная неорганическая составляющая костной золы. Это компонент трансплантатов для замены костей, что объясняется его химическим сходством с минералами, присутствующими в кости.
Кальцийфосфатные биоматериалы используются для исправления дефектов костей и при нанесении покрытий на протезы из титанового металла. Фосфат кальция осаждается на них, изолируя их от окружающей среды и замедляя процесс коррозии титана..
Фосфаты кальция, в том числе Ca3(РО4)2, Они используются для производства керамических материалов. Эти материалы являются биосовместимыми и в настоящее время используются для восстановления потери альвеолярного отростка в результате заболеваний пародонта, эндодонтических инфекций и других состояний..
Однако их следует использовать только для ускорения восстановления периапикальной кости в тех местах, где нет хронической бактериальной инфекции..
Фосфат кальция можно использовать при восстановлении костных дефектов, когда невозможно использовать аутогенный костный трансплантат. Его можно использовать отдельно или в сочетании с биоразлагаемым и рассасывающимся полимером, таким как полигликолевая кислота..
Биокерамические цементы
Кальцийфосфатный цемент (CPC) — еще одна биокерамика, используемая для восстановления костной ткани. Это сделано, смешивая порошок различных типов фосфатов кальция с водой, формируя пасту. Пасту можно вводить или подгонять к дефекту кости или полости.
Цементы формуются, постепенно рассасываются и заменяются новообразованной костью.
медицинская
-Ca3(РО4)2 Это основная соль, поэтому она используется в качестве антацида для нейтрализации избытка желудочной кислоты и повышения pH. В зубной пасте он обеспечивает источник кальция и фосфата для облегчения процесса реминерализации зубов и гемостаза кости.
-Он также используется в качестве пищевой добавки, хотя самый дешевый способ заменить кальций — это использовать его карбонат и цитрат..
-Фосфат кальция можно использовать при лечении тетании, скрытой гипокальциемии и поддерживающей терапии. Кроме того, это полезно в добавках кальция во время беременности и кормления грудью.
-Используется при лечении радиоактивных изотопов радиоактивного (Ra-226) и стронция (Sr-90). Фосфат кальция блокирует поглощение радиоактивных изотопов в пищеварительном тракте, тем самым ограничивая ущерб, наносимый ими.
другие
-Фосфат кальция используется в качестве корма для птиц. Кроме того, он используется в зубных пастах для контроля зубного камня.
-Он используется в качестве средства против слеживания, например, для предотвращения уплотнения поваренной соли.
-Работает как отбеливатель для муки. В то время как в свином сале предотвращается нежелательная окраска и улучшается состояние жарки.
ссылки
- Тунг М.С. (1998) Фосфаты кальция: структура, состав, растворимость и стабильность. В кн .: Амджад З. (ред.) Фосфаты кальция в биологических и промышленных системах. Спрингер, Бостон, Массачусетс.
- Лю Лангланг, Янзэн Ву, Чао Сюй, Сучунь Ю, Сяопэй Ву и Хунлянь Дай. (2018). «Синтез, характеристика нано-β-трикальцийфосфата и ингибирование клеток гепатоцеллюлярной карциномы», журнал Nanomaterials, vol. 2018, ID статьи 7083416, 7 страниц, 2018.
- Гребни, Христос и Рей, Кристиан. (2010). Аморфные фосфаты кальция: синтез, свойства и применение в биоматериалах. Acta Biomaterialia, vol. 6 (№ 9). стр. 3362-3378. ISSN 1742-7061
- Wikipedia. (2019). Трикальцийфосфат. Получено с: en.wikipedia.org
- Abida et al. (2017). Порошок трикальцийфосфата: подготовка, характеристика и способность к уплотнению. Средиземноморский журнал химии 2017, 6 (3), 71-76.
- PubChem. (2019). Кальций фосфат. Получено из: pubchem.ncbi.nlm.nih.gov
- Elsevier. (2019). Кальций фосфат. Наука Директ. Получено с: sciencedirect.com
Фосфат кальция содержится в больших количествах в костной ткани человека. Его много в молоке и других молочных продуктах. В то же время его можно найти в списке вредных пищевых добавок под номером Е341. Как такое возможно, действительно ли имеется в виду одно и то же вещество?
Проблему усложняет то, что под названием «фосфат кальция» подразумеваются как минимум три соединения. Существует много названий и терминов, принятых в их отношении. Одни названия чаще используют в химии, другие в медицине, третьи в пищевой промышленности. Как они связаны и чем отличаются, попытаемся разобраться в этой статье.
Общие сведения
Фосфат кальция – это соль, образованная кальцием и фосфорной кислотой. Представляет собой белый порошок, без запаха и вкуса, нерастворимый в воде. Он входит в состав костей и зубов человека в виде гидроксиапатита. Около 70% костей человека состоит из этого вещества. Зубная эмаль содержит 96% гидроксиапатита.
Фосфат кальция содержится в молоке и некоторых молочных продуктах. Поскольку он нерастворим, то находится в молоке в виде микроскопических взвешенных частиц. Он связан с молочным белком казеином и частично входит в его состав.
В пищевой промышленности используется как добавка Е341. Его применяют в качестве разрыхлителя, уплотнителя, регулятора кислотности. Впрочем, это применение основано не на полезных свойствах вещества, а на технологических. Нерастворимый в воде порошок хорошо структурирует продукты.
Получают это вещество синтетически, из фосфоритной муки и фосфорной кислоты. Другой способ получения – обработка фосфорной кислотой гашеной извести.
Разновидности и их названия
Фосфат кальция имеет три разновидности, у которых разные химические формулы и обозначения:
| Химическая формула | Химическое название | Технические названия | Обозначение в качестве пищевой добавки | Где применяется чаще всего |
| Са(H2PO4)2 | Дигидро-фосфат | Однозамещенный фосфат | Е341 i | Как удобрение. В составе биологически-активных добавок (БАД) |
| CaHPO4 | гидрофосфат | Двухзамещенный, дикальцийфосфат | Е341 ii | В медицине – зубные пасты, БАД. Как удобрение в сельском хозяйстве |
| Ca3(PO4)2 | фосфат | Трехзамещенный, трикальцийфосфат | Е341 iii | В животноводстве как подкормка |
Все эти три вещества применяются в качестве пищевых добавок. Все они выглядят примерно одинаково, представляют собой белые порошки, нерастворимые в воде. В кислой среде они, наоборот, хорошо растворяются, благодаря чему могут усваиваться человеком. Ведь в желудке содержится соляная кислота, которая создает высокую кислотность.
Польза
Фосфат кальция:
- Является хорошим источником кальция, требующегося для костей. В большом количестве содержится в молоке и молочных продуктах, вместе с белком казеином, с которым хорошо усваивается.
- Является источником фосфора, который нужен для нормальной работы мышц, требуется для синтеза белков и выполняет много важных функций в организме.
- Входит в состав зубной эмали и поэтому используется в зубных пастах. В основном в виде дикальцийфосфата CaHPO4. Это вещество также является мягким абразивом, то есть позволяет бережно очищать зубной налет, не повреждая эмали. Также в пастах используются его близкие аналоги глицерофосфат и гидроксиапатит.
- Препятствует слипанию и комкованию веществ в виде порошков, то есть является разрыхлителем. Поэтому его используют как пищевую добавку в производстве сухого молока, сухих сливок, хлебобулочных изделий.
- Применяется в производстве плавленых сыров как эмульгатор.
- Применяется в качестве минеральных удобрений в сельском хозяйстве как источник фосфора. В частности, дигидрофосфат с формулой Са(H2PO4)2 – основной компонент такого удобрения, как суперфосфат. А удобрение преципитат состоит из гидрофосфата с формулой CaHPO4.
- Входит в состав комбинированных кормов для животных. Чаще всего в виде трикальцийфосфата Ca3(PO4)2.
Вред
Фосфат кальция содержится в организме в больших количествах, поэтому не представляет большой опасности. В то же время распространена таблица вредных пищевых добавок, в которой добавка Е341 описана как вызывающая расстройства желудка. С чем это связано?
В природных продуктах, таких как молоко, фосфат кальция находится вместе с другими компонентами, с которыми легче усваивается. Если же потреблять много продуктов, куда его добавляют искусственно, он начинает не усваиваться, а накапливаться и зашлаковывать организм. В этом виде он способен:
- Ухудшать работу желудочно-кишечного тракта.
- Вызывать почечную недостаточность и почечно-каменную болезнь.
- Способствовать образованию излишков холестерина.
Избыток фосфора может образовываться в организме при употреблении большого количества мясных продуктов, особенно колбас. Фосфат кальция используют как антиоксидант при производстве колбасы, зачастую с нарушением технологий и в слишком большом количестве – для увеличения объема и веса товара.
Добавка Е341 присутствует в плавленых сырах, маргарине, сухих смесях на основе муки, сухом молоке и сливках.
Кроме того, избыток фосфатов возникает при увлечении фастфудом и полуфабрикатами.
Рекомендации к применению
Фосфат кальция применяется как биологическая добавка при нехватке кальция и фосфора. Рекомендуется при переломах костей, ломкости ногтей. Используют при таком заболевании как остеопороз. Добавки, содержащие это вещество и его аналоги, советуют принимать в период беременности и лактации.
Входит в состав таких препаратов, как фтизион, остеогенон и множества БАДов (например, Camosten, Arthromil). Чаще всего при этом используется дикальцийфосфат. Для полноценного усвоения этих добавок стоит придерживаться рекомендаций:
- Употреблять лучше натощак, до приема пищи.
- Кальций полноценно усваивается организмом в сочетании с витамином D, поэтому лучше употреблять препараты, которые содержат этот витамин. Если же используются другие, то витамин D стоит принять отдельно, за 1–2 часа до приема кальциевых препаратов.
- Противопоказания для приема – заболевания паращитовидных желез, мочекаменная болезнь, индивидуальная непереносимость.
Аналогами фосфата кальция являются гидроксиапатит и глицерофосфат (правда, они стоят несколько дороже). Также в качестве кальциевых добавок употребляют цитрат и карбонат этого металла, которые хорошо усваиваются, но не содержат фосфора. Глюконат кальция, популярный в качестве источника этого элемента, относится к плохо усваиваемым препаратам.
Вывод
Фосфат кальция не представляет вреда при поступлении с обычной пищей. Но продукты, содержащие его как пищевую добавку Е341, должны вызывать настороженность. При частом употреблении таких продуктов могут накопиться излишки этого вещества в организме, которые способны стать причиной расстройств желудка и привести к почечно-каменной болезни. В большом количестве фосфат зашлаковывает организм.
С другой стороны, это вещество полезно принимать в виде БАДов, особенно если есть проблемы с костями. Его также рекомендуют беременным и кормящим женщинам.