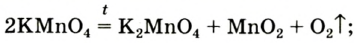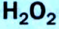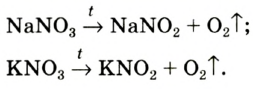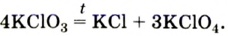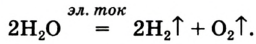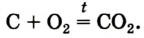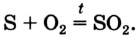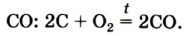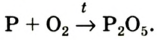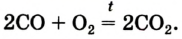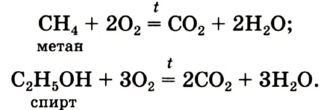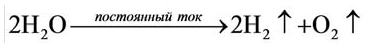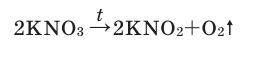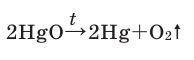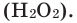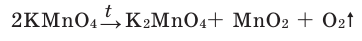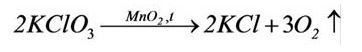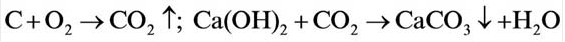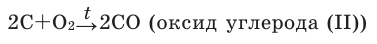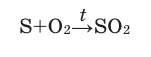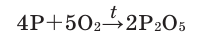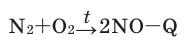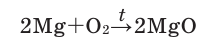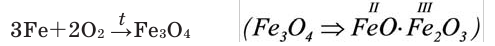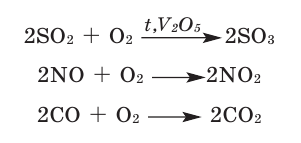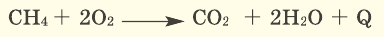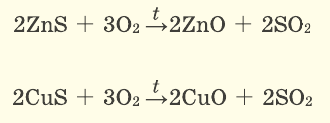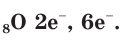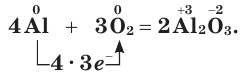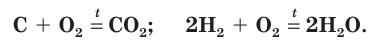Содержание:
- Воздух
- Средства защиты атмосферы
- Горение
- Медленное окисление
- Условия возникновения и прекращения горения
- Образование основных и кислотных оксидов
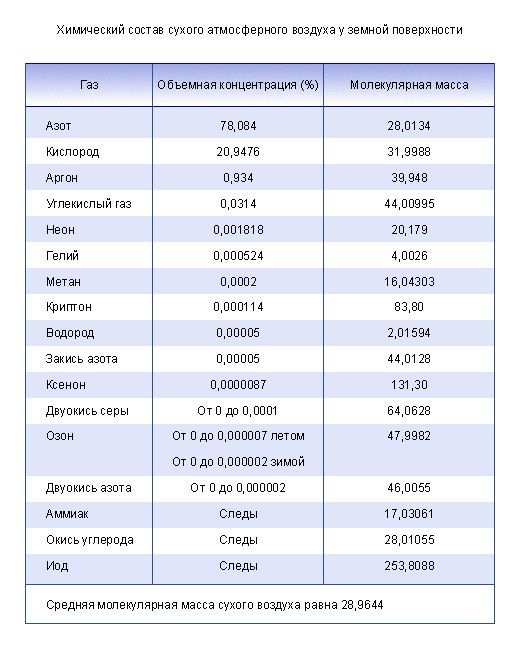
Химический состав. Воздух состоит из смеси примерно двадцати семи различных газов. Примерно на 99% — это смесь кислорода и азота. В составе оставшегося процента: водяной пар, углекислый газ, метан, водород, озон, инертные газы (аргон, ксенон, неон, гелий, криптон) и другие.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Воздух
Молекулярная и химическая формула воздуха, в основном азот N₂ и кислород О₂. Воздух – естественная смесь газов, образующая атмосферу Земли.
В 1774 г. французский ученый А. Лавуазье доказал, что воздух — это смесь в основном двух газов: азота и кислорода, содержание азота составляет 4/5 и 1/5 кислорода (по объему).
Качественный состав воздуха можно доказать посредством следующего опыта. Заполненный воздухом колокол опускают в воду. В железную ложечку помешают кусочек фосфора, его зажигают и вносят под колокол. При этом вода в колоколе поднимается на 1/5, так как при горении фосфора расходуется только кислород. Газ, оставшийся под колоколом — азот, он в реакцию не вступает (рис. 16).
Рис. 16. Сжигание фосфора пои колоколом: а — горение фосфора; б — уровень волы поднялся на 1/5 объема
В конце XIX в. было установлено, что в состав воздуха, кроме кислорода и азота, входят пять газообразных веществ: аргон (Аr), ксенон (Хе), криптон (Кг), гелий (Не), неон (Ne). Эти газы называются благородными из-за их химической неактивности.
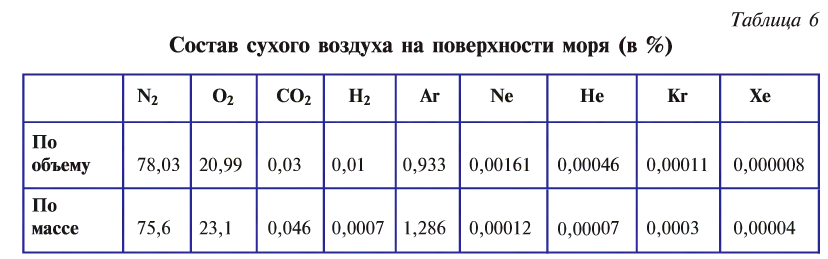
Кроме того, в воздухе содержатся оксид углерода (IV) и водяные пары. Примерный состав воздуха показан в табл. 6.
Антуан Лоран Лавуазье (1743—1794)
Французский ученый в 1774 г. установил состав воздуха, ввел понятия «химический элемент» и «химическое соединение». Лавуазье был автором первой классификации химических веществ и учебника «Элементарный курс химии».
Содержание углекислого газа (СО2) и водяных паров изменяется в зависимости от условий. Например, при сырой и теплой погоде в воздухе содержится больше водяных паров, а при сухой и прохладной — меньше. Процессы горения увеличивают долю оксида углерода (IV) и уменьшают содержание кислорода.
Таблица 6
Состав воздуха
| Составные части | Содержание газов (в %) | |
| по объему | по массе | |
| Азот | 78,08 | 75,50 |
| Кислород | 20,95 | 23,10 |
| Благородные газы (в основном аргон) | 0,94 | 1,30 |
| Оксид углерода (IV) | 0,03 | 0,046 |
В результате природных явлений и деятельности человека (при землетрясении, вулканических извержениях, при сгорании топлива и выбросах из заводских труб) в атмосферу поступают такие газы, как оксиды азота — NO и NO2, оксиды серы — SO2 и SO3, сероводород — H2S.
В настоящее время на долю автомобильного транспорта приходится больше половины всех вредных выбросов в окружающую среду, которые являются главным источником загрязнения атмосферы, особенно в мегаполисах. В среднем при пробеге 15 тыс. км в год каждый автомобиль сжигает 2 т топлива и около 26—30 т воздуха, в том числе 4,5 т кислорода, что в 50 раз больше потребностей человека.
Атмосферный воздух является одним из основных жизненно важных элементов окружающей среды.
Средства защиты атмосферы
Средства защиты атмосферы должны ограничивать наличие вредных веществ в воздухе на уровне не выше ПДК (предельно допустимой концентрации).
Для очистки газов от частиц широко применяют сухие пылеуловители — циклоны различных типов.
Один из наиболее совершенных видов очистки газов от взвешенных в них частиц пыли и тумана — электрическая очистка (электрофильтр).
Для высокоэффективной очистки выбросов применяют аппараты многоступенчатой очистки.
В крупных городах для снижения вредного влияния загрязнения воздуха на человека применяют специальные градостроительные мероприятия. Построены и строятся автомагистрали в обход городов, принявшие весь поток транзитного транспорта, который раньше нескончаемой лентой тянулся по городским улицам.
Предприятия или их отдельные здания и сооружения, технологические процессы которых являются источником выделения в атмосферный воздух неприятно пахнущих веществ, отделяют от жилой застройки санитарно-защитными зонами.
Для повышения эффективности санитарно-защитных зон на их территории высаживают древесно-кустарниковую и травянистую растительность, снижающую концентрацию промышленной пыли и газов.
Знаешь ли ты?
Атмосфера земного шара весит 5 300 000 000 000 000 т. Если бы, например, потребовалось перевезти из Астаны в Алматы груз, равный весу земной атмосферы, и если бы каждый поезд имел 100 вагонов и проходил весь путь за 10 ч, на перевозку этого груза было бы потрачено почти 4 млрд. лет.
Самое важное
В воздухе содержится (по объему) 78% азота, 21% кислорода, 1% инертных и других газов. Кроме вышеприведенных простых веществ, в составе воздуха находятся углекислым газ и водяные пары, содержание которых может изменяться в зависимости от условии.
Горение
В повседневной жизни мы часто наблюдаем, как горит такое топливо, как природный газ. дрова, уголь. Знаете ли вы, что горение происходит с участием кислорода, входящего в состав воздуха? Кислород при нагревании энергично реагирует со многими веществами, при этом выделяются теплота и свет. Такие реакции называются реакциями горения. При горении атомы простых веществ соединяются с атомами кислорода и образуются оксиды. Общая схема взаимодействия простых веществ с кислородом такова:
простое вещество + кислород = оксид
Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
Реакции взаимодействия веществ с кислородом называются окислением , а их продукты — оксидами.
Оксиды — это сложные вещества, которые состоят из двух элементов, один из которых кислород. При горении веществ в воздухе образуются те же продукты, т. е. оксиды. Однако горение веществ в воздухе происходит медленнее, чем в кислороде, так как последнего в воздухе содержится примерно в пять раз меньше.
Если опустить в сосуд с кислородом О2, тлеющий уголек (рис. 17а), то он раскаляется добела и сгорает, образуя оксид углерода (IV) СО2 (углекислый газ):
углерод — кислород = оксид углерода (IV)
Чтобы определить, какое образовалось вещество, в сосуд наливают известковую воду — она мутнеет. Это доказывает наличие углекислого газа.
В железную ложечку поместим кусочек серы и подожжем над пламенем спиртовки, затем внесем в сосуд с кислородом. Сера S горит в кислороде О2 ярким синим пламенем (рис. 17 б) с образованием газа с резким запахом оксида серы (IV) (опыт проводится под тягой):
сера + кислород = оксид серы (IV)
Фосфор Р сгорает в кислороде О2 ярким пламенем с образованием белого дыма, состоящего из твердых частиц оксида фосфора (V) (рис. 17 в):
фосфор + кислород = оксид фосфора (V)
В кислороде горят и такие вещества (рис. 17 г), которые обычно считают негорючими, например железо. Если к тонкой стальной проволоке прикрепить спичку, зажечь ее и опустить в сосуд с кислородом, то от спички загорится и железо. Горение железа происходит с треском и разбрасыванием ярких раскаленных искр — расплавленных капель железной окалины Fe3O4. Реакцию горения железа в кислороде можно выразить следующим уравнением:
| железо+кислород | железная окалина — (смесь оксидов железа) |
Другие металлы также могут взаимодействовать с кислородом, хотя эти реакции не всегда сопровождаются горением. Если сильно нагреть медь в кислороде, она, не сгорая, превратится в черный порошок — оксид меди (II):
| медь — кислород | оксид меди (II) |
Рис. 17. Горение в кислороде: а — угля; б — серы; в — фосфора; г — железа
Вам уже известно, что при горении простых веществ образуются оксиды, теперь выясним, как происходит горение сложных веществ. При горении парафиновой свечи в химическом стакане на его стенках появляются капельки воды. Если в стакан налить известковую воду, то она мутнеет, что доказывает наличие оксида углерода. Таким образом, при горении сложного вещества образовались оксиды тех элементов, которые входят в состав сложного вещества. Парафин состоит из двух элементов — углерода и водорода.
Медленное окисление
Если какое-либо вещество медленно реагирует с кислородом, то теплота выделяется постепенно. Такой процесс называется медленным окислением.
Это явление наблюдается довольно часто. Например, в процессе гниения (окисления) навоза выделяется теплота, которая может использоваться в парниках.
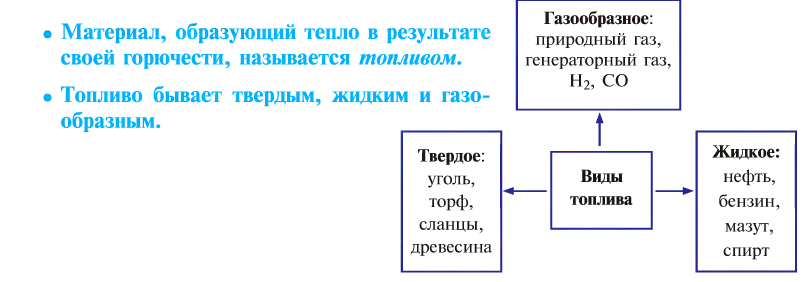
♦ Вещества, при горении которых выделяется большое количество теплоты, называют топливом. На практике используют топливо трех видов: твердое, жидкое и газообразное.
К твердому топливу относятся антрацит, каменный уголь, бурый уголь, торф и дрова; к жидкому — продукты переработки нефти: бензин, керосин, мазут и др.; к газообразному — природный и попутный нефтяной газы, а также другие промышленные газы.
Условия возникновения и прекращения горения
Огонь возникает, когда есть три составляющие (схема 5). Первая — это топливо, которым может служить дерево, бумага, спирт, газ и т. д Второе, что необходимо, — это кислород, который взаимодействует с топливом, результатом чего является горение. Третья необходимая составляющая — это тепло. Только нагретое до определенной температуры топливо будет гореть в воздухе. Для того чтобы погасить огонь, необходимо или перекрыть доступ кислорода, или максимально понизить температуру, или устранить источник возгорания (то, что горит).
При тушении огня на пламя направляют углекислый газ или пену, которые затрудняют доступ воздуха к горючему веществу. Небольшие очаги пожара можно потушить, накрыв их сверху брезентом или одеялом. Можно также использовать песок. Для тушения угля или горящей древесины используют воду. Она охлаждает их, а образующиеся водяные пары затрудняют доступ воздуха.
Схема 5
Самое важное
Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света. Горение веществ в воздухе происходит медленнее, чем в кислороде. При горении простых и сложных веществ образуются оксиды. Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород.
Образование основных и кислотных оксидов
Изучая горение серы, фосфора и железа, вы убедились, что металлы и неметаллы горят в воздухе, образуя оксиды. Для изучения свойств оксидов проделаем следующие опыты.
Опыт 1
В фарфоровую чашку помещаем немного свежепрокаленного оксида кальция СаО, (жженая известь), обливаем его водой. При этом выделяется большое количество теплоты, что свидетельствует о протекании химической реакции. В результате образуется рыхлый порошок гашеной извести, при растворении которого в воде получается мыльный на ощупь раствор. Изменение окраски лакмуса в синюю подтверждает об образовании основания. Схема реакции оксида кальция с водой следующая:
оксид кальция + вода 
Таким образом, оксидам металлов соответствуют основания. Растворимые основания называются щелочами .
Растворимые в воде основания изменяют цвет индикаторов*.
* Информация индикаторах дана в § 11.
Из этого можно заключить, что оксиды металлов являются основными оксидами.
Опыт 2
Наливаем в химический стакан немного горячей воды, добавляем несколько капель раствора фиолетового лакмуса и сжигаем над водой в металлической ложечке красный фосфор. Образовавшийся в виде белого дыма оксид фосфора постепенно растворяется в воде, и образуется фосфорная кислота. Это подтверждает изменение окраски лакмуса на красную. Как видим, оксидам неметаллов соответствует кислота. Таким образом, оксиды неметаллов являются кислотными оксидами. Схема реакции:
оксид фосфора (V) + вода 
Самое важное
При горении металлов образуется основной оксид. Основным оксидам соответствуют основания. Растворимые основания называются щелочами. При горении неметаллов образуются кислотные оксиды, им соответствуют кислоты. Существуют вещества, которые под действием кислот и щелочей изменяют свой цвет. Эти вещества называются индикаторами.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Содержание:
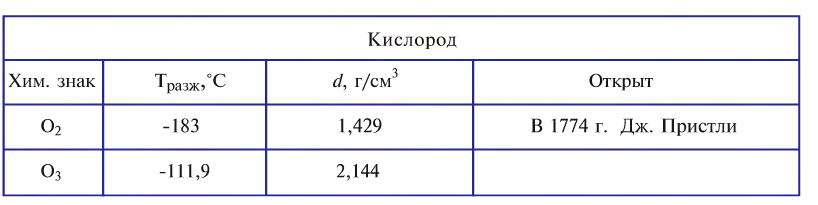
Кислород как химический элемент:
Кислород — самый распространенный элемент на Земле.
Дыхание, горение, многие процессы в живой и неживой природе, а также в технике протекают в присутствии кислорода как простого вещества.
Кислород, являясь самым распространенным элементом в земной коре, считается одним из самых необходимых элементов для жизнедеятельности на Земле.
Кислород был открыт в 1774 г. Дж. Пристли и независимо от него — К. Шееле, но как новое вещество его подробно охарактеризовал А. Лавуазье.
Название «кислород» предложено А. Лавуазье. По-латыни (oxygenium) оно означает «рождающий кислоты». Химическим знаком его была взята первая буква латинского названия. Порядковый номер кислорода в периодической системе — 8, а относительная атомная масса равна 15,9994
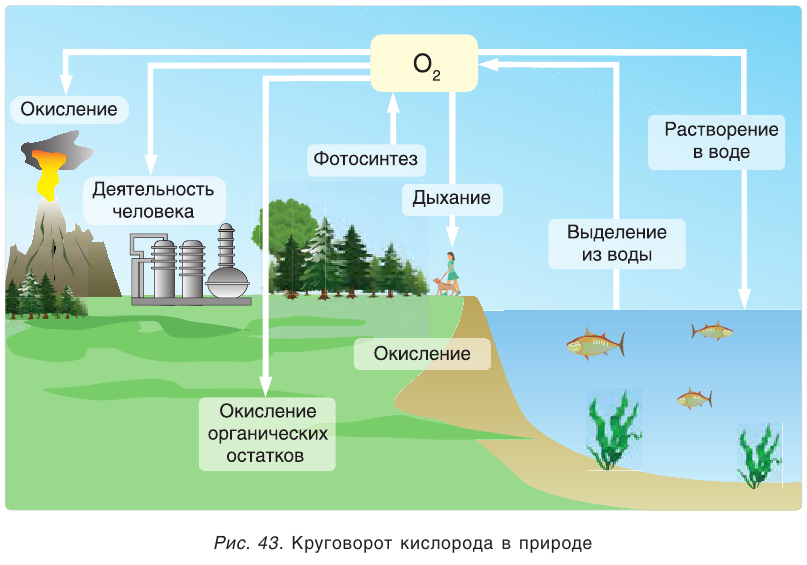
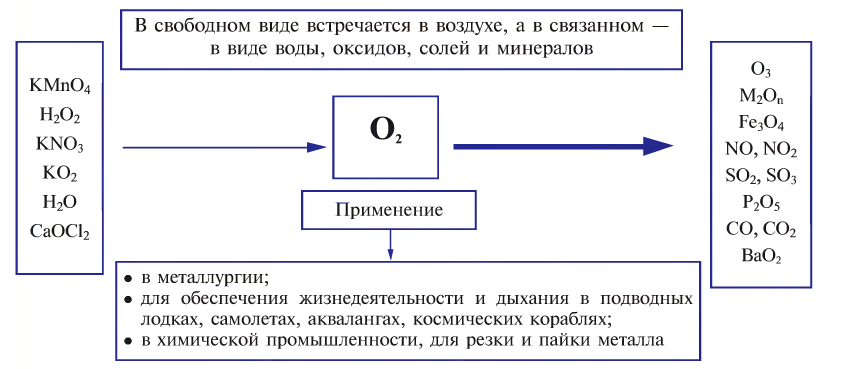
В свободном виде кислород встречается в атмосферном воздухе, а в связанном виде, т.е. в виде соединений, входит в состав воды, минералов и других веществ, составляющих горные породы, а также растительные и животные организмы. В земной коре масса кислорода составляет 47%. Объемная доля молекулярного кислорода в воздухе составляет 20,94%. В воде масса связанного кислорода составляет 89%.
Кислород как простое вещество
Получение:
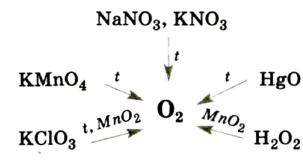
В лаборатории кислород получают следующими способами.
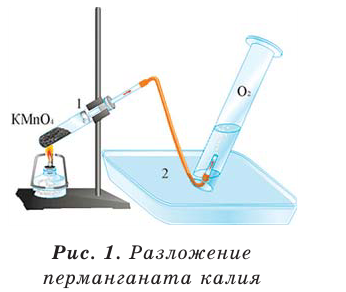
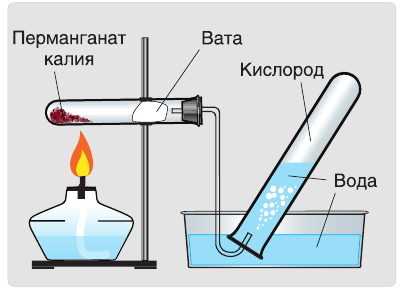
1. Термическим разложением перманганата калия:
2. Термическим разложением бертолетовой соли в присутствии катализатора:
3. Термическим разложением нитратов щелочных металлов:
4. Электролизом воды (рис. 19):
Рис. 19. При электролизе воды образуется один объем кислорода и два объема 4
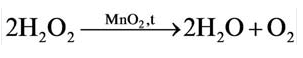
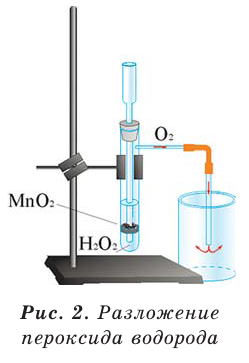
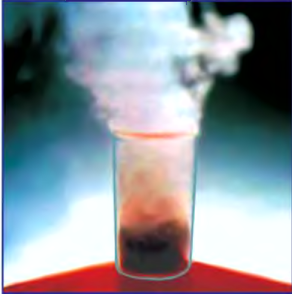
5. Пероксид водорода в присутствии катализатора оксида марганца (IV) разлагается на воду и кислород (рис. 20):
В промышленности кислород получают электролизом воды или из жидкого воздуха.
Рис. 20. Разложение 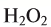
Понятие о катализаторах:
Если обратить внимание на реакцию получения кислорода посредством разложения пероксида водорода, то можно увидеть, что этот процесс осуществляется очень быстро в присутствии черного порошка — оксида марганца (IV) — 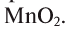
Если отделить фильтрованием порошок, находящийся на дне сосуда, и высушить его, то можно заметить, что его исходные масса и свойства не изменились. Им можно пользоваться при разложении других образцов пероксида водорода.
Вещества, участвующие в химической реакции и ускоряющие ее, но которые при этом не расходуются и не изменяются, называются катализаторами.
Процесс, протекающий в присутствии катализатора, называется катализом.
Рис. 21. Притяжение кислорода к магниту
Физические свойства:
Молекула кислорода состоит из двух атомов и как простое вещество выражается формулой 02. Относительная молекулярная масса равна 32. При обычных условиях кислород — газ без цвета, вкуса и запаха. Он немного тяжелее воздуха (1 л кислорода весит 1,43 г, а 1 л воздуха — 1,293 г). Кислород мало растворяется в воде: при 0°С в 1 л — 49 мл кислорода, при 20°С в 1л — 31 мл кислорода. Приблизительно при 1500°С кислород расщепляется на атомы. При —183°С кислород превращается в голубоватую жидкость. Жидкий кислород способен притягиваться к магниту (рис. 21).
Озон:
При пропускании через кислород или воздух электрической искры (или грозового разряда) образуется новое вещество с характерным запахом — озон. Возможность получения озона из чистого кислорода доказывает, что он является его аллотропическим видоизменением и состоит из атомов кислорода:
Озон постоянно образуется в стратосфере (слой атмосферы на высоте 23—25 км от Земли) под действием ультрафиолетовых лучей, а также в результате окисления смолистых веществ хвойных растений. Озоновый слой составляет в толщину 2—4,5 мм, он защищает Землю от губительной солнечной радиации (вредных лучей). Нарушение целостности озонового слоя чрезвычайно опасно для жизни на Земле. Поэтому ученые постоянно проводят исследования по изучению причин появления озоновых дыр и мер по их предупреждению.
Озон разъедает резину, обесцвечивает масло и бумагу, убивает бактерии. Он используется при усовершенствовании технологических процессов в промышленности, при очистке дымовых газов, промышленных и бытовых стоков, а также при дезинфекции питьевой воды.
Озон — газ голубого цвета с характерным запахом, в воде растворяется лучше, чем кислород (при 0°С в 1 л воды 490 мл).
Озон легко разлагается:
В лаборатории озон получают с помощью озонатора.
Озон отделяют от кислорода путем сильного вымораживания (озон кипит при температуре -111,9°С).
Озон ядовит. Его количество в воздухе не должно превышать 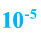
Серебро не взаимодействует с кислородом, но при взаимодействии с озоном дает оксид.
Химические свойства кислорода:
Кислород (после фтора) — самый активный неметалл.
Кислород поддерживает горение.
Кислород соединяется почти со всеми металлами (окисляет их), кроме золота, серебра, платины и металлов группы платины:
Кислород вступает в реакцию также со всеми неметаллами, кроме галогенов (элементов VII группы главной подгруппы), образуя оксиды:
Кислород также вступает в реакцию со сложными органическими и неорганическими веществами:
Оксиды — это вещества, образующиеся в результате взаимодействия кислорода и большинства простых или сложных веществ.
В оксидах кислород двухвалентен.
Биологическое значение кислорода
Кислород считается важным биогенным элементом. Он составляет 45% сухой биомассы растений. Процесс дыхания живых организмов на Земле непосредственно связан с кислородом. Кислород также является источником озонового слоя, задерживающего опасные солнечные лучи. Роль кислорода огромна при распаде и гниении умерших организмов. Процесс фотосинтеза также нельзя представить без кислорода. Он составляет 65% тела человека.
Применение кислорода
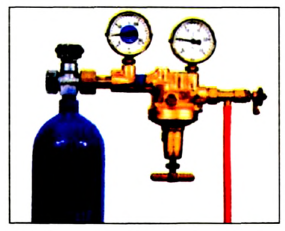
Кислород широко применяется в медицине, при обеспечении жизнедеятельности в подводных и космических аппаратах, при осуществлении процессов дыхания, горения и гниения, для создания высоких температур в производственных процессах, в производстве химических веществ, в качестве окислителя топлива в различных агрегатах. Кислород хранится в 40-литровых голубых баллонах (вес тары 80 кг) при давлении 150-160 атм и объеме 6-7 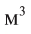
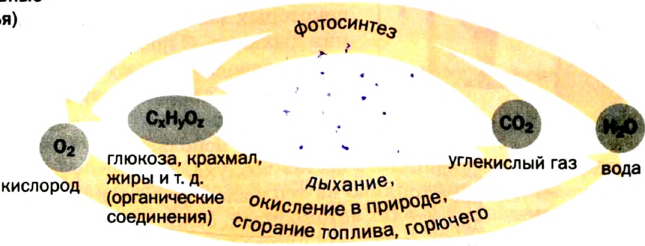
Круговорот кислорода в природе
О том, что кислород в большом количестве находится в литосфере, гидросфере и атмосфере, мы говорили в предыдущих разделах учебника (табл. 5).
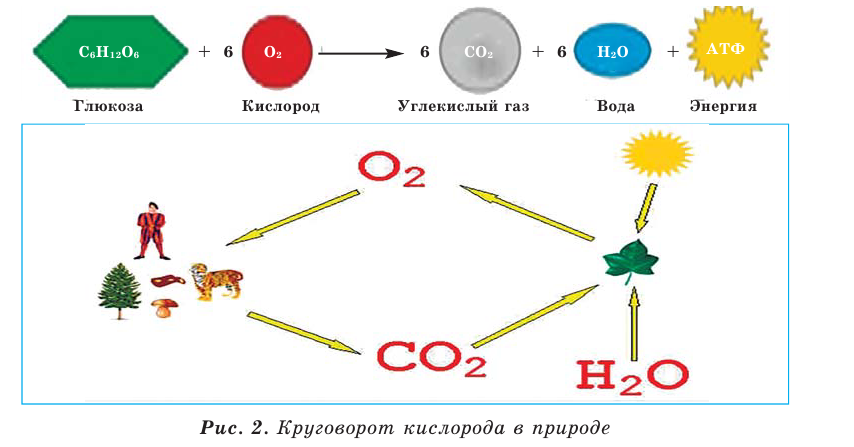
Круговорот кислорода на Земле несущественно отличается от его круговорота в атмосфере, литосфере и гидросфере. На Земле круговорот в основном протекает в процессе фотосинтеза и дыхания. В процессе фотосинтеза углекислый газ, взаимодействуя с водой, образует органические вещества и кислород. В результате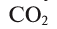
При дыхании, разложении умерших организмов и горении кислород из биосферы возвращается обратно в гидросферу и атмосферу:
В биомассе Земли кислород полностью меняется каждые 20—30 лет. В литосферу кислород переходит из атмосферы в виде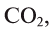
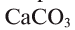
Эта реакция наблюдается в основном в зонах повышенной вулканической деятельности, тем самым постепенно обновляя углекислый газ в атмосфере.
Кислород и воздух
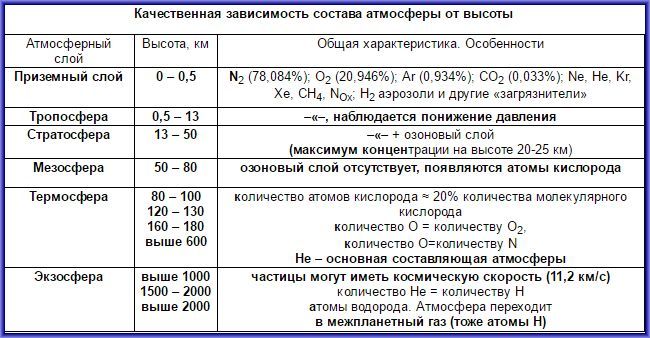
Атмосферный воздух — это природная смесь многих газов. Помимо азота и кислорода, являющихся основной составной частью воздуха, в его состав входят в небольшом количестве инертные газы, углекислый газ, пары воды и водород (табл. 6). Кроме них, в воздухе встречаются, в зависимости от внешних условий, пыль, некоторые случайные примеси. Кислород, азот и инертные газы являются постоянными составляющими воздуха, они встречаются в любом месте почти в одинаковом количестве. Содержание же углекислого газа, паров воды и пыли изменяется в зависимости от условий.
Один литр воздуха при 20°С и нормальном атмосферном давлении весит 1,293 г. При —192°С и давлении 101,33 кПа воздух превращается в бесцветную прозрачную жидкость. Из жидкого воздуха выделяются азот, кислород и инертные газы.
Углекислый газ и водяные пары воздуха выполняют функцию защитного экрана, препятствующего распространению во Вселенной тепла Земли, а озон не пропускает губительные для жизни на Земле коротковолновые ультрафиолетовые лучи, исходящие от Солнца и звезд. Твердые частицы воздуха (пыль) служат основой для образования дождевых капель (в состав пыли входят минеральные вещества, частицы угля, растительная пыль и различные бактерии).
К случайным примесям воздуха относятся сероводород и аммиак, образующиеся при гниении органических остатков, выбрасываемый промышленными предприятиями сернистый газ, образующиеся в результате электрических разрядов оксиды азота, которые периодически выводятся из состава воздуха дождем и снегом.
Воздух является необходимой составной частью жизни на Земле. Сохранение его чистоты имеет огромное значение для человечества. Для защиты воздуха от техногенных загрязнений необходимо использовать новые безотходные технологии, предупреждать уменьшение биомассы Земли, обеспечивать нормальную работу естественных механизмов очистки воздуха.
Горение и виды горючих веществ
Реакция, протекающая с участием кислорода и сопровождающаяся выделением большого количества света и тепла, называется горением.
В чистом кислороде, по сравнению с воздухом, вещества горят во много раз быстрее (рис. 22). В обоих случаях выделяется равное количество теплоты, но в кислороде этот процесс протекает быстрее и выделяющаяся теплота не расходуется, как в случае с воздухом, на нагревание азота. Температура при горении в чистом кислороде выше, чем в воздухе. Опуская тлеющую лучину в сосуд с чистым кислородом, можно увидеть, как она сразу загорается. А в воздухе тлеющая лучина может вскоре и потухнуть. Если эта лучина зажжена, то она продолжает гореть на воздухе, потому что выделяющееся при горении тепло требует большей температуры, чем температура воспламенения лучины.
Рис. 22. Горение магния в чистом кислороде
Рис. 23. Тушение пламени
Температура, необходимая для поджигания вещества на воздухе, называегся температурой воспламенения.
Значит, для обеспечения горения веществ, нужно нагревать их до температуры воспламенения и подавать кислород в достаточном количестве.
Для того чтобы потушить пламя, необходимо ликвидировать факторы, обеспечивающие его появление, т.е. охладить вещество до температуры ниже температуры возгорания и прекратить подачу кислорода (рис. 23).
Чтобы потушить горящую вещь, сначала следует понизить температуру, используя невоспламеняющиеся средства, затем накрыть источник возгорания одеялом или брезентом, чтобы прекратить подачу воздуха.
В непредвиденных ситуациях для тушения пожара необходимо использовать специальные средства, а если их нет, то применять указанный выше способ.
Вообще процесс горения имеет огромное значение в промышленности и в повседневной жизни.
От твердого топлива остается минеральный осадок — пепел. Жидкое и газообразное топливо такого недостатка не имеет. Но любое топливо независимо от места добычи, промышленного объема, экономической эффективности имеет только свое место применения, и возможности по его взаимозамещению ограничены.
Неправильное сжигание топлива приносит вред народному хозяйству.
Топливо позволяет спокойно переносить холод, варить пищу, которая не употребляется в сыром виде, получать металлы из руд путем их выплавки, обеспечивать движение транспорта, получать другие виды энергии.
Оксиген
Это первый элемент, который вы будете подробно изучать. Из периодической системы Д. И. Менделеева можно получить такие сведения о нем:
- • символ Оксигена — О;
- • порядковый номер элемента — 8;
- • Оксиген находится во 2-м периоде, в VI группе;
- • относительная атомная масса элемента — 16 (точное значение — 15,999).
Значение порядкового номера элемента указывает на то, что атом Оксигена содержит 8 электронов, а заряд ядра атома равен +8.
Оксиген — неметаллический элемент, поскольку его простые вещества кислород 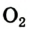
Вам известно, что Оксиген имеет постоянное значение валентности — 2. Атом этого элемента легко присоединяет 2 электрона и превращается в простой ион 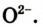
Распространенность оксигена в природе
Оксиген — один из самых распространенных элементов на нашей планете. В земной коре его атомов больше, чем атомов любого другого элемента (§ 6). Атомы Оксигена содержатся в песке, глине, известняке, многих минералах. Оксиген — второй по распространенности в атмосфере (после Нитрогена) и в гидросфере (после Гидрогена).
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 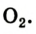
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 02. Это вещество содержит молекулы, состоящие из двух атомов Оксигена.
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
02 = 20.
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5 объема воздуха. Состав сухого воздуха
Организм взрослого мужчины ежесуточно потребляет приблизительно 900 г кислорода, а женщины — 600 г.
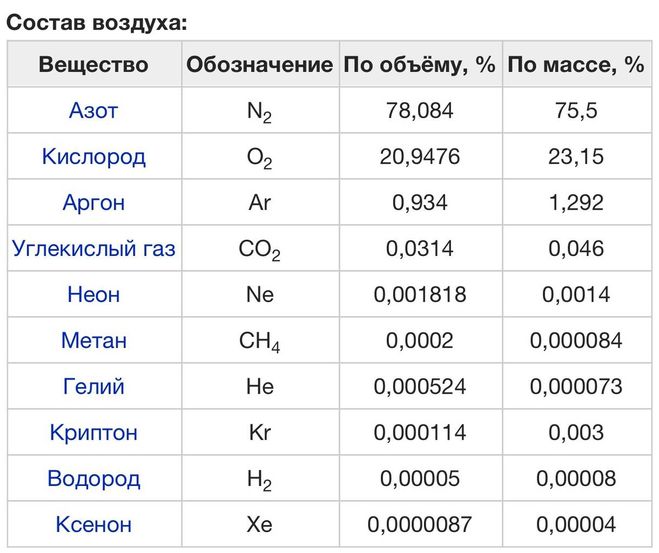
Состав воздуха:
Газ компонент воздуха Доля воздуха в%
| Название | Формула | объемная* | массовая |
| Азот | 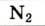 | 78,09 | 75,51 |
| Кислород | 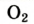 | 20,95 | 23,15 |
| Аргон | 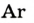 | 0,93 | 1,28 |
| углекислый газ | 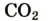 | 0,037 | 0,056 |
| Другие газы | менее 0,002 | менее 0,003 |
* Объемная доля вещества в смеси — отношение объема вещества к объему смеси. Объемную долю обозначают греческой буквой
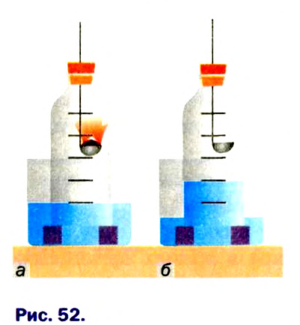
Определить объемную долю кислорода в воздухе можно экспериментально. Для этого нужны стеклянная бутылка без дна с пробкой и кристаллизатор с водой. В пробку вставляют ложку для сжигания, в которую набрано немного красного фосфора. Его поджигают, быстро вносят в бутылку и плотно I закрывают ее пробкой (рис. 52). Когда горение фосфора прекратится, вода займет примерно 1/5 часть объема бутылки. Этот объем занимал в воздухе кислород, который вступил в реакцию с фосфором.
Кислород содержится не только в атмосфере. Небольшое его количество вместе с другими газами воздуха растворено в природной воде.
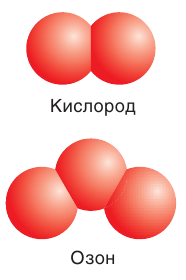
Существует еще одно простое вещество Оксигена — озон 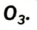
Озон содержится в атмосфере в незначительном количестве; его объемная доля не превышает
Определение объемной доли кислорода в воздухе сжиганием фосфора:
а — начало опыта;
б — окончание опыта
1 0,0004 %. Распадаясь, он поглощает часть ультрафиолетовых лучей солнечного света, вредную для растений и животных, и тем самым оберегает природу.
Физические свойства кислорода
В обычных условиях кислород — бесцветный газ, который не имеет запаха и вкуса. При охлаждении до -183 °С превращается в голубую жидкость, которая при температуре -219 °С затвердевает, образуя синие кристаллы. Кислород в 1,1 раза тяжелее воздуха. Он плохо растворяется в воде, но этого достаточно для существования в природных водоемах рыб, других живых существ, которые дышат растворенным кислородом.
Жидкий кислород, как и железо, притягивается к магниту.
Вывод:
Оксиген — неметаллический элемент. В природе распространено его простое вещество кислород, а также вода и другие соединения. На кислород приходится немногим более 1/5 объема воздуха.Кислород — газ без запаха и вкуса, необходимый для дыхания; он поддерживает горение.
Открытие кислорода
Кислород был открыт во второй половине XVIII в. несколькими учеными разных стран. Первым этот газ получил шведский химик К.-В. Шееле в 1772 г., а через два года, не зная об опытах предшественника, — английский химик Дж. Пристли. В 1775 г. французский ученый A.-JI. Лавуазье исследовал кислород и дал ему название oxygen.
Кислород можно обнаружить с помощью тлеющей лучинки. Лучинка, помещенная в сосуд с этим газом, ярко вспыхивает (рис. 53).
Рис. 53.Обнаружение кислорода:
а — тлеющая лучинка на воздухе; б — возгорание лучинки в кислороде
Получение кислорода в промышленности
Неисчерпаемым источником кислорода является воздух. Чтобы получить из него кислород, следует отделить этот газ от азота и других газов. На такой идее основан промышленный метод получения кислорода. Его реализуют, используя специальную, достаточно громоздкую аппаратуру. Сначала воздух сильно охлаждают до превращения его в жидкость. Затем температуру сжиженного воздуха постепенно повышают. Первым из него начинает выделяться газ азот (температура кипения жидкого азота составляет -196 °С), а жидкость обогащается кислородом (температура кипения кислорода -183 °С).
Получение кислорода в лаборатории
Лабораторные методы получения кислорода основаны на химических реакциях.
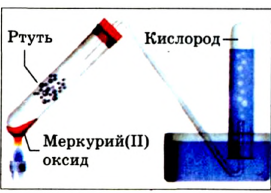
Дж. Пристли получал этот газ из соединения, название которого — меркурий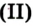
В современном исполнении этот опыт изображен на рисунке 54. При нагревании меркурий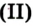
Рис. 54.Получение кислорода нагреванием меркурий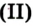
Соответствующее химическое уравнение:
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.
Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:
- калий перманганат
(бытовое название — марганцовка; вещество является распространенным дезинфицирующим средством)
Небольшое количество катализатора — манган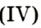
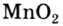
Получение кислорода разложением гидроген пероксида
Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган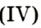
Составьте уравнение реакции разложения гидроген пероксида, если вторым продуктом реакции является вода
В лаборатории кислород можно также получить разложением натрий нитрата 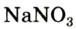

Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:
Лабораторные методы получения кислорода
В природе кислород образуется вследствие фотосинтеза в зеленых листьях растений. Упрощенная схема этого процесса такова:
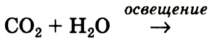
Выводы:
Кислород был открыт в конце XVIII в. несколькими учеными. Кислород получают в промышленности из воздуха, а в лаборатории — с помощью реакций разложения некоторых оксигенсодержащих соединений. Во время реакции разложения из одного вещества образуются два или более веществ.
Химические свойства кислорода
Химические свойства каждого вещества проявляются в химических реакциях при его участии.
Кислород — один из наиболее активных неметаллов. Но в обычных условиях он реагирует с немногими веществами. Его реакционная способность существенно возрастает с повышением температуры.
Реакции кислорода с простыми веществами
Кислород реагирует, как правило, при нагревании, с большинством неметаллов и почти со всеми металлами.
Реакция с углем (углеродом)
Известно, что уголь, нагретый на воздухе до высокой температуры, загорается. Это свидетельствует о протекании химической реакции вещества с кислородом. Теплоту, которая выделяется при этом, используют, например, для обогрева домов в сельской местности.
Основным продуктом сгорания угля является углекислый газ. Его химическая формула —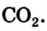
Карбон образует простые вещества — графит и алмаз. Они имеют общее название — углерод — и взаимодействуют с кислородом при нагревании согласно приведенному химическому уравнению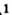
Реакции, при которых из нескольких веществ образуется одно, называют реакциями соединения.
Реакция с серой
Это химическое превращение осуществляет каждый, когда зажигает спичку; сера входит в состав ее головки. В лаборатории реакцию серы с кислородом проводят в вытяжном шкафу. Небольшое количество серы (светло-желтый порошок или кристаллы) нагревают в железной ложке. Вещество сначала плавится, потом загорается в результате взаимодействия с кислородом воздуха и горит едва заметным синим пламенем (рис. 56, б). Появляется резкий запах продукта реакции — сернистого газа (этот запах мы ощущаем в момент загорания спички). Химическая формула сернистого газа — 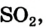
Рис. 56. Сера (а) и ее горение на воздухе (б) и в кислороде (в)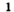
Если ложку с горящей серой поместить в сосуд с кислородом, то сера будет гореть более ярким пламенем, чем на воздухе (рис. 56, в). Это можно объяснить тем, что молекул 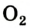
Рис. 57.Красный фосфор (а) и его горение на воздухе (б) и в кислороде (в)
Реакция с фосфором
Фосфор, как и сера, горит в кислороде интенсивнее, чем на воздухе (рис. 57). Продуктом реакции является белое твердое вещество — фосфор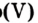
Реакция с магнием. Раньше эту реакцию использовали фотографы для создания яркого освещения («магниевая вспышка») при фотосъемке. В химической лаборатории соответствующий опыт проводят так. Металлическим пинцетом берут магниевую ленту и поджигают на воздухе. Магний сгорает ослепительно-белым пламенем (рис. 58, б); смотреть на него нельзя! В результате реакции образуется белое твердое вещество. Это соединение Магния с Оксигеном; его название — магний оксид.
Рис. 58. Магний (а) и его горение на воздухе (б)
Реакции кислорода со сложными веществами
Кислород может взаимодействовать с некоторыми оксигенсодержащими соединениями. Например, угарный газ СО горит на воздухе с образованием углекислого газа:
Немало реакций кислорода со сложными веществами мы осуществляем в повседневной жизни, сжигая природный газ (метан), спирт, древесину, бумагу, керосин и др. При их горении образуются углекислый газ и водяной пар:
Оксиды
Продуктами всех реакций, рассмотренных в параграфе, являются бинарные соединения элементов с Оксигеном.
Соединение, образованное двумя элементами, одним из которых является Оксиген, называют оксидом.
Общая формула оксидов —
Каждый оксид имеет химическое название, а некоторые — еще и традиционные, или тривиальные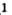
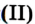
Таблица 4
Формулы и названия некоторых оксидов
Выводы:
Кислород — химически активное вещество. Он взаимодействует с большинством простых веществ, а также со сложными веществами. Продуктами таких реакций являются соединения элементов с Оксигеном — оксиды.
Реакции, при которых из нескольких веществ образуется одно, называют реакциями соединения.
Горение и кислород
Рассмотренные в предыдущем параграфе реакции с участием кислорода сопровождаются одинаковыми внешними эффектами.
Химическую реакцию, во время которой выделяется теплота и появляется пламя, называют горением.
Пламя возникает вследствие свечения раскаленных частиц веществ, которые сгорают или образуются во время реакции.
Для того чтобы горючее вещество воспламенилось, необходимы такие условия:
- наличие кислорода (воздуха);
- нагревание вещества до температуры самовозгорания (для бензина она составляет 220 °С, сухой древесины — 250—300 °С, бумаги — 440 °С, угля — свыше 600 °С).
Кислород поддерживает горение веществ, но сам не горит.
Если не выполняется хотя бы одно из этих условий, то горение не происходит. Это учитывают во время работы с огнеопасными веществами, а также при тушении пожаров.
Погасить огонь можно, залив горящее вещество или предмет водой, засыпав его песком или землей, накрыв одеялом или направив на него струю углекислого газа (он не поддерживает горения и тяжелее воздуха) (рис. 63).
Рис. 63. Гашение пламени:
а — водой; б — песком; в — углекислым газом
В лабораториях, на предприятиях с этой целью используют огнетушители (рис. 64).
Рис. 64. Огнетушитель (а)и его использование (б)
Окисление и кислород
Взаимодействие веществ с кислородом не всегда сопровождается их горением. Большинство таких реакций происходят медленно, иногда — незаметно. Вещество, которое взаимодействует с кислородом, подвергается окислению, т. е. изменяется при участии кислорода.
Медленным окислением веществ обусловлено появление ржавчины на железе, прокисание молока, прогорание масла, порча многих других продуктов питания.
Реакции веществ с кислородом, которые не сопровождаются горением, используют в цветной металлургии, химической промышленности.
Кислород, поступая через легкие в организм животного или человека, окисляет различные вещества, в том числе и те, которые постоянно поступают вместе с пищей.
Выводы:
При взаимодействии некоторых веществ с кислородом происходит их горение — химическое превращение с выделением теплоты и появлением пламени.
Условиями, необходимыми для горения, являются наличие кислорода и достижение веществом определенной температуры. Для того чтобы погасить пламя, необходимо устранить хотя бы одно из этих условий.
Любую реакцию вещества с кислородом называют окислением. Многие из таких реакций происходят медленно и не сопровождаются появлением пламени.
Круговорот оксигена в природе
Каждое мгновение на Земле происходит множество физических и химических превращений. Эти изменения в природе являются циклическими, т. е. периодически повторяющимися.
Часть изменений, которые происходят с веществами на планете, обусловлена химическими реакциями.
Совокупность процессов, происходящих в природе, при которых атомы или ионы элемента в результате реакций переходят от одних веществ к другим, называют круговоротом элемента.
Если главным веществом в круговороте Оксигена выбрать кислород, то можно выделить такие звенья круговорота (схема 8):
- расходование, или связывание, кислорода (процессы дыхания, сгорания топлива и горючего, окисление различных веществ в природе, в технологических процессах);
- взаимопревращение оксигенсодержащих соединений;
- образование кислорода (процесс фотосинтеза, разложение воды в верхних слоях атмосферы). Неизменность содержания кислорода в атмосфере свидетельствует о том, что процессы связывания и выделения кислорода компенсируют друг друга.
Схема 8. Круговорот Оксигена(основные звенья)
Оксиген способствует круговороту других элементов, поскольку образует с ними многочисленные соединения.
Применение кислорода в различных отраслях
Кислород используют в различных отраслях, причем в больших количествах (схема 9). В металлургии он ускоряет процесс выплавки стали и улучшает ее качество. Этот газ необходим в производстве многих химических соединений, используется в специальных устройствах для резки и сварки металлов (водородно-кислородные, ацетиленово-кислородные горелки). Баллоны, наполненные кислородом (рис. 66) или его смесью с инертным газом гелием, используют космонавты, военные летчики, пожарники, водолазы. Кислородные подушки применяют при некоторых заболеваниях для облегчения дыхания. С помощью сжиженного кислорода создают необходимые условия для сгорания горючего в космических ракетах.
Схема 9.Применение кислорода
Широко используется и кислород, входящий в состав воздуха. При его участии сгорает топливо на теплоэлектростанциях, горючее в двигателях автомобилей, обжигают металлические руды на заводах цветной металлургии.
Рис. 66. Баллон с кислородом
Во время сжигания топлива и горючего образуется и попадает в воздух значительное количество угарного (СО) и сернистого 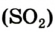
Биологическая роль кислорода
Кислород необходим живым существам для дыхания. Попадая через легкие в организм, этот газ соединяется с гемоглобином (компонент крови) и поступает во все органы и ткани. При участии кислорода происходят различные реакции. Некоторые из них сопровождаются выделением теплоты; благодаря этому поддерживается постоянная температура тела.
Выводы:
В природе атомы Оксигена в результате химических реакций постоянно переходят от одних веществ к другим; происходит круговорот этого элемента.
Кислород широко используется в промышленности, технике, медицине, а в составе воздуха — в теплоэнергетике, автотранспорте, других областях.
Кислород необходим живым существам. Попадая в организм во время дыхания, он принимает участие во многих химических реакциях. Кислород также является продуктом фотосинтеза.
Отравление угарным газом СО происходит потому, что он реагирует с гемоглобином, и поступление кислорода в организм прекращается.
Распространение кислорода в природе и его получение
Что происходит с вами, оставаясь в закрытом помещении, без воздуха? Какие газы и сколько процентов содержится в составе воздуха, которым мы дышим?
Общая характеристика:
Распространение кислорода в природе:
Кислород был открыт в 1772 году шведским ученым Карлом Шееле. Это самый распространенный в природе элемент. Примерно 49,4% массы земной коры приходится на долю кислорода. Кислород в атмосфере земного шара (по массе 23%, по объёму 21%) и в природных водах существует в растворённом виде.
Наличие кислорода в атмосферном воздухе впервые было установлено А.Лавуазье в 1774 году. Кроме кислорода в воздухе содержится 78% по объему и 75,5% по массе азота (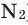
Кислород в виде соединений является основной составной частью почвы, воды, горных пород, руд, минералов. Он входит в состав всех живых организмов (растений, животных и т.д.). Приблизительно 65% человеческого тела составляет элемент кислород.
В природных соединениях встречается три изотопа 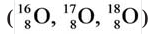
Французский химик. В 1774 году экспериментальным путем доказал состав воздуха.
Получение кислорода в лаборатории
Кислород получают в лаборатории в результате разложения воды под действием постоянного электрического тока:
В результате разложения нитрата калия. Впервые кислород был открыт К.Шееле в 1772 году в результате реакции разложения нитрата калия.
В результате разложения оксида ртути (II). В 1774 году кислород был получен английским ученым Джозефом Пристли путем нагревания оксида ртути (II) 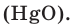
В настоящее время самыми удобными для получения кислорода в лабораторных условиях веществами являются известный в народе под названием «марганцовка» перманганат калия (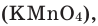
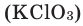
В результате разложения перманганата калия (рис. 1).
В результате разложения пероксида водорода 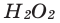
Вещества, которые ускоряют ход химических реакций, сохраняя при этом свое количество после реакции без изменения, называются катализаторами.
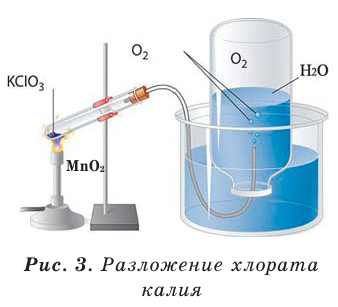
В результате разложения хлората калия (Бертолетова соль) при участии оксида марганца (IV) (рис. 3).
Без участия оксида марганца (IV) 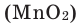
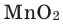
Получение кислорода в промышленности
В промышленности кислород в большом количестве получают при дистилляции сжиженного воздуха. Очистив воздух от пыли, влаги и углекислого газа, его сжижают путем сжатия под высоким давлением и охлаждения. Температуру сжиженного и охлажденного до — 200 


Свойства и применение кислорода
Рассмотрите картинки и поясните свои соображения. Какова причина длительного пребывания водолазов под водой? Где ещё используется кислородный баллон?
Физические свойства:
Кислород — это бесцветный газ без запаха и вкуса, относительно мало растворим в воде (при температуре 20°С в 100 объёмах воды растворяется 3,1 объёма кислорода). Кислород немного тяжелее воздуха, при температуре — 183 °С сжижается, а при понижении температуры до — 218,8 °С — затвердевает.
Химические свойства:
В обычных условиях кислород в чистом виде и в составе воздуха химически неактивен. Однако при нагревании его активность резко возрастает. Кислород может находиться во взаимодействии с большинством простых веществ — неметаллами и металлами, а также со сложными веществами.
Взаимодействие кислорода с неметаллами. Если раскалить под действием пламени спиртовки уголек в железной ложке, то он не загорится, а начнет дымиться. Поместим железную ложку с дымящимся угольком в банку с кислородом (для того, чтобы банка не разбилась, дно посыпаем мелким песком). Раскаленный уголек будет гореть без пламени, выделяя тепло. Если нальем в банку известковую воду 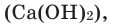
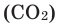
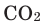
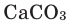
При горении раскаленного угля в условиях нехватки кислорода образуется очень опасный удушающий угарный газ:
Нагреем в железной ложке немножко серы. Сера горит слабым голубоватым пламенем. Опустим ложку в банку с кислородом. Скорость горения серы увеличивается, появляется пламя ярко-голубого цвета. В банке образуется бесцветный газ с резким запахом — серный газ (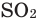
Возьмем немного фосфора в железной ложке и нагреем на огне спиртовки. Фосфор начинает гореть. Если опустить горящий фосфор в банку с кислородом, то горение ускорится и очень скоро банка наполнится белым дымом оксида фосфора (V). Горение фосфора тоже сопровождается выделением теплоты.
Все неметаллы, кроме фтора (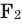
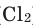
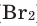
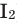
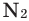
Взаимодействие кислорода с металлами. Кроме ценных (благородных) металлов (Ag, Au, Pt), большинство других металлов находятся в непосредственном взаимодействии с кислородом. Для вступления металлов в реакцию с кислородом, их следует нагреть, после чего реакция протекает самопроизвольно, с выделением света и тепла.
Магний горит в воздухе ярким, ослепительным пламенем. Если опустить ленту горящего магния в сосуд с кислородом, яркость пламени еще больше увеличится. В результате реакции образуется белый порошок оксида магния:
Если, насадив на железную проволоку деревянную щепку, мы зажжем ее и опустим в сосуд с кислородом, то вначале будет гореть кусок дерева, а затем железо. Железо горит без пламени, разбрасывая вокруг искры железной окалины.
Сложные вещества, состоящие из двух элементов, один из которых является кислородом, называются оксидами.
Взаимодействие сложных веществ с кислородом. Как и простые вещества, сложные вещества тоже могут гореть в кислороде и окисляться. Реакции взаимодействия веществ с кислородом являются реакциями окисления. Ряд оксидов, взаимодействуя с кислородом, образуют новые оксиды.
В наших квартирах ежедневно в газовых печах горит природный газ (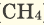
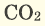
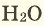
Серные соединения некоторых металлов (сульфиды) при горении в кислороде образуют два оксида.
Применение:
Сварка и резка металлов происходит при участии чистого кислорода. В металлургической и химической промышленности больше всего используется кислород из воздуха. Например, при производстве чугуна и серной кислоты использование кислорода из воздуха позволяет значительно ускорить и повысить производительность производственных процессов.
В медицине чистый кислород применяют для облегчения затрудненного дыхания. В этих целях в больницах используются кислородные подушки и заполненные чистым кислородом стальные баллоны. Летающие на большой высоте летчики, космонавты, работающие под водой водолазы также пользуются небольшими по размеру кислородными баллонами.
Все живые организмы в природе при дыхании употребляют кислород, ежегодно усваивая миллионы тонн атмосферного кислорода. Так, например, было вычислено, что только люди употребляют в течение года свыше 1330 миллиардов кубических метров атмосферного кислорода. Кроме того, в громадных количествах атмосферный кислород тратится при сжигании топлива, на процессы гниения, при вулканических извержениях (рис. 1).
В организме человека и животных происходит медленное окисление глюкозы кислородом (рис. 2).
Кислород — химический элемент и простое вещество
В периодической системе элементов кислород О расположен во втором периоде в VIА-группе. Кроме него в эту группу входят еще три неметалла — сера S, селен Se и теллур Te, а также один металл — полоний Po.
Кислород в природе
Кислород составляет почти половину массы земной коры (49 %). Он входит в состав самых разнообразных соединений: воды, оксидов, солей и т. д. Этот элемент является неотъемлемой частью живой материи — тканей растений и животных.
Основным источником кислорода на Земле является атмосферный воздух, в котором на долю кислорода приходится около 21 % по объему. Несмотря на колоссальные масштабы потребления кислорода (процессы горения, дыхания, промышленные потребности и т. д.), содержание 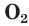
Процессы, происходящие в природе с участием кислорода, называются по-разному. Энергичное окисление с выделением тепла и света — горение, медленное окисление железа — ржавление, поглощение кислорода из воздуха живыми организмами — дыхание.
Строение атома кислорода
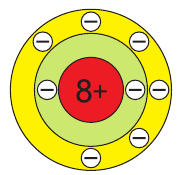
В атоме кислорода 8 электронов, которые располагаются на двух электронных слоях (рис. 44):
На внешнем электронном слое у атома кислорода находится 6 электронов, следовательно, до завершения этого слоя ему не хватает 2 электронов. Поэтому в своих
соединениях с металлами и водородом кислород обычно проявляет степень окисления, равную –2, как, например, в оксиде железа FeO. Кислород — второй по электроотрицательности химический элемент после фтора, поэтому только атомы фтора способны отнимать у него электроны. Положительную степень окисления +2 кислород проявляет только в соединении со фтором 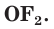
Строение и физические свойства простых веществ
С простым веществом кислородом вы уже познакомились в курсе химии 7-го класса. Напомним, что простое вещество кислород в природе существует в виде двух аллотропных модификаций — обычного кислорода 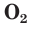
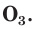
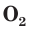
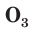
В природе озон образуется при грозовых разрядах и при окислении смолы хвойных деревьев. Небольшие количества озона в воздухе оказывают целебное действие на людей. Однако сильное обогащение воздуха озоном может стать опасным для здоровья. Увеличение содержания озона в воздухе выше предельно допустимой концентрации приводит к появлению головных болей, раздражению дыхательных путей и глаз, а затем к ослаблению сердечной деятельности. Источниками озона являются работающие приборы, в которых происходит высоковольтный электрический разряд — копировальные установки и лазерные принтеры, а также источники ультрафиолетового и рентгеновского излучения. Поэтому помещения, в которых находятся такие приборы, необходимо часто проветривать.
Озон сосредоточен в верхних слоях атмосферы, образуя озоновый слой, который защищает Землю и ее обитателей от жесткого ультрафиолетового излучения Солнца. Поверхности Земли достигают только те ультрафиолетовые лучи, которые не опасны для живых организмов. Когда мы загораем на солнце, на нашу кожу падают «мягкие» ультрафиолетовые лучи, не способные принести вреда здоровью (если загорать в меру).
Кислород и озон в воде мало растворимы. При 20 °С в 100 объемах 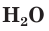
Химические свойства кислорода
Из-за высокой химической активности простое вещество кислород взаимодействует с большинством простых веществ и многими сложными веществами. Практически во всех своих реакциях кислород выступает в качестве окислителя.
Основными продуктами реакций кислорода с простыми веществами обычно являются оксиды. Окисление некоторых металлов происходит даже без нагревания, например:
Но для протекания большинства реакций кислорода с металлами требуется нагревание, иногда значительное.
При окислении кислородом неметаллов обычно выделяется большое количество теплоты, как, например, при горении углерода и водорода:
Кислород легко окисляет и многие сложные вещества. Например, известный вам из курса химии 7-го и 8-го классов оксид углерода(II) окисляется до углекислого газа:
При окислении сульфида цинка образуются два оксида — оксид цинка и оксид серы(IV):
Окисляются кислородом и органические вещества, например метан:
При этом, как правило, также образуются оксиды. Высокая окислительная способность кислорода является основой горения всех видов топлива.
С химическими свойствами озона вы познакомитесь в 11-м классе.
Применение кислорода и озона
Применение кислорода основано на его окислительных свойствах и свойстве поддерживать дыхание. Как окислитель он широко используется в металлургии, химической промышленности, других технологических процессах. Кислород применяют в качестве окислителя топлива в ракетных двигателях (рис. 47).
С участием кислорода совершается один из важнейших процессов жизнедеятельности живых организмов — дыхание. Окисление кислородом жиров, белков и углеводов служит источником энергии для живых организмов.
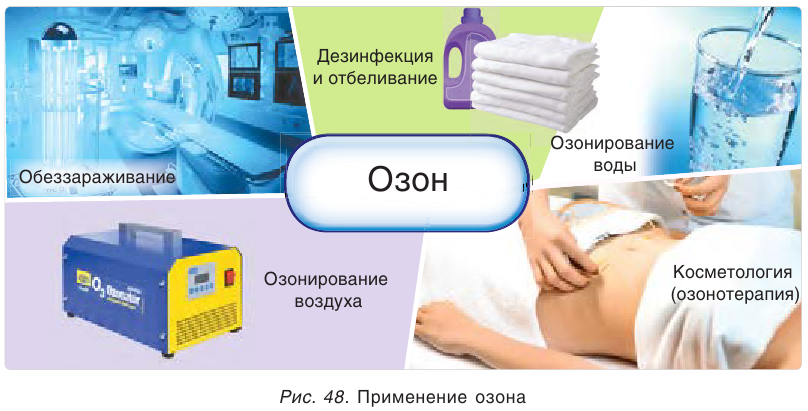
Озон используется для озонирования воздуха и питьевой воды, обезвреживания промышленных сточных вод, как дезинфицирующее средство в медицине, в качестве отбеливающего средства (рис. 48).
Атомы кислорода имеют на внешнем электронном слое по 6 электронов.
В соединениях с другими элементами кислород чаще всего проявляет степень окисления –2.
Известны две аллотропные модификации кислорода: кислород 
Кислород реагирует со многими простыми и сложными веществами.
Практически во всех реакциях кислород выступает в качестве окислителя.
8
Как выглядит химическое соединение — воздух ?
формула воздуха
10 ответов:
9
0
Много людей иногда задается вопросом с чего состоит воздух и какая у него формула. Воздух — это смесь газов, которая окутывает нашу Землю в атмосфере. Так вот основным составляющим является азот и кислород, остальные это газы которые просто немного добавляют воздух
7
0
Воздух это смесь газов. Состав воздуха не является постоянной величиной и меняется в зависимости от местности, региона и даже количества людей находящихся рядом с вами. В основном воздух состоит из Азота примерно на 78% и кислорода на 21%, остальное это примеси различных соединений.
5
0
Владимир! Как таковой химической формулы воздуха не существует..
воздух-ЭТО СМЕСЬ различных газов- кислорода ,окиси углерода,азота и других газов..
точную пропорцию этих газов в атмосфере назвать трудно…
4
0
Со школьной программы помню что атмосферный воздух это смесь газов в котором основные это — азот и кислород на их долю приходится 99% этой смеси сам состав атмосферного воздуха примерно такой:
азот — 78%.
кислород — 21%.
аргон — 1%.
углекислый газ — 0,03%.
далее процент настолько мал но видимо без них мы дышать возможно и сможем но могут возникнуть нарушения:
неон — 0,002%.
метан — 0,0002%.
гелий — 0,0005%.
криптон — 0,0001%.
водород — 0,00005%.
ксенон — 0,000009%.
Но хочу добавить что процент газов на планете Земля не везде одинаков.
4
0
Воздух нельзя назвать химическим соединением, ведь он состоит из смеси разнообразных газов, которая постоянно меняет свой состав. Причем, это изменение носит как качественный, так и количественный характер. Так, если до высоты в 13 километров, состав атмосферы меняется мало, то выше появляется озоновый слой, то есть в атмосфере возникает большое количество трехатомного кислорода. Напротив у поверхности на состав атмосферы оказывают большое влияние загрязнения как техногенного (выбросы предприятий, автомобилей), так и природного характера (вулканическая деятельность). Химическое же соединение как правило постоянно, атомы элементов в нем связаны различными связями и находятся в строгих пропорциях.
Вот состав атмосферы у поверхности:
А вот какие изменения происходят в атмосфере с высотой:
3
0
Вы нигде не сможете отыскать какую-то химическую формулу воздуха. Всё дело в том, что воздух в своём составе имеет огромнейшее количество различных примесей газов, поэтому вам можно только предоставить перечень этих примесей с примерным процентным содержанием, а вот и этот перечень:
2
0
Наверное не совсем корректно говорить о воздухе как о химическом соединении. Скорее это смесь газов в которой присутствуют пары воды. Основной состав воздуха это азот-кислород в объемном соотношении 78-21%. Остальное принадлежит водороду, углекислому газу, аргону, гелию и пр. Состав воздуха может меняться в зависимости от географии места (город, лес, горы, море) в пределах 2% для каждого газа.
2
0
Невозможно составить единую цельную формулу для атмосферы Земли. Но можно определить какие газы есть в воздухе:
- Азот N2 — 78.084 %.
- Оксиген (которым мы дышим) О2 — 20.9476 %.
- Аргон Ar — 0.934 %.
- Углекислый газ CO2 — 0.0314%.
- Неон Ne — 0.001818%.
- Метан CH4 — 0.0002%.
- Гелий He — 0.000524%.
- Криптон Kr — 0.000114%.
- Гидроген H2 — 0.00005%.
- Ксенон Xe — 0.0000087%.
- Озон O3 — 0.000007%.
- Нитроген диоксид NO2 — 0.000002%.
- Йод I2 — 0.000001%.
- Количество карбона моноксида CO и аммония NH3 ничтожно мало.
1
0
Воздух по существу представляет собой смесь азота (около 80%) и кислорода (около 20%), другие газы составляют около 1% или меньше. Как таковой химической формулы воздуха не существует, так как это смесь различных соединений в различном процентном соотношении.
1
0
Воздух — это не химическое соединение. Воздух представляет собой смесь газов, причем его состав не постоянен и зависит непосредственно от места, в котором мы будем анализировать состав воздуха, наличия тех или иных загрязнений.
98-99% состава воздуха приходится на азот и кислород. Также в состав воздуха входят
Читайте также
Обманывают, понятно, зачем, — с целью поживиться. И Киевстар в этом преуспевает. У меня так свекровь попалась. Иногда приходят служебные СМС от Киевстар, свекровь открывает СМС — со счёта сразу списывают приличную сумму. Отключить рассылку операторы отказались, теперь все служебные СМС сразу удаляет, не открывая. И сама я попалась однажды. В 3 часа ночи зазвонил мобильный. Номер был киевстаровский. Понятно, что звонок в такое время пугает. Не успев взять трубку, я перезвонила по этому номеру, и слышу голоса примерно 8-10 человек, таких же, как я, которым позвонили ночью, и они перезванивают, испугавшись за близких. Все ругаются. Слушала я примерно 1 минуту, пока до меня дошло, что включен режим конференции. Со счёта за эту минуту снялось около 50 гривен. Звонки оператору, обращение в милицию ничего не дали.
Воров и мошенников много. От этого никуда не уйдёшь в наше время. Плохо то, что государство от них не защищает, и не гарантирует защиты и безопасности. И руки у жулья развязаны — они-то как-раз уверены в своей безнаказанности, им защита гарантирована.
Грибы растут после обильных осадков, которые случаются после метеоритных дождей. А метеоритные дожди случаются в новолуние. При стареющей луне происходит образование плодового тела, а при растущей луне происходит его рост.
Кстати, есть рекомендации сеять семена корнеплодов после полнолуния, а листовых после новолуния. Тут такая же картина, я думаю. Грибница просыпается после полнолуния и образует плодовое тело, а после новолуния растет сам гриб. То есть при стареющей луне растет подземная часть, а при растущей растет наземная часть.
Хотя говорят, что луна не влияет на рост грибов, она влияет на погоду, а погода влияет на рост грибов.
Я живу в Екатеринбурге . Население больше миллиона. Крупный транспортный узел. Через Екатеринбург проходит Трансиб. Идут поезда на Владивосток, Барнаул, Новый Уренгой, Нижневартовск. Через Екатеринбург идут поезда и на Москву, поезда южного направления.
Платформы на нашем вокзале расположены не как в Москве, неудобно. Нужно подниматься и спускаться по лесенкам в вагон.
И во всех городах Свердловской области та же картина. И вещи и дети у пассажиров в руках. И стоянка 2 минуты . Так что реклама фастум — геля актуальна.
И из электричек на станциях спускаешься по ступенькам .
Не думают об удобстве пассажиров.
Много и разных.Например:
Каменный и бурый угли, торф, газ, нефть,железная руда, марганец, никель, алюминий , вольфрам,уран,медь,олово,платина,золото,калийные соли, поваренная соль, минеральные воды, графит,мрамор,гранит,слюда,драгоценные и поделочные камни, горючие сланцы, мел,гравий,песок, известняк,асфальтовая смола,и так далее, список можно продолжать .
Мы богатая страна с бедным народом, что странно и противоестественно.
Звук является в языке основной единицей наряду со словом и предложением. Все звуки в языке делятся на гласные и согласные. Гласные звуки (само название говорящее) образовываются с помощью ГОЛОСА. В речевом аппарате человека воздух свободно проходит через гортань между напряженными голосовыми связками и выходит через рот, который может менять свои очертания. Так образуются гласные звуки. Если рот округлиться, то мы говорим гласный звук «О», если губы вытянем вперед трубочкой, то все услышат:»У-у-у!»
Воздух и его свойства
Воздух состоит из смеси различных газов. В основном там преобладает кислород и азот, чья доля около 99% от всего содержания воздуха. Остальные 1-2% приходятся на углекислый газ, водород и другие вещества, содержание которых значительно ниже.
Кислород является одним из самых главных компонентов, обеспечивающих жизнь на земле. Без него невозможно существование аэробных живых организмов, которые непосредственно дышат кислородом. Этот элемент является важным сопоставляющим воздуха и при дыхании попадает в живые организмы, позволяя им осуществлять свою работу.
Сама формула воздуха представляет собой большое количество различных примесей газов. Основой являются азот и кислород. Причем большее содержание именно у азота — 78%. Кислород же составляет 21%, а все остальное это различные примеси. Такой состав не является постоянным и может меняться в зависимости от места взятия пробы. Близость промышленных объектов или автомобильных дорог могут привести к значительным отклонениям от нормы в результате значительных выбросов вредных веществ. Также на результаты анализов может повлиять сезон, погодные условия на момент пробы или отдаленность от моря.
К свойствам можно отнести:
- Прозрачность и бесцветность. Если же вы наблюдаете наличие какого-либо оттенка или отсутствие прозрачности, то это первый сигнал о загрязнении.
- Отсутствие запаха.
- При нагревании он расширяется, а при охлаждении наоборот сжимается. Это особенно заметно при вычислении объема.
- Является плохим проводником тепла.
- Сам по себе не имеет формы и поэтому заполняет все пространство.
Но на этом функции воздуха не заканчиваются. Человек стал широко применять его в своей деятельности и сейчас он необходим в промышленности. Также для получения тепла он используется в процессе сжигания. И таких примеров очень много. Поэтому без этой важной составляющей жизнь человека невозможна. Но следует следить и за тем, чтобы качественные характеристики воздуха соответствовали нормам. Проводить измерения в помещении намного легче, нежели на улице. Также помимо формул такие измерения проводятся при помощи различных инструментов. Так атмосферное давление измеряется при помощи специального барометра. Поэтому если вы хотите провести химический анализ воздуха, который покажет содержание различных газов и соответствуют ли эти показатели норме, вы можете обратиться в нашу лабораторию. Независимая лаборатория «ЭкоТестЭкспресс» также проводит различные виды исследований, такие как измерения уровня радиации. Это позволит своевременно выявить окружающие вас проблемы и ликвидировать их до того, как они скажутся на вашем здоровье.
Формула силы сопротивления воздуха
В повседневной жизни мы совершенно не задумываемся о воздухе, которым мы дышим. Но на самом деле существует сила сопротивления воздуха, с которой человек сталкивается, ежедневно совершая какие-либо действия.
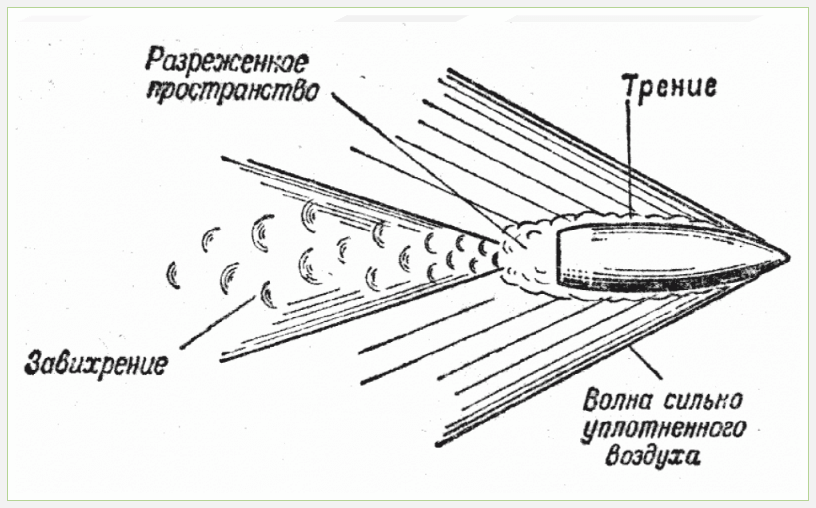
Эта величина складывается из различных факторов. К ним относятся лобовое сопротивление, завихрение воздуха, трение воздух о поверхность, внутренние сопротивления, индуцируемое сопротивление и различные дополнительные сопротивления. К основным причинам, которые вызывают сопротивление, относятся как раз трение воздуха и образование завихрений.
В каждом случае сила этого сопротивления рассчитывается индивидуально, исходя из существующих условий. К примеру для автомобиля показатель лобового аэродинамического сопротивления будет рассчитываться по формуле F = Сх*S*V2*r/2, где С — это коэффициент аэродинамического сопротивления, S – площадь передней поверхности автомобиля, V является скоростью, а r обозначает плотность воздуха. Даже тут будет множество нюансов и результаты будут зависеть даже от формы машины. На этом примере можно понять, что эта величина зависит от тела, совершающего действие и от внешних показателей, таких как плотность. Плотность воздуха больше влияет на объекты, которые находятся в воздушном пространстве.
Такая формула позволяет измерить силу, с которой различные факторы влияют на сопротивление. Это помогает, например, на производствах. Для уменьшения силы трения на изделии уменьшают шероховатости и делают более обтекаемые формы. Специалисты нашей лаборатории могут провести необходимые расчеты или же другое исследование. Исследование микроклимата также является очень важной и необходимой процедурой и мы готовы провести его с использованием самого точного оборудования. Благодаря ему вы можете узнать о качестве воздуха, его влажности, температуре, скорости движения и многих других факторах, которые влияют на работоспособность и здоровье человека.
Формула плотности по воздуху
Она представляет собой формулу, необходимую для расчета массы газа атмосферы. Этот показатель является очень важным во многих сферах деятельности человека и учитывается в таких сферах, как авиаперелеты.
Ученые рассчитали стандартную величину плотности воздуха. При температуре 15 градусов она равна 1,225 кг/м³. Плотность воздуха может быть двух типов: массовой и весовой.
Формула относительной плотности по воздуху учитывает все особенности, к примеру то, что вес воздуха не является постоянным. Он зависит как от климата, так и от географических условий, в которых проводится расчет. В различных погодных условиях плотность может значительно различаться. Так в жаркую погоду плотность будет меньше, нежели в прохладных условиях. Плотность влажного воздуха ощутимо меньше, нежели плотность сухого. При этом в отличие от относительной массовая плотность является постоянной.
Для расчетов необходимо принять во внимание скорость света, которая представлена в виде c=3*10^8 м/с или же равняется 300000 километров в секунду. Она может быть как фазовой, так и групповой.
Плотность сухого воздуха можно рассчитать по формуле Менделеева-Клапейрона : ρ= p*M/R*T. ρ – плотность воздуха, M равно 29 г/моль, р это абсолютное давление, а Т — температура в кельвинах. Для влажного воздуха такая формула будет отличаться и выглядеть примерно как ρ = pd/Rd*T+ pv/Rv*T . Тут pd это частичное давление сухого воздуха , Rdпостоянная величина, равная 287,058 Дж/кг*К , pvвыступает как давление водяного пара, а Rv постоянная, равная 461,495 Дж/кг*К.
Но не только плотность воздуха важна, но и другие показатели. К примеру, качественный воздух подразумевает под собой и состав, соответствующий различным нормам. Микробиологический анализ воздуха может вам рассказать о том, что содержится в воздухе, которым вы дышите.
Формула объема воздуха
Как же вычислить объем воздуха? Для этого тоже существуют свои методы и формулы. Для этого следует вычислить объем помещения, если вас интересуют показатели воздуха именно в нем. Это производится путем измерения длинны, высоты и ширины и перемножения всех величин. Этот способ подходит для помещений с правильной геометрической формой. Если же планировка не является симметричной, то следует это учесть при вычислениях.
Формула расчета объема воздуха V = A*В*Н, где A – длина, B – ширина, а H, собственно, высота является основной для помещений. Таким образом можно рассчитать объем, который находится внутри помещения.

Сам же воздух собой представляет смесь большого количества самых разнообразных газов. Азот составляет большую часть, равную 78,08 %. После этого идет кислород, содержание которого равно 20,945%. Все остальные газы содержатся уже в намного меньшем объеме. Но это состав воздуха в идеале. Сейчас, в результате деятельности человека, все эти показатели могут очень сильно отличаться от нормальных. Постоянные выбросы в атмосферу приводят к тому, что процентный состав воздуха может меняться и содержание примесей оказывается зачастую очень сильно завышенным. Особенно хорошо это можно наблюдать в местах различных производств, также автострады тоже могут нанести большой урон качеству состава воздуха в атмосфере Земли.
Наши специалисты могут провести для вас все необходимые вычисления и помочь там, где простая формула объема воздуха помочь не в силах. К примеру, для помещений со сложной планировкой необходимо использовать тот способ вычислений, который будет учитывать все особенности планировки. Мы не только проводим замеры и вычисления, но и выполняем целый спектр различных услуг. У нас можно заказать исследование почвы, которое способно сказать вам о составе и качестве вашего грунта.
Формула давления воздуха
Давление воздуха представляет собой атмосферное давление. Это давление атмосферного воздуха на предметы, которые располагаются на поверхности земли. Из-за того, что атмосферный воздух пребывает в постоянном движении то человек тоже может ощущать эту величину. Она также не является постоянной и зависит от погодных условий, и географического расположения. Немаловажную роль играет и высота. Давление воздуха уменьшается с высотой поэтому человек может начать себя плохо чувствовать при покорении горы. Это происходит именно потому, что атмосферное давление не соответствует оптимальной для человека норме на этой высоте.
Для измерения давления человек зачастую использует специальные барометры, среди которых самым точным будет ртутный. Есть и стандартная величина, равная 100 кПа.
Существует и формула расчета давления воздуха. К примеру формула давления воздуха для высоты меньше 100 км может представлять собой рh=poe*-ρogh/рo. Здесь рh выступает атмосферным давлением на высоте, рo, следовательно, давлением у поверхности Земли. Высота обозначается как h, ускорение свободного падения как g и ρo— это плотность воздуха. e является постоянной величиной, равной 2.71828.
Все эти расчеты можно провести самостоятельно, но доверив их в руки экспертов вы можете сэкономить не только свои нервы, но и время. В нашей лаборатории работают высококвалифицированные специалисты, которые в кратчайшие сроки проведут для вас все необходимые измерения. Также вы можете заказать и другую интересующую вас услугу. Существует целый перечень различных экспертиз, которые не только могут сказать вам о качестве вашего воздуха, но и выявить скрытые опасности. А эксперты-экологи проконсультируют вас по итогам анализов.





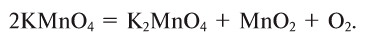
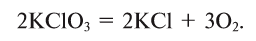
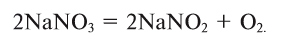
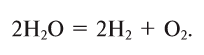

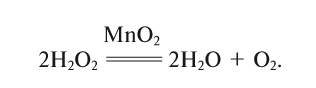
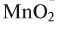

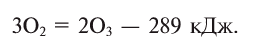
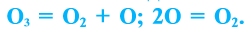
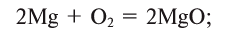
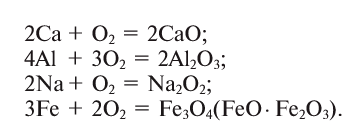
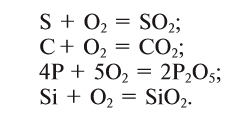
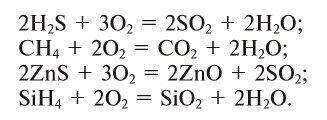

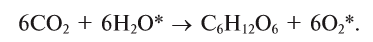
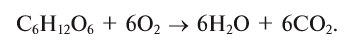
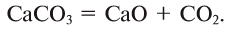


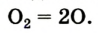
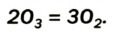

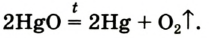
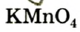 (бытовое название — марганцовка; вещество является распространенным дезинфицирующим средством)
(бытовое название — марганцовка; вещество является распространенным дезинфицирующим средством)