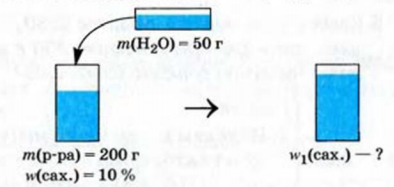
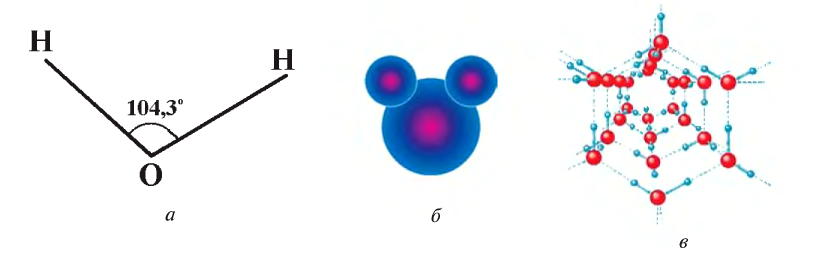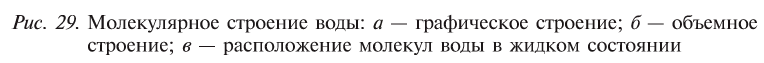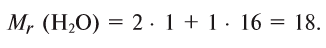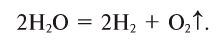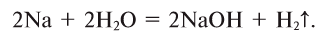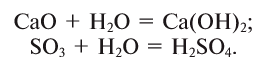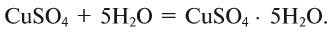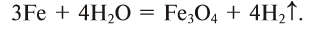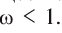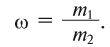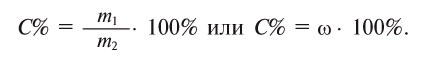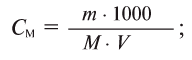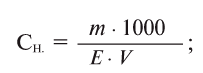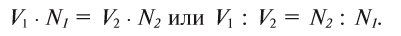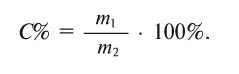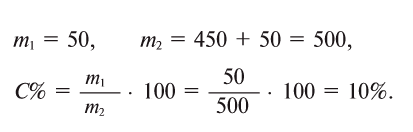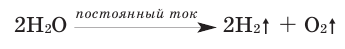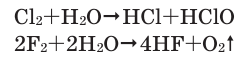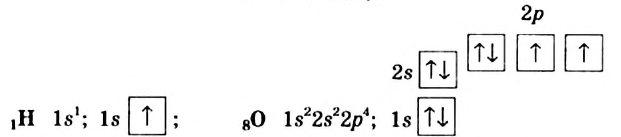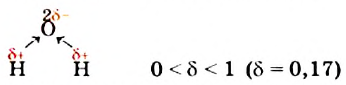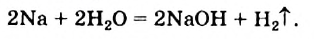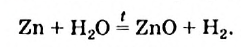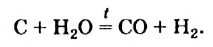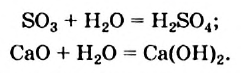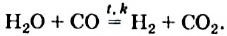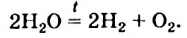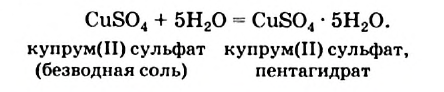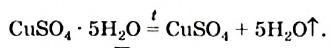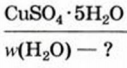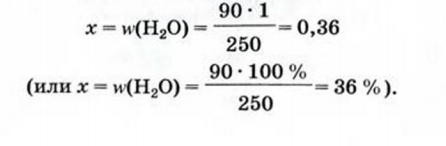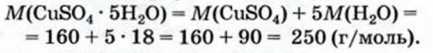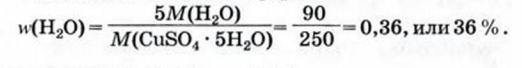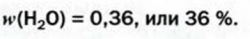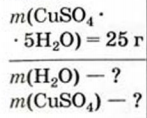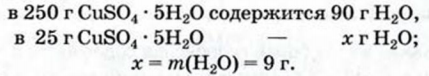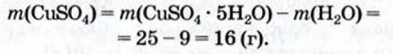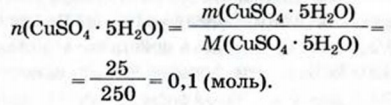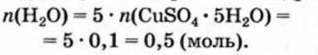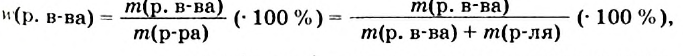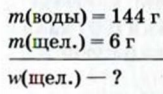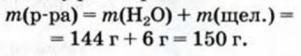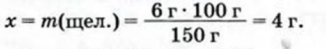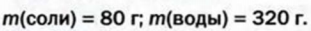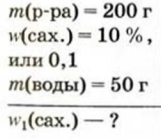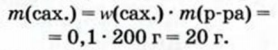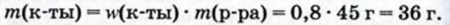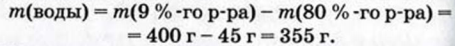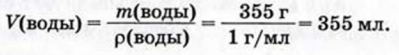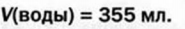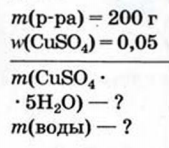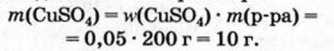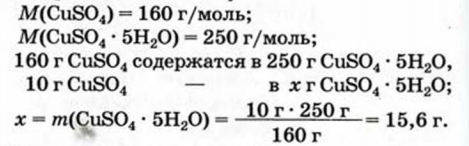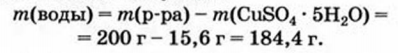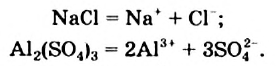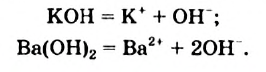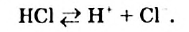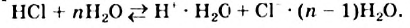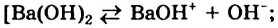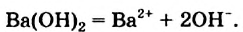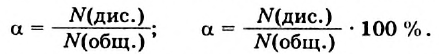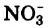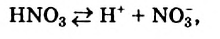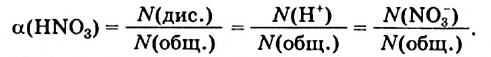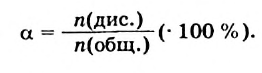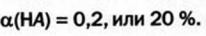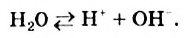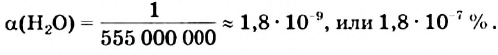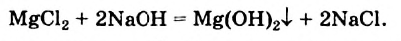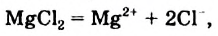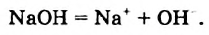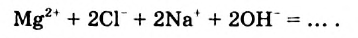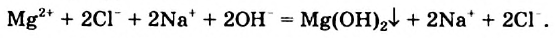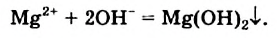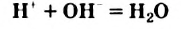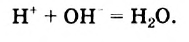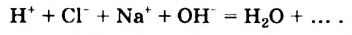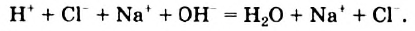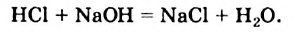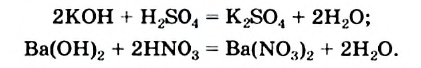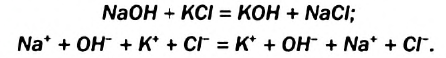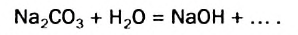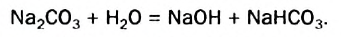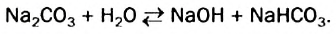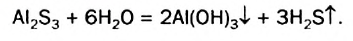Физические и химические свойства
Физические и химические свойства воды определяются химическим, электронным и пространственным строением молекул Н2O.
Атомы Н и О в молекуле Н20 находятся в своих устойчивых степенях окисления, соответственно +1 и -2; поэтому вода не проявляет ярко выраженных окислительных или восстановительных свойств. Обратите внимание: в гидридах металлов водород находится в степени окисления -1.
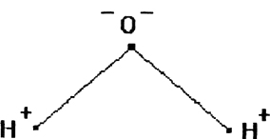
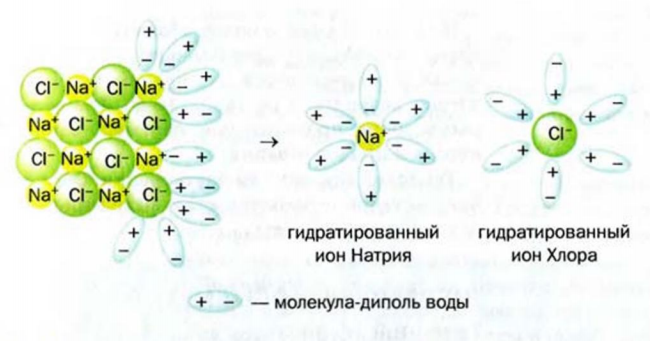
Молекула Н2O имеет угловое строение. Связи Н-O очень полярны. На атоме О существует избыточный отрицательный заряд, на атомах Н — избыточные положительные заряды. 8 целом молекула Н2O является полярной, т.е. диполем. Этим объясняется тот факт, что вода является хорошим растворителем для ионных и полярных веществ.
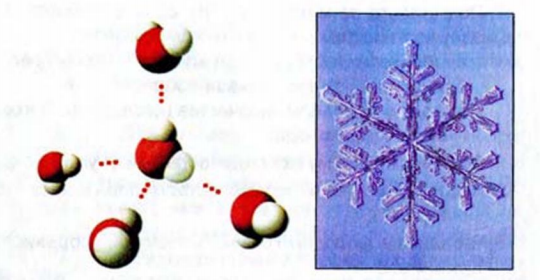
Наличие избыточных зарядов на атомах Н и О, а также неподеленных электронных пар у атомов О обусловливает образование между молекулами воды водородных связей, вследствие чего они объединяются в ассоциаты. Существованием этих ассоциатов объясняются аномально высокие значения т. пл. и т. кип. воды.
Наряду с образованием водородных связей, результатом взаимного влияния молекул Н2O друг на друга является их самоионизация:
в одной молекуле происходит гетеролитический разрыв полярной связи О-Н, и освободившийся протон присоединяется к атому кислорода другой молекулы. Образующийся ион гидроксония Н3О+ по существу является гидратированным ионом водорода Н+ • Н2O, поэтому упрощенно уравнение самоионизации воды записывается так:
Н2O ↔ H+ + OH—
Константа диссоциации воды чрезвычайно мала:
Это свидетельствует о том, что вода очень незначительно диссоциирует на ионы, и поэтому концентрация недиссоциированных молекул Н2O практически постоянна:
В чистой воде [Н+] = [ОН—] = 10-7 моль/л. Это означает, что вода представляет собой очень слабый амфотерный электролит, не проявляющий в заметной степени ни кислотных, ни основных свойств.
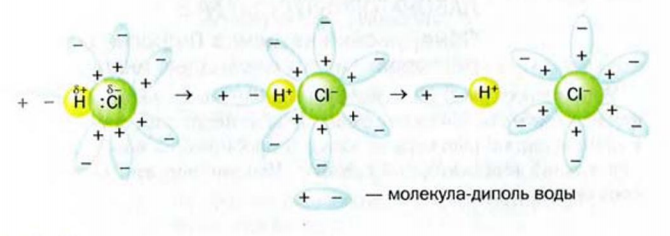
Однако вода оказывает сильное ионизирующее действие на растворенные в ней электролиты. Под действием диполей воды полярные ковалентные связи в молекулах растворенных веществ превращаются в ионные, ионы гидратируются, связи между ними ослабляются, в результате чего происходит электролитическая диссоциация. Например:
HCl + Н2O — Н3O+ + Сl—
(сильный электролит)
(или без учета гидратации: HCl → Н+ + Сl—)
CH3COOH + H2O ↔ CH3COO— + H+ (слабый электролит)
(или CH3COOH ↔ CH3COO— + H+)
Согласно теории кислот и оснований Брёнстеда-Лоури, в этих процессах вода проявляет свойства основания (акцептор протонов). По той же теории в роли кислоты (донора протонов) вода выступает в реакциях, например, с аммиаком и аминами:
NH3 + H2O ↔ NH4+ + OH—
CH3NH2 + H2O ↔ CH3NH3+ + OH—
Окислительно-восстановительные реакции с участием воды
Эти реакции возможны только с сильными восстановителями, которые способны восстановить ионы водорода, входящие в состав молекул воды, до свободного водорода.
а) При обычных условиях Н2О взаимодействует только со щел. и щел.-зем. металлами:
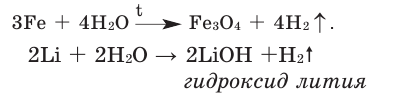
2Na + 2Н+2О = 2NaOH + H02↑
Ca + 2Н+2О = Ca(OH)2 + H02↑
б) При высокой температуре Н2О вступает в реакции и с некоторыми другими металлами, например:
Mg + 2Н+2О = Mg(OH)2 + H02↑
3Fe + 4Н+2О = Fe2O4 + 4H02↑
в) Al и Zn вытесняют Н2 из воды в присутствии щелочей:
2Al + 6Н+2О + 2NaOH = 2Na[Al(OH)4] + 3H02↑
C + Н+2О = CO + H02↑ («водяной газ»)
2P + 6Н+2О = 2HPO3 + 5H02↑
В присутствии щелочей кремний вытесняет водород из воды:
Si + Н+2О + 2NaOH = Na2SiO3 + 2H02↑
NaH + Н+2 O = NaOH + H02↑
CaH2 + 2Н+2О = Ca(OH)2 + 2H02↑
CO + Н+2O = CO2 + H02
2CH4 + O2 + 2Н+2 O = 2CO2 + 6H02
Реакции используются в промышленности для получения водорода.
ти реакции возможны только с очень сильными окислителями, которые способны окислить кислород СО С. О. -2, входящий в состав воды, до свободного кислорода O2 или до пероксид-анионов [O2]2-. В исключительном случае (в реакции с F2) образуется кислород со c o. +2.
2F2 + 2Н2O-2 = O02 + 4HF
или:
2F2 + Н2O-2 = O+2F2 + 2HF
Н2O-2 + O• = Н2O—2
При высокой Т происходит обратимая реакция
2Cl2 + 2Н2O-2 = O02 + 4HCl
Под действием электрического тока или высокой температуры может происходить разложение воды на водород и кислород:
2Н+2O-2 = 2H02↑ + O02↑
Термическое разложение — процесс обратимый; степень термического разложения воды невелика.
Обратимый гидролиз:
а) по катиону соли
Fe3+ + Н2O = FeOH2+ + Н+; (кислая среда. рН
б) по аниону соли
СО32- + Н2O = НСО3— + ОН—; (щелочная среда. рН > 7)
в) по катиону и по аниону соли
NH4+ + СН3СОО— + Н2O = NH4OH + СН3СООН
(среда, близкая к нейтральной)
Необратимый гидролиз:
Al2S3 + 6Н2O = 2Аl(ОН)3↓ + 3H2S↑
Al4C3 + 12Н2O = 4Аl(ОН)3↓ + 3CH4↑
нетан
СаС2 + 2Н2O = Са(ОН)2 + С2Н2↑
ацетилен
Mg2Si + 4Н2O = 2Mg(OH)2↓ + SiH4↑
силан
Ca3N2 + 6Н2O = ЗСа(ОН)2 + 2NH3↑ аммиак
Cu3P2 + 6Н2O = ЗСu(ОН)2 + 2РН3↑
фосфин
Cl2 + Н2O = HCl + HClO
Вr2 + Н2O = НВr + НВrО
| Классы органических веществ | Продукты гидролиза (органические) |
| Галогеналканы (алкилгалогениды) | Спирты |
| Арилгалогениды | Фенолы |
| Дигалогеналканы | Альдегиды или кетоны |
| Алкоголяты металлов | Спирты |
| Галогенангидриды карбоновых кислот | Карбоновые кислоты |
| Ангидриды карбоновых кислот | Карбоновые кислоты |
| Сложные зфиры карбоновых кислот | Карбоновые кислоты и спирты |
| Жиры | Глицерин и высшие карбоновые кислоты |
| Ди- и полисахариды | Моносахариды |
| Пептиды и белки | α-Аминокислоты |
| Нуклеиновые кислоты | Азотсодержащие гетероциклы, пентозы (рибоза или дезоксирибоза) |
1.1. Физические свойства воды
Физические свойства в полной мере изложены во многих работах. Вода (Н2O) – простейшее устойчивое химическое соединение водорода с кислородом, бесцветная жидкость с температурой кипения 100 °С. Химическая формула воды такая простая: Н2О; Н–О–Н [1–8]. Размер одной молекулы воды составляет около 3 Å (ангстрем) или примерно 0,28 нм (нанометра).
Рис. 1. Схема строения
молекулы воды
Рис. 2. Тетраэдрическая структура молекулы воды
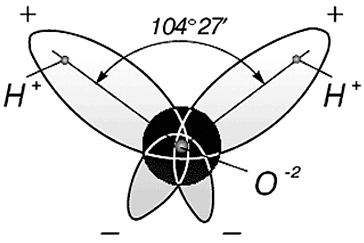
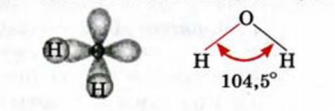
Вода состоит из одного относительно большого атома кислорода и двух небольших атомов водорода, вокруг которого вращается облачко общих отрицательно заряженных электронов (рис. 1). Угол H–O–H молекулы H2O в газообразном и жидком виде колеблется от 104,5 до 109°
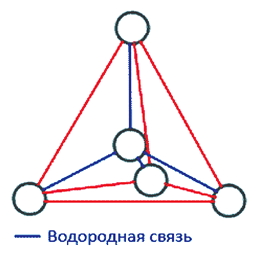
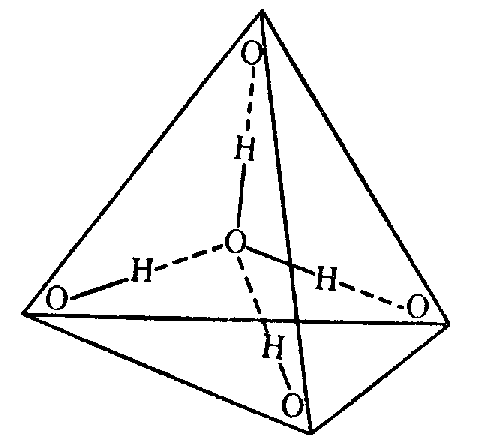
Во льду все молекулы связаны между собой водородными связями. При этом четыре связи каждой молекулы локально организованы в тетраэдрическую структуру, четыре близлежащие молекулы располагаются в вершинах трехгранной пирамиды, в центре которой находится пятая молекула
воды (рис. 2).
Положительно заряженное ядро атома кислорода, ввиду своей большой массы и заряда, сильнее притягивает к себе электронное облачко, оголяя при этом ядра водорода.
Три ядра в молекуле воды образуют равнобедренный треугольник с двумя протонами водорода в основании и кислородом в вершине. Расстояние O–H 0,9568 Å (0,1 нм); H–H – 1,54 Å (0,15 нм). Модель молекулы воды, предложенная Нильсом Бором [9], показана на рис. 3.
а б
Рис. 3. Строение молекулы воды, предложенное Н. Бором [9]:
а – угол между связями H–H;
б – внешний вид электронного облака молекулы воды
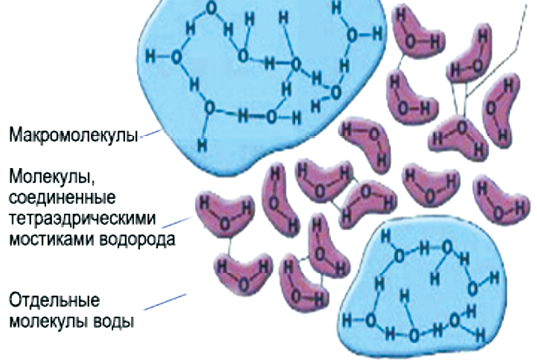
Свойства воды в основном зависят от водородных связей. Из-за большой разности электроотрицательности атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а также того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому каждый атом кислорода притягивается к атомам водорода других молекул и наоборот.
Каждая молекула воды может участвовать максимум в четырех водородных связях: два атома водорода – каждый в одной, а атом кислорода – в двух; в таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвется, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность ее растет, но при температуре выше 4 °С этот эффект становится слабее. При испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная
теплота плавления и кипения и высокая теплоемкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями. Строение электронного облака молекулы воды таково, что во льду каждая молекула связана четырьмя водородными связями с ближайшими к ней молекулами, координационное число молекул в структуре льда равно четырем. О размере молекулы можно судить по величине расстояния между ближайшими молекулами во льду, составляющего 2,67 Å (0,267 нм). Соответственно молекуле воды можно приписать радиус равный 1,38 Å (0,138 нм). Дипольный момент воды равен 1,87 Дебая. Электрический дипольный момент – векторная физическая величина, характеризующая, наряду с суммарным зарядом электрические свойства системы заряженных частиц (распределения зарядов) в смысле создаваемого ею поля и действия на нее внешних полей.
Исследования показали, что в воде сохраняется ближняя упорядоченность, свойственная структуре льда. Следовательно, тенденция каждой молекулы воды к окружению четырьмя ближайшими молекулами и к образованию с ними водородных связей свойственна как жидкому, так и твердому состоянию. Расстояние между ближайшими молекулами при плавлении льда изменяется от 2,76 Å (0,276 нм) до 2,90 Å (0,29 нм). Свойственное среднее расположение ближайших молекул ведет к очень рыхлой, ажурной структуре. Именно с этим связаны аномальные свойства воды.
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула является миниатюрным диполем с высоким дипольным моментом.
Полярность молекул, наличие в них частично некомпенсированных электрических зарядов создает группировки молекул – ассоциаты. Полностью соответствует формуле Н2O лишь вода, находящаяся в парообразном состоянии. В температурном интервале от 0 до 100 °С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1 %. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой
[Н2O]Х. Причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды.
Неравномерное распределение электрических зарядов приводит к тому, что молекула воды поляризуется, становится маленьким магнитиком.
В магнитном поле Земли молекулы воды, находящейся в жидком состоянии, собираются в некие нестабильные конструкции под действием притяжения разноименно заряженных полюсов. Нестабильность таких конструкций определяется слабостью водородных связей между молекулами воды, называемых иногда водородными мостиками.
Тетраэдрическая форма отдельной молекулы повторяется в кристаллической структуре льда. Возможно, определенную роль здесь играет то, что угол H–O–H молекулы H2O почти равен идеальному тетраэдрическому углу 109°, а молекулы воды, как мы знаем, объединяются с помощью водородных связей, которые они образуют именно в направлении O–H. Эти трехгранные пирамиды могут также объединяться в некую сверхструктуру. Во льду такая сложная трехмерная сверхструктура из тетраэдров простирается на весь объем (рис. 4).
Рис. 4. Структура Н2О льда
Льдообразная молекула воды содержит как простые молекулы воды, так и кластера льдообразных структур (рис. 5).
Рис. 5. Структура льдообразной воды
Содержание:
- Вода
- Химический состав воды
- Физические свойства воды
- Способы очистки воды
- Вода – обыкновенное чудо
- Химические свойства воды
- Взаимодействие воды с простыми веществами
- Взаимодействие воды со сложными веществами
- Применение воды
- Причины загрязнения воды
- Жесткость воды способы ее устранения
- Вода в природе
- Физические свойства воды
- Диаграмма состояния воды
- Химические свойства воды
- Растворы
- Характеристика растворов. Процесс растворения
- Способы выражения состава растворов
- Гидраты и кристаллогидраты
- Растворимость
- Пересыщенные растворы
- Осмос
- Давление пара растворов
- Замерзание и кипение растворов
Вода — окисел водорода, содержащий 88.6% кислорода и 11,4% водорода, что отвечает простейшей формуле H²O. Эта формула знакома всем — даже людям, знающим о химии только понаслышке.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Вода
Вода (оксид водорода, гидроксид водорода) — бинарное неорганическое соединение с химической формулой H2O: молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях).
Что вы знаете о воде? Где она встречается? Для чего нужна вода? Как можно получить чистую воду?
Вода – химическое вещество, с которым вы знакомы с рождения.
Вода – основа жизни, самое распространенное на Земле вещество. Вода занимает 3/4 поверхности земного шара. Организмы человека и животных на 65–70% состоят из воды, а в растениях ее содержание достигает 90%. В зависимости от давления и температуры вода может находиться в жидком, твердом и газообразном состоянии в виде тумана, облака, дождя, росы, льда и т. д.
Химическая формула воды – 
Химический состав воды
• качественно: Н и О – атомы водорода и кислорода;
• количественно: m (H) : m (O) = 1 : 8;
Физические свойства воды
Чистая вода – бесцветная жидкость без запаха и вкуса. При нормальном давлении кипит при 100°C и замерзает при 0°C, превращаясь в лед (

Если глубина слоя воды превышает 5 м, то она кажется голубой.
Теплоемкость воды очень высокая, поэтому в знойный летний день возле водоемов всегда прохладно. Поглощенное за летний период тепло вода постепенно отдает в зимнее время в окружающее пространство, смягчая климат Земли; задерживает до 60% теплового излучения нашей планеты, не давая ей охлаждаться. По этой причине над поверхностью озер и рек в
холодное зимнее время стоит туман.
Природная вода всегда содержит нерастворимые и растворимые примеси. В морской воде примерно 3,5% растворенных солей, а в проточной и подземной воде – большое количество солей магния и кальция. В дождевой и талой воде примеси в основном представлены растворенными газами 
Способы очистки воды
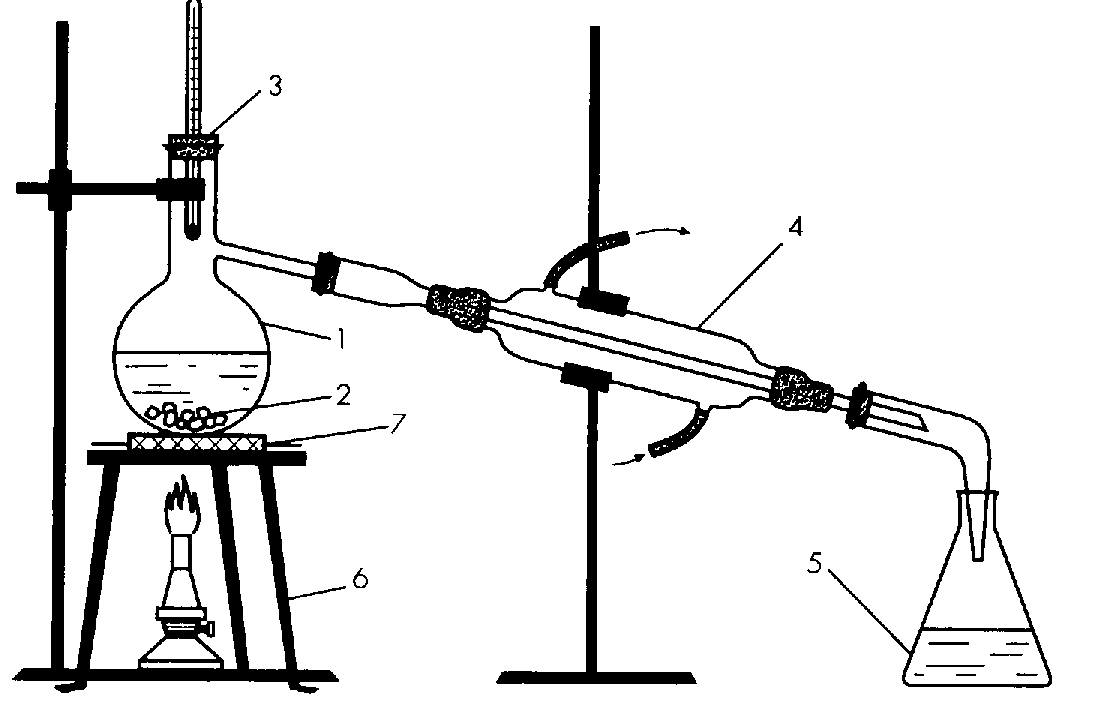
Они зависят от того, какими примесями и насколько она загрязнена. От нерастворимых примесей воду очищают с помощью отстаивания и фильтрования. От растворимых примесей – способом перегонки. Чистая, без примесей, вода называется дистиллированной (рис. 75).
Питьевую воду получают путем очистки природной воды. Очистка природных вод – основная проблема водоснабжения мегаполисов. Для этого отфильтрованную воду направляют в отстойники, где происходит оседание неотфильтрованных частиц. Затем вода направляется на вторичную очистку. Ее обрабатывают хлором, иногда озоном для уничтожения бактерий. Все эти операции выполняются на специально оборудованных площадках водоочистительных станций (рис. 76).
Сточные воды крупных промышленных предприятий, отходы сельскохозяйственных комплексов также требуют дополнительной очистки. Их нельзя сбрасывать в водоемы, и за этим строго следят органы экологического контроля.
Дистиллированная вода по составу близка к дождевой воде. Она используется при изготовлении лекарственных препаратов, а также в научно-исследовательских целях.
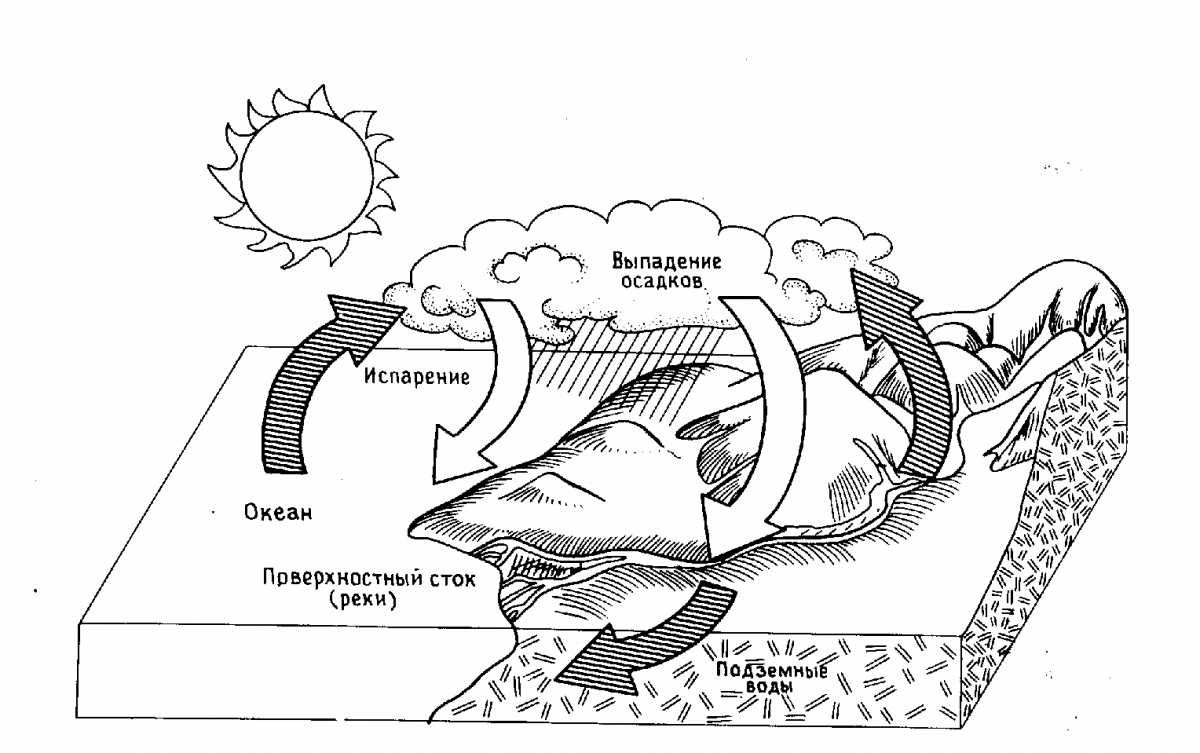
Атмосфера постоянно насыщается парами воды, которая испаряется с поверхности морей, рек, ледников, почвы и листьев растений. Избыток поступивших в нее паров конденсируется на взвешенных пылинках, образуя дождь и снег. Выпавшие осадки, собираясь в реках, озерах и подземных водах, попадают в моря.
С древнейших времен на нашей планете совершается такой круговорот воды: море → атмосфера → дождь или снег → море (рис. 77).
Всевозможные экологические катастрофы связаны с нарушением круговорота воды. Например, попавшие в воду нефтепродукты быстро растекаются по ее поверхности, уменьшая тем самым испарение и задерживая круговорот воды.
На территории Казахстана насчитывается 85 022 реки и временных водотока, в том числе 84 694 реки длиной 100 км, 305 – до 500 км, 23 реки длиной свыше 500–1000 км. Ертис – наиболее многоводная река Казахстана. Его длина в пределах РК составляет 1700 км (общая длина 4248 км). Вторая по величине река Сырдария длиной 1400 км в пределах республики (общая 2219 км). Река Иле в пределах РК 815 км (1001 км). Наиболее значительные реки РК – Жайык, Ертис, Тобол, Иле, Шу, Торгай, Сарысу, Талас, Нура, Эмба и др.
В Казахстане имеется 48 262 озера: Каспийское, Аральское моря, Балкаш, Тениз, Алаколь, Маркаколь, Зайсан и др. Более подробно о водных ресурсах РК вы узнаете при изучении «Физической географии Казахстана».
Вода – обыкновенное чудо
Главное из природных богатств – это вода.
Вода вездесуща. Это единственное вещество, которое существует на Земле в трех агрегатных состояниях. Она находится во всех земных сферах, не только в гидросфере, т. е. в океанах, морях, озерах, болотах, реках, ледниках, подземных водах, но и в атмосфере – на поверхности суши и в воздухе, в литосфере – в почве и в земной коре и в биосфере – в организмах всех животных и растений.
Вода – среда жизни. Одно из удивительных физико-химических свойств воды – это высокая растворяющая способность. Вода является инертным растворителем, т. е. химически не изменяющимся под воздействием тех веществ, которые растворяет. Поэтому вещества, необходимые для живых тканей, попадают в организм с водой в малоизмененном виде.
Вода – основной источник кислорода, входящего в состав атмосферного воздуха. Растения выделяют кислород в процессе фотосинтеза.
Вода регулирует климат. Исключительно высокая теплоемкость воды привела к тому, что океан стал регулировать климат Земли.
Вода формирует поверхность Земли. Реки, ручьи размывают горы, образуя широкие долины или глубокие ущелья, меняя таким образом ландшафт.
Вода – источник электрической энергии. Гидроэлектростанции превращают механическую энергию водного потока в электрическую.
Главное преимущество ГЭС перед тепловыми электростанциями (ТЭС), в которых используется энергия сжигаемого топлива, – это постоянное самовозобновление источника энергии, поэтому стоимость эксплуатации дешевле.
Вода – самая оживленная «трасса» для мореходных судов и танкеров.
Вода – целитель. Из-за высокой теплоемкости и большой теплопроводности она хорошо растворяет соли и газы и при купании благотворно влияет на кожный покров, улучшает кровообращение.
Вода – «землекоп». Гидромеханизация – подача воды под большим давлением. Под давлением в 6–12 атм вода легко размывает рыхлые горные породы, а при давлении 15–20 атм – более твердые. Гидромеханизация широко применяется на золотых приисках и угольных шахтах.
Вода измеряет. Человек выбрал воду в качестве эталона для измерения температуры, массы, количества тепла, времени, высоты местности.
В Древней Греции для измерения времени использовали водяные часы. Наверное, там и родилось выражение «ваше время истекло».
Вода тушит пожары. Вода не горит, потому что является продуктом сгорания водорода. При тушении пожара вода охлаждает горящие предметы, преграждает доступ кислорода из воздуха к очагу возгорания.
Вода – разрушитель. При замерзании вода расширяется. Превращаясь в лед, вода «рвет» даже гранитные валуны на части. Отсюда и пословица: «Вода камень точит».
Вода и магия. С древних времен воде приписывали магические свойства. Это отразилось, например, в христианском обряде крещения, совершаемом в знак приобщения к религии Христа. Мусульмане перед пятикратным намазом совершают омовение.
Погружению в воду или обливанию во многих религиях придают значение не только физического, но и нравственного очищения.
Иногда о человеке, предугадавшем события, говорят: «Как в воду глядел».
Вода угрожает. Если воды оказывается катастрофически много или мало, то происходит стихийное бедствие (наводнение, засуха).
В настоящее время человек мужественно и умело борется со стихией, возводя плотины и дамбы, строя водохранилища. В Казахстане множество водохранилищ, самые крупные: Буктармин ское, Капшагайское, Шардаринское и Коксараинское.
Вода является для человека более ценным природным богатством, чем нефть и газ, железо и уголь и т. д., ибо она незаменима.
Что такое «мертвая вода»? Это D.,0 или Т.,О. Цвет, вкус и запах у них, как у воды, но они тормозят процесс обмена веществ, в клетке происходят необратимые процессы, что способствует быстрому старению организма. У «мертвой воды» температура плавления и кипения, а также плотность выше, чем у обыкновенной воды, а растворимость ниже.
Химические свойства воды
Водород, кислород, растворитель.
Под действием электрического тока или при температуре 2000°С происходит разложение воды. Эта реакция, как вы уже знаете, – один из способов получения водорода:
Разложение соединения на составные части называется анализом. Реакция получения сложных молекул (воды) из простых веществ называется синтезом:
Взаимодействие воды с простыми веществами
1. Взаимодействие воды с активными металлами также рассматривалось нами как один из способов получения водорода в лабораторных условиях. При этом протекают реакции замещения:
При взаимодействии металлов средней активности при нагревании с водой образуются оксид металла и водород:
Малоактивные металлы с водой не реагируют.
2. При определенных условиях вода реагирует с некоторыми неметаллами. При пропускании паров воды над раскаленным углем происходит реакция:
В результате реакции образуется смесь двух газов, которые способны гореть. Такая газовая смесь называется водяным газом.
При пропускании хлора через воду образуется смесь двух кислот хлора:
Взаимодействие воды со сложными веществами
1. С оксидами активных металлов вода реагирует с образованием растворимых оснований –
щелочей:
При взаимодействии оксида кальция (негашеная известь) с водой реакция протекает бурно с выделением большого количества тепла (рис. 78), и образуется гидроксид кальция (гашеная известь):
Отсюда можно сделать следующий вывод:
2. Гидриды активных металлов вступают во взаимодействие с водой по реакции:
В результате реакции образуются щелочи и водород.
3. Оксиды некоторых неметаллов взаимодействуют с водой с образованием кислот:
Следовательно:
4. Некоторые соли химически взаимодействуют с водой с образованием кристаллогидратов. Кристаллогидратами называют кристаллические гидраты определенного состава:
При расчете молекулярных масс кристаллогидратов масса воды суммируется с массой соли:
Применение воды
Вода – второй (после кислорода) по величине природный ресурс, используемый человеком. Применение ее в промышленности, сельском хозяйстве и в быту очень многообразно.
Основные области применения воды показаны на схеме 10.
- • Содержание воды в костях достигает 31%.
- • На вершине Эвереста вода кипит при 71 С.
- • Жирафы могут обходиться без воды дольше, чем верблюды.
Сколько жидкости в нашем теле? 5 л крови; 2 л лимфы; 28 л внутриклеточной и межклеточной воды; 1,5 л слюны, 5 л желудочного сока; 1 л желчи; 0,7 л сока поджелудочной железы; 0,1-0,2 л воды в головном и спинном мозге. Конечно же, это не чистая вода, а растворенные в воде органические и неорганические вещества. Очень много воды в стекловидном теле глаза (99%), а меньше всего — в эмали зубов.
Причины загрязнения воды
Почему в жесткой воде мыло не пенится? Знаете ли вы причину этого явления?
В 1886 году немецкий ученый, дарвинист Эрнест Геккель ввел понятие «экология». В переводе с греческого это означает «наука о постоянном местожительстве». Химическая наука при решении вопросов охраны природы и рационального использования природных ресурсов имеет решающую роль. В то же время химическая промышленность, принося нам пользу, одновременно является источником загрязнения окружающей среды. Поэтому нельзя
изучать химию, не касаясь экологической проблемы.
Причины загрязнения воды:
Наиболее распространенным загрязнителем воды являются углеводороды (нефть и нефтепродукты), которые попадают в воду в основном при их транспортировке и авариях, а также радиоактивные вещества (рис. 79).
В промышленных районах загрязняются не только атмосфера, но и водные объекты. В Балкаше качество воды ухудшается из-за деятельности Балкашского медеплавильного завода, который сбрасывает в озеро использованную воду. На реке Ертис ПДК по железу, меди и марганцу превышены в 1,7–1,8 раза. Только в Восточно-Казахстанской области в бассейн реки ежегодно сбрасывается 200 млн 
С точки зрения химического воздействия на природу, ученые выделяют следующие направления:
1) потребление химических веществ из природы;
2) загрязнение природы отходами человеческой деятельности;
3) появление новых высокоактивных химических соединений, выделенных из природных источников или синтезированных человеком.
Многие экологические проблемы создает металлургическое производство. Его основные этапы:
1) добыча руды на месторождениях;
2) обогащение руды;
3) переработка руды и получение металлов.
Для производства металлов необходимы более сложные технические приспособления, чем для переработки минералов. Поэтому производство металлов – очень дорогостоящая отрасль. Из каждой добытой 1000 т сырья 1/4 часть остается в земле. При первичной обработке и обогащении руды теряется еще 1/3 произведенного сырья. Ведь обычно обогащение производится по одному элементу, а все остальное не используется. Поэтому вокруг горно-
обогатительных комбинатов растут «горы» из остатков и отходов.
Некоторые их составляющие вымываются дождевой водой и выветриваются. Вследствие этого снижается плодородие прилегающих почв, загрязняются реки и озера. Тем самым создается опасное санитарно-гигиеническое состояние среды.
Для охраны природы разрабатываются различные мероприятия. Среди них:
1. Комплексное использование руд с использованием циркуляционных принципов технологии.
2. Разработка и использование экологически чистых источников энергии.
3. Разработка новых фильтров, адсорбентов для задержания твердых и ядовитых газообразных отходов производства. 4. Повышение степени очистки сточных вод с использованием современных технологий.
В нашей республике экологические проблемы волнуют жителей особенно в таких городах, как Усть-Каменогорск, Павлодар, Темиртау, Шымкент, Тараз, Балкаш, а также космодром Байконур и ближайшие районы.
Жесткость воды способы ее устранения
Жесткость воды обусловлена наличием в ней ионов 

В жесткой воде мыло не пенится, поэтому используют синтетические моющие средства. Из-за жесткости воды на внутренних стенках трубопроводов и паровых котлов оседает
накипь – твердые соли 
Жесткость воды бывает двух видов: временная и постоянная (схема 11).
Временная жесткость вызвана присутствием в воде гидрокарбонатов 

устранимой.
Постоянная жесткость сохраняется при кипячении воды, она обусловлена содержанием 



чтобы осадить ионы кальция и магния.
В настоящее время для устранения жесткости воды применяются ионообменные смолы.
Жесткость воды, виды жесткости воды: временная, постоянная и общая; методы устранения жесткости.
Лабораторный опыт №10
Определение жесткости воды
Цель: знать понятие «жесткость воды» и способы ее устранения.
Возьмите две пробирки с жесткой водой (с ионами 
Вопросы и задания
1. Какую жесткость устраняют кипячением воды?
2. Почему добавили соду во вторую пробирку? Какую жесткость устраняют с помощью этого реактива?
3. Напишите свои наблюдения и уравнения проделанных опытов в лабораторный журнал. Сделайте соответствующие выводы.
ДЕЛАЕМ ВЫВОДЫ
- 1. Вода — универсальный растворитель, основа жизни.
- 2. В зависимости от температуры и давления вода может существовать в трех агрегатных состояниях: газообразном, твердом и жидком.
- 3. Вода — уникальное соединение. Плотность льда меньше плотности воды в жидком состоянии, поэтому лед плавает на поверхности воды, так как при температуре 4 С р(Н.,О) = 1 г/мл.
- 4. Вода взаимодействует с активными металлами, их оксидами.
Вода в природе
Вода—весьма распространенное па Земле вещество. Почти 3/4 поверхности земного шара покрыты водой, образующей океаны, моря, реки и озера. Много воды находится в газообразном состоянии в виде паров в атмосфере; в виде огромных масс снега и льда лежит она круглый год на вершинах высоких гор и в полярных странах. В недрах земли также находится вода, пропитывающая почву н горные породы.
Природная вода не бывает совершенно чистой. Наиболее чистой является дождевая вода, но и она содержит незначительные количества различных примесей, которые захватывает из воздуха.
Количество примесей в пресных водах обычно лежит в пределах от 0,01 до 0,1 % (масс.). Морская вода содержит 3,5 % (масс.) растворенных веществ, главную массу которых составляет хлорид натрия (поваренная соль).
Вода, содержащая значительное количество солей кальция и магния, называется жесткой в отличие от мягкой воды, например дождевой. Жесткая вода дает мало пены с мылом, а на стенках котлов образует накипь. Подробнее о жесткости воды см. § 212.
Чтобы освободить природную воду от взвешенных в ней частиц, ее фильтруют сквозь слой пористого вещества, например, угля, обожженной глины и т. п. При фильтровании больших количеств воды пользуются фильтрами из песка и гравия. Фильтры задерживают также большую часть бактерий. Кроме того, для обеззараживания питьевой воды ее хлорируют; для полной стерилизации воды требуется не более 0,7 г хлора на 1 т воды.
Фильтрованием можно удалить из воды только нерастворимые примеси. Растворенные вещества удаляют из нее путем перегонки (дистилляции) или ионного обмена (см. §212).
Вода имеет очень большое значение в жизни растений, животных и человека. Согласно современным представлениям, само происхождение жизни связывается с морем. Во всяком организме вода представляет собой среду, в которой протекают химические процессы, обеспечивающие жизнедеятельность организма; кроме того, она сама принимает участие в целом ряде биохимических реакций.
Физические свойства воды
Чистая вода представляет собой бесцветную прозрачную жидкость. Плотность воды при переходе ее из твердого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает. При нагревании воды от 0 до 4 °С плотность ее также увеличивается. При 4 °С вода имеет максимальную плотность, и лишь при дальнейшем нагревании ее плотность уменьшается.
Если бы при понижении температуры и при переходе из жидкого состояния в твердое плотность воды изменялась так же, как это происходит у подавляющего большинства веществ, то при приближении зимы поверхностные слои природных вод охлаждались бы до 0°С и опускались на дно, освобождая место более теплым слоям, и так продолжалось бы до тех пор, пока вся масса водоема не приобрела бы температуру 0°С. Далее вода начинала бы замерзать, образующиеся льдины погружались бы на дно и водоем промерзал бы на всю его глубину. При этом многие формы жизни в воде были бы невозможны. Но так как наибольшей плотности вода достигает при 4°С, то перемещение ее слоев, вызываемое охлаждением, заканчивается при достижении этой температуры, При дальнейшем понижении температуры охлажденный слой, обладающий меньшей плотностью, остается на поверхности, замерзает и тем самым защищает лежащие ниже слои от дальнейшего охлаждения и замерзания.
Большое значение в жизни природы имеет и тот факт, что вода обладает аномально высокой теплоемкостью [4,18Дж/(г*К)] *. Поэтому в ночное время, а также при переходе от лета к зиме вода остывает медленно, а днем или при переходе от зимы к лету так же медленно нагревается, являясь таким образом, регулятором температуры на земном шаре.
* Укажем для сравнения значения удельной теплоемкости некоторых веществ (Дж/(г*К)]: песок 0,79, известняк 0,88, хлорид натрия 0,88, глицерин 2,43, этиловый спирт 2,85.
В связи с тем, что при плавлении льда объем, занимаемый водой, уменьшается, давление понижает температуру плавления льда. Это вытекает из принципа Ле Шателье. Действительно, пусть лед и жидкая вода находятся в равновесии при 0°С. При увеличении давления равновесие, согласно принципу Ле Шателье, сместится в сторону образования той фазы, которая при той же температуре занимает меньший объем. Этой фазой является в данном случае жидкость. Таким образом, возрастание давления при 0°С вызывает превращение льда в жидкость, а это и означает, что температура плавления льда снижается.
Молекула воды имеет угловое строение; входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине — ядро атома кислорода. Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно примерно 0,15 нм. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды
две электронные пары образуют ковалентные связи О—Н, а остальные четыре электрона представляют собой две неподеленных электронных пары.
Как уже указывалось, атом кислорода в молекуле воды находится в состоянии sр3-гибридизацпи. Поэтому валентный угол НОН (104,3°) близок к тетраэдрическому (109,5°). Электроны, образующие связи О—Н, смещены к более электроотрицательному атому кислорода. В результате атомы водорода приобретают эффективные положительные заряды, так что на этих атомах создаются два положительных полюса. Центры отрицательных зарядов неподеленных электронных пар атома кислорода, находящиеся на гибридных sр3-орбнталях, смещены относительно ядра атома и создают два отрицательных полюса (рис. 71).
Рис. 71. Схема строения молекулы воды.
Молекулярная масса парообразной воды равна 18 и отвечает ее простейшей формуле. Однако молекулярная масса жидкой воды, определяемая путем изучения ее растворов в других растворителях (см. § 80), оказывается более высокой. Это свидетельствует о том, что в жидкой воде происходит ассоциация молекул, т. е. соединение их в более сложные агрегаты. Такой вывод подтверждается и аномально высокими значениями температур плавления и кипения воды (см. рис. 57). Как уже говорилось в § 47, ассоциация молекул воды вызвана образованием между ними водородных связей.
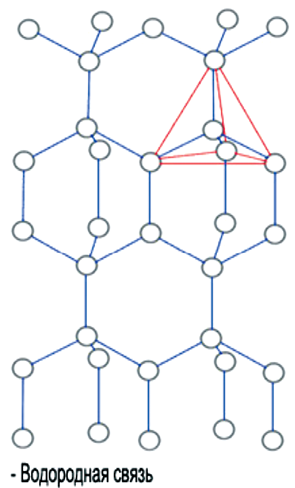
В твердой воде (лед) атом кислорода каждой молекулы участвует в образовании двух водородных связей с соседними молекулами воды согласно схеме
в которой водородные связи показаны пунктиром. Схема объемной структуры льда изображена на рис. 72. Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются друг с другом своими разноименными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащими к тому же слою, и с одной — из соседнего слоя. Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры которых несколько превышают размеры молекулы Н2О.
Рис. 72. Схема структуры льда.
При плавлении льда его структура разрушается. Но и в жидкой воде сохраняются водородные связи между молекулами: образуются ассоциаты — как бы обломки структуры льда, — состоящие из большего или меньшего числа молекул воды. Однако в отличие от льда каждый ассоциат существует очень короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах таких «ледяных» агрегатов могут размещаться одиночные молекулы воды; при этом упаковка молекул воды становится более плотной. Именно поэтому при плавлении льда объем, занимаемый водой, уменьшается, а ее плотность возрастает.
По мере нагревания воды обломков структуры льда в ней становится все меньше, что приводит к дальнейшему повышению плотности воды. В интервале температур от 0 до 4°С этот эффект преобладает над тепловым расширением, так что плотность воды продолжает возрастать. Однако при нагревании выше 4°С преобладает влияние усиления теплового движения молекул и плотность воды уменьшается. Поэтому при 4°С вода обладает максимальной плотностью.
При нагревании воды часть теплоты затрачивается на разрыв водородных связей (энергия разрыва водородной связи в воде составляет примерно 25 кДж/моль). Этим объясняется высокая теплоемкость воды.
Водородные связи между молекулами воды полностью разрываются только при переходе воды в пар.
Диаграмма состояния воды
Диаграмма состояния (или фазовая диаграмма) представляет собой графическое изображение зависимости между величинами, характеризующими состояние системы, и фазовыми превращениями в системе (переход из твердого состояния в жидкое, из жидкого в газообразное и т. д.). Диаграммы состояния широко применяются в химии. Для однокомпонентных систем обычно используются диаграммы состояния, показывающие зависимость фазовых превращений от температуры и давления; они называются диаграммами состояния в координатах Р — Т.
На рис. 73 приведена в схематической форме (без строгого соблюдения масштаба) диаграмма состояния воды. Любой точке на диаграмме отвечают определенные значения температуры и давления.
Диаграмма показывает те состояния воды, которые термодинамически устойчивы при определенных значениях температуры и давления. Она состоит из трех кривых, разграничивающих все возможные температуры и давления на три области, отвечающие льду, жидкости и пару.
Рис. 73. Диаграмма состояния воды в области невысоких давлений.
Рассмотрим каждую из кривых более подробно. Начнем с кривой ОА (рис. 73), отделяющей область пара от области жидкого состояния. Представим себе цилиндр, из которого удален воздух, после чего в него введено некоторое количество чистой, свободной от растворенных веществ, в том числе от газов, воды; цилиндр снабжен поршнем, который закреплен в некотором положении (рис. 74). Через некоторое время часть воды испарится и над ее поверхностью будет находиться насыщенный пар. Можно измерить его давление и убедиться в том, что оно не изменяется с течением времени и не зависит от положения поршня. Если увеличить температуру всей системы и вновь измерить давление насыщенного пара, то окажется, что оно возросло. Повторяя такие измерения при различных температурах, найдем зависимость давления насыщенного водяного пара от температуры. Кривая ОА представляет собой график этой зависимости: точки кривой показывают те пары значений температуры и давления, при которых жидкая вода и водяной пар находятся в равновесии друг с другом — сосуществуют. Кривая ОА называется кривой равновесия жидкость — пар или кривой кипения. В табл. 8 приведены значения давления насыщенного водяного пара при нескольких температурах.
Таблица 8. Давление насыщенного водяного пара при различных температурах
| Температура, °С | Давление насыщенного пара | Температура, °С | Давление насыщенного пара | ||
| кПа | мм рт. ст. | кПа | мм. рт. ст. | ||
| 0,61 | 4,6 | 50 | 12,3 | 92,5 | |
| 10 | 1,23 | 9,2 | 60 | 19,9 | 149 |
| 20 | 2,34 | 17,5 | 70 | 31,2 | 234 |
| 30 | 4,24 | 31,8 | 80 | 47,4 | 355 |
| 40 | 7,37 | 55,3 | 100 | 101,3 | 760 |
Рис. 74. Цилиндр с водой, находящейся в равновесии с водяным паром.
Попытаемся осуществить в цилиндре давление, отличное от равновесного, например, меньшее, чем равновесное. Для этого освободим поршень и поднимем его. В первый момент давление в цилиндре, действительно, упадет, но вскоре равновесие восстановится: испарится добавочно некоторое количество воды и давление вновь достигнет равновесного значения. Только тогда, когда вся вода испарится, можно осуществить давление, меньшее, чем равновесное. Отсюда следует, что точкам, лежащим на диаграмме состояния ниже или правее кривой ОА, отвечает область пара. Если пытаться создать давление, превышающее равновесное, то этого можно достичь, лишь опустив поршень до поверхности воды. Иначе говоря, точкам диаграммы, лежащим выше или левее кривой ОА, отвечает область жидкого состояния.
До каких пор простираются влево области жидкого и парообразного состояния? Наметим по одной точке в обеих областях и будем двигаться от них горизонтально влево. Этому движению точек на диаграмме отвечает охлаждение жидкости или пара при постоянном давлении. Известно, что если охлаждать воду при нормальном атмосферном давлении, то при достижении 0°С вода начнет замерзать. Проводя аналогичные опыты при других давлениях, придем к кривой ОС, отделяющей область жидкой воды от области льда. Эта кривая — кривая равновесия твердое состояние — жидкость, или кривая плавления, — показывает те пары значений температуры и давления, при которых лед и жидкая вода находятся в равновесии.
Двигаясь по горизонтали влево в области пара (в нижней части диаграммы), аналогичным образом придем к кривой ОВ. Это — кривая равновесия твердое состояние — пар, или кривая сублимации. Ей отвечают те пары значений температуры и давления, при которых в равновесии находятся лед и водяной пар.
Все три кривые пересекаются в точке О. Координаты этой точки — это единственная пара значений температуры и давления, при которых в равновесии могут находиться все три фазы: лед, жидкая вода и пар. Она носит название тройной точки.
Кривая плавления исследована до весьма высоких давлений. В этой области обнаружено несколько модификаций льда (на диаграмме не показаны).
Справа кривая кипения оканчивается в критической точке. При температуре, отвечающей этой точке, — критической температуре — величины, характеризующие физические свойства жидкости и пара, становятся одинаковыми, так что различие между жидким и парообразным состоянием исчезает.
Существование критической температуры установил в I860 г. Д. И. Менделеев, изучая свойства жидкостей. Он показал, что при температурах, лежащих выше критической, вещество не может находиться в жидком состоянии. В 1869 г. Эндрьюс, изучая свойства газов, пришел к аналогичному выводу.
Критические температура и давление для различных веществ различны. Так, для водорода tкрит = —239,9 °С, ркрит = 1,30 МПа, для хлора tкрит = 144°С, ркрит = 7,71 МПа, для воды tкрит = 374,2 °С, ркрит = 22,12 МПа.
Одной из особенностей воды, отличающих ее от других веществ, является понижение температуры плавления льда с ростом давления (см. § 70). Это обстоятельство отражается на диаграмме. Кривая плавления ОС на диаграмме состояния воды идет вверх влево, тогда как почти для всех других веществ она идет вверх вправо.
Превращения, происходящие с водой при атмосферном давлении, отражаются на диаграмме точками пли отрезками, расположенными на горизонтали, отвечающей 101,3 кПа (760 мм рт. ст.). Так, плавление льда или кристаллизация воды отвечает точке D (рис. 73), кипение воды — точке Е, нагревание или охлаждение воды — отрезку DE и т. п.
Диаграммы состояния изучены для ряда веществ, имеющих научное или практическое значение. В принципе они подобны рассмотренной диаграмме состояния воды. Однако на диаграммах состояния различных веществ могут быть особенности. Так, известны вещества, тройная точка которых лежит при давлении, превышающем атмосферное. В этом случае нагревание кристаллов при атмосферном давлении приводит не к плавлению этого вещества, а к его сублимации — превращению твердой фазы непосредственно в газообразную,
Химические свойства воды
Молекулы воды отличаются большой устойчивостью к нагреванию. Однако при температурах выше 1000°С водяной пар начинает разлагаться на водород и кислород:
Процесс разложения вещества в результате его нагревания называется термической диссоциацией. Термическая диссоциация воды протекает с поглощением теплоты. Поэтому, согласно принципу Ле Шателье, чем выше температура, тем в большей степени разлагается вода. Однако даже при 2000°С степень термической диссоциации воды не превышает 2 %, т. е. равновесие между газообразной водой и продуктами ее диссоциации — водородом и кислородом — все еще остается сдвинутым в сторону воды. При охлаждении же ниже 1000°С равновесие практически полностью сдвигается в этом направлении.
Для определения степени термической диссоциации вещества применяют различные методы. Олин из них основан на так называемом «замораживании равновесия». Если образовавшиеся при высокой температуре продукты диссоциации быстро охладить, то равновесие не успевает сразу сместиться, а затем уже не смещается ввиду крайне малой скорости реакции при низкой температуре. Таким образом сохраняется соотношение между веществами, существовавшее при высокой температуре. Это соотношение может быть определено путем анализа.
Вода — весьма реакционноспособное вещество. Оксиды многих металлов п неметаллов соединяются с водой, образуя основания и кислоты; некоторые соли образуют с водой кристаллогидраты (см. § 75); наиболее активные металлы взаимодействуют с водой с выделением водорода.
Вода обладает также каталитической способностью. В отсутствие следов влаги практически не протекают некоторые обычные реакции; например, хлор не взаимодействует с металлами, фтороводород не разъедает стекло, натрий не окисляется в атмосфере воздуха.
Вода способна соединяться с рядом веществ, находящихся при обычных условиях в газообразном состоянии, образуя при этом так называемые гидраты газов. Примерами могут служить соединения Хе*6Н2О, Сl2*8 Н2О, С2Н6*6Н2О, СзН8*17Н2О, которые выпадают в виде кристаллов при температурах от 0 до 24°С (обычно при повышенном давлении соответствующего газа). Подобные соединения возникают в результате заполнения молекулами газа («гостя») межмолекулярных полостей, имеющихся в структуре воды («хозяина»); они называются соединениями включения или клатратами.
В клатратных соединениях между молекулами «гостя» и «хозяина» образуются лишь слабые межмолекулярные связи: включенная молекула не может покинуть своего места в полости кристалла преимущественно из-за пространственных затруднений. Поэтому клатраты — неустойчивые соединения, которые могут существовать лишь при сравнительно низких температурах.
Клатраты используют для разделения углеводородов и благородных газов. В последнее время образование и разрушение клатратов газов (пропана и некоторых других) успешно применяется для обессоливания воды. Нагнетая в соленую воду при повышенном давлении соответствующий газ, получают льдоподобные кристаллы клатратов, а соли остаются в растворе. Похожую на снег массу кристаллов отделяют от маточного раствора п промывают. Затем при некотором повышении температуры пли уменьшении давления клатраты разлагаются, образуя пресную воду и исходный газ, который вновь используется для получения клатрата. Высокая экономичность и сравнительно мягкие условия осуществления этого процесса делают его перспективным в качестве промышленного метода опреснения морской воды.
Тяжелая вода. При электролизе обычной води, содержащей наряду с молекулами Н2О также незначительное количество молекул D2O, образованных тяжелым изотопом водорода, разложению подвергаются преимущественно молекулы Н2О. Поэтому при длительном электролизе воды остаток постепенно обогащается молекулами D2O. Из такого остатка после многократного повторения электролиза в 1933 г. впервые удалось выделить небольшое количество воды, состоящей почти на 100 % из молекул D2O и получившей название тяжелой веды.
По своим свойствам тяжелая вода заметно отличается от обычной воды (табл. 9). Реакции с тяжелой водой протекают медленнее, чем с обычной. Тяжелую воду применяют в качестве замедлителя нейтронов в ядерных реакторах.
Таблица 9. Некоторые константы обычной и тяжелой воды
| Константа | Н2О | D2O |
| Молекулярная масса | 18 | 20 |
| Температура замерзания, °С, | 3,8 | |
| Температура кипения, СС, | 100 | 101,4 |
| Плотность при 25 °С, г/см3 | 0,9971 | 1,1042 |
| Температура максимальной плотности, °С | 4 | 11,6 |
Растворы
Растворы имеют важное значение в жизни и практической деятельности человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т. д.). Производства, в основе которых лежат химические процессы, обычно связаны с использованием растворов.
Характеристика растворов. Процесс растворения
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут изменяться в широких пределах. Наиболее важный вид растворов — жидкие растворы, рассмотрению которых и посвящается настоящий раздел.
Всякий раствор состоит из растворенных веществ и растворителя, т. е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор (например, в случае водного раствора соли растворителем, конечно, является вода). Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
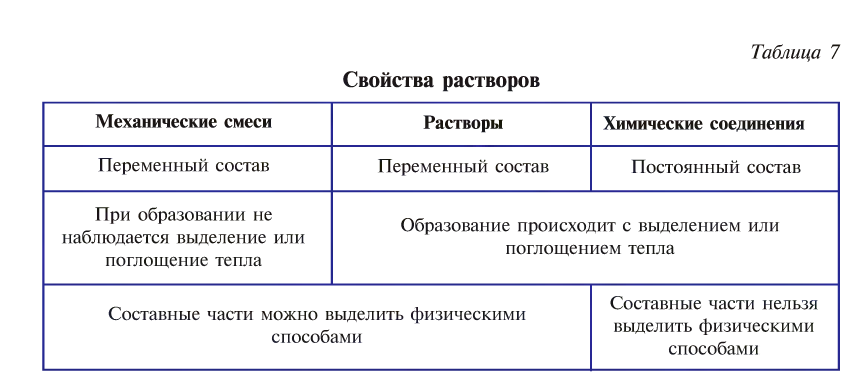
Однородность растворов делает их очень сходными с химическими соединениями. Выделение теплоты при растворении некоторых веществ тоже указывает па химическое взаимодействие между растворителем и растворяемым веществом. Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения. Непостоянство состава растворов приближает их к механическим смесям, но от последних они резко отличаются своею однородностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями.
Растворение кристалла в жидкости протекает следующим образом. Когда вносят кристалл в жидкость, в которой он может растворяться, от поверхности его отрываются отдельные молекулы. Последние благодаря диффузии равномерно распределяются по всему объему растворителя. Отделение молекул от поверхности твердого тела вызывается, с одной стороны, их собственным колебательным движением, а с другой, — притяжением со стороны молекул растворителя. Этот процесс должен был бы продолжаться до полного растворения любого количества кристаллов, если бы одновременно не происходил обратный процесс — кристаллизация. Перешедшие в раствор молекулы, ударяясь о поверхность еще нерастворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов. Понятно, что выделение молекул из раствора будет идти тем быстрее, чем выше их концентрация в растворе. А так как последняя по мере растворения вещества увеличивается, то, наконец, наступает такой момент, когда скорость растворения становится равной скорости кристаллизации. Тогда устанавливается динамическое равновесие, при котором в единицу времени столько же молекул растворяется, сколько и выделяется из раствора. Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором.
Способы выражения состава растворов
Насыщенные растворы применяют сравнительно редко. В большинстве случаев пользуются ненасыщенными растворами, содержащими меньше растворенного вещества, чем его содержит при данной температуре насыщенный раствор. При этом растворы с низким содержанием растворенного вещества называются разбавленными, с высоким — концентрированными.
Состав раствора (и, в частности, содержание в нем растворенного вещества) может выражаться разными способами — как с помощью безразмерных единиц (долей или процентов), так и через размерные величины — концентрации. В химической практике наиболее употребительны следующие величины, выражающие содержание растворенного вещества в растворе:
1. Массовая доля — отношение (обычно — процентное) массы растворенного вещества к массе раствора. Например, 15 % (масс.) водный раствор хлорида натрия — это такой раствор, в 100 единицах массы которого содержится 15 единиц массы NaCl и 85 единиц массы воды.
2. Молярная доля — отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, составляющих раствор. В случае раствора одного вещества в другом молярная доля растворенного вещества (N2) равна
N2 = n2/( n1 + n2)
а молярная доля растворителя (N1)
N1= n1/( n1 + n2)
где n1 и n2 — соответственно количества вещества растворителя п растворенного вещества.
3. Молярная концентрация, или молярность — отношение количества растворенного вещества к объему раствора. Обычно молярность обозначается См или (после численного значения молярности) М. Так, 2М H2SO4 означает раствор, в каждом литре которого содержится 2 моля серной кислоты, т. е. См = = 2 моль/л.
4. Моляльная концентрация, или моляльность — отношение количества растворенного вещества к массе растворителя. Обычно моляльность обозначается буквой m. Так, для раствора серной кислоты запись m = 2 моль/кг (Н2O) означает, что в этом растворе на каждый килограмм растворителя (воды) приходится 2 моля H2SO4. Моляльность раствора в отличие от его молярности не изменяется при изменении температуры.
5. Эквивалентная, или нормальная концентрация — отношение числа эквивалентов растворенного вещества к объему раствора. Концентрация, выраженная этим способом, обозначается Сн или (после численного значения нормальности) буквой н. Так, 2 н. H2SO4 означает раствор, в каждом литре которого содержится 2 эквивалента серной кислоты, т. е. Сн (1/2 H2SO4) = 2 моль/л.
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка. Пусть V1 л раствора вещества 1 с нормальностью N1 реагирует с V2 л раствора вещества 2 с нормальностью N2. Это означает, что в реакцию вступило N1V1 эквивалентов вещества 1 в N2V2 эквивалентов вещества 2. Но вещества реагируют в эквивалентных количествах, следовательно
V1N1 = V2N2
или
V1 : V2= N2 :N1
Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
На основании этой зависимости можно не только вычислять требуемые для проведения реакций объемы растворов, но и обратно, по объемам затраченных на реакцию растворов находить их концентрации.
Пример 1. Сколько миллилитров 0,3 н. раствора хлорида натрия надо прибавить к 150 мл 0,16 н. раствора нитрата серебра, чтобы осадить все находящееся в растворе серебро в виде хлорида серебра?
Подставляя данные задачи в последнее уравнение, получим:
150/V2= 0,3/0,16, откуда V2 = 0,16 * 150/0,3 = 80 мл
Пример 2. Для нейтрализации 40 мл раствора серной кислоты потребовалось прибавить к ним 24 мл 0,2 н. раствора щелочи. Определить нормальность взятого раствора H2SO4.
Обозначив неизвестную нормальность раствора серной кислоты через х, получим:
40: 24 = 0,2 : х, откуда х = 24 * 0,2/40 = 0,12 н.
Гидраты и кристаллогидраты
Большинство веществ, находящихся в кристаллическом состоянии, растворяются в жидкостях с поглощением теплоты. Однако при растворении в воде гидроксида натрия, карбоната калия, безводного сульфата меди и многих других веществ происходит заметное повышение температуры. Выделяется теплота также при растворении в воде некоторых жидкостей и всех газов.
Количество теплоты, поглощающейся (или выделяющейся) при растворении одного моля вещества, называется теплотой растворения. этого вещества.
Теплота растворения имеет отрицательное значение, если при растворении теплота поглощается, и положительное — при выделении теплоты. Например, теплота растворения нитрата аммония равна —26,4 кДж/моль, гидроксида калия +55,6 кДж/моль и т. д. *
* Значения теплот растворения изменяются в зависимости от количества взятого растворителя и температуры, при которой происходит растворение. Приведенные величины относятся к температуре 18—20°С и большому количеству воды (1 моль растворяемого вещества на 200—800 моль воды).
Процесс растворения сопровождается значительным возрастанием энтропии системы, так как в результате равномерного распределения частиц одного вещества в другом резко увеличивается число микросостояний системы. Поэтому, несмотря на эндотермичность растворения большинства кристаллов, изменение энергии Гиббса системы при растворении отрицательно и процесс протекает самопроизвольно.
При растворении кристаллов происходит их разрушение, что требует затраты энергии. Поэтому растворение должно было бы сопровождаться поглощением теплоты. Если же наблюдается обратный эффект, то это показывает, что одновременно с растворением происходит какое-то взаимодействие между растворителем и растворенным веществом, при котором выделяется в виде теплоты больше энергии, чем ее расходуется на разрушение кристаллической решетки.
Действительно, в настоящее время установлено, что при растворении многих веществ их молекулы (или ионы) связываются с молекулами растворителя, образуя соединения, называемые сольватами (от латинского solvere — растворять); этот процесс называется сольватацией. В частном случае, когда растворителем является вода, эти соединения называются гидратами, а самый процесс их образования — гидратацией.
В зависимости от природы растворенного вещества, сольваты могут образовываться различными путями. Так, при растворении веществ с ионной структурой молекулы растворителя удерживаются около иона силами электростатического притяжения. В этом случае говорят о ион-дипольном взаимодействии. Кроме того, может иметь место донорно-акцепторное взаимодействие. Здесь ионы растворенного вещества обычно выступают в качестве акцепторов, а молекулы растворителя — в качестве доноров электронных пар. Ясно, что в таком взаимодействии могут участвовать растворители, молекулы которых обладают неподеленными электронными парами (например, вода, аммиак). Гидраты, образующиеся в результате донорно-акцепторного взаимодействия, представляют собой частный случай комплексных соединений, рассматриваемых в главе XVIII ( аквакомплексы — см. § 204).
При растворении веществ с молекулярной структурой сольваты образуются вследствие диполь-дипольного взаимодействия. Диполи растворенного вещества могут быть при этом постоянными (у веществ с полярными молекулами) или наведенными (у веществ с неполярными молекулами).
Предположение о существовании в водных растворах гидратов высказано и обосновано в восьмидесятых годах XIX века Д. И. Менделеевым, который считал, что растворение— не только физический, но и химический процесс, что вещества, растворяющиеся в воде, образуют с ней соединения. Об этом свидетельствует прежде всего изучение теплот растворения.
Подтверждением химизма процесса растворения является и тот факт, что многие, вещества выделяются из водных растворов в виде кристаллов, содержащих так называемую кристаллизационную воду (см. ниже), причем на каждую молекулу растворенного вещества приходится определенное число молекул воды. «Это,— писал Д. И. Менделеев,— дает повод думать, что и в самих растворах имеются такие же или подобные им соединения растворенных тел с растворителем, только в жидком (и отчасти разложенном) виде».
Гидраты, как правило, нестойкие соединения, во многих случаях разлагающиеся уже при выпаривании растворов. Но иногда гидраты настолько прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов. Вещества, в кристаллы которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода — кристаллизационной.
Состав кристаллогидратов принято изображать формулами, показывающими, какое количество кристаллизационной воды содержит кристаллогидрат. Например, кристаллогидрат сульфата меди (медный купорос), содержащий на один моль CuSO4 пять молей воды, изображается формулой CuSO4*5H2O; кристаллогидрат сульфата натрия (глауберова соль)—формулой Na2SO4* 10Н2О.
Прочность связи между веществом и кристаллизационной водой в кристаллогидратах различна. Многие из них теряют кристаллизационную воду уже при комнатной температуре. Так, прозрачные кристаллы соды (Na2СОз* 10Н2О) легко «выветриваются», — теряя кристаллизационную воду, становятся тусклыми и постепенно рассыпаются в порошок. Для обезвоживания других кристаллогидратов требуется довольно сильное нагревание.
Процесс образования гидратов протекает с выделением теплоты. При растворении вещества, подвергающегося гидратации, общий тепловой эффект складывается из теплового эффекта собственно растворения и теплового эффекта гидратации. Поскольку первый из этих процессов эндотермичен, а второй экзотермичен, то общий тепловой эффект процесса растворения, равный алгебраической сумме тепловых эффектов отдельных процессов, может быть как положительным, так и отрицательным.
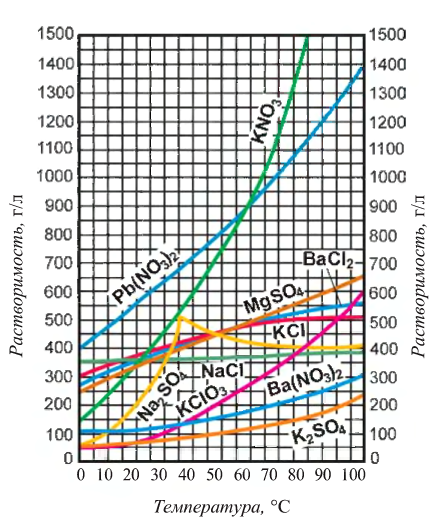
Растворимость
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях служит содержание его в насыщенном растворе. Поэтому численно растворимость может быть выражена теми же способами, что и состав, например, процентным отношением массы растворенного вещества к массе насыщенного раствора или количеством растворенного вещества, содержащимся в 1 л насыщенного раствора. Часто растворимость выражают также числом единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы растворителя; иногда выраженную этим способом растворимость называют коэффициентом растворимости.
Растворимость различных веществ в воде изменяется в широких пределах. Если в 100 г воды растворяется более 10 г вещества, то такое вещество принято называть хорошо растворимым; если растворяется менее 1 г вещества — малорастворимым и, наконец, практически нерастворимым, если в раствор переходит менее 0,01 г вещества.
Принципы, позволяющие предсказать растворимость вещества, пока не известны. Однако обычно вещества, состоящие из полярных молекул, и вещества с ионным типом связи лучше растворяются в полярных растворителях (вода, спирты, жидкий аммиак), а неполярные вещества — в неполярных растворителях (бензол, сероуглерод).
Растворение большинства твердых тел сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллической решетки твердого тела, что обычно не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольватов). Прилагая принцип Ле Шателье к равновесию между веществом в кристаллическом состоянии и его насыщенным раствором
приходим к выводу, что в тех случаях, когда вещество растворяется с поглощением энергии, повышение температуры должно приводить к увеличению его растворимости. Если же, однако, энергия гидратации (сольватации) достаточно велика, чтобы образование раствора сопровождалось выделением энергии, растворимость с ростом температуры понижается. Это происходит, например, при растворении в воде щелочей, многих солей лития, магния, алюминия.
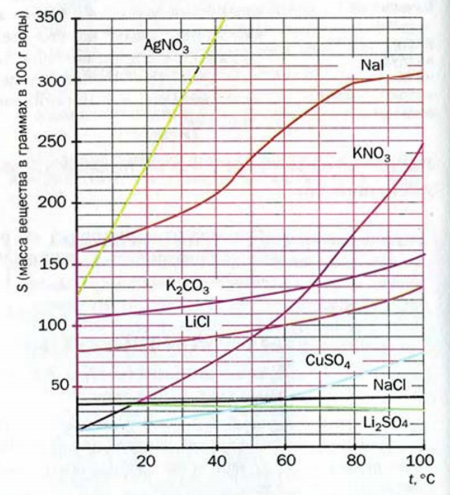
Зависимость между растворимостью и температурой очень удобно изображать графически — в виде кривых растворимости. Для построения кривой растворимости откладывают на горизонтальной оси температуру, а на вертикальной — растворимость вещества при соответствующей температуре.
На рис. 75 приведено несколько характерных кривых растворимости. Резко поднимающиеся вверх кривые растворимости нитратов калия, свинца, серебра показывают, что с повышением температуры растворимость этих
веществ сильно возрастает. Растворимость хлорида натрия лишь
незначительно изменяется по мере повышения температуры, что показывает почти горизонтальная кривая растворимости этой соли. Более сложный вид имеет кривая растворимости сульфата натрия (рис. 76). До 32°С эта кривая круто поднимается, что указывает на быстрое увеличение растворимости. При 32°С происходит резкий излом кривой, после чего она идет несколько вниз. Следовательно, сульфат натрия обладает наибольшей растворимостью при 32°С. Наличие максимума на кривой растворимости сульфата натрия объясняется тем, что ниже 32°С в равновесии с насыщенным раствором находится кристаллогидрат Na2SO4*10Н2О, растворение которого сопровождается поглощением теплоты; но при более высоких температурах твердая фаза, находящаяся в равновесии с насыщенным раствором, представляет собой безводную соль Na2SO3, растворяющуюся с выделением теплоты.
Рис. 75. Зависимость растворимости некоторых солей в воде от температуры.
Рис. 76. Зависимость растворимости сульфата натрия в воде от температуры.
При растворении твердых тел в воде объем системы обычно изменяется незначительно. Поэтому растворимость веществ, находящихся в твердом состоянии, практически не зависит от давления.
Жидкости также могут растворяться в жидкостях. Некоторые из них неограниченно растворимы одна в другой, т. е. смешиваются друг с другом в любых пропорциях, как, например, спирт и вода, другие — взаимно растворяются лишь до известного предела. Так, если взболтать диэтиловый эфир с водой, то образуются два слоя: верхний представляет собой насыщенный раствор воды в эфире, а нижний — насыщенный раствор эфира в воде. В большинстве подобных случаев с повышением температуры взаимная растворимость жидкостей увеличивается до тех пор, пока не будет достигнута температура, при которой обе жидкости смешиваются в любых пропорциях.
Температура, при которой ограниченная взаимная растворимость жидкостей переходит в неограниченную, называется критической температурой растворения. Так, при температуре ниже 66,4°С фенол ограниченно растворим в воде, а вода ограниченно растворима в феноле. Температура 66,4°С — критическая температура растворения для системы вода—фенол: начиная с этой температуры, обе жидкости неограниченно растворимы друг в друге.
Как и в случае растворения твердых тел, взаимное растворение жидкостей обычно не сопровождается значительным изменением объема. Поэтому взаимная растворимость жидкостей мало зависит от давления и заметно возрастает лишь при очень высоких давлениях (порядка тысяч атмосфер).
Если в систему, состоящую из двух несмешивающихся жидкостей, ввести третье вещество, способное растворяться в каждой из этих жидкостей, то растворенное вещество будет распределяться между обеими жидкостями пропорционально своей растворимости в каждой из них. Отсюда вытекает закон распределения, согласно которому вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества:
С1/С2= К
Здесь С1 и С2 — концентрации растворенного вещества в первом и втором растворителях; К — так называемый коэффициент распределения.
Так, коэффициент распределения йода между водой и хлороформом равен 130. Если к воде, содержащей растворенный йод, добавить не смешивающийся с нею хлороформ, взболтать эту систему и дать ей отстояться, то после установления равновесия концентрация йода в хлороформе окажется в 130 раз более высокой, чем в воде, независимо от общего количества растворенного пода. Таким образом с помощью хлороформа можно извлечь (экстрагировать) из воды преобладающую часть растворенного в ней йода. Такой, основанный на законе распределения способ извлечения растворенного вещества из раствора с помощью второго растворителя, не смешивающегося с первым, называется экстракцией и широко применяется в лабораторной практике и в химической промышленности.
Растворение газов в воде представляет собой экзотермический процесс. Поэтому растворимость газов с повышением температуры уменьшается. Если оставить в теплом помещении стакан с холодной водой, то внутренние стенки его покрываются пузырьками газа — это воздух, который был растворен в воде, выделяется из нее вследствие нагревания. Кипячением можно удалить из воды весь растворенный в ней воздух.
Однако растворение газов в органических жидкостях нередко сопровождается поглощением теплоты; в подобных случаях с ростом температуры растворимость газа увеличивается.
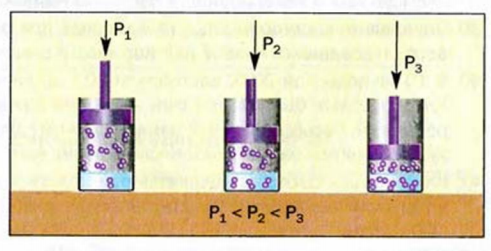
При растворении газа в жидкости устанавливается равновесие:
При этом объем системы существенно уменьшается. Следовательно, повышение давления должно приводить к смещению равновесия вправо, т. е. к увеличению растворимости газа.
К этому же выводу можно прийти, исходя из динамического характера равновесия между газом и его раствором в жидкости. Молекулы газа, находящиеся над жидкостью в закрытом сосуде, бомбардируют поверхность жидкости и растворяются в жидкости со скоростью, пропорциональной концентрации газа. Перешедшие в раствор молекулы в свою очередь время от времени ударяются о поверхность жидкости изнутри и вылетают наружу. По мере того как в результате растворения концентрация растворенных молекул будет увеличиваться, скорость их выделения, т. е. число молекул, уходящих из раствора в единицу времени, тоже будет расти, пока, наконец, не сравняется со скоростью растворения.
В результате установится состояние равновесия, т. е. жидкость станет насыщенной газом.
Если теперь увеличить давление газа, например, в 2 раза, то во столько же раз увеличится и концентрация его молекул над жидкостью, а следовательно, и скорость растворения газа. Равновесие нарушится. Чтобы при новом давлении снова установилось равновесие, концентрация растворенных молекул, очевидно, тоже должна увеличиться вдвое.
Таким образом, приходим к выводу, который известен под названием закона Генри:
Масса газа, растворяющегося при постоянной температуре в данном объеме жидкости, прямо пропорциональна парциальному давлению газа.
Закон Генри может быть выражен уравнением
С = kp
где С — массовая концентрация газа в насыщенном растворе; р — парциальное давление; k — коэффициент пропорциональности, называемый константой Генри (или коэффициентом Генри).
Отметим важное следствие закона Генри. Пусть при данном давлении в некотором объеме жидкости растворяется одни объем газа, содержащий т г этого газа. Не меняя температуры, увеличим давление в п раз. При этом, согласно закону Бойля — Мариотта, объем, занимаемый газом, уменьшится в п раз; следовательно, масса газа, содержащегося в единице объема, возрастет в п раз и составит пт г. С другой стороны, в соответствии с законом Генри масса газа, растворяющегося в определенном объеме жидкости, также возрастет в п раз, т. е. также станет равна пт г. Иначе говоря, в данном объеме жидкости по-прежнему будет растворяться один объем газа.
Следовательно, объем газа, растворяющегося при постоянной температуре в данном объеме жидкости, не зависит от его парциального давления. Именно поэтому растворимость газов обычно выражают не в граммах, а в миллилитрах, указывая объем газа, растворяющийся в 100 мл растворителя.
Растворимость некоторых газов в воде при 0 и при 20°С приведена в табл. 10.
Если над жидкостью находится смесь нескольких газов, то растворимость каждого из них определяется его парциальным давлением. Это необходимо учитывать при расчете растворимости газов, находящихся в смеси с другими газами.
Газы подчиняются закону Генри при не очень высоких давлениях и притом лишь в случае, когда они не вступают в химическое взаимодействие с растворителем. При высоких давлениях, когда поведение всех газов заметно отличается от идеального, отклонение от закона Генри наблюдается и в случае газов, химически не взаимодействующих с растворителем.
Таблица 10. Растворимость газов в воде
Пересыщенные растворы
Растворимость большинства веществ уменьшается с понижением температуры, поэтому при охлаждении горячих насыщенных растворов избыток растворенного вещества обычно выделяется. Однако, если производить охлаждение осторожно и медленно, защитив при этом раствор от возможности попадания в него частиц растворенного вещества извне, то выделения его из раствора может и не произойти. В этом случае получится раствор, содержащий значительно больше растворенного вещества, чем его требуется для насыщения при данной температуре. Это явление было открыто и подробно изучено русским академиком Т. Е. Ловицем (1794 г.), который назвал такие растворы пересыщенными. В спокойном состоянии они могут годами оставаться без изменения. Но стоит только бросить в раствор кристаллик того вещества, которое в нем растворено, как тотчас же вокруг него начинают расти другие кристаллы и через короткое время весь избыток растворенного вещества выкристаллизовывается. Иногда кристаллизация начинается от простого сотрясения раствора, а также от трения стеклянной палочкой о стенки сосуда, в котором находится раствор. При кристаллизации выделяется значительное количество теплоты, так что сосуд с раствором заметно нагревается. Очень легко образуют пересыщенные растворы Na2SO4*10H2O (глауберова соль), Na2B4O7*10Н2О (бура), Na2S2O3*5H2O (тиосульфат натрия).
Из сказанного следует, что пересыщенные растворы являются неустойчивыми системами, способными к существованию только при отсутствии в системе твердых частиц растворенного вещества. Возможность длительного существования таких растворов объясняется трудностью первоначального возникновения мельчайших «зародышевых» кристалликов, так называемых центров кристаллизации, от которых кристаллизация распространяется на всю массу раствора.
Осмос
Как уже говорилось, раствор представляет собой гомогенную систему. Частицы растворенного вещества и растворителя находятся в беспорядочном тепловом движении и равномерно распределяются по всему объему раствора.
Если поместить в цилиндр концентрированный раствор какого-либо вещества, например, сахара, а поверх него осторожно налить слои более разбавленного раствора сахара, то вначале сахар и вода будут распределены в объеме раствора неравномерно. Однако через некоторое время молекулы сахара н воды вновь равномерно распределятся по всему объему жидкости. Это происходит потому, что молекулы сахара, беспорядочно двигаясь, проникают как из концентрированного раствора в разбавленный, так и в обратном направлении; но при этом в течение любого промежутка времени из более концентрированного раствора в менее концентрированный переходит больше молекул сахара, чем из разбавленного раствора в концентрированный. Точно так же молекулы воды движутся в различных направлениях, ио при этом из разбавленного раствора, более богатого водой, в концентрированный раствор переходит больше молекул воды, чем за то же время переносится в обратном направлении. Таким образом возникает направленное перемещение сахара из концентрированного раствора в разбавленный, а воды—из разбавленного раствора в концентрированный; каждое вещество переносится при этом туда, где его концентрация меньше. Такой самопроизвольный процесс перемещения вещества, приводящий к выравниванию его концентрации, называется диффузией.
В ходе диффузии некоторая первоначальная упорядоченность в распределении веществ (высокая концентрация вещества в одной части системы и низкая—в другой) сменяется полной беспорядочностью их распределения. При этом энтропия системы возрастает. Когда концентрация раствора во всем его объеме выравнивается, энтропия достигает максимума и диффузия прекращается.
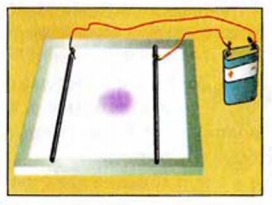
Диффузию можно наблюдать, если палить в стеклянный цилиндр какой-либо окрашенный раствор, например, раствор КМnО4, а сверху него осторожно, чтобы не вызвать перемешивания, добавить воды. Вначале будет заметна резкая граница, но постепенно она будет размываться; через некоторое время растворенное вещество равномерно распределится по всему объему раствора и вся жидкость примет одни и тот же цвет.
В рассмотренном примере частицы растворителя и растворенного вещества диффундируют в противоположных направлениях. Такой случай называется встречной или двусторонней диффузией. Иначе будет обстоять дело, если между двумя растворами поместить перегородку, через которую растворитель может проходить, а растворенное вещество—не может. Такие перегородки, получившие название полупроницаемых, существуют в природе, а также могут быть получены искусственно. Например, если пропитать глиняный пористый цилиндр раствором медного купороса, а затем погрузить его в раствор гексацианоферрата(II) калия (К4[Fe(CN)6]), то в порах цилиндра осядет гексацианоферрат(II) меди. Обработанный таким образом цилиндр обладает свойствами полупроницаемой перегородки; через его стенки могут проходить молекулы воды, но для молекул растворенного вещества они непроницаемы.
Если в такой цилиндр налить раствор какого-либо вещества, например, сахара, и погрузить цилиндр в воду, то выравнивание концентраций будет происходить только вследствие перемещения молекул воды.
Последние в большем числе диффундируют в раствор, чем обратно, поэтому объем раствора будет постепенно увеличиваться, а концентрация сахара в нем уменьшаться. Такая односторонняя диффузия через полупроницаемую перегородку называется осмосом.
Возьмем сосуд 2 с полупроницаемыми стенками, переходящий вверху в узкую вертикальную трубку 3 (рис. 77). Наполним его раствором сахара и погрузим в сосуд 1 с водой. Вследствие осмоса объем раствора будет постепенно увеличиваться и раствор начнет заполнять вертикальную трубку. По мере поднятия уровня раствора в трубке будет создаваться избыточное давление водяного столба (гидростатическое давление), измеряемое разностью уровней жидкости и противодействующее проникновению молекул воды в раствор. Когда гидростатическое давление достигнет определенной величины, осмос прекратится—наступит равновесие. Гидростатическое давление станет равным тому давлению, которое служит количественной характеристикой осмоса, — осмотическому давлению раствора. Измеряя гидростатическое давление при таком равновесии, можно тем самым определить величину осмотического давления *.
Рис. 77. Схема прибора для измерения осмотического давления:
1 — сосуд с содой; 2 — сосуд с полупроницаемыми стенками; 3 — трубка.
* Измеренное таким способом осмотическое давление относится не к исходному раствору, а к раствору, несколько разбавленному водой в результате протекавшего в ходе опыта осмоса. Однако при большом объеме раствора и малом диаметре трубки это разбавление незначительно изменяет концентрацию исходного раствора.
Явления осмоса играют очень важную роль в жизни животных и растительных организмов. Оболочки клеток представляют собой перепонки, легко проницаемые для воды, но почти непроницаемые для веществ, растворенных во внутриклеточной жидкости. Проникая в клетки, вода создает в них избыточное давление, которое слегка растягивает оболочки клеток и поддерживает их в напряженном состоянии. Вот почему такие мягкие органы растения, как травянистые стебли, листья, лепестки цветов, обладают упругостью. Если срезать растение, то вследствие испарения воды объем внутриклеточной жидкости уменьшается, оболочки клеток опадают, становятся дряблыми — растение вянет. Но стоит только начавшее вянуть растение поставить в воду, как начинается осмос, оболочки клеток снова напрягаются и растение принимает прежний вид.
Осмос является также одной из причин, обусловливающих поднятие воды по стеблю растения, питание клеток и многие другие явления.
При измерениях осмотического давления различных растворов было установлено, что величина осмотического давления зависит от концентрации раствора и от его температуры, но не зависит ни от природы растворенного вещества, ни от природы растворителя. В 1886 г. Вант-Гофф * показал, что для растворов неэлектролитов невысоких концентраций зависимость осмотического давления от концентрации и температуры раствора выражается уравнением (закон Вант-Гоффа):
P = CRT
Здесь Р — осмотическое давление раствора, кПа; С — его молярная концентрация (молярность), моль/л; R — универсальная газовая постоянная, 8,314 Дж/(моль*К); Т—абсолютная температура раствора.
*Якоб Гендрик Вант-Гофф (1852—1911)—выдающийся голландский физико-химик. Изучал законы течения химических реакций, химическое равновесие, свойства растворов. Высказал и развил идею о направленности валентных связей атома углерода, разработал основы стереохимии — учения о пространственном расположении атомов в молекуле.
Молярность раствора С представляет собой отношение количества растворенного вещества п к объему раствора V (л)
С = n/V
а количество вещества равно его массе m, деленной на молярную массу М. Отсюда для молярности раствора получаем:
С = m/MV
Подставляя это значение С в уравнение Вант-Гоффа, найдем:
PV = mRT/M
Полученное уравнение по форме напоминает уравнение состояния идеального газа Клапейрона —Менделеева, Это уравнение позволяет по величине осмотического давления раствора определять молярную массу (а значит, и относительную молекулярную массу) растворенного вещества.
Пример. Осмотическое давление раствора, в 250 мл которого содержится 3 г сахара, при 12°С равно 83,14 кПа. Определить относительную молекулярную массу сахара.
Подставляя данные в последнее уравнение, получаем
83,14 * 0,25 = 3 * 8,314 (273 + 12)/М
откуда М = 342 г/моль. Относительная молекулярная масса сахара равна 342.
Если к раствору, отделенному от воды полупроницаемой перегородкой, приложить внешнее давление, равное осмотическому давлению раствора, то, как уже говорилось, осмос прекратится. Если же приложенное внешнее давление превысит осмотическое, то диффузия волы будет преимущественно происходить из раствора в водную фазу, т. е. в направлении, противоположном направлению переноса воды при осмосе. Такое явление получило название обратного осмоса.
В настоящее время обратный осмос начали применять как одни из наиболее экономичных способов опреснения волы. Солевой раствор (например, морскую воду) отделяют полупроницаемой мембраной от пресной воды и подвергают давлению более высокому, чем осмотическое давление раствора. В результате часть содержащейся в растворе воды «вытесняется» в фазу пресной воды, а концентрация солей в оставшемся растворе повышается. Концентрированный солевой раствор периодически заменяют свежими порциями подлежащей опреснению воды.
Давление пара растворов
При данной температуре давление насыщенного пара над каждой жидкостью — величина постоянная. Опыт показывает, что при растворении в жидкости какого-либо вещества давление насыщенного пара этой жидкости понижается. Таким образом, давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре. Разность между этими величинами принято называть понижением давления пара над раствором (или понижением давления пара раствора). Отношение величины этого понижения к давлению насыщенного пара над чистым растворителем называется относительным понижением давления пара над раствором.
Обозначим давление насыщенного пара растворителя над чимстым растворителем через р0, а над раствором через р. Тогда относительное понижение давления пара над раствором будет представлять собою дробь:
(р0 — р)/ р0
В 1887 г. французский физик Рауль, изучая растворы различных нелетучих * жидкостей и веществ в твердом состоянии, установил закон, связывающий понижение давления пара над разбавленными растворами неэлектролитов с концентрацией:
Относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества.
* В случае растворов летучих веществ закономерности носят более сложный характер, поскольку над раствором находится смесь паров растворенного вещества и растворителя.
Математическим выражением закона Рауля является уравнение:
(р0 — р)/ р0 = N2
Здесь N2— молярная доля растворенного вещества.
Явление понижения давления насыщенного пара над раствором вытекает из принципа Ле Шателье. Представим себе равновесие между жидкостью, например, водой, и ее паром. Это равновесие, которому отвечает определенное давление насыщенного пара, можно выразить уравнением
Если теперь растворить в воде некоторое количество какого-либо вещества, то концентрация молекул воды в жидкости понизится и пойдет процесс, увеличивающий ее,— конденсация пара. Новое равновесие установится при более низком давлении насыщенного пара.
Понижение давления пара над раствором находит отражение на диаграмме состояния. На рис. 78 приведена схема диаграммы состояния воды и водного раствора нелетучего вещества. Согласно закону Рауля, давление водяного пара над водным раствором ниже, чем над водой. Поэтому кривая кипения для раствора лежит ниже, чем для воды. При переходе от воды к раствору изменяется также положение кривой плавления. И кривая кипения, и кривая плавления раствора расположены тем дальше от соответствующих
кривых воды, чем концентрированнее раствор.
Рис. 78. Диаграмма состояния воды и водного раствора нелетучего вещества.
Замерзание и кипение растворов
Индивидуальные вещества характеризуются строго определенными температурами переходов из одного агрегатного состояния в другое (температура кипения, температура плавления или кристаллизации). Так, вода при нормальном атмосферном давлении (101,3 кПа) кристаллизуется при температуре 0°С и кипит при 100°С.
Иначе обстоит дело с растворами. Присутствие растворенного вещества повышает температуру кипения и понижает температуру замерзания растворителя, и тем сильнее, чем концентрированнее раствор. В большинстве случаев из раствора кристаллизуется (при замерзании) или выкипает (при кипении) только растворитель вследствие чего концентрация раствора в ходе его замерзания или кипения возрастает. Это, в свою очередь, приводит к еще большему повышению температуры кипения и снижению температуры замерзания. Таким образом, раствор кристаллизуется и кипит не при определенной температуре, а в некотором температурном интервале. Температуру начала кристаллизации и начала кипения данного раствора называют его температурой кристаллизации и температурой кипения.
Разность между температурами кипения раствора и чистого растворителя называют повышением температуры кипения раствора (∆tкип). Разность между температурами замерзания чистого растворителя и раствора называют понижением температуры замерзания раствора (∆tзам). Обозначая температуры кипения и замерзания раствора 

Всякая жидкость начинает кипеть при той температуре, при которой давление ее насыщенного пара достигает величины внешнего давления. Например, вода под давлением 101,3 кПа кипит при 100°С потому, что при этой температуре давление водяного пара как раз равно 101,3 кПа. Если же растворить в воде какое-нибудь нелетучее вещество, то давление ее пара понизится. Чтобы довести давление пара полученного раствора до 101,3 кПа, нужно нагреть раствор выше 100°С. Отсюда следует, что температура кипения раствора всегда выше температуры кипения чистого растворителя. Аналогично объясняется и понижение температуры замерзания растворов.
Повышение температуры кипения и понижение температуры замерзания растворов соответствуют принципу Ле Шателье. Рассмотрим в этом плане замерзание раствора. Пусть имеется равновесие между жидкостью и твердой фазой, например, равновесие вода — лед при 0°С. Его можно выразить уравнением:
Если растворить в воде некоторое количество какого-либо вещества, то концентрация молекул воды в жидкости понизится и пойдет процесс, увеличивающий ее, — плавление льда. Для установления нового равновесия необходимо понизить температуру.
Повышение температуры кипения и понижение температуры замерзания находят отражение на диаграмме состояния. На рис. 79 приведена часть диаграммы состояния воды и раствора—отрезки кривых плавления и кипения в области давлений, близких к нормальному атмосферному давлению (101,3 кПа). Отрезки пересечены горизонталью, отвечающей давлению 101,3 кПа (масштаб чертежа увеличен по сравнению с рис. 73 и 78). Видно, что точки пересечения этой горизонтали с кривыми плавления и кипения для воды и для раствора различны. Абсциссы этих точек — температура замерзания и температура кипения — для воды равны 0 и 100°С, а для раствора они соответственно ниже 0°С и выше 100°С. Кривые, отвечающие раствору, тем больше удалены от соответствующих кривых воды, чем концентрированнее раствор. Поэтому и разность между температурами кипения или замерзания воды и раствора тем больше, чем выше концентрация раствора.
Рис. 79. Часть диаграммы состояния воды и раствора в области давлений, близких к 101,3 кПа (схема):
а — кривые плавлення; б — кривые кипения.
Изучая замерзание и кипение растворов, Рауль установил, что для разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорциональны концентрации раствора:
Здесь т — молярная концентрация (моляльность); Е и К — эбуллиоскопическая* и криоскопическая** постоянные, зависящие только от природы растворителя, но не зависящие от природы растворенного вещества. Для воды криоскопическая постоянная К равна 1,86, эбуллиоскопическая постоянная Е равна 0,52. Для бензола К = 5,07, Е — 2,6.
* От лат. «ebullire» — выкипать.
** От греч, «криос» — холод.
На измерениях температур кипения и замерзания растворов основаны эбуллиоскопический и криоскопический методы определения молекулярных масс веществ. Оба метода широко используются в химии, так как, применяя различные растворители, можно определять молекулярные массы разнообразных веществ.
Пример. При растворении 2,76 г глицерина в 200 г воды температура замерзания понизилась на 0,279 градусов. Определить молекулярную массу глицерина.
Находим, сколько граммов глицерина приходится в растворе на 1000 г воды:
р = 2,76 * 1000/200= 13,8 г
Выражаем моляльность раствора (m) через массу глицерина (р), приходящуюся на 1000 г воды, и его молярную массу (M):
т = р/M = 13,8/M
Подставляем данные в уравнение:
∆tзам = Кm; 0,279 = 1,86 * 13,8/М
Отсюда молярная масса глицерина М = 92 г/моль, а молекулярная масса равна 92.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
ВОДА – оксид водорода H2O.
В течение многих столетий вода считалась простым веществом. Лишь в 1783 французский химик Антуан Лоран Лавуазье (1743–1794) сумел разложить ее. Он показал, что вода состоит из водорода и кислорода, а в 1789 дал первую оценку ее количественного состава: 15% водорода и 85% кислорода. В дальнейшем количественный анализ воды проводили многие ученые. Долгое время образцовыми считались результаты французского химика и физика Жозефа Луи Гей-Люссака (1778–1850), полученные около 1808: 13,27% водорода и 86,73% кислорода. Только в 1821 шведский химик Йенс Якоб Берцелиус (1779–1848) и французский физик и химик Пьер Луи Дюлонг (1785–1838) сделали более правильный анализ воды и нашли, что она содержит 11,1% водорода и 88,9% кислорода, что очень близко к современным значениям (11,19% водорода и 88,81% кислорода).
Изучая объемные отношения реагирующих газов, Гей-Люссак показал, что один объем кислорода и два объема водорода при взаимодействии дают два объема водяного пара (при температуре выше 100° С). На основании этих результатов с учетом закона Авогадро был сделан вывод, что две частицы водяного пара образуются из одной частицы кислорода и двух частиц водорода. Таким образом была выведена формула воды H2O.
На нашей планете вода играет очень важную роль. В природе она совершает непрерывный круговорот. Под влиянием солнечной энергии жидкая вода (главным образом, в теплых морях и океанах) превращается в пар, который поднимается в верхние слои атмосферы. Это происходит благодаря тому, что водяной пар легче воздуха. Так происходит образование облаков, которые ветрами переносятся в другие части планеты, где в виде дождя и других осадков вода попадает на поверхность земли. Здесь она образует ручьи и реки, которые возвращают испаренную воду в океаны (рис. 1).
Чистой воды в природе нет. Даже наиболее чистая дождевая вода при падении через атмосферу растворяет газы и захватывает пыль. При ее испарении всегда остается небольшой остаток – около 0,03 г на литр. На поверхности земли вода дополнительно растворяет многие твердые вещества. Часть ее впитывается в почву. В глубине земли продолжается растворение различных веществ, так что при выходе на поверхность вода иногда образует минеральные источники. Ключевая и колодезная вода от растворенных в ней солей часто бывает жесткой.
Речная (пресная) вода содержит до 0,5 г растворенных солей в одном литре. В конце концов, все это попадает в море. Таким образом, море, испаряя чистую воду, получает взамен воду с растворенными в ней веществами. Количество солей, поставляемое реками в моря и океаны, огромно. Так, река Дон ежегодно вносит в Азовское море около 16 млн. т солей, Дунай в Черное море – 9 млн. т.
В океанской воде содержится около 35 г солей в литре. Столько же имеется в водах большинства морей. Однако для закрытых морей встречаются отклонения от средней солености, связанные с числом впадающих рек, средней температурой и другими факторами. Балтийское море содержит лишь 3–8 г солей на литр, а Красное – до 45 г. В соленых озерах содержание солей может быть намного больше: в Мертвом море – 228 г в одном литре, в оз. Эльтон – 270 г. В морской воде растворен, в основном, хлорид натрия; кроме того, имеются и другие соли натрия, магния, кальция.
Для научной работы, а также для фармацевтических и других целей, воду перегоняют (рис. 2). Для этого ее превращают в пар, который затем охлаждают, получая чистую дистиллированную воду. Примеси остаются в перегонном сосуде.
Молекула воды имеет угловое строение с длиной связи О–Н 96 пм и валентным углом Н-О-Н 104,5°. Молекула воды полярна, ее дипольный момент равен 1,86 Д.(Д –дебай, 1 Д = 3,34·10-30 Кулон·м).
Природная вода содержит следы «тяжелой» воды (оксида дейтерия) D2O. Физические свойства H2O и D2O заметно различаются.
| H2O | D2O | |
| t плав.,°С | 0,0 | 3,8 |
| t кип., °С | 100,0 | 101,4 |
Свойства воды служат точкой отсчета для многих физических величин. Так, температуры замерзания и кипения воды лежат в основе шкалы Цельсия. Один литр – это объем 1 кг чистой воды, взвешенной при +4 °С (при этой температуре вода имеет максимальную плотность).
Многие физические свойства воды аномальны по сравнению с другими жидкостями. Одной из причин этого служат малые размеры молекул воды – минимальные среди всех жидких веществ при обычных условиях. Однако наиболее важным свойством воды является ее способность образовывать прочные водородные связи.
В водяном паре при температуре кипения и атмосферном давлении присутствует около 1% димеров, в которых молекулы воды объединены в пары водородными связями. В жидком и твердом состоянии каждая молекула воды образует четыре водородные связи: две как донор протонов и две – как акцептор протонов. Водородные связи молекулы воды направлены приблизительно к вершинам правильного тетраэдра (рис. 3.).
Если бы водородных связей не было, то температуры плавления и кипения воды были бы существенно ниже, как это наблюдается у других водородных соединений неметаллов. Водородные связи являются причиной и другого уникального свойства воды – при плавлении ее плотность возрастает. При 0°С плотность льда (0,9168 г/см3) меньше, чем плотности жидкой воды (0,9998 г/см3), поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.
Чтобы превратить воду в пар, надо затратить много энергии – около 44 кДж/моль. При обратном переходе пара в жидкую воду выделяется то же количество теплоты.
Вода устойчива при нагревании вплоть до 1000°С. При более высоких температурах она частично разлагается на водород и кислород. Эти же продукты образуются при электролизе воды.
Разложение воды искрами электрической машины заметили еще в 1789, а годом позже воду разложили с помощью гальванического электричества. В России это впервые было сделано профессором С.-Петербургской Медико-Хирургической Академии В.В. Петровым летом 1802 посредством огромной «гальвани-вольтовой батареи», состоявшей из 4200 медных и цинковых кружков. Электролиз чистой воды идет очень медленно. Для более быстрого разложения воды электрическим током в нее добавляют какую-либо кислоту, щелочь или соль. Этот процесс иногда используют для получения чистого водорода и кислорода (рис. 4).
Под действием УФ-излучения вода распадается на ионы Н+ и ОН–, а под действием ионизирующего излучения радиоактивных веществ – образует Н2, Н2О2 и свободные радикалы Н*, ОН*, НО2*.
Вода вступает в химическое взаимодействие со многими простыми веществами. Большинство таких реакций протекает при высокой температуре. Только наиболее активные металлы (щелочные и щелочноземельные) и неметаллы (галогены) реагируют с водой при комнатной температуре. Однако при одновременном воздействии воды и окислителей даже при обычной температуре происходит разрушение металлов средней активности (таких как железо) в результате коррозии.
Очень сильными восстановителями вода восстанавливается до водорода, очень сильными окислителями – окисляется до кислорода.
Вода взаимодействует со многими основными оксидами с образованием гидроксидов. В реакциях воды с большинством кислотных оксидов образуются кислоты.
РЕАКЦИИ ВОДЫ
| С простыми веществами: | |
| металлами | неметаллами |
| 2Na + 2H2O = 2NaOH + H2 | Cl2 + H2O⇋ HCl + HClO |
| 2Fe + 3H2O = Fe2O3 + 3H2 (600 °C) | H2O + C ⇋ CO + H2 (800–1000 °C) |
| С оксидами: | |
| основными | кислотными |
| CaO + H2O = Ca(OH)2 | SO3 + H2O = H2SO4 |
| Na2O + H2O = 2NaOH | N2O5 +H2O = 2HNO3 |
| Термическое разложение: 2Н2О⇋ 2Н2 + О2 | |
Некоторые сложные вещества полностью разлагаются водой – подвергаются необратимому гидролизу:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Вода может служить катализатором. Например, щелочные металлы и водород реагируют с хлором только в присутствии следов воды. Иногда вода является каталитическим ядом, например, для железного катализатора при синтезе аммиака.
В результате образования водородных связей твердая вода (лед) имеет рыхлую структуру с обширными замкнутыми полостями двух типов: больших и малых. В этих полостях могут размещаться молекулы других веществ, имеющие соответствующие размеры. Они удерживаются в них ван-дер-ваальсовыми силами. Так образуются газовые гидраты – клатраты, соединения типа «гость-хозяин», в которых «гостями» являются молекулы газов или легкокипящих жидкостей (благородные газы, галогены, углеводороды и др.), а «хозяевами» – молекулы воды, образующие кристаллический каркас. По внешнему виду газовые гидраты напоминают снег или рыхлый лед, но могут существовать только при повышенном давлении и отрицательной (по Цельсию) температуре. Наиболее важным на сегодняшний день газовым гидратом является гидрат природного газа метана, колоссальные скопления которого обнаружены в недрах земли, в особенности на шельфе морей и океанов.
Газовые гидраты относятся к соединениям переменного состава. Если диаметр молекулы газа менее 0,52 нм (Ar, CH4, H2S), то в предельном случае могут заполниться и большие и малы полости кристаллической решетки. При полном заполнении всех полостей число молекул воды, приходящихся на одну молекулу «гостя», составляет 5,75 (например, 4Ar . 23H2O). Молекулы «гостей» с диаметром от 0,52 до 0,59 нм (Br2, CH3SH, COS) могут заполнять лишь большие полости. В этом случае минимальной число молекул воды, приходящееся на одну молекулу «гостя», равно 7,66 (например, 3Br2 . 23H2O). Гидраты газов с диаметром молекул от 0,59 до 0,69 нм (C3H8, изо-C4H10, CHCl3) имеют другую структуру и состав, например C3H8 . 17H2O.
Вода хорошо растворяет многие вещества, имеющие ионное строение (соли, щелочи), а также вещества, молекулы которых полярны. Наличие в жидкой воде ассоциатов (элементов кристаллической структуры) наряду с большим дипольным моментом молекул приводит к высокой диэлектрической проницаемости воды (ε = 78,3 при 25 °С). Это вызывает заметное ослабление кулоновского притяжения в водной среде, а, следовательно, способствует электролитической диссоциации ионных и полярных ковалентных соединений. При этом полярные молекулы воды участвуют в процессе гидратации за счет притяжения соответствующих полюсов полярных молекул воды к образующимся катионам и анионам. В ряде случаев образующиеся связи являются настолько прочными, что можно говорить о возникновении аквакомплексов. Аквакомплексы обнаружены не только в водных растворах, но и во многих кристаллических структурах.
Твердые вещества, как правило, лучше растворяются при нагревании. При этом вещества с очень прочной кристаллической решеткой мало растворимы в воде. К ним относятся хлориды, бромиды и иодиды серебра и свинца, сульфаты щелочноземельных металлов и свинца, большинство гидроксидов, сульфидов, ортофосфатов и карбонатов металлов.
Газы обычно плохо растворяются в воде. Исключение составляют газообразные вещества, взаимодействующие с водой, например аммиак, хлороводород или диоксид серы. Растворимость всех газов возрастает при увеличении давления и, как правило, понижается при нагревании.
В жидкой воде одна из каждых 10 миллионов молекул диссоциирует, образуя ионы: катионы водорода Н+ и гидроксид-ионы ОН–:
Н2О ⇋ Н+ + ОН–
Чистая вода содержит одинаковую молярную концентрацию катионов водорода Н+ и гидроксид-ионов ОН–, и среда ее нейтральна. Однако при растворении многих веществ в воде концентрации ионов Н+ и ОН– изменяются. Если увеличивается концентрация катионов водорода, среда становится кислотной. При увеличении концентрации гидроксид-ионов среда становится щелочной. Определить характер среды можно с помощью индикаторов.
| Индикатор | Кислотная среда | Нейтральная среда | Щелочная среда |
| Лакмус | Красный | Фиолетовый | Синий |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
| Метиловый оранжевый | Розовый | Оранжевый | Желтый |
Основания диссоциируют в водном растворе с образованием гидроксид-ионов, создавая щелочную среду:
NaOH = Na+ + OH– (сильное основание)
NH3 . H2O ⇋ NH4+ + OH– (слабое основание)
При диссоциации кислот в растворе образуются катионы водорода, и среда становится кислотной.
H2SO4 = 2H+ + SO42– (сильная кислота)
H2CO3 ⇋ H+ + HCO3– (слабая кислота)
| Вещества | Сильные | Слабые |
| Основания | NaOH, KOH, Ca(OH)2, Ba(OH)2 | NH3 |
| Кислоты | HCl, HBr, HI, H2SO4, HNO3 | H3PO4, H2CO3, H2S |
Соли при растворении в воде диссоциируют на катионы металла и анионы кислоты. Растворы многих солей имеют кислотную или щелочную среду за счет обратимого гидролиза по катиону или по аниону (см. ГИДРАТАЦИЯ, ГИДРАТЫ, ГИДРОЛИЗ).
| СОЛЬ | ГИДРОЛИЗ | СРЕДА РАСТВОРА | рН | |
| Катион | Анион | |||
| сильного основания | сильной кислоты | — | нейтральная | 7 |
| сильного основания | слабой кислоты | по аниону | щелочная | > 7 |
| слабого или малорастворимого основания | сильной кислоты | По катиону | кислотная | < 7 |
| слабого или малорастворимого основания | слабой кислоты | По катиону и аниону | Нейтральная кислотная или щелочная | 7 > 7 < 7 |
Несмотря на свое название, многие кислые соли (например, гидрокарбонат натрия) создают в водном растворе щелочную среду:
NaHCO3 = Na+ + HCO3–
HCO3– + H2O ⇋ H2CO3 + OH–
Вода используется во многих технологических процессах главным образом как охлаждающая жидкость, транспортирующая среда для сыпучих материалов (например, золы), важнейший растворитель, реагент. Тяжелую воду применяют в качестве эффективного замедлителя нейтронов. Обычная вода не токсична, однако тяжелая вода опасна для млекопитающих.
Вода является жизненно важным веществом. Она является обязательным компонентом всех живых существ. Организм взрослого человека массой 65 кг содержит до 40 кг воды. Вода является растворителем, составной частью клеток, участником биохимических реакций. Она играет важную роль в терморегуляции. У взрослого человека суточная потребность в воде составляет примерно 2,4 кг. Сюда включается вода, поступающая в организм с твердой и жидкой пищей, в виде напитков, а также вода, образующаяся в результате дыхательных процессов (около 300 г).
Человек чрезвычайно остро ощущает изменения содержания воды в организме и может прожить без воды лишь несколько суток. Потеря 10–20% воды опасна для жизни. В то же время избыток воды приводит к перегрузке сердечно-сосудистой системы, потере солей.
Очень важен минеральный состав питьевой воды. Человек употребляет для питья воду, содержащую от 0,02 до 2 г минеральных веществ на 1 л. Большое значение имеют вещества, находящиеся в малых концентрациях, но играющие важную роль в физиологических процессах организма. Например, длительное употребление питьевой воды, содержащей фтора менее 0,6 мг/л, ведет к кариесу зубов, а потребление воды с концентрацией фтора более 1 мг/л вызывает флюороз.
Если в питьевую воду попадают возбудители инфекционных заболеваний, она может явиться фактором их распространения. Многие возбудители кишечных инфекций сохраняют свою жизнеспособность в воде в течение нескольких месяцев.
При определении качества питьевой воды немаловажное значение имеют свойства, воспринимаемые органами чувств (органолептические свойства): температура, прозрачность, цвет, запах, вкус, жесткость. Питьевая вода должна быть безопасной в эпидемиологическом отношении, безвредной по химическому составу, благоприятной по органолептическим свойствам. Чтобы использовать для питья природную воду, ее обычно очищают. С этой целью применяют как физические (фильтрование, отстаивание), так и химические (хлорирование, озонирование) методы.
В 1 мл питьевой воды должно быть не более 100 микроорганизмов (число бактерий группы кишечных палочек – не более 3). Не менее жесткие ограничения накладываются на содержание химических веществ.
| Алюминий 0,5 | Полифосфаты 3,5 |
| Бериллий 0,002 | Свинец 0,03 |
| Железо 0,3 | Селен 0,001 |
| Марганец 0,1 | Стронций 7,0 |
| Медь 1,0 | Сульфаты 500,0 |
| Молибден 0,25 | Фтор 0,7–1,5 (для различных климатических районов) |
| Мышьяк 0,05 | Хлориды 350,0 |
| Нитраты 45,0 | Цинк 5,0 |
| Полиакриламид 2,0 |
Общая жесткость питьевой воды должна быть не выше 7,0 ммоль/л, а сухой остаток – 1000 мг/л. Значения рН не должны выходить за пределы 6,0–9,0.
Ресурсы питьевой воды не безграничны. Проблема обеспечения питьевой водой растущего народонаселения является одной из наиболее острых экологических проблем современности. На возобновляемые водные ресурсы – речной сток воды – оказывает влияние не только растущее загрязнение окружающей среды, но и глобальное потепление климата Земли. Хотя в ряде районов России увеличение количества атмосферных осадков и повышение температуры воздуха в холодное время года благоприятно отражаются на стоке воды рек, на северо-западе и юге нашей страны наметилась тенденция к уменьшению количества ежегодно возобновляющихся водных ресурсов.
Для предотвращения водного кризиса, помимо усиления административных мер по охране природных ресурсов, необходимо экологическое образование население. Это должно помочь правильному восприятию взаимосвязей между всеми сферами Земли, включая ее водную оболочку.
Елена Савинкина
Содержание:
Вода ее элементный состав, молекулярное строение, формула и молярная масса:
Вода — одно из важнейших химических соединений, широко распространенное на земном шаре.
Вода — это сложное вещество, состоящее из двух атомов водорода и одного атома кислорода (рис. 29).
Молекулярная формула воды —
Относительная молекулярная масса воды равна сумме относительных атомных масс водорода и кислорода:
Следовательно, масса 1 моля воды — 18 г, а молярная масса воды — 18 г/моль.
Вода и её физические свойства
Чистая вода — прозрачная жидкость без цвета, вкуса и запаха. Вкус и запах воде придают растворенные в ней примеси. Многие физические свойства воды очень своеобразны. При соответствующих обстоятельствах они являются аномальными, т.е. отклоняются от привычных. Например, плотность воды при переходе из твердого состояния (лед) в жидкое не уменьшается, как у большинства веществ, а увеличивается (рис. 30). Плотность растет и при нагревании воды от 0°С до + 4°С, достигая своего максимума — 
Еще одно свойство воды — это ее высокая теплоемкость (4,18 Дж/кг) (для сравнения: у песка —
0,79; известняка — 0,88; поваренной соли — 0,88; глицерина — 2,43; этилового спирта — 2,85). Поэтому вода в ночное время или при переходе от летнего сезона к зимнему медленно остывает, а в дневное время и при смене зимы летом так же медленно нагревается.
Вода замерзает при 0°С (при этой же температуре лед начинает таять) и превращается в пар (кипит) при 100°С.
Вода, являясь универсальным растворителем, растворяет многие органические и неорганические вещества.
Вода и её химические свойства
Молекулы воды очень устойчивы к нагреванию, но при температуре выше 1000°С пары воды начинают разлагаться на водород и кислород:
Реакционная способность воды очень велика.
Активные металлы, взаимодействуя с водой, выделяют из нее водород:
Рис. 30. Вода и лед
При взаимодействии с водой оксидов многих металлов и неметаллов образуются основания и кислоты:
Некоторые соли образуют с водой соединения, называемые кристаллогидратами:
Нагретое железо вступает в реакцию с парами воды:
Вода катализирует ряд химических процессов: при ее отсутствии «гремучий газ» не взрывается даже при высокой температуре, угарный газ не горит в кислороде, натрий и фосфор не окисляются на воздухе, не взаимодействуют с хлором и не происходит травления стекла фтористым водородом.
Распространение воды в природе
Три четверти поверхности земного шара покрыто водой в виде океанов, морей, озер, рек. Вода распространена в атмосфере в виде паров, на горных вершинах и полюсах — в виде ледников и снега. Существуют также подземные воды, увлажняющие почву и горные породы.
Объем Мирового океана составляет 
Вода имеет огромное значение в жизни растений, животных и людей. По современным представлениям, происхождение и развитие жизни на Земле было связано с морем. Вода — это среда, которая обеспечивает жизнедеятельность каждого организма посредством химических процессов, в ней протекающих. Кроме того, вода сама участвует в ряде биохимических процессов.
Аномальные физические свойства воды имеют важное значение в обеспечении жизненных процессов. Если бы плотность воды при переходе из жидкого состояния в твердое изменялась так же, как и у других веществ, то с приходом зимы поверхность воды, замерзая при 0°С, оседала бы ниже и уступала бы свое место более теплому слою, который также замерзал бы и оседал на дно. Таким образом вся вода превратилась бы в лед и многие формы жизни прекратили бы свое существование.
Но то, что вода при +4°С обладает максимальной плотностью, не дает происходить подобному явлению, так как обладающий меньшей плотностью лед остается на поверхности воды и предохраняет от замерзания более глубокие теплые слои.
Высокая теплоемкость воды также имеет большое значение для жизни на Земле. На нагревание воды необходимо затратить больше энергии, чем на нагревание любого другого вещества, т.е. вода, поглотившая тепло, нагревается при более низкой температуре, чем любая другая жидкость. Одна третья часть поглощаемой энергии Солнца расходуется на испарение воды Мирового океана и других водных бассейнов.
Вода выполняет специфическую роль терморегулятора и тем самым обеспечивает нормальную жизнедеятельность на поверхности Земли. Водные ресурсы земного шара могут быть как солеными, так и пресными, но все они имеют важное значение для промышленности.
Промышленность приспособлена для потребления в основном пресной воды. По имеющимся сведениям, в год на одного жителя планеты приходится в среднем 8000 л воды. Это количество воды используется как в бытовых, так в сельскохозяйственных и промышленных целях.
Только 10% расходуемой воды приходится на бытовые расходы, а остальное количество затрачивается на промышленность и сельское хозяйство. Для получения 1 кг сахара необходимо 400 л воды, для обработки 1 кг зерна — 1500 л, а для получения 1 кг синтетической резины необходимо примерно 2500 л воды.
В промышленности вода в основном используется как растворитель, охладитель и очиститель.
Пресная вода широко используется в сельском хозяйстве для полива полей и питья в животноводстве.
Повсеместное использование воды в промышленности связано с проблемами возникновения сточных вод и загрязнения окружающей среды. Для решения этих проблем необходим комплексный подход.
Не забывайте, что вода является бесценным богатством!
Меры по сохранению водных ресурсов от загрязнения
Для жизнедеятельности (т.е. для бытовых нужд, сельского хозяйства и промышленности) используют воды озер, рек, подземные воды и воды искусственных водоемов. Для водообеспечения большое значение имеет сохранение чистоты воды, которая загрязняется, проходя через систему канализационных сетей, промышленных предприятий, подвергаясь «обработке» путем смыва химических средств с полей.
Возвращаемые в водоемы сточные воды должны проходить соответствующую очистку, поскольку они могут быть загрязнены выбросами ферм, мусоросборников, городской канализацией, дренажными водами, остатками минеральных удобрений, инсектицидами, гербицидами, отходами больниц, торговых предприятий, общественного питания, заводов, фабрик и лабораторий. Такие воды должны быть подвергнуты многоступенчатой очистке. Сначала вода пропускается через механические фильтры, на которых задерживаются песок и другие частицы. Мелкие же частицы и многие бактерии осаждаются путем добавления в воду сначала извести, а затем сульфата алюминия. При пропускании воздуха через такую воду в ней усиливается разложение органических веществ. На последней стадии, чтобы очистить воду от бактерий, ее обрабатывают озоном или хлором. После такой стерилизации воду можно использовать для потребления.
При применении данного метода очистки вода очищается от вредных веществ. Но в некоторых случаях появляется необходимость ее очистки от ионов кальция и магния, повышающих жесткость воды. Эти ионы в сочетании с мылом образуют в воде нерастворимые соединения, отрицательно влияющие на эффективность синтетических моющих веществ. Такая вода при кипячении дает накипь. Многие подземные воды подвергаются такой очистке, потому что в результате взаимодействия известняка, а также других соединений магния и кальция содержание их ионов в воде возрастает. Эта вода обрабатывается гашеной или негашеной известью, а также содой. Потом проводят ее обработку квасцами. Такая вода полностью готова к употреблению.
Для очистки сточных вод существует особый способ, состоящий из трех стадий. На первой стадии очистку проходят 30% воды, на второй 60%, 10% воды не подвергаются очистке. При этом на первой стадии фильтрованием отделяются крупные твердые частицы, 60% которых могут выпасть в осадок. Если не подвергать такую воду вторичной очистке, то следует провести ее обеззараживание хлором и отправить в водоем.
При вторичной очистке посредством воздуха разлагаются органические вещества, увеличивается количество аэробных бактерий, которые, питаясь остатками органических веществ, очищают воду. Затем они осаждаются, а вода подвергается обработке хлором и сливается в водоем. На этой стадии можно осадить до 90% твердых частиц.
Вода, прошедшая первичную и вторичную обработку, может содержать значительное количество соединений фосфора и азота, что приводит к размножению водорослей в водоемах. Помимо этого, многие химические вещества, содержащиеся в сточных водах, пройдя эти стадии очистки, могут снова загрязнять окружающую среду и водные бассейны.
Однако полная очистка воды от многих металлов и органических веществ — очень дорогостоящая процедура. Поэтому вода в незначительных количествах подвергается третичной обработке, при которой с помощью специальных средств такие примеси ликвидируются.
Вода — один из лучших растворителей
Вода имеет огромное значение в жизни и практической деятельности человека. Процесс усвоения пищи связан с переводом питательных веществ в растворимые формы посредством воды. Все физиологически важные жидкости (кровь, лимфа и др.) — водные растворы. В основе многих сфер производственной деятельности лежат процессы, в которых используются водные растворы.
Жидкие растворы — это жидкие гомогенные (однородные) системы, состоящие из двух или более компонентов.
Общая поверхность Земли составляет 510100000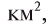
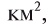
В природе вода широко распространена в виде растворенных в ней солей. Такие реки, как Ганг или Миссисипи, растворяют до 100 млн т солей в год, а все реки мира — 2,735 млрд т солей.
Почти все вещества растворяются в воде (рис. 31): некоторые — очень хорошо, другие — средне, а остальные — плохо.
Проходя через нижние слои атмосферы, дождевая вода может растворить значительное количество различных веществ. При выпаривании 1000 г дождевой воды остается 3—5 г твердого осадка.
Растворенные и попавшие в почву вещества, химически взаимодействуя с компонентами почвы и горных пород, активно участвуют в непрерывном процессе образования почвы и минералов, разрушения горных пород.
Рис. 31. Растворение различных веществ в воде:
1 — хлорид кальция; 2 — перманганат калия; 3 — пищевая соль; 4 — бихромат калия;5 — карбонат натрия; 6 — бертолетова соль
Рис. 32. Растворение сахара в воде
Вода — универсальный растворитель, который может растворять и газы (кислород, водород, углекислый газ и др.), и жидкости (спирт, кислоты и др.), и твердые вещества (соли, минералы и др.).
В воде растворяются в небольшом количестве даже те вещества, которые, казалось бы, совсем не растворяются в ней. К.В. Шееле, кипятя в течение 12 дней в колбе дистиллированную снеговую воду, отметил небольшое разъедание стенок колбы. А. Лавуазье, кипятя определенное количество воды в колбе в течение 101 дня, заметил, что масса сосуда уменьшилась на определенное число, а масса осадка, полученного после выпаривания воды, равняется этому числу. Следовательно, даже стекло незначительно растворяется в воде.
Способность вещества растворяться называется растворимостью.
Например, понаблюдаем растворение сахара в воде (рис. 32). При комнатной температуре (20°С) в 100 г воды может раствориться 200 г сахара. Большее количество сахара при этой температуре не растворится. Такой раствор называется насыщенным.
Мера растворимости определяется количеством вещества в насыщенном растворе при определенных условиях.
Растворимость определяется растворением вещества в 100 г растворителя. Если в растворителе растворяется больше 10 г вещества, то оно считается хорошо растворимым, если меньше 1 г — малорастворимым, если меньше 0,01 г — практически нерастворимым.
Растворимость многих твердых веществ возрастает с повышением температуры. Эту зависимость можно представить в виде графика (рис. 33).
Растворимость газов при повышении температуры уменьшается (при кипячении воды растворенные в ней газы выделяются).
Рис. 33. Кривые растворимости различных солей
Но повышение давления приводит к возрастанию их растворимости (открывая бутылку минеральной воды, мы уменьшаем давление внутри сосуда, и поэтому растворенный в ней углекислый газ начинает интенсивно выделяться).
Понятие о растворах и их концентрациях
Раствор — это однородная система, состоящая из растворителя, растворенного вещества и продуктов их взаимодействия.
Вещество в растворе измельчено до молекул, атомов или других частиц и равномерно распределено между молекулами растворителя, так как размеры частиц растворенного вещества составляют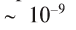
Растворы бывают жидкими, твердыми и газообразными. Примерами жидких растворов могут быть водные растворы соли, сахара, спирта; твердых растворов — золотометаллические изделия, сплавы типа дюралюминия; газообразных растворов — воздух или другие смеси газов.
При образовании растворов наблюдается выделение или поглощение тепла. Растворы могут хорошо проводить или не проводить электрический ток.
Растворы обладают свойствами как механических смесей, так и химических соединений (табл. 7).
При практическом применении растворов важное значение имеет точное определение количества вещества, растворенного в общей массе раствора.
Состав раствора (в частности, количество растворенного вещества) можно установить различными способами и выразить в размерных величинах (концентрациях).
Когда речь идет о компонентах раствора, под ними подразумеваются чистые вещества, при смешивании которых образуется раствор. При этом большее количество вещества принимается за растворитель, а меньшее — за растворенное вещество (рис. 34).
Эти термины были приняты для удобства, потому что при смешивании двух компонентов их нельзя строго разделять. При образовании раствора из чистой жидкости и твердого вещества обычно за растворитель принимается жидкий компонент. Независимо от того, что является растворенным веществом — газ, жидкость или твердое тело, — когда мы говорим о составе раствора, то обязаны учитывать отношение растворенного вещества к раствору. Это относительное количество называется концентрацией и выражается в различных величинах.
Обычно в химии концентрация выражается:
- — в массовых долях вещества, растворенного в одной весовой части раствора;
- — в процентах растворенного вещества, содержащегося в 100 г раствора;
- — в молях или эквивалентах растворенного вещества, содержащегося в 1 л раствора.
Рис.34 Соли (а)и их растворы (б)
Массовая доля, процентная, молярная и нормальная концентрация вещества в растворе
Как уже было сказано при изучении предыдущей темы, при определении состава раствора необходимо учитывать природу и количество его компонентов.
Насыщенный раствор — это раствор, который при данной температуре не может растворить большего количества вещества.
Ненасыщенный раствор — это раствор, который при данной температуре продолжает растворять вещество.
Если количество растворенного вещества очень мало, то такой раствор называется разбавленным.
Если количество растворенного вещества будет достаточно высоким, то такой раствор называется концентрированным (рис. 35).
В химии в основном пользуются ненасыщенными растворами.
Рис. 35. Взаимодействие цинка с растворами серной кислоты различной концентрации
В химической практике для выражения количества растворенного вещества широко применяются следующие величины:
1. Массовая доля
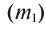
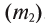
2. Процентная концентрация (С%) — выражение в процентах отношения массы растворенного вещества 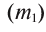
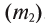
3. Молярная концентрация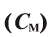
Здесь М — молярная масса вещества.
4. Нормальная концентрация 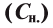
Здесь Е — эквивалентная масса вещества.
Зная нормальные концентрации растворов, можно легко подсчитать, в каких объемах их необходимо взять, чтобы они провзаимодействовали друг с другом без остатка. При взаимодействии друг с другом 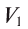
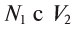
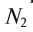
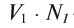
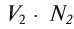
Таким образом, объемы растворов веществ, вступающих в реакцию, обратно пропорциональны значениям их нормальных концентраций.
На основе этой зависимости можно подсчитать не только необходимые для реакции объемы растворов, но и по ним — их концентрации.
Значение растворов для жизни человека
Растворы имеют очень важное значение для жизни человека. Конечно, самый большой класс растворов — эго водные растворы. Вода в живом организме занимает особое место как растворитель, переносчик питательных веществ, среда, обеспечивающая жизнедеятельность и осуществление различных процессов (таких, как регуляция температуры тела, вывод вредных веществ из организма).
Две трети части тела человека состоят из воды в виде различных растворов: кровь содержит 83% воды, мозг и сердце — 80%, кости — около 20—25%; 80% тела рыбы, 95—98% тела медузы, 95—99% тела водорослей, 50—75% тела растений суши составляет вода в виде различных растворов.
Основным компонентом клеток живых организмов являются водные растворы, которые имеют огромное значение как среда или непосредственный участник протекания жизненных процессов, обеспечивающих их существование.
К важному источнику нашего питания — растениям — вода проходит через почву. Основным условием урожайности также является вода. Вода растворяет органические и минеральные вещества в почве и поставляет их растениям. При недостатке воды растения не могут усваивать питательные вещества, ослабляется активность фотосинтеза, замедляется их рост, и в результате снижается урожайность.
Вода — растворитель, без которого сложно представить промышленные процессы. Вода является уникальной средой для протекания многих химических реакций. Без воды невозможно было бы дубить и перерабатывать кожу, крахмалить и красить ткани, производить мыло и г.д.
В медицине вода применяется при изготовлении различных лекарственных растворов, которые используются для лечения многих заболеваний.
Простая минерализованная вода представляет собой раствор различных целебных солей и используется в лечении и профилактике некоторых заболеваний.
Водные растворы различных веществ широко применяются в технике. Например, растворы кислот и оснований используются в простых энергетических аккумуляторах, позволяющих обеспечить электроэнергией автомобили и другие средства передвижения.
Помимо воды прочное место в жизни человека занимают бензин, растворы различных спиртов и органических кислот. Этиловый спирт широко используется при изготовлении как продтоваров, так и лекарственных препаратов или применяемых при охлаждении различных механизмов антифризов.
Мы также знакомы с использованием бензина и подобных ему растворителей в качестве средств химической чистки при выводе пятен с одежды.
Основу различных косметических средств, красок и лаков также составляют растворители.
Вся жизнь человека тесно связана с растворами.
Вычисление воды
Нахождение массовой доли растворенного вещества
Пример №1
Какова концентрация раствора, полученного смешением 50 г поваренной соли с 450 г воды?
Решение:
Найдем процентную концентрацию растворенного вещества по формуле:
Для этого, сложив массы соли и воды — 50 и 450 г, получим массу образовавшегося раствора — 500 г.
Ответ: 10%.
Пример №2
Концентрация солей в воде некоторых озер близ Аральского моря составляет 4%. Какое количество соли останется при выпаривании 10 кг такой озерной воды?
1-й способ. 4%-ный раствор — это значит, что в 100 г раствора содержится 4 г соли (в 100 кг раствора 4 кг соли). Если в 100 кг раствора содержится 4 кг соли, то в 10 кг раствора — х.
О т в е т: 0,4 кг или 400 г.
2-й с п о с о б. Из формулы 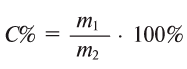
Ответ: 0,4 кг или 400 г.
Нахождение молярности растворенного вещества в растворе определенного объема.
Пример №3
Молярная концентрация в 2 л водного раствора гидроксида натрия содержится 16 г NaOH. Рассчитайте молярную концентрацию этого раствора.
Решение:
1) 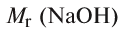
2) если в 2 л (2000 мл) раствора содержится 16 г NaOH, то в 1 л (1000 мл) раствора — 8 г NaOH; ^
3) содержание в 1000 мл раствора 8 г или 0,2 моля = 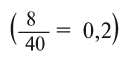
Ответ: 0,2 моль/л или 0,2М.
Пример №4
Сколько соли необходимо для приготовления 500 мл 2М раствора хлорида капьция? Как можно приготовить такой раствор?
Решение:
1) 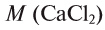
2) 2 моля 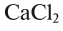
3) 2 моль/л значит, что в 1 л (1000 мл) раствора содержится 2 моля, т.е. 222 г 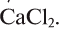
4) 111 г 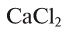
Ответ: 111 г.
Вода и её распространение в природе и свойства
Вода является самым широко распространенным веществом в земной коре. Примерно 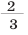
Для очистки воды от растворенных в ней веществ, т.е. для получения чистой воды, используют метод дистилляции.
Физические свойства
Вода — это бесцветная жидкость, без вкуса и запаха, при нормальном атмосферном давлении (101,3 кПа) и температуре 0


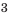
Химические свойства
Под действием постоянного тока вода разлагается (чистая вода не проводит электрический ток).
Вода также вступает во взаимодействие с галогенами (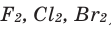
В обычных условиях вода вступает в реакцию с активными металлами (Li, Na, К, Са, Ва и др.). А при высокой температуре она может взаимодействовать с большинством малоактивных металлов (Mg, Zn, Fe и др.). Например:
Влейте в пробирку немного воды и добавьте несколько капель фенолфталеина. Затем прикрепите пробирку к рукоятке штатива. Добавьте в воду бензин и опустите в эту смесь кусок металла натрия. Что вы наблюдаете? Напишите уравнение реакции. В чём причина изменения цвета воды и не смешивания бензина с водой?
Из металлов вода ни при каких условиях не вступает в реакцию с Сu, Hg, Ag, Pt, Аu.
Проблема загрязнения водных бассейнов
Без воды нет жизни. При потере живыми организмами 10-20% воды они погибают. Для нормальной жизненной деятельности в течение суток человеку требуется до 2 л воды (рис.1).
Вода является жизненной средой для тысяч растений и животных. Стабильность сохранения кислорода в атмосфере также связана с выделением его зелеными растениями в результате реакции фотосинтеза, протекающей с помощью воды.
Несмотря на то, что примерно 70% земной поверхности покрыто водой, с каждым годом все более обостряется проблема нехватки воды (рис.2). Это связано с употреблением людьми и всеми живыми существами лишь пресной воды. Большая же часть природных вод (
В сельском хозяйстве, городах, в сферах быта и промышленности потребность в воде все более возрастает. С каждым годом потребность в пресной воде ощущается все острее. В настоящее время 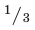
Загрязнение воды приводит к уменьшению количества растворенного в ней кислорода. Нехватка же кислорода затрудняет жизнедеятельность обитающих в воде растений и животных, нарушается нормальный ход биохимических процессов (рис.3).
Более всего вреда от загрязнения наносится источникам пресной воды, т.к. в быту, технике и сельском хозяйстве используются воды рек и пресных озер.
Промышленные отходы наряду с нарушением нормальной жизнедеятельности гидрофауны, меняют физико-химические свойства вод водоемов. Такие воды непригодны не только для питья, но и для оросительных и технических целей в сельском хозяйстве. Употребление людьми ряда живых организмов, приспособленных к условиям жизни в загрязненной воде (улитки, рыбы, водоросли и др.), приводит к возникновению все новых и новых болезней. Ряд канцерогенных веществ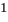
Загрязнение природных вод нефтью и нефтепродуктами чревато еще более тяжелыми последствиями (рис.4). Нефть является сильным ядом для всех обитателей воды (кроме некоторых бактерий).
Попав в воду, нефть разливается по ее поверхности, образуя тонкую пленку, и тем самым закрывая доступ кислорода в воду из воздуха и затрудняя дыхание живым организмам. Одна капля нефти покрывает пленкой 1,5-2 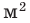
Основными источниками загрязнения нефтью морей и океанов являются транспортирующие нефть танкеры, морские нефтяные залежи, нефтеперерабатывающие заводы, смазочные масла морских судов и лодок. Сегодня имеются такие участки мировых океанов и морей, где невозможно заниматься ловлей рыбы. В некоторых морях (например, в Средиземном море) выловленную рыбу и других морских животных невозможно употреблять в пищу из-за резкого запаха нефти.
Для очистки сточных вод применяются в последовательном порядке механический, физико-химический и биологический методы.
В настоящее время самым эффективным и современным методом обезвреживания воды считается очистка с использованием атомарного кислорода. При данном методе молекулы кислорода в специальном устройстве превращаются в атомы, которые уничтожают имеющиеся в воде бактерии, водоросли, плесневые грибки и вирусы. Таким образом обеспечивается охрана открытых водоемов от загрязнения. Атомарный кислород также легко окисляет многие органические и неорганические соединения, превращая их в безвредные вещества.
Что такое вода и из чего она состоит
Каждый из вас, услышав слово «раствор», наверное, представит себе прозрачную жидкость — бесцветную или окрашенную, а также вспомнит о воде, которая входит в состав многих растворов.
Почему вода растворяет то или иное вещество? Существует ли связь между способностью вещества растворяться и его строением? Что происходит при образовании раствора? Ответы на эти и другие вопросы вы найдете, внимательно прочитав эту страницу. Узнаете и о том, какие частицы существуют в растворах, поймете суть химических реакций с участием растворенных веществ. Кроме того, вы научитесь готовить растворы и проводить соответствующие вычисления.
Вода — наиболее распространенное соединение на нашей планете. Она покрывает свыше 2/3 поверхности Земли (рис. 1).
Рис. 1. Вода на поверхности Земли
Приблизительно 97 % всей воды находится в морях и океанах. Такая вода содержит многие растворенные вещества. На пресную воду приходится 3 %. Почти вся она сконцентрирована в снегах и льдах Антарктиды, Арктики, регионах с вечной мерзлотой. Реки и озера содержат лишь 0,03 % всей воды, имеющейся на планете. Именно эту воду человек использует для своих потребностей. Поэтому охрана водных ресурсов планеты от загрязнений является одной из важных задач, стоящих перед человечеством (рис. 2).
Рис. 2. Вода — наше богатство
Вода в незначительном количестве содержится в атмосфере, причем — в трех агрегатных состояниях: газообразном (водяной пар обуславливает влажность воздуха), жидком и твердом (туман, облака). Атмосферные осадки (дождь, снег), выпадая на земную поверхность, захватывают с собой пыль, некоторые растворившиеся газы и тем самым очищают воздух.
Вода содержится и в твердой оболочке планеты — литосфере, причем как в «свободном» состоянии (подземные воды), так и в «химически связанном» — в составе различных природных соединений и минералов.
Массовая доля воды в живых организмах составляет от 50 до 99 %, а в организме взрослого человека — около 65 %.
Природная вода всегда содержит примеси. Сравнительно чистую воду получают перегонкой. Ее называют дистиллированной и используют в научных исследованиях, некоторых производствах, для приготовления лекарств.
Строение молекулы воды
Химическая формула воды 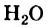
Обратим внимание на строение атомов Гидрогена и Оксигена (их электронные формулы вы составляли в 8 классе):
Каждая связь в молекуле воды образована s-электроном атома Гидрогена и одним р-электроном атома Оксигена. Два р-электрона атома Оксигена, участвующие в этих связях, являются неспаренными и находятся в разных орбиталях. Поскольку р-орбитали расположены перпендикулярно друг другу, молекула воды имеет угловое строение (Такое объяснение строения молекулы воды является упрощенным).. Правда, угол между прямыми, соединяющими центры атомов Гидрогена и Оксигена, составляет не 90°, а 104,5°:
На рисунке 3 изображены две модели молекулы воды. В шаростержневой модели стержни имитируют простые ковалентные связи между атомами, а в масштабной модели соблюдено соотношение размеров атомов и молекулы.
Рис. 3. Модели молекулы воды: а — шаро-стержневая; б — масштабная. Белые шарики — атомы Гидрогена, красные — атомы Оксигена
Поскольку Оксиген — более электроотрицательный элемент, чем Гидроген, то общие электронные пары смещены от двух атомов Гидрогена к атому Оксигена. Связи О-Н являются полярными. На атоме Оксигена сосредоточен небольшой отрицательный заряд, а на каждом из двух атомов Гидрогена — положительный:
Итак, молекула воды со стороны атома Оксигена заряжена отрицательно, а с противоположной стороны, где размещены атомы Гидрогена, — положительно. Такую молекулу называют полярной; она является диполем (Термин происходит от греч. di(s) — дважды и polos — полюс), т. е. имеет два разноименно заряженных полюса. Ее условно изображают эллипсом, в который вписаны знаки « + » и « — » без указания величин зарядов:
Полярность молекулы воды существенно влияет на свойства этого вещества.
Водородная связь. Молекулы-диполи воды могут притягиваться друг к другу, а именно, атом 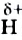
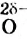
Электростатическое взаимодействие между молекулами с участием атомов Гидрогена называют водородной связью.
Водородную связь принято обозначать тремя точками: 
Рис. 4. Рис . 5.
Водородные связи Снежинка
Водородные связи существуют и в жидкой воде, и во льду. Каждая молекула воды соединена водородными связями с четырьмя другими (рис. 4). Это является причиной характерной формы снежинок (рис. 5). В жидкой воде часть водородных связей постоянно разрушается, но одновременно образуются новые связи.
Выводы:
Вода — одно из наиболее распространенных в природе соединений. Ее молекула содержит ковалентные полярные связи О-Н, имеет угловую форму и является полярной. На каждом атоме Гидрогена молекулы воды сосредоточен небольшой положительный заряд, а на атоме Оксигена — небольшой отрицательный заряд.
Молекулы воды притягиваются друг к другу вследствие электростатического взаимодействия между атомами Гидрогена и Оксигена разных молекул. Такое взаимодействие называют водородной связью.
Физические свойства воды
Каждому известно, что вода — бесцветная жидкость без вкуса и запаха, которая замерзает при температуре О °С, а закипает при 100 °С (при давлении 760 мм рт. ст.). Вода имеет плотность 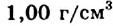
Температуры плавления льда и кипения воды значительно выше, чем, например, метана 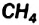
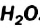
Лед немного легче воды; его плотность составляет 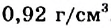
Рис. 6. В реке, покрытой льдом, жизнь продолжается
Лед не тонет в воде, и зимой водоемы обычно не промерзают до дна. Это спасает рыбу, других обитателей рек и озер от гибели (рис. 6).
Химические свойства воды
Вода проявляет достаточную химическую активность. Она реагирует со многими веществами — и простыми, и сложными.
Рис. 7. Реакция натрия с водой
Реакции с простыми веществами и водой
Вам известно, что вода взаимодействует с наиболее активными металлами — щелочными (рис. 7) и щелочноземельными. Продуктами каждой реакции является основание (щелочь) и водород:
С магнием вода реагирует при нагревании.
С водой взаимодействуют и некоторые менее активные металлы, но при достаточно высокой температуре (реагентом является водяной пар). При этом вместо гндроксидов металлических элементов образуются оксиды:
Вода реагирует и с некоторыми неметаллами. Взаимодействием водяного пара с раскаленным углем получают смесь газов, которую используют как топливо:
Реакции со сложными веществами и водой
Среди соединений, с которыми реагирует вода, — немало оксидов и солей.
Вода взаимодействует с некоторыми основными оксидами и почти со всеми кислотными. Такие химические превращения вы изучали в 8 классе. Все они являются реакциями соединения. Кислотные оксиды, взаимодействуя с водой, образуют соответствующие оксигенсо-держащие кислоты, а оксиды щелочных и щелочноземельных элементов — основания (щелочи):
Из известных вам кислотных оксидов лишь один не вступает в реакцию с водой; его формула — 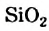
Вода реагирует с некоторыми солями. Часть этих химических превращений, которые являются реакциями соединения, рассмотрим в следующем параграфе.
Это интересно. Водяной пар в особых условиях реагирует с несолеобразующим оксидом СО:
Разложение воды
Вода — термически устойчивое вещество. Ее молекулы начинают разрушаться при очень высокой температуре. При 2500 °С разлагается приблизительно 11 % всех молекул, а при 1000 °С — лишь 0,03 %. Продукты разложения воды — водород и кислород:
Воду можно разложить и с помощью электрического тока.
Рис. 8. Разложение воды постоянным электрическим током
Выводы:
Вода при обычных условиях — бесцветная жидкость с плотностью 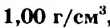
Вода взаимодействует со щелочными и щелочноземельными металлами, оксидами щелочных и щелочноземельных элементов, кислотными оксидами. При очень высокой температуре или действии постоянного электрического тока вода разлагается на водород и кислород.
Кристаллогидраты
Вода вступает в реакции соединения с некоторыми солями. При этом образуются вещества (тоже — соли), которые, кроме соответствующих катионов и анионов, содержат молекулы воды.
ЛАБОРАТОРНЫЙ ОПЫТ № 1
Реакция купрум(II) сульфата с водой
В маленькую фарфоровую чашку поместите немного порошка купрум(II) сульфата (соединение белого цвета) и добавьте несколько капель воды. Что наблюдаете?
Добавляйте к веществу воду (небольшими порциями) при перемешивании до его полного растворения.
Поставьте фарфоровую чашку на кольцо лабораторного штатива, зажгите спиртовку и осторожно выпаривайте из раствора воду до появления мелких голубых кристаллов.
Выпаривание можно проводить на предметном стекле. Необходимо нанести на него 2—3 капли раствора и держать стекло над пламенем.
В этом опыте купрум(II) сульфат превращается в новое вещество. Его химическая формула — 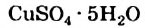
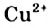
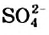
Уравнение реакции образования медного купороса:
Кристаллические вещества, в состав которых входят молекулы воды, называют кристаллогидратами.
Рис. 9. Природные кристаллы гипса
Известно много кристаллогидратов. Среди Кристаллогидрат них — гипс 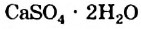
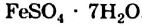
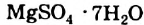
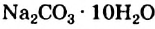
Воду, которая содержится в кристаллогидратах, называют кристаллизационной.
Часто кристаллогидраты и соответствующие безводные соединения имеют различную окраску (рис. 10).
Рис. 10. Некоторые кристаллогидраты и безводные соли
При нагревании кристаллогидраты разлагаются с выделением воды:
Решение задач на тему: Вода
При использовании кристаллогидратов нередко возникает потребность в различных расчетах.
Пример №5
Найти массовую долю воды в медном купоросе.
Дано:
Решение:
1-й способ
1. Вычисляем молярную массу медного купороса:
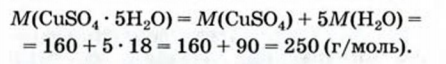
2. Составляем пропорцию и находим массовую долю воды в кристаллогидрате:
250 г (масса 1 моль кристаллогидрата) — 1 (или 100%),
90 г (масса 5 моль воды) — х;
2-й способ
1. Вычисляем молярную массу медного купороса:
2. Находим массовую долю воды в криллогидрате по соотвутствующей формуле:
Ответ:
Пример №6
Какие массы кристаллизационной воды и безводной соли содержатся в 25 г медного купороса?
Дано:
Решение
1-й способ
1. Вычислив молярную массу медного купороса (см. задачу 1), находим массу кристаллизационной воды:
2. Рассчитываем массу безводной соли:
2-й способ
1. Вычисляем количество вещества кристаллогидрата:
2. Находим количество вещества кристаллизационной воды в 0.1 моль кристаллогидрата:
3. Рассчитываем массу кристаллизационной воды:
4. Вычисляем массу безводной соли:
Ответ:
Выводы:
Кристаллические вещества, в состав которых входят молекулы воды, называют кристаллогидратами. При нагревании они разлагаются с образованием безводных соединений и воды.
Вода и растворы
Что общего у воздуха, морской воды, нефти, гранита, молока, ювелирного сплава, зубной пасты? Это — смеси веществ.
Вам известно, что смеси бывают однородными и неоднородными.
В неоднородной смеси можно увидеть невооруженным глазом или с помощью микроскопа твердые частицы, капельки отдельных веществ, пузырьки газов. Некоторые смеси этого типа имеют общие названия.
Неоднородную смесь жидкости и газа называют пеной. Она образуется, например, когда в стакан наливают из бутылки газированный напиток.
Хорошо взболтанную смесь двух жидкостей, которые не растворяются друг в друге, называют эмульсией. Примером эмульсии является молоко; его главные компоненты — вода и жидкие жиры.
Если перемешать жидкость с нерастворимым в ней, хорошо измельченным твердым веществом, получим суспензию. Суспензиями являются смеси воды с порошком мела, мукой, некоторые лекарственные препараты.
Растворы:
Однородные смеси отличаются от неоднородных тем, что в них равномерно распределены мельчайшие частицы веществ — атомы, молекулы, ионы. Эти частицы нельзя обнаружить даже с помощью мощного микроскопа.
Однородные смеси веществ называют растворами.
Наверное, каждый из вас полагает, что раствор — это жидкость. Но, кроме жидких растворов, существуют твердые и газообразные растворы (рис. 11).
Рис. 11. Растворы (однородные смеси): а — водный раствор 
Раствор содержит по меньшей мере два вещества. Это — его компоненты. Один из них называют растворителем, а остальные — растворенными веществами. Растворителем считают вещество, которое находится в таком же агрегатном состоянии, что и раствор.
Если агрегатное состояние всех веществ, образовавших раствор, одинаково, то растворителем считают вещество, масса которого наибольшая. Правда, для водных растворов существует традиция именно воду называть растворителем.
Вода растворяет многие вещества; это — лучший растворитель.
Различают концентрированные и разбавленные растворы. Разбавленный раствор содержит значительно больше растворителя, чем растворенного вещества, а концентрированный — наоборот.
Свойства раствора отличаются от свойств его компонентов. Например, водный раствор поваренной соли замерзает при температуре несколько ниже О °С, закипает при температуре, превышающей 100 °С, и, в отличие от воды и кристаллов натрий хлорида, хорошо проводит электрический ток.
Образование раствора:
Процесс образования раствора часто сопровождается не только физическими явлениями, но и химическими.
Рассмотрим, как происходит растворение в воде ионного вещества. При попадании кристалла такого вещества в воду к каждому иону, находящемуся на его поверхности, притягиваются молекулы воды своими противоположно заряженными частями (рис. 12). Если силы такого взаимодействия преобладают над силами притяжения между катионами и анионами в кристалле, ионы постепенно отделяются друг от друга и переходят в воду. Кристалл растворяется. В образовавшемся растворе находятся ионы растворенного вещества, соединенные с молекулами воды. Такие частицы называют гидратированными. Растворение натрий хлорида в воде можно проиллюстрировать такой схемой:
Рис. 12. Растворение ионного кристалла в воде
Образование гидратированных ионов обуславливает существование кристаллогидратов.
Растворение молекулярных веществ в воде может происходить по-разному. Если, например, молекулы кислорода, спирта, сахара, попадая в воду, остаются неизменными, то молекулы хлороводорода, сульфатной кислоты распадаются на ионы (§ 8). А растворение углекислого газа в воде сопровождается химической реакцией — образованием карбонатной кислоты. Правда, с водой реагирует лишь незначительная часть карбон(IV) оксида.
Процесс образования водного раствора можно разделить на три стадии:
- Взаимодействие частиц вещества и молекул воды.
- Отделение частиц вещества (молекул, ионов) друг от друга под действием молекул воды.
- Взаимная диффузия вещества и воды, т. е. проникновение частиц одного вещества между частицами другого (рис. 13).
При растворении газа в воде вторая стадия отсутствует.
Рис. 13. Диффузия окрашенных ионов 
Для того чтобы твердое вещество растворялось быстрее, его измельчают, увеличивая таким образом поверхность будущего контакта частиц вещества с растворителем. Кроме того, растворение проводят при перемешивании, а иногда и при нагревании.
Тепловой эффект при растворении:
Образование раствора сопровождается выделением или поглощением теплоты.
ЛАБОРАТОРНЫЙ ОПЫТ № 2
Тепловой эффект при растворении вещества
В пробирку поместите приблизительно 1/2 чайной ложки натрий нитрата и добавьте 5 мл воды. Содержимое пробирки перемешивайте стеклянной палочкой для ускорения процесса растворения. Прикоснитесь рукой ко дну пробирки. Что ощущаете?
Появление теплового эффекта при растворении можно объяснить следующим образом. Взаимодействие частиц вещества и молекул воды (это — первая стадия растворения) происходит с выделением теплоты, а разъединение молекул или ионов вещества (вторая стадия растворения) — с поглощением теплоты. Если на первой стадии растворения выделяется больше теплоты, чем ее поглощается на второй, то происходит разогревание раствора. А если наоборот — раствор охлаждается.
Смешав спирт или сульфатную кислоту с водой, мы зафиксируем повышение температуры раствора (во втором случае — очень сильное). Причина состоит в том, что на второй стадии растворения этих веществ поглощается мало теплоты, так как взаимодействие между молекулами спирта или кислоты является довольно слабым.
Рис. 14. Правильное приготовление разбавленного раствора сульфатной кислоты
Существует правило приготовления разбавленного раствора сульфатной кислоты из концентрированного. Концентрированный раствор добавляют в воду (рис. 14), причем медленно, небольшими порциями, постоянно перемешивая и охлаждая сосуд водопроводной водой. Если же добавлять воду в концентрированную кислоту, то образующийся раствор может даже закипеть, а брызги кислоты — попасть на кожу и вызвать сильные ожоги.
Иногда при образовании раствора обнаружить тепловой эффект не удается (например, при растворении поваренной соли в воде). На самом деле он есть, но незначительный.
Коллоидные растворы:
Водные растворы крахмала и натрий хлорида внешне не отличаются друг от друга, они бесцветны и прозрачны. Но если на каждый раствор направить пучок света, то лишь в растворе крахмала мы увидим его «путь» (рис. 15).
Рис. 15. Прохождение света через раствор крахмала
Свет рассеивают очень большие молекулы этого вещества; каждая из них содержит тысячи соединенных атомов (О крахмале пойдет речь в § 31). Подобное явление наблюдается при прохождении солнечных лучей сквозь туман (рис. 16) или запыленный воздух. В первом случае свет отражают мелкие капельки воды, во втором — пылинки.
Рис. 16. Солнечные лучи в лесу
Растворы, содержащие большие частицы растворенных веществ, скопления многих атомов или молекул, называют коллоидными, а те, в которых находятся мельчайшие частицы веществ (отдельные атомы, молекулы, ионы), — истинными.
Это интересно. Размер молекулы воды — 0,25 нм.
Размеры частиц растворенных веществ в коллоидных растворах составляют от 1 до 100 нм (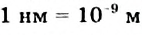
Коллоидные растворы довольно устойчивы; частицы растворенных веществ в них длительное время не оседают. Одна из причин этого — наличие на их поверхности одноименных зарядов (частицы отталкиваются друг от друга и не «слипаются»). Вызвать осаждение частиц можно нагреванием коллоидного раствора или растворением в нем какой-либо соли (например, натрий хлорида).
Коллоидные растворы очень распространены в живой природе. Ими являются кровь, плазма крови, межклеточные жидкости, соки растений.
Общее научное название неоднородных смесей и коллоидных растворов — дисперсные системы.
Значение растворов:
Вещества, растворяясь в природной воде, «путешествуют» по планете, попадают на земную поверхность, участвуют в химических реакциях с образованием минералов, компонентов почвы. Растворы поступают в растения через корни и листву, а в организмы животных и человека — вместе с пищевыми продуктами, поставляя необходимые вещества.
Химические реакции в живых организмах протекают только в водных растворах (в основном, — коллоидных). В процессе пищеварения принимают участие слюна, желудочный сок, желчь. Вместе с мочой и потом из организма выводятся продукты жизнедеятельности, а иногда — и токсичные вещества.
Вода, которую мы пьем, в действительности является очень разбавленным раствором. В ней растворены ничтожно малые количества различных веществ, которые придают воде едва ощутимый вкус. Пить только чистую (дистиллированную) воду нельзя, так как организм не будет получать некоторые элементы и из него будут «вымываться» нужные вещества. При наличии в природной воде некоторых веществ и ионов она может иметь лечебные свойства, восстанавливать солевой баланс в организме. Жидкие лекарства в основном являются водными растворами.
Живые существа дышат кислородом, входящим в состав воздуха. А воздух — это природный газовый раствор. Если бы мы дышали чистым кислородом, то процессы окисления в организме происходили очень интенсивно, а этого наш организм не выдержал бы.
Без растворов не могут работать металлургические и химические заводы, предприятия легкой и пищевой промышленности, бытового обслуживания, медицинские учреждения.
Выводы:
Смеси веществ бывают однородными и неоднородными. В однородных смесях (растворах) равномерно распределены атомы, молекулы или ионы веществ.
При образовании раствора происходят физические и химические явления. Химические явления обусловлены взаимодействием частиц растворенного вещества и растворителя.
Процесс растворения вещества сопровождается выделением или поглощением теплоты.
Коллоидные растворы отличаются от обычных (истинных) тем, что содержат очень большие молекулы или скопления частиц растворенного вещества.
Растворимость веществ в воде
Характеризуя физические свойства какого-либо вещества, обычно указывают, растворяется ли оно в воде, спирте, других растворителях.
Свойство вещества образовывать с другим веществом раствор называют растворимостью.
Сульфатная и нитратная кислоты, этиловый спирт, ацетон смешиваются с водой в любых соотношениях с образованием растворов. Эти вещества имеют неограниченную растворимость в воде. Но для многих других веществ существует предел растворения.
ЛАБОРАТОРНЫЙ ОПЫТ № 3
Обнаружение ограниченной растворимости вещества в воде
Налейте в пробирку 2 мл воды и растворяйте в ней калий нитрат небольшими порциями при перемешивании стеклянной палочкой. Каждую порцию вещества добавляйте после полного растворения предыдущей. Зафиксируйте момент, когда растворение соли прекращается.
Оставьте пробирку со смесью веществ для следующего опыта.
Раствор, в котором при данных условиях вещество больше не растворяется, называют насыщенным (рис. 17), а тот, в котором еще можно растворить определенную порцию вещества, — ненасыщенным.
Рис. 17. Насыщенный раствор калий бромата 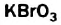
Растворимость большинства веществ можно оценить количественно. Для этого указывают максимальную массу вещества, которая может раствориться в 100 г растворителя при определенной температуре. Для газа обычно указывают его максимальный объем, растворяющийся в 100 г или 1 л растворителя при определенных температуре и давлении. Соответствующую физическую величину принято обозначать буквой S (от латинского слова solvere — растворять).
Веществ, абсолютно нерастворимых в воде, не существует. Если в серебряный сосуд налить воды, то ничтожное количество металла со временем растворится. Полученная «серебряная» вода имеет антимикробные свойства и, в отличие от обычной, может храниться неограниченное время.
Способность вещества растворяться в воде зависит от его строения, т. е. от типа частиц, из которых состоит вещество, а также от внешних условий — температуры, давления.
Зависимость растворимости веществ от их строения. Большинство ионных веществ хорошо растворяется в воде. Таким свойством обладают и вещества, которые, как и вода, состоят из полярных молекул. Вещества с неполярными молекулами, например азот 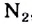
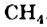
Зависимость растворимости веществ от температуры. Влияние температуры на растворимость вещества большей частью определяется его агрегатным состоянием.
Если в стакан налить холодной водопроводной воды и оставить в теплом месте, то спустя некоторое время на его стенках появятся пузырьки воздуха, который был растворен в воде (рис. 18). В теплой воде растворимость газов меньше, и «лишний» воздух выделяется из нее.
Растворимость газов в воде с повышением температуры уменьшается.
Определим с помощью эксперимента, как влияет температура на растворимость твердого вещества в воде.
ЛАБОРАТОРНЫЙ ОПЫТ № 4
Влияние температуры на растворимость твердого вещества
Осторожно нагревайте пробирку со смесью калий нитрата и его насыщенного раствора (эта смесь осталась после лабораторного опыта № 3). Содержимое пробирки периодически перемешивайте. Что наблюдаете?
Сделайте вывод относительно влияния температуры на растворимость калий нитрата в воде.
Рис. 18. Выделение пузырьков растворенного воздуха из нагретой водопроводной воды
Растворимость большинства твердых веществ в воде с повышением температуры увеличивается.
Некоторые соединения, в частности кальций гидроксид 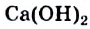
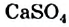
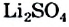
Зависимость растворимости вещества от температуры часто представляют графически — в виде кривой растворимости (рис. 19). На горизонтальной оси такого графика обозначают температуру, а на вертикальной — растворимость, т.е. максимальную массу вещества, которая растворяется при данной температуре в 100 г воды.
Точки на кривой растворимости отвечают составу насыщенных растворов, а область под кривой — ненасыщенным растворам.
Рис. 19. Кривые растворимости некоторых солей в воде
Зависимость растворимости газов от давления:
Если открыть бутылку с газированным напитком, то углекислый газ, который был растворен в жидкости при повышенном давлении, начнет из нее быстро выделяться; жидкость вспенивается. Причина этого состоит в том, что раствор попадает в условия обычного давления, при котором растворимость газа намного меньше.
Растворимость газов и воде с повышением давления увеличивается.
Растворимость большинства газов в воде прямо пропорциональна давлению; соответствующий график является прямой линией. Если давление увеличить в несколько раз, то растворимость газа в воде возрастет во столько же раз (рис. 20).
Рис. 20. Влияние давления на растворимость газа в воде
На растворимость в воде твердых и жидких веществ давление не влияет.
Выводы:
Свойство вещества образовывать с другим веществом раствор называют растворимостью.
Большинство веществ имеет ограниченную растворимость в воле. Ее выражают максимальной массой вещества, которая может раствориться при определенной температуре (для газов — еще и при определенном давлении) в 100 г воды. Раствор, в котором содержится максимально возможное количество растворенного вещества, называют насыщенным.
Растворимость большинства твердых веществ в воде с повышением температуры возрастает, а от давления не зависит. Газы увеличивают растворимость в воде с понижением температуры и повышением давления.
ЭКСПЕРИМЕНТ:
Выращивание кристаллов медного купороса
Приготовьте насыщенный раствор медного купороса. Для этого насыпьте в стеклянный сосуд чайную ложку соединения и доливайте небольшими порциями, постоянно перемешивая, горячую воду до растворения кристаллов. В случае необходимости горячий раствор профильтруйте. Накройте сосуд листом бумаги и оставьте раствор охпаждаться до комнатной температуры.
Рис. 21. Выращивание кристалла медного купороса из насыщенного раствора
На следующий день вы увидите на дне сосуда кристаллы вещества: над ними будет насыщенный раствор. Достаньте пластмассовым пинцетом кристалл правильной формы, без дефектов, и положите его на бумагу. Слейте насыщенный раствор с оставшихся кристаллов в другой сосуд и осторожно положите на дно этого сосуда отобранный кристалл. Его можно подвесить на тонкой нити (рис. 21). Сосуд ничем не накрывайте и оставьте на несколько дней.
Вода будет постепенно испаряться из насыщенного раствора, на дне стакана появятся новые кристаллы вещества и вырастет тот. который был помещен в раствор. Удаляя мелкие кристаллы и переворачивая отобранный на разные грани для равномерного роста (делайте это с интервалом в несколько дней), можно вырастить красивый кристалл величиной в несколько сантиметров. Периодически добавляйте в сосуд новые порции холодного насыщенного раствора соединения.
Если мелкие кристаллы из сосуда не удалять, то образуются друзы — группы кристаллов, сросшихся друг с другом (рис. 22).
Рис. 22. Друзы кристаллов различных солей
Можно также выращивать кристаллы алюмокалменых квасцов 
Количественный состав раствора. Массовая доля растворенного вещества
Человек использует в своей жизни много растворов. Среди них — спиртовый раствор иода, водные растворы аммиака и перекиси водорода, столовый уксус и уксусная эссенция (рис. 23). Обратите внимание на этикетки, имеющиеся на бутылках с этими растворами. Вы заметите возле названия растворенного вещества цифру и знак процента (%). Это — значение массовой доли растворенного вещества в растворе. Оно соответствует массе вещества (в граммах), которая содержится в 100 г раствора.
Рис. 23. Водные растворы, используемые в быту
Столовый уксус является водным раствором уксусной кислоты. Согласно этикетке на бутылке, в каждых 100 г уксуса содержится 9 г уксусной кислоты. Массе воды в 100 г уксуса составляет 100 г — 9 г = 91 г.
Если растворителем является водя, то па этикетках обычно не Указывают слова «водный раствор».
Для обозначения массовой доли растворенного вещества в растворе, как и массовой доли элемента в соединении, используют латинскую букву 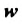
Вам известно, что массовую долю выражают не только в процентах, но и положительным числом, которое меньше единицы.
Формула для вычисления массовой доли растворенного вещества в растворе:
где 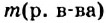
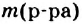
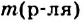
Массовая доля растворенного вещества в растворе отношение массы вещества к массе раствора.
Решение задач на тему: Вода и растворы
В повседневной жизни (например, при консервировании) нередко возникает необходимость приготовить водный раствор с определенной массовой долей растворенного вещества. Для этого обычно используют вещество и воду. Иногда разбавляют водой концентрированный раствор вещества, в частности уксусную эссенцию. В любом случае перед приготовлением раствора проводят необходимые расчеты.
Рассмотрим, как решают задачи на вычисление массовой доли растворенного вещества в растворе, а также задачи, в которых используют эту величину. Один из способов решения основан на составлении пропорции, другой предполагает расчет по соответствующей математической формуле.
Пример №7
В 144 г воды растворили 6 г щелочи. Рассчитать массовую долю щелочи в растворе.
Дано:
Решение:
1-й способ
1. Находим массу раствора:
2. Определяем массу щелочи, кооторая содержится в 100 г раствора. Для этого составляем пропорцию и решаем ее:
в 150 г раствора содержится 6 г щелочи,
в 100 г раствора — х г щелочи;
Отсюда
2-й способ
Вычисляем массовую долю щелочи в растворе по соответствующей формуле:
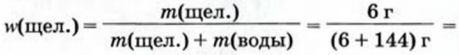
Ответ: 
Пример №8
Какие массы соли и воды нужно взять для приготовления 400 г раствора соли с массовой долей растворенного вещества 0,2?
Дано:
Решение:
1. Вычисляем массу соли, воспользовавшись формулой для массовой доли растворенного вещества:
2. Находим массу воды:
Ответ:
Пример №9
К 200 г в одного раствора сахара с массовой долей растворенного вещества 10 % добавили 50 г воды. Вычислить массовую долю сахара в образовавшемся растворе.
Дано:
Решение: Условие задачи проиллюстрируем рисунком:
1. Вычисляем массу сахара в 200 г раствора:
2. Находим массу образовавшегося раствора:
3. Рассчитваем массовую долю сахара в образовавшемся растворе по соответствующей формуле:
Ответ:
Пример №10
Какой объем воды нужно добавить к 45 г уксусной эссенции (раствор с массовой долей уксусной кислоты 80 %), чтобы приготовить 9 %-й раствор уксусной кислоты?
Дано:
Решение:
1. Рассчитываем массу уксусной кислоты в 45 г уксусной эссенции:
2. Вычисляем массу 9%-го раствора, в котором будут находиться 36 г кислоты:
3. Рассчитываем массу воды, которую нужно добавить к уксуссной эссенции:
4. Находим объем воды:
Ответ:
Пример №11
Какие массы медного купороса 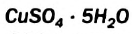

Дано:
Решение:
1. Находим массу купрум(II) сульфата, которая будет находиться в 200 г раствора:
2. Вычисляем массу медного купороса, в которой содержится 10 г 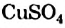
3. Рассчитываем массу воды:
Ответ:
Состав раствора, образованного двумя жидкостями, часто представляют соотношением их объемов. В химической лаборатории на бутылках с растворами кислот можно увидеть надписи «1:2», «1:4». Они свидетельствуют о том, что растворы приготовлены смешиванием одного объема кислоты с двумя или четырьмя объемами воды.
Выводы:
Количественный состав раствора характеризуют массовой долей растворенного вещества.
Массовая доля растворенного вещества является отношением массы вещества к массе раствора. Значение массовой доли, выраженное в процентах, численно равно массе растворенного вещества (в граммах), которая содержится в 100 г раствора.
Электролиты и неэлектролиты и вода
Общеизвестно, что металлы проводят электрический ток. Такое их свойство обусловлено наличием в металлах электронов, которые не удерживаются « своими» атомами и свободно перемещаются в веществе. Если соединить металлическую проволоку или пластину с батарейкой (аккумулятором), то эти электроны начнут перемещаться к положительно заряженному полюсу батарейки. В веществе возникнет электрический ток.
Рис. 25. Прибор для исследования электропроводности веществ, растворов, расплавов
Соли, основания, основные и амфотерные оксиды содержат заряженные частицы иного типа — ионы. Выясним с помощью эксперимента, способны ли вещества ионного строения проводить электрический ток.Перед проведением опытов соберем прибор, состоящий из стакана, двух электродов, лампочки и батарейки (рис. 25). Электродом может служить стержень или пластина из электропроводящего материала — металла или графита. Будем погружать электроды в твердые вещества, их расплавы, водные растворы. Обнаружим, что лампочка горит лишь тогда, когда электроды находятся в жидкости — расплаве или растворе ионного вещества (рис. 26).
Рис. 26. Обнаружение способности водных растворов и воды проводить электрический ток
Объясним результаты опытов.
В твердом веществе ионы соединены друг с другом. Поэтому вещество не проводит электрический ток. В жидкости (расплаве, растворе) ионы движутся хаотически (рис. 27). Если в нее погрузить электроды, соединенные с источником постоянного тока, движение ионов станет направленным. Положительно заряженные ионы (катионы) будут перемещаться к отрицательно заряженному электроду (катоду), а отрицательно заряженные (анионы) — к положительно заряженному электроду (аноду) (рис. 28).
Рис. 27. Хаотическое движение ионов в расплаве или растворе ионного соединения
Рис. 28. Направленное движение ионов к электродам R РЯСПЛЯНР или рястворе ионного соединения
Электропроводными являются не только расплавы и водные растворы ионных веществ, но и водные растворы некоторых молекулярных веществ — кислот. Причина состоит в том, что во время растворения кислоты в воде часть ее молекул разрушается с образованием ионов. Этот процесс рассмотрим в следующем параграфе.
Соединения, водные растворы и расплавы которых проводят электрический ток, называют электролитами. Термин происходит от греческого слова lytos — разлагаемый.
Электролиты (в водном растворе): соли, щелочи, кислоты.
Общее название веществ, растворы и расплавы которых не проводят ток, — неэлектролиты. К ним относятся многие молекулярные вещества, а также все вещества атомного строения.
Значительный вклад в исследование электропроводности водных растворов сделал в начале кислоты XIX в. английский ученый Майкл Фарадей.
Майкл Фарадей (1791-1867)
Выдающийся английский физик и химик, член Лондонского королевского общества (Английской академии наук), почетный член Петербургской академии наук. Открыл законы, устанавливающие зависимость между количеством электричества и массами веществ, разлагающихся или образующихся при действии электрического тока (1833— 1834). Усовершенствовал способ сжижения газов и получил в жидком состоянии хлор, сероводород, аммиак, карбон(IV) оксид, нитроген(IV) оксид. Одним из первых начал изучать реакции, происходящие в присутствии катализаторов. Выполнил фундаментальные исследования по электричеству, магнетизму, сделал немало открытий в физике. Не имел высшего образования.
Электролиты (в расплавленном состоянии): соли, щелочи, ионные оксиды.
То, что ионы в растворе движутся к электродам, соединенным с батарейкой, можно доказать с помощью такого эксперимента. Лист фильтровальной бумаги помещают на стеклянную или полимерную пластину и смачивают бесцветным раствором электролита (например, натрий хлорида). Затем в центр листа наносят несколько капель раствора соли, которая содержит окрашенные катионы (купрум(II) сульфат 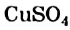
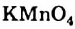
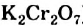
Рис. 29. Опыт по обнаружению движения ионов в растворе к электродам
Цветное пятно начинает смещаться к одному из электродов.
Выводы:
Соединения, водные растворы и расплавы которых проводят электрический ток, называют электролитами. К электролитам относятся все ионные вещества — щелочи, соли, основные и амфотерные оксиды, а также часть молекулярных веществ — кислоты (они проводят ток только в водном растворе). Другие вещества являются неэлектролитами.
Электролитическая диссоциация
Способность растворов или расплавов некоторых веществ проводить электрический ток обусловлена наличием ионов в этих жидкостях.
Распад вещества на ионы при его растворении или его растворении называют электрической диссоциацией. Термин происходит от латинского слова dissociatio — разъединение.
Теорию электролитической диссоциации веществ в растворах создал шведский ученый Сванте-Август Аррениус в 1887 году.
Сванте-Август Аррениус (1859-1927)
Выдающийся шведский ученый, академик Королевской академии наук Швеции, почетный член Петербургской академии, академий наук СССР и многих других стран. Один из основателей физической химии. Сделал значительный вклад в исследования растворов и химических реакций. Автор теории электролитической диссоциации (1887), за создание которой ученому была присуждена Нобелевская премия (1903). Объяснил зависимость скорости реакции от температуры, выдвинув представление об •активных молекулах- (1889). Математическая формула этой зависимости названа уравнением Аррениуса. Автор многих научных работ по химии, биологии, геологии, физике.
Вы уже знаете, что вещества, которые распадаются в растворе или расплаве на ионы, называют электролитами. Среди них есть соединения ионного и молекулярного строения.
Электролитическая диссоциация ионных веществ:
Молекулы воды благодаря электростатическому взаимодействию с ионами, расположенными на поверхности кристаллов, постепенно извлекают эти частицы из вещества (рис. 12). Кристаллы разрушаются, вещество растворяется. Оставаясь соединенными с молекулами воды, катионы и анионы электролита вместе с другими молекулами воды образуют раствор.
Электролитическую диссоциацию вещества, как и химическую реакцию, можно отобразить с помощью химического уравнения. Запишем уравнения электролитической диссоциации натрий хлорида и алюминий сульфата в водном растворе:
Водные растворы солей содержат ионы, из которых состоят эти вещества.
Соли — электролиты, которые диссоциируют в водных растворах или расплавах на катионы металлических элементов и анионы кислотных остатков.
В водных растворах щелочей содержатся катионы металлических элементов и гидроксид-ионы ОН . Уравнения электролитической диссоциации калий гидроксида и барий гидроксида:
Основания — электролиты, которые диссоциируют в водных растворах или расплавах с образованием анионов такого типа — гидроксид-ионов 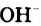
ЛАБОРАТОРНЫЙ ОПЫТ № 5
Обнаружение гидроксид-ионов в растворах щелочей с помощью индикатора
В двух пробирках находятся разбавленные растворы натрий гидроксида и барий гидроксида. Нанесите с помощью пипетки или стеклянной палочки каплю раствора из каждой пробирки на полоску универсальной индикаторной бумаги или другой индикатор. Что наблюдаете? Сделайте соответствующий вывод.
Наличие гидроксид-ионов в водных растворах щелочен обуслпаштпет общие химические спой-ства этих соединений. Так, щелочи одинаково действуют на определенный индикатор: фенолфталеин окрашивается в малиновый цвет, метилоранж — в желтый, лакмус — в синий, универсальный индикатор — в сине-зеленый. Таким образом, с помощью индикатора можно обнаружить в водном растворе щелочи ионы ОН , но не само вещество.
Нерастворимые основания на индикаторы не действуют.
В химии часто используют словосочетание « щелочная среда». Оно указывает на присутствие в растворе гидроксид-ионов.
Электролитическая диссоциация молекулярных веществ. В электролитах молекулярного строения — кислотах — ионы отсутствуют. Они образуются только при растворении веществ в воде.
Рассмотрим, как происходит этот процесс в водном растворе хлороводорода НСl — хлоридной кислоте.
В молекуле НСl существует полярная кова-лентная связь. Общая электронная пара смещена к более электроотрицательному атому Хлора (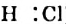
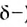
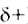
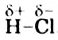
Это интересно. Заряд в атоме Гидрогена в молекуле НСl равен +0 2, а на атоме Хлора +0,2.
При растворении хлороводорода молекулы 
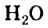
Вследствие этого ковалентные связи во многих молекулах 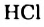
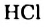
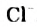
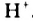
Рис. 30. Образование ионов из молекулы 
Некоторые ионы 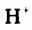
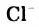
Участие воды в процессе электролитической диссоциации можно проиллюстрировать такой схемой:
Знак обратимости 
В хлоридной кислоте и водных растворах других кислот содержатся, кроме молекул воды, катионы Гидрогена 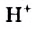
Кислоты — электролиты, которые диссоциируют в полных растворах с образованием катионов одного типа — ионов Гидрогена 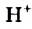
Наличие ионов 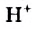
ЛАБОРАТОРНЫЙ ОПЫТ № 6
Обнаружение катионов Гидрогена в растворах кислот с помощью индикатора
В двух пробирках находятся разбавленные хлоридная и сульфатная кислоты. Нанесите с помощью пипетки или стеклянной палочки каплю раствора из каждой пробирки на полоску универсальной индикаторной бумаги. Что наблюдаете? Сделайте соответствующий вывод.
Таким образом, с помощью индикатора можно обнаружить в водном растворе ионы 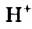
Нерастворимые кислоты на индикаторы не действуют.
Выражение «кислая среда» означает, что в растворе присутствуют катионы Гидрогена.
Диссоциация многоосновных кислот имеет ступенчатый характер; она происходит в несколько стадий. Рассмотрим этот процесс на примере трехосновной ортофосфатной кислоты 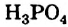
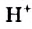
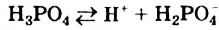
затем, уже от иона 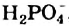
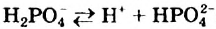
и, наконец, — третий (от иона 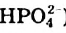
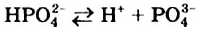
Обратите внимание: заряд иона в левой части второго (или третьего) уравнения равен сумме зарядов ионов в правой части.
На каждой стадии диссоциирует только часть молекул или ионов. Водный раствор ортофос-фатной кислоты содержит, кроме молекул воды, молекулы 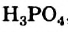
Щелочи и соли, в отличие от кислот, диссоциируют не ступенчато 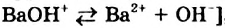
В раствор переходят ионы, из которых состоят эти соединения.
Названия ионов:
Название каждого иона состоит из двух слов.
Почти все катионы являются простыми (одноатомными. Существуют и сложные катионы, например ион аммония 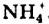
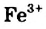
Название «ион Гидрогена» неоднозначно, так как Гидроген — единственный элемент, образующий и катион, и анион. В то же время название «ион Натрия» соответствует только катиону; Натрий как металлический элемент анионов не образует.
Анионы бывают простыми и сложными. Простые анионы образуют только неметаллические элементы. Один из вариантов составления названия простого аниона — такой же, как и для катиона:
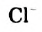
В другом варианте первое слово названия аниона состоит из корня названия элемента и суффикса «ид»; второе слово «ион» пишут после дефиса:
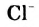
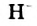
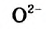
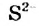
Названия сложных (многоатомных) анионов происходят от химических названий соответствующих кислот:
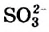
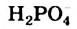
Название аниона 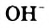
Выводы:
Распад вещества на ионы при его растворении или плавлении называют электролитической диссоциацией. В случае растворения ионного вещества (щелочи, соли) этот процесс заключается в переходе ионов из вещества в раствор. Электролитическая диссоциация молекулярного вещества (кислоты) происходит вследствие распада молекул на ионы.
Соли диссоциируют на катионы металлических элементов и анионы кислотных остатков, основания — с образованием гидроксид-ионов, а кислоты — с образованием катионов Гидрогена.
Не все молекулы кислоты распадаются в растворе на ионы. Электролитическая диссоциация многооснбвных кислот происходит в несколько стадий.
Индикаторы обнаруживают в растворе ионы 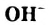
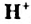
Это интересно. Известны простые анионы, содержащие по два или три одинаковых атома, — 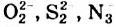
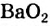
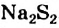
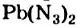
Степень электролитической диссоциации. Вода как электролит
Ионные вещества диссоциируют в водном растворе полностью, а молекулярные — частично. Во втором случае для количественной характеристики этого процесса используют величину, которую называют степенью электролитической диссоциации. (Для упрощения второе слово в названии термина далее указывать не будем.)
Степень диссоциации по отношение числа молекул электролита, распавшихся на ионы, к общему числу его молекул до ассоциации.
Степень диссоциации обозначают греческой буквой 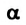
В приведенных формулах 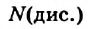
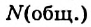
Интервалы значений степени диссоциации: 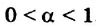
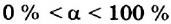
В приведенных выше формулах число продиссоциировавших молекул можно заменить числом образовавшихся катионов или анионов. Учитывая, например, что каждая молекула нитратной кислоты при диссоциации дает один ион 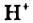
получаем:
В формулу для степени диссоциации можно записать и количество вещества электролита (то, которое продиссоциировало, — в числителе, и общее, т. е. до диссоциации, — в знаменателе):
ЗАДАЧА. В растворе кислоты НА на каждую пару ионов 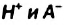
Дано:
Решение: Пара ионов 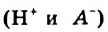
Значит, до диссоциации молекул кислоты 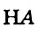
Вычисляем степень диссоциации кислоты:
Ответ:
Слабые и сильные электролиты:
Если значение степени диссоциации равно, например, 0,01 или 0,001 (1 % или 0,1 %), то соединение незначительно распадается на ионы в растворе. Его называют слабым электролитом. Если же значение 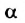
Вам известно, что ионные вещества — щелочи и соли — находятся в растворах только в виде соответствующих ионов. Для этих соединений 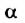
Что касается кислот (молекулярных веществ), то некоторые из них распадаются на ионы в растворах почти полностью, а другие — незначительно. Первые называют сильными кислотами, вторые — слабыми. Существуют и кислоты средней силы.
Приводим примеры важнейших кислот каждого типа; их формулы записаны в порядке уменьшения степени диссоциации соединений в растворах:
Мы назвали сильными кислотами те, которые активно взаимодействуют со многими веществами. Теперь вы знаете, что в растворах таких кислот содержится наибольшее количество катионов Гидрогена. Значит, химическая активность кислоты зависит от количества ионов 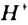
В предыдущем параграфе отмечалось, что многоосновные кислоты диссоциируют в несколько стадий. Каждую стадию можно охарактеризовать соответствующей степенью диссоциации:
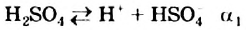
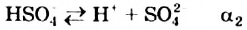
Кислота диссоциирует по первой стадии полнее, чем по второй: 
Вода как электролит:
Результаты опытов свидетельствуют о том, что чистая вода (например, дистиллированная, в которой нет растворенных электролитов) имеет чрезвычайно низкую электропроводимость. Это объясняется наличием в воде ничтожно малого количества ионов 
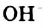
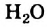
Итак, вода — очень слабый электролит. Она диссоциирует согласно уравнению
Ученые выяснили, что при температуре 25 °С только одна молекула воды из каждых 555 миллионов молекул распадается на ионы. Степень электролитической диссоциации воды составляет
Выводы:
Степень диссоциации — это отношение числа молекул электролита, распавшихся на ионы, к общему числу его молекул. Степень диссоциации также выражают в процентах.
Если электролит распадается на ионы в незначительной мере, его называют слабым, а если полностью или почти полностью, — сильным. Среди кислот имеются электролиты всех типов, а щелочи и соли являются сильными электролитами, поскольку состоят из ионов.
Вода — очень слабый электролит.
Ионно-молекулярные уравнения. Реакции обмена между электролитами в растворе
Уравнения реакций с участием растворов электролитов — щелочей, кислот, солей, которые вы составляли в 8 классе, не передают сути химических превращений, поскольку в них записаны формулы веществ, а не формулы ионов.
Что же происходит на самом деле при взаимодействии электролитов в растворе? Выясним это, рассмотрев реакцию между растворами магний хлорида 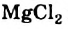
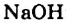
Раствор исходной соли содержит катионы Магния и анионы Хлора
а раствор щелочи — катионы Натрия и гидроксид-ионы:
В результате реакции ионы 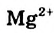
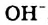
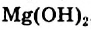
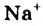
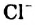
Изменим приведенное выше химическое уравнение с учетом состояния (диссоциированного, недиссоциированного) каждого реагента и продукта. Вместо формул обоих реагентов записываем формулы ионов, находившихся в растворах соединений до реакции, вместе с соответствующими коэффициентами (учитываем индекс 2 в формуле соли Магния и коэффициент 2 перед формулой щелочи):
В правой части уравнения оставляем формулу 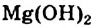
В обеих частях нового уравнения имеются одинаковые ионы — 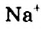
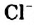
Ионно-молекуляриое уравнение — это уравнение, содержащее формулы веществ и формулы ионов.
Ионно-молекулярное уравнение указывает на то, что именно происходит при химическом превращении, какие частицы взаимодействуют в растворе и какие образуются. При составлении такого уравнения каждое вещество представляют в той форме (диссоциированной, недиссоциированной), которая преобладает в реакционной смеси или является в ней единственно возможной.
При составлении ионно-молекулярного уравнения придерживаются такой последовательности действий:
- Записывают «обычное» химическое уравнение (его называют молекулярным; такое название условное, поскольку молекул оснований и солей не существует; это — ионные вещества).
- По таблице растворимости определяют, какие реагенты и продукты реакции растворяются в воде, а какие — не растворяются.
- Выясняют, какие реагенты и продукты реакции являются сильными электролитами, а какие — слабыми электролитами или неэлектролитами.
- В молекулярном уравнении формулы растворимых сильных электролитов заменяют формулами соответствующих ионов, учитывая при этом индексы и коэффициенты. Сначала записывают катионы, затем — анионы.
- Из обеих частей полученного уравнения удаляют одинаковые ионы (в случае их наличия) в одинаковых количествах.
- Если все коэффициенты окажутся уравнение кратными, их делят на соответствующее число.
Теперь рассмотрим, как выполняют обратное задание. Составим молекулярное уравнение, которое отвечает ионно-молекулярному уравнению
В левой части уравнения записаны только формулы ионов. Значит, соединения, которые взаимодействуют, должны быть растворимыми и сильными электролитами.
Ионы 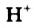
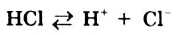
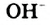
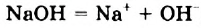
Ионы 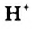
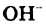
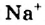
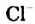
«Соединив» ионы в формулы соответствующих веществ, получаем молекулярное уравнение:
Таким образом, чтобы составить молекулярное уравнение к данному ионно молекулярному уравнению, необходимо заменить каждый ион формулой соответствующего сильного и растворимого электролита, а затем дописать формулы других реагентов (продуктов) — растворимых сильных электролитов.
Очевидно, что ионно-молекулярному уравнению 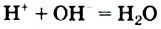
Отметим, что пара реагентов 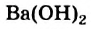
Это интересно. В некоторых ионно-молекулярных уравнениях (например, 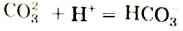
Реакции обмена между электролитами в растворе:
Рассмотренные в параграфе реакции относятся к реакциям обмена. В них соединения обмениваются своими составляющими — ионами.
Не все реакции обмена возможны. В 8 классе вы узнали, что реакция такого типа происходит, если ее продукт является малорастворимым, нерастворимым (он выделяется в виде осадка), газом или слабой кислотой. Теперь добавим, что реакция происходит и тогда, когда образуется слабый электролит, в том числе вода.
Таким образом, для выяснения возможности реакции обмена нужно иметь сведения о растворимости и силе электролитов. Необходимо также знать, что фторидная кислота 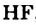
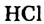
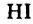
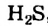
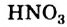
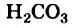
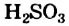
Обратите внимание на ионно-молекулярные уравнения, приведенные в параграфе. Каждое из них указывает на то, что в результате реакции обмени количество ионов в растворе уменьшается.
Рассмотрим случай, когда реакция обмена между электролитами не происходит. Если слить, например, растворы натрий гидроксида (щелочь) и калий хлорида (соль), то никаких изменений или внешних эффектов не заметим. Раствор останется бесцветным; из него не будут выделяться ни осадок, ни газ. Составляя ионно-молекулярное уравнение, обнаружим, что его левая и правая части одинаковы:
Полученный раствор содержит все ионы, которые были в растворах натрий гидроксида и калий хлорида. Следовательно, реакция между этими соединениями не происходит.
Изложенный выше материал касается реакций обмена, в которых оба реагента — растворимые и сильные электролиты. Если же, например, исходная соль нерастворима или исходная кислота — слабая, то вывод о возможности реакции делают после проведения соответствующего химического эксперимента.
Выводы:
Суть реакции, происходящей между электролитами в растворе, передает ионно-молекулярное уравнение; оно содержит формулы веществ и формулы ионов.
Ионно-молекулярное уравнение составляют, представляя растворимые сильные электролиты в диссоциированной форме, т. е. записывая формулы соответствующих ионов, а остальные вещества — в недиссоциированной форме.
Реакция обмена между электролитами в растворе происходит тогда, когда среди ее возможных продуктов имеется нерастворимое либо малорастворимое соединение, газ или слабый электролит.
В результате реакции обмена количество ионов в растворе уменьшается.
Гидролиз солей:
Если в раствор кальцинированной соды, или натрий карбоната, 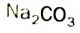
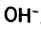
Можно предположить, что второй продукт — карбонатная кислота. Вы знаете, что эта кислота неустойчива и разлагается с образованием углекислого газа. Но выделения газа из раствора соды мы не наблюдаем. Значит, вторым продуктом реакции является другое вещество.
Простое сопоставление количества атомов каждого элемента в формулах двух реагентов и натрий гидроксида указывает на образование наряду со щелочью кислой соли 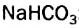
Известно, что с водой реагирует лишь незначительная часть соды. Одновременно происходит обратная реакция — между соединениями 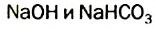
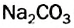
Рассмотренная реакция является реакцией обмена. Правда, обмен веществ своими частицами является неполным: лишь половина ионов Натрия в исходной соли обменивается на атомы Гидрогена.
Реакцию обмена между солью и водой называют реакцией гидролиза. Термин происходит от греческих слов hydor — вода и lysis — разложение.
Установлено, что с водой могут взаимодействовать соли, образованные слабыми основаниями или слабыми кислотами (сода образована слабой карбонатной кислотой). Среду раствора соли обуславливает сильный электролит (в нашем случае — натрий гидроксид), от которого происходит соль; он образуется при ее гидролизе. Так, растворы солей 
Теперь вы сможете объяснить, почему в клетках таблицы растворимости. которые отвечают некоторым солям, имеются обозначения #. Каждая из этих солей происходит от слабого основания и слабой кислоты и поэтому подвергается полному гидролизу:
Качественные реакции на некоторые ионы
Часто возникает необходимость выяснить, содержит ли водный раствор определенные катионы или анионы. Если для обнаружения ионов 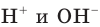
Предлагаем вам осуществить реакции, с помощью которых можно обнаружить в растворе некоторые анионы.
Карбонат-ионы можно также обнаружить в растворе, добавив к нему кислоту. Выделяется углекислый газ, не имеющий запаха. При пропускании этого газа в раствор кальций гидроксида образуется белый осадок кальций карбоната.
Для обнаружения в растворе некоторых анионов вместо аргентум нитрата можно использовать плюмбум(II) нитрат. Хлорид, бромид, сульфат, ортофосфат и карбонат Плюмбума(II) — белые осадки, а иодид — желтый (рис. 27).
Если исследуют очень разбавленные растворы, то некоторые реакции обмена могут не произойти, так как соли 
Поскольку хлорид-ионы выявляют в растворе, добавляя к нему раствор аргентум нитрата, то катионы Аргентума можно обнаружить, воспользовавшись хлоридной кислотой или раствором натрий хлорида.
Провести качественную реакцию с целью обнаружения определенных ионов часто не удается из-за наличия в исследуемом растворе некоторых других катионов или анионов. Вы не сможете, например, проверить с помощью соли 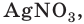
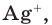
Качественные реакции используют не только для выявления тех или иных ионов, но и для распознавания соединений или их растворов. С помощью таких реакций обнаруживают токсичные катионы и анионы в промышленных стоках. Качественные реакции на нитрат-ионы дают возможность проверить, содержатся ли остатки удобрений (нитратов) в овощах.
Выводы:
Реакции с участием определенных ионов, протекающие с характерным внешним эффектом (образование осадка, выделение газа, появление или изменение окраски раствора), называют качественными реакциями. Их проводят с целью обнаружения различных ионов в растворе, распознавания соединений.