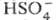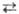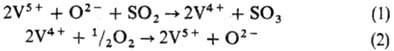серная кислота (Н2SW4) представляет собой жидкое химическое соединение, маслянистое и бесцветное, растворимое в воде с выделением тепла и вызывающее коррозию металлов и тканей. Обугливает древесину и большинство органических веществ при соприкосновении с ней, но вряд ли это может привести к пожару.
Серная кислота, пожалуй, самая важная из всех тяжелых промышленных химикатов, и ее потребление неоднократно указывалось в качестве показателя общего состояния экономики страны..
Длительное воздействие низких концентраций или кратковременное воздействие высоких концентраций может привести к неблагоприятным последствиям для здоровья. Безусловно, самое важное использование серной кислоты в промышленности фосфорных удобрений..
Другие важные области применения: нефтепереработка, производство пигментов, травление стали, извлечение цветных металлов и производство взрывчатых веществ, моющих средств, пластмасс, искусственных волокон и фармацевтических препаратов..
индекс
- 1 купорос, предшественник серной кислоты
- 2 Формула
- 3 Химическая структура
- 3.1 В 2D
- 3.2 В 3D
- 4 Характеристики
- 4.1 Физико-химические свойства
- 4.2 Реакции с воздухом и водой
- 4.3 Воспламеняемость
- 4.4 Реакционная способность
- 4.5 Токсичность
- 5 использует
- 5.1 Косвенный
- 5.2 Прямой
- 6 Развитие сернокислотной промышленности
- 6.1 Процесс купороса
- 6.2 Ведущие камеры
- 7 Текущее производство: контактный процесс
- 7.1 Двойной контакт
- 8 Сырье для производства серной кислоты
- 8.1 Пирит
- 8.2 Диоксид серы
- 8.3 Переработка
- 9 клинических эффектов
- 10 Безопасность и риски
- 10.1 Классы опасности СГС
- 10.2 Коды пруденциальных советов
- 11 ссылок
Витриоло, история серной кислоты
В средневековой Европе серная кислота была известна алхимикам как купорос, масло купороса или ликер купороса. Он считался наиболее важным химическим веществом и пытался использовать в качестве философского камня.
У шумеров уже был список нескольких видов купороса. Кроме того, Гален, греческий доктор Диоскорид и Плиний Старший, подняли вопрос о медицинском применении..
В эллинистических алхимических работах уже упоминалось металлургическое использование веществ из стекловидного тела. Витриол — это группа стеклообразных минералов, из которых можно получить серную кислоту..
формула
-формула: H2SW4
-Номер Кас: 7664-93-9
Химическая структура
В 2D
3D
черты
Физико-химические свойства
Серная кислота относится к реакционноспособной группе сильных окисляющих кислот.
Реакции с воздухом и водой
— Реакция с водой незначительна, если кислотность не превышает 80-90%, тогда теплота гидролиза является чрезмерной, это может вызвать серьезные ожоги.
воспламеняемость
— Сильные окисляющие кислоты, как правило, не горючи. Они могут ускорить сгорание других материалов, обеспечивая кислородом место сгорания..
— Тем не менее, серная кислота обладает высокой реакционной способностью и способна воспламенить мелкодисперсные горючие материалы при контакте с ними..
— При нагревании выделяет высокотоксичные пары.
— Это взрывоопасно или несовместимо с огромным разнообразием веществ.
— Может подвергаться сильным химическим изменениям при высоких температурах и давлении.
— Может бурно реагировать с водой.
реактивность
— Серная кислота сильно кислотная.
— Реагирует бурно с пентафторидом брома.
— Взрывается с пара-нитротолуолом при 80 ° C.
— Взрыв происходит, когда концентрированная серная кислота смешивается с кристаллическим перманганатом калия в контейнере, содержащем влагу. Образуется гептоксид марганца, который взрывается при 70 ° C.
— Смесь акрилонитрила с концентрированной серной кислотой должна хорошо охлаждаться, в противном случае происходит энергичная экзотермическая реакция.
— Температуру и давление повышают, смешивая в закрытом контейнере серную кислоту (96%) равными порциями с любым из следующих веществ: ацетонитрил, акролеин, 2-аминоэтанол, гидроксид аммония (28%), анилин, н-бутиральдегид, хлорсульфоновая кислота, этилендиамин, этиленамин, эпихлоргидрин, этиленциангидрин, соляная кислота (36%), плавиковая кислота (48,7%), пропиолактон, пропиленоксид, гидроксид натрия, мономер стирола.
— Серная кислота (концентрат) чрезвычайно опасна при контакте с карбидами, броматами, хлоратами, молниеносными материалами, пикратами и порошкообразными металлами.
— Он может вызвать бурную полимеризацию аллилхлорида и экзотермически реагирует с гипохлоритом натрия с образованием газообразного хлора..
— Смешивание хлорной и 98% серной кислот дает HCl.
токсичность
— Серная кислота вызывает коррозию всех тканей организма. Вдыхание паров может привести к серьезным повреждениям легких. Контакт с глазами может привести к полной потере зрения. Контакт с кожей может привести к серьезному некрозу.
— Прием серной кислоты в количестве от 1 чайной ложки до половины унции концентрированного химического вещества может быть фатальным для взрослого человека. Даже несколько капель могут быть смертельными, если кислота попадает в трахею.
— Хроническое воздействие может вызвать трахеобронхит, стоматит, конъюнктивит и гастрит. Могут возникнуть перфорация желудка и перитонит, за которыми может последовать нарушение кровообращения. Сердечно-сосудистый шок часто является непосредственной причиной смерти.
— Люди с хроническими респираторными, желудочно-кишечными или нервными заболеваниями и любыми заболеваниями глаз и кожи подвержены большему риску.
приложений
— Серная кислота является одним из наиболее используемых промышленных химических веществ в мире. Но большинство его применений можно рассматривать как косвенные, участвуя в качестве реагента, а не как ингредиент
— Большая часть серной кислоты превращается в кислоту, расходуемую на производство других соединений, или в виде какого-либо сульфатного остатка.
— Определенное количество продуктов включает серу или серную кислоту, но почти все они являются специальными продуктами небольшого объема..
— Около 19% серной кислоты, произведенной в 2014 году, было израсходовано на химические процессы, а остальное — на широкий спектр промышленных и технических применений..
— Рост спроса на серную кислоту во всем мире обусловлен, в порядке убывания, производством: фосфорной кислоты, диоксида титана, плавиковой кислоты, сульфата аммония, а также при переработке урана и металлургии..
косвенный
— Крупнейшим потребителем серной кислоты является, безусловно, промышленность удобрений. В 2014 году на него приходилось чуть более 58% общего мирового потребления. Однако ожидается, что эта доля уменьшится примерно до 56% к 2019 году, главным образом в результате более быстрого роста других химических и промышленных применений..
— Производство фосфорных удобрений, особенно фосфорной кислоты, является основным рынком сбыта для серной кислоты. Он также используется для производства удобрений, таких как тройной суперфосфат и моно- и диаммонийфосфаты. Незначительные количества используются для производства суперфосфата и сульфата аммония.
— В других отраслях промышленности значительные количества серной кислоты используются в качестве реакционной среды для дегидратации кислоты, в органической химии и нефтехимических процессах, включающих такие реакции, как нитрование, конденсация и дегидратация, а также при переработке нефти. где он используется при рафинировании, алкилировании и очистке неочищенных дистиллятов.
— В неорганической химической промышленности его использование примечательно при производстве пигментов TiO2, соляной кислоты и плавиковой кислоты.
— В металлообрабатывающей промышленности серная кислота используется для травления стали, выщелачивания минералов меди, урана и ванадия при гидрометаллургической переработке минералов, а также при подготовке электролитических ванн для очистки и металлизации металлов. цветной.
— Определенные процессы при производстве древесной массы в бумажной промышленности, при производстве некоторых текстильных изделий, при производстве химических волокон и при дублении кожи также требуют серной кислоты..
прямой
— Вероятно, наибольшее использование серной кислоты, в которой сера включена в конечный продукт, находится в процессе органического сульфирования, в частности, для производства моющих средств..
— Сульфирование также играет важную роль в получении других органических химических веществ и незначительных фармацевтических продуктов.
— Свинцово-кислотные аккумуляторы являются одним из самых известных потребительских товаров, содержащих серную кислоту, и составляют лишь небольшую долю от общего потребления серной кислоты..
— При определенных условиях серная кислота используется непосредственно в сельском хозяйстве для восстановления очень щелочных почв, таких как почвы, обнаруженные в пустынных районах на западе Соединенных Штатов. Однако это использование не очень важно с точки зрения общего объема используемой серной кислоты..
Развитие сернокислотной промышленности
Купорос процесс
Самым старым способом получения серной кислоты является так называемый «процесс купороса», основанный на термическом разложении купоросов, представляющих собой сульфаты различных типов природного происхождения..
Персидские алхимики Джабир ибн Хайян (также известный как Гебер, 721–815 гг. Н.э.), Рази (865–925 гг. Н.э.) и Джамал Дин аль-Ватват (1318 н.э.) включили в свои списки минералов классификацию купоросов.
Первое упоминание о «купоросном процессе» появляется в трудах Джабира ибн Хайяна. Затем алхимики Святой Альберт Великий и Василий Валентин описали процесс более подробно. В качестве сырья использовались квасцы и кальканит (синий купорос).
В конце средневековья серная кислота была получена в небольших количествах в стеклянных контейнерах, в которых сера сжигалась с помощью селитры во влажной среде..
Процесс купороса был использован в промышленном масштабе с шестнадцатого века из-за большего спроса на серную кислоту.
Витриоло де Нордхаузен
Основное внимание в производстве было уделено немецкому городу Нордхаузен (что стало называться купоросом как «купорос Нордхаузена»), где использовался сульфат железа (II) (зеленый купорос, FeSO).4 — 7H2O) в качестве сырья, которое нагревали, и полученный триоксид серы смешивали с водой, чтобы получить серную кислоту (купоросное масло).
Процесс проводили в камбузах, некоторые из которых имели несколько уровней параллельно, чтобы получить большие количества купоросового масла.
Ведущие камеры
В 18 веке был разработан более экономичный процесс производства серной кислоты, известный как «процесс с использованием свинцовой камеры»..
До этого максимальная концентрация получаемой кислоты составляла 78%, в то время как с помощью «процесса купороса» были получены концентрированные кислота и олеум, поэтому этот метод продолжал использоваться в определенных секторах промышленности до появления «процесса контакт »в 1870 году, с помощью которого концентрированная кислота может быть получена дешевле.
Олеум или дымящая серная кислота (CAS: 8014-95-7) представляет собой раствор маслянистой консистенции и темно-коричневого цвета, переменного состава триоксида серы и серной кислоты, который можно описать формулой H2SW4.XSO3 (где х представляет собой свободное молярное содержание оксида серы (VI)). Значение для х 1 дает эмпирическую формулу H2S2О7, что соответствует дисульфуровой кислоте (или пиросерной кислоте).
процесс
Процесс свинцовой камеры был промышленным методом, используемым для производства серной кислоты в больших количествах, прежде чем его вытеснил «контактный процесс»..
В 1746 году в Бирмингеме, Англия, Джон Робак начал производить серную кислоту в свинцовых камерах, которые были прочнее и дешевле, чем стеклянные контейнеры, которые использовались ранее, и их можно было сделать намного больше..
Диоксид серы (от сжигания элементарной серы или металлических минералов, содержащих серу, таких как пирит), вводился с паром и оксидом азота в большие камеры, облицованные свинцовыми листами..
Диоксид серы и диоксид азота растворяются, и в течение примерно 30 минут диоксид серы окисляется до серной кислоты..
Это позволило эффективно индустриализировать производство серной кислоты, и с различными усовершенствованиями этот процесс оставался стандартным методом производства в течение почти двух столетий..
В 1793 году Clemente y Desormes добился лучших результатов, введя дополнительный воздух в процесс камеры свинца.
В 1827 году Гей-Люссак представил метод поглощения оксидов азота из отходящих газов из свинцовой камеры..
В 1859 году Гловер разработал метод восстановления оксидов азота из вновь образовавшейся кислоты путем увлечения горячими газами, что позволило непрерывно катализировать процесс с помощью оксида азота..
В 1923 году Петерсен представил усовершенствованный процесс башни, который позволял ее конкурентоспособность по отношению к процедуре контакта до 1950-х годов.
Камерный процесс стал настолько устойчивым, что в 1946 году он все еще представлял 25% мирового производства серной кислоты.
Текущее производство: контактный процесс
Контактный процесс представляет собой современный способ производства серной кислоты в высоких концентрациях, необходимый в современных промышленных процессах. Раньше катализатором этой реакции была платина. Однако в настоящее время предпочтительным является пятиокись ванадия (V2O5)..
В 1831 году в Бристоле, Англия, Peregrine Phillips запатентовал окисление диоксида серы до триоксида серы с использованием платинового катализатора при повышенных температурах..
Однако принятие его изобретения и интенсивное развитие процесса контакта начались только после того, как спрос на олеум для производства красителей увеличился с 1872 года..
Затем были найдены лучшие твердые катализаторы и исследована химия и термодинамика равновесия SO2 / SO3..
Процесс контакта можно разделить на пять этапов:
- Сочетание серы и кислорода (O2) с образованием диоксида серы.
- Очистка диоксида серы в установке очистки.
- Добавление избытка диоксида кислорода к диоксиду серы в присутствии катализатора на основе пентаоксида ванадия при температуре 450 ° С и давлении 1-2 атм..
- Образовавшийся триоксид серы добавляют к серной кислоте, которая дает олеум (дисульфуровая кислота).
- Затем олеум добавляют в воду с образованием серной кислоты, которая является очень концентрированной.
Основным недостатком процессов окисления азота (во время процесса в свинцовой камере) является то, что концентрация получаемой серной кислоты ограничена максимумом от 70 до 75%, в то время как в процессе контакта образуется концентрированная кислота (98). %).
С разработкой относительно недорогих ванадиевых катализаторов для контактного процесса, наряду с растущей потребностью в концентрированной серной кислоте, глобальное производство серной кислоты на заводах по переработке оксида азота неуклонно снижалось.
К 1980 году на заводах по переработке оксида азота в Западной Европе и Северной Америке практически не производили кислоту..
Процесс двойного контакта
Процесс двойного контакта с двойным поглощением (DCDA или двойной контакт с двойным поглощением) привел к улучшению процесса контакта для производства серной кислоты.
В 1960 году Байер подал заявку на патент для так называемого процесса двойного катализа. Первый завод, который использовал этот процесс, был запущен в 1964 году.
Включая стадию поглощения SO3 перед заключительными каталитическими стадиями улучшенный процесс контакта позволил значительно увеличить конверсию SO2 , существенно сократить выбросы в атмосферу.
Газы возвращаются обратно через конечную абсорбционную колонну, получая не только высокую эффективность преобразования SO2 так3 (около 99,8%), но также позволяет получать более высокую концентрацию серной кислоты.
Существенная разница между этим процессом и обычным процессом контакта заключается в количестве стадий поглощения..
Начиная с 1970-х годов, основные промышленные страны ввели более строгие правила защиты окружающей среды, и процесс двойного поглощения был распространен на новых заводах. Тем не менее, традиционный контактный процесс продолжает использоваться во многих развивающихся странах с менее требовательными экологическими стандартами..
Наибольший импульс для нынешнего развития контактного процесса направлен на увеличение извлечения и использования большого количества энергии, производимой в процессе.
На самом деле, большой современный сернокислотный завод можно рассматривать не только как химический завод, но и как теплоэлектростанцию..
Сырье, используемое при производстве серной кислоты
пирит
Пирит был доминирующим сырьем в производстве серной кислоты до середины 20-го века, когда большие количества элементарной серы начали извлекаться из процесса переработки нефти и очистки природного газа, становясь основным материалом. отраслевая премия.
Диоксид серы
В настоящее время диоксид серы получают различными способами из нескольких видов сырья..
В Соединенных Штатах, промышленность была основана с начала двадцатого века в получении элементарной серы из подземных месторождений по «процессу Фраш».
Умеренно концентрированная серная кислота также получается путем повторного концентрирования и очистки большого количества серной кислоты, получаемой в качестве побочного продукта других промышленных процессов..
переработаны
Переработка этой кислоты становится все более важной с точки зрения окружающей среды, особенно в основных развитых странах..
Производство серной кислоты на основе элементарной серы и пирита, конечно, относительно чувствительно к рыночным условиям, поскольку кислота, полученная из этих материалов, представляет собой первичный продукт.
С другой стороны, когда серная кислота является побочным продуктом, произведенным в качестве средства устранения отходов другого процесса, уровень ее производства определяется не условиями на рынке серной кислоты, а условиями рынка для основной продукт.
Клинические эффекты
-Серная кислота используется в промышленности и в некоторых бытовых чистящих средствах, таких как чистящие средства для ванных комнат. Это также используется в батареях.
-Умышленное проглатывание, особенно продуктов с высокой концентрацией, может привести к серьезным травмам и смерти. Эти воздействия при приеме внутрь редки в Соединенных Штатах, но распространены в других частях мира.
-Это сильная кислота, которая вызывает повреждение тканей и коагуляцию белка. Он вызывает коррозию кожи, глаз, носа, слизистых оболочек, дыхательных путей и желудочно-кишечного тракта, а также любых тканей, с которыми он вступает в контакт.
-Тяжесть травмы определяется концентрацией и продолжительностью контакта.
-Легкое воздействие (концентрация менее 10%) вызывает только раздражение кожи, верхних дыхательных путей и слизистой оболочки желудочно-кишечного тракта..
-Респираторные последствия острого вдыхания включают: раздражение носа и горла, кашель, чихание, рефлекторный бронхоспазм, одышку и отек легких. Смерть может наступить в результате внезапного нарушения кровообращения, отека голосовой щели и нарушения дыхательных путей или острого повреждения легких.
-Проглатывание серной кислоты может привести к немедленной боли в эпигастральной области, тошнота, слюнотечение и рвота, мукоидного или геморрагический материальный аспект «молотого кофе». Изредка наблюдается рвота свежей кровью.
-Прием внутрь концентрированной серной кислоты может вызвать коррозию пищевода, некроз и перфорацию пищевода или желудка, особенно в привратнике желудка. Изредка наблюдается повреждение тонкой кишки. Более поздние осложнения могут включать стеноз и образование свища. Метаболический ацидоз может развиться после приема пищи.
-Серьезные ожоги кожи могут возникать при некрозе и рубцах. Они могут быть смертельными, если затронут достаточно большой участок поверхности тела.
-Глаз особенно чувствителен к коррозии. Раздражение, слезотечение и конъюнктивит могут развиваться даже при низких концентрациях серной кислоты. Брызги с серной кислотой в высоких концентрациях вызывают: ожоги роговицы, потерю зрения и иногда перфорацию баллона.
-Хроническое воздействие может быть связано с изменениями в функции легких, хронический бронхит, конъюнктивит, эмфизема, частые инфекции дыхательных путей, гастрит, эрозии зубной эмали, и, возможно, рака дыхательных путей.
Безопасность и риски
Заявления об опасности Глобально согласованной системы классификации и маркировки химических веществ (SGA)
Согласованная на глобальном уровне система классификации и маркировки химических веществ (SGA) представляет собой согласованную на международном уровне систему, созданную Организацией Объединенных Наций и призванную заменить различные стандарты классификации и маркировки, используемые в разных странах, путем использования согласованных глобальных критериев (Организация Объединенных Наций). United, 2015).
Классы опасности (и его соответствующая глава СГС) стандартов классификации и маркировки, а также рекомендации в отношении серной кислоты являются следующие (European Chemicals Agency, 2017 год; Организация Объединенных Наций, 2015 год; PubChem, 2017):
Классы опасности СГС
H303: Может причинить вред при проглатывании [Предупреждение Острая оральная токсичность — Категория 5] (PubChem, 2017).
H314: Вызывает серьезные ожоги кожи и травмы глаз [Опасная коррозия / раздражение кожи — Категория 1A, B, C] (PubChem, 2017).
H318: Вызывает серьезное повреждение глаз [Опасность Серьезное повреждение глаз / раздражение глаз — Категория 1] (PubChem, 2017).
H330: смертельный исход при вдыхании [Опасность Острая токсичность при вдыхании — Категория 1, 2] (PubChem, 2017).
H370: вызывает повреждение органов [Опасность Специфическая токсичность для органа-мишени, однократное воздействие — Категория 1] (PubChem, 2017).
H372: вызывает повреждение органов в результате длительного или многократного воздействия [Опасность Специфическая токсичность для органа-мишени, повторное воздействие — Категория 1] (PubChem, 2017).
H402: Вредно для водных организмов [Опасно для водной среды, острая опасность — Категория 3] (PubChem, 2017).
Коды пруденциальных советов
Р260, Р264, Р270, Р271, Р273, Р280, Р284, Р301 + Р330 + Р331, Р303 + P361 + P353, P304 + P340, P305 + P351 + P338, P307 + Р311, Р310, P312, P314, P320, P321, P363, P403 + P233, P405 и P501 (PubChem, 2017).
ссылки
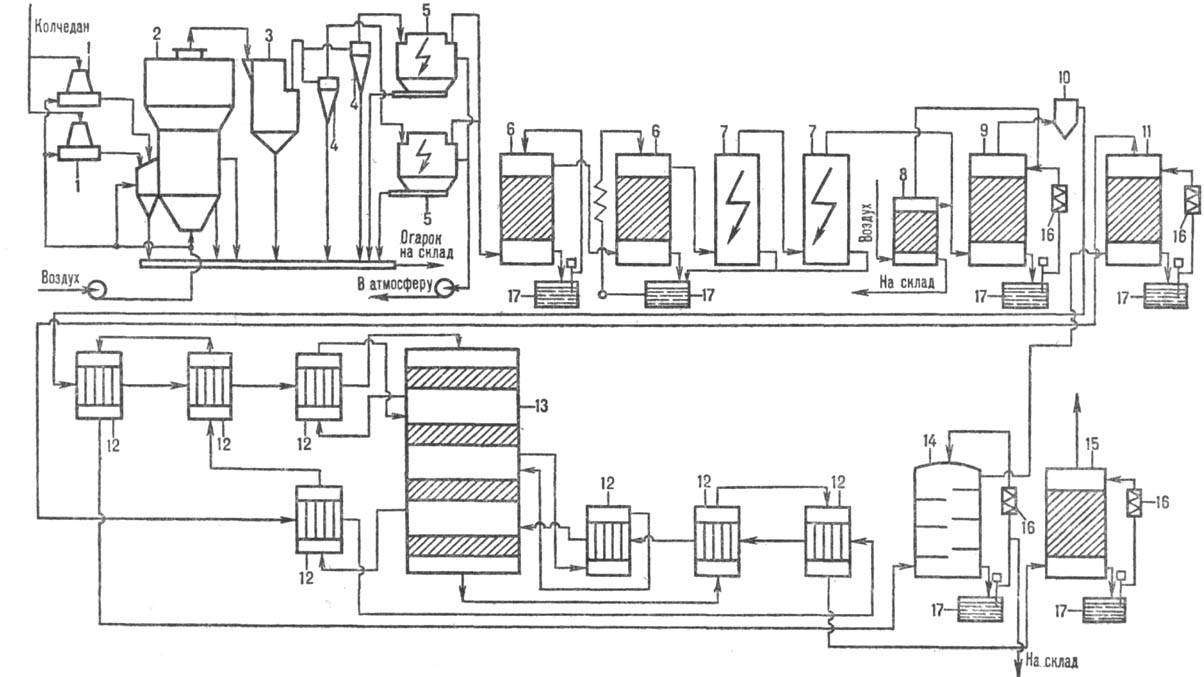
- Arribas, H. (2012) Схема производства серной кислоты контактным методом с использованием пирита в качестве сырья [изображение] Получено с wikipedia.org.
- Справочник по химической экономике, (2017). Серная кислота Восстановлено с ihs.com.
- Справочник по химической экономике, (2017 г.) Мир серной кислоты — 2013 г. [изображение]. Восстановлено с ihs.com.
- ChemIDplus, (2017). 3D структура 7664-93-9 — серная кислота [изображение] Получено из: chem.nlm.nih.gov.
- Codici Ashburnhamiani (1166). Портрет «Гебер» пятнадцатого века. Библиотека Медичи Лауренциана [изображение]. Получено с wikipedia.org.
- Европейское химическое агентство (ECHA), (2017). Краткое изложение классификации и маркировки. Гармонизированная классификация — Приложение VI к Регламенту (ЕС) № 1272/2008 (Регламент CLP).
- Банк данных по опасным веществам (HSDB). TOXNET. (2017). Серная кислота Bethesda, MD, EU: Национальная медицинская библиотека. Получено от: toxnet.nlm.nih.gov.
- Leyo (2007) Скелетная формула серной кислоты [изображение]. Получено с: commons.wikimedia.org.
- Фирма «Либихский экстракт мяса» (1929) Альбертус Магнус, Чимистес Келебрес [изображение]. Получено с: wikipedia.org.
- Мюллер, Х. (2000). Серная кислота и триоксид серы. В энциклопедии промышленной химии Ульмана. Wiley-VCH Verlag GmbH & Co. KGaA. Доступно по адресу: doi.org.
- Организация Объединенных Наций (2015). Согласованная на глобальном уровне система классификации и маркировки химических продуктов (SGA), шестое пересмотренное издание. Нью-Йорк, США: издание Организации Объединенных Наций. Получено от: unece.org.
- Национальный центр биотехнологической информации. База данных PubChem Compound, (2017). Серная кислота — ПабХим Состав. [изображение] Bethesda, MD, EU: Национальная библиотека медицины. Получено из: pubchem.ncbi.nlm.nih.gov.
- Национальный центр биотехнологической информации. База данных PubChem Compound, (2017). Серная кислота Bethesda, MD, EU: Национальная медицинская библиотека. Получено из: pubchem.ncbi.nlm.nih.gov.
- Национальное управление океанических и атмосферных исследований (NOAA). CAMEO Химические вещества. (2017). Химический паспорт. Серная кислота, отработанная. Серебряная весна, MD. ЕС; Получено от: cameochemicals.noaa.gov.
- Национальное управление океанических и атмосферных исследований (NOAA). CAMEO Химические вещества. (2017). Химический паспорт. Серная кислота Серебряная весна, MD. ЕС; Получено от: cameochemicals.noaa.gov.
- Национальное управление океанических и атмосферных исследований (NOAA). CAMEO Химические вещества. (2017). Reactive Group Datasheet. Кислоты, сильные окисляющие. Серебряная весна, MD. ЕС; Получено от: cameochemicals.noaa.gov.
- Oelen, W. (2011) Серная кислота, 96% сверхчистая [изображение]. Получено с: wikipedia.org.
- Оппенгейм, Р. (1890). Schwefelsäurefabrik пасЬ дем в дер zweiten Bleikammerverfahren Hälfte де Lehrbuch дер Technischen Chemie 19. [Изображение]. Получено с: wikipedia.org.
- Приснер, C. (1982) Иоганн Кристиан Бернхард и умирают Витриольсюре, в: Chemie in unserer Zeit. [Image]. Получено с: wikipedia.org.
- Stephanb (2006) Сульфат меди [изображение]. Получено с: wikipedia.org.
- Штольц Д. (1614) Алхимическая диаграмма. Theatrum Chymicum [изображение] Получено с: wikipedia.org.
- Википедия, (2017). Кислота серная кислота. Получено с: wikipedia.org.
- Википедия, (2017). Серная кислота Получено с: wikipedia.org.
- Википедия, (2017). Bleikammerverfahren. Получено с: wikipedia.org.
- Википедия, (2017). Процесс контакта. Получено с: wikipedia.org.
- Википедия, (2017). Ведущий камерный процесс. Получено с: wikipedia.org.
- Википедия, (2017). Oleum. Получено с: https://en.wikipedia.org/wiki/Oleum
- Википедия, (2017). Oleum. Получено с: https://en.wikipedia.org/wiki/%C3%93leum
- Википедия, (2017). Оксид серы. Получено с: wikipedia.org.
- Википедия, (2017). Купорос процесс. Получено с: wikipedia.org.
- Википедия, (2017). Диоксид серы. Получено с: wikipedia.org.
- Википедия, (2017). Триоксид серы. Получено с: wikipedia.org.
- Википедия, (2017). Серная кислота Получено с: wikipedia.org.
- Википедия, (2017). Vitriolverfahren. Получено с: wikipedia.org.
- Райт, J. (1770) Alchymist, В поисках философского камня, Обнаруживает Фосфор, и молится за заключение своей успешной работы, как это было в обычае древних Химической астрологов. [изображение] Получено с: wikipedia.org.
Определение
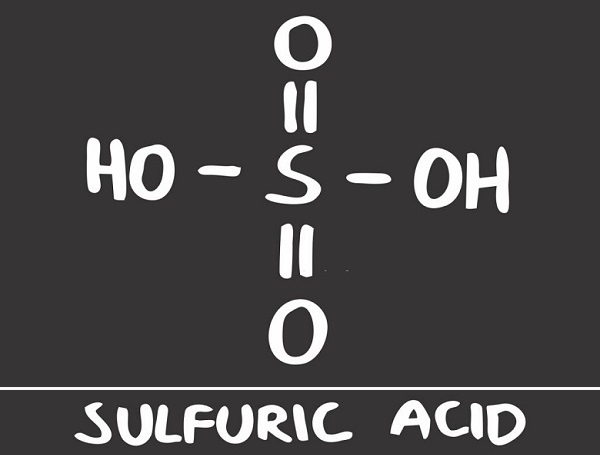
Серная кислота (серная кислота) является едкой минеральной кислотой с маслянистым, стекловидным внешним видом, что дало ей более раннее название масла купороса. Другие названия – сульфиновая кислота, аккумуляторная кислота и сероводород. Формула серной кислоты H2SO4 указывает на присутствие атома серы, окруженного двумя гидроксидными соединениями и двумя атомами кислорода. Эта мощная кислота используется в различных отраслях промышленности, прежде всего в производстве удобрений и химических веществ.
Короче говоря, Производство серной кислоты делится на пять этапов – извлечение серы из земли или в качестве побочного продукта других производственных процессов, превращение серы в диоксид серы, дальнейшее превращение диоксида серы в триоксид серы и окончательное добавление воды для превращения триоксида серы в дымящую серную кислоту и добавление концентрированной серной кислоты для получения еще большего количества молекул.
Серная кислота в производстве удобрений
Производство удобрений использует серную кислоту для добавления серы в почву. Большая часть сельскохозяйственных земель требует источника серы для замены того, что использовалось зерновыми культурами или выщелачивалось в дождливые периоды. Недостаток серы приводит к лист пожелтение, лист и ткань некроз и задержка развития. Пока растения не могут использовать элементарную серу, почвы бактерии окисляют это, чтобы сформировать сульфат. Сульфат является наиболее важным источником питания для всех растение Жизнь и растения могут легко поглотить его через свои корни.
Во время переработки ископаемого топлива сера извлекается в качестве побочного продукта из угля, сырой нефти и природного газа, которые содержат его в небольших или больших количествах. Во время переработки ископаемого топлива эта сера удаляется и чаще всего отправляется в виде серной кислоты на заводы по производству удобрений. Сера не только добавляется в почву, но и необходима для производства суперфосфата извести, где фосфат породы смешивается с серной и фосфорной кислотой. Суперфосфат извести позволяет растениям поглощать фосфаты. Другим важным удобрением является сульфат аммония, получаемый в результате реакции между аммонием и серной кислотой. Серная кислота, производимая для производства удобрений, имеет техническую чистоту или загрязнена и слабо окрашена с концентрацией от 78 до 93%.
Серная кислота в химическом производстве
Использование серной кислоты в химическом производстве включает производство капролактама для нейлоновых волокон и диоксида титана, который представляет собой ярко-белый пигмент. Кроме того, серная кислота необходима для производства плавиковой кислоты, которая заменила хлорфторуглероды (ХФУ) для использования в холодильниках или системах кондиционирования воздуха.
Сульфатные соли, такие как сульфат кальция (гипс и гипс) и гидросульфат, являются производными этой конкретной кислоты. Хотя сульфиты металлов, как правило, нелегко растворяются в воде, другие сульфатные соли, наоборот, образуют серную кислоту один из самых доступных и лучших растворителей для использования в широком спектре отраслей промышленности, Минеральные добавки в секторе здравоохранения и лауретсульфат натрия в шампуне и туалетных принадлежностях являются другими примерами сульфатных солей. Именно эти частицы способствуют кислотному дождю, но в то же время они могут играть незначительную защитную роль в качестве частиц в воздухе по отношению к диффузия солнечной радиации.
Серная кислота также используется для производства взрывчатых веществ. Добавление азотной и серной кислот в целлюлозу делает легковоспламеняющейся нитроцеллюлозой. По этой причине покупка серной кислоты в больших количествах требует лицензии. Коммерческая серная кислота продается с минимальной концентрацией 95%.
Серная кислота в лаборатории
В лаборатории серная кислота используется в качестве осушающего агента и в количественном анализе, где концентрация решение рассчитывается с использованием метода, известного как титрование. Всякий раз, когда к кислоте добавляют воду (остерегайтесь реакции с серной кислотой и всегда добавляйте кислоту в воду, а не наоборот), положительно заряженные ионы водорода высвобождаются из кислоты путем донорства протонов. Основания или щелочи, такие как гидроксид натрия, производят отрицательно заряженные гидроксид-ионы в присутствии воды из-за принятия протонов. В зависимости от количества кислоты или щелочи в растворе, можно рассчитать его концентрацию, сложив противоположные и выяснив, когда отрицательные и положительные заряды нейтрализуют друг друга и объединяются, образуя воду молекула, Например, когда серная кислота и гидроксид натрия (NaOH) смешиваются, они реагируют и образуют молекулы воды. Однако такой металл, как натрий, в присутствии серы и воды будет дополнительно производить сульфат натрия (Na2SO4) и воду.
Примером использования титрования может быть определение концентрации раствора серной кислоты. Титрование кислоты требует известной концентрации щелочного реагента (титранта) – в данном случае гидроксида натрия. Добавляя небольшие известные количества основания к кислоте и проверяя реакцию нейтрализации с помощью индикатора pH, можно определить, сколько молей NaOH требуется для реакции с H2SO4, и таким образом рассчитать концентрацию в молях на литр.
Серная кислота в автомобильной промышленности
Серная кислота является электролитом; электролит – это раствор, в котором присутствуют ионы. Свинцово-кислотные аккумуляторы в автомобилях состоят из наборов положительно заряженных пластин из оксида свинца, погруженных в электролит, и отрицательно заряженных пластин из чистого свинца, погруженных аналогичным образом. Этот электролит представляет собой разбавленную серную кислоту (примерно 33%). Вот почему серная кислота часто упоминается как аккумуляторная кислота,
Автомобильные аккумуляторы накапливают химическую энергию и преобразуют ее в электрическую энергию посредством реакций водорода, кислорода, свинца и серы друг с другом. Присутствие дистиллированной (чистой) воды в серной кислоте производит водород и сульфат. Отпущенные отрицательные электроны перемещаются от отрицательной к положительной пластине, в то время как сульфат-ионы замещают эту потерю в отрицательно заряженной пластине (электроде), впоследствии реагируя со свинцом с образованием сульфата свинца. Серная кислота идеально подходит для этой реакции, поскольку она является дипротоновой кислотой, способной высвобождать два своих протона одновременно.
Эта реакция также происходит в положительной пластине, где связи оксида свинца разрываются, и атомы кислорода растворяются в растворе серной кислоты, оставляя атомы свинца в пластине для связи с сульфатом. Присутствие кислорода и водорода в растворе приводит к образованию воды, понижающей концентрацию серной кислоты. Когда эта концентрация слишком низкая, батарею необходимо заменить или перезарядить.
Перезарядка является противоположностью вышеописанного процесса, возвращая аккумулятор в исходное состояние положительной пластины сульфата свинца, отрицательной пластины чистого свинца и исходной концентрации сернокислого электролита; Однако, ионы медленно теряются со временем Именно поэтому срок службы батареи, даже когда она перезаряжаемая, ограничен.
Что касается энергетики, серная кислота также является компонентом литий-серно-хлоридных (Li-SO2Cl2) и литий-серно-диоксидных батарей (Li-SO2). Литий-серные батареи в настоящее время вызывают большой интерес, поскольку теоретически они могут хранить значительно больше энергии, чем литий-ионные альтернативы; Тем не менее, много исследований еще предстоит сделать.
Серная кислота в пищевой промышленности
Серная кислота часто используется в пищевой промышленности для обезвоживания некоторых пищевых продуктов, таких как фрукты, или для остановки роста бактерий и других вредных микробов, которые ускоряют процесс распада. Используется в форме спрея для сохранения мяса или птицы. Серная кислота также является пищевой добавкой общего назначения, используемой в алкогольных напитках и сыре.
Для сушки фруктов высоко ценится способность серной кислоты удалять воду. В присутствии воды серная кислота вступает в реакцию с образованием H3O + (гидроний) и HSO4– (сероводород). Последующая реакция объединяет сероводород с водой для получения большего количества H3O + и SO42- или сульфата. В виде реакция гидратации серной кислоты не требует энергии – это термодинамически выгодно – и так как в нем много атомов водорода (протонов), которые она с радостью жертвует, серная кислота быстро снижает pH любой ткани, с которой она вступает в контакт. Однако, в процессах сушки фруктов концентрированная серная кислота не находится в прямом контакте с фруктами но вместо этого используется для сушки воздуха вокруг него, удаляя влагу и тем самым помогая и ускоряя процесс обезвоживания.
Серная кислота в организме человека
В организме человека только аминокислоты цистеин (необязательно) и метионин (обязательно) содержат серу. Это означает, что многие белки, содержащие их, способны производить небольшое количество серной кислоты при метаболизме. Когда эта нелетучая (метаболическая) серная кислота не расщепляется и не используется, она выводится через почки.
Сера является одним из самых распространенных минералов в организме человека. и легко доступны в пищевых источниках от чеснока до мяса. Большинство волос и кожа Лечение, диетические добавки и совместное лечение фармацевтическими препаратами содержат большое количество этого элемента.
H2SO4 + 2NaHCO3 → Na2SO4 + 2H2O + CO2
Производство CO2 позволяет организму быстро регулировать pH посредством вентиляции легких, в то время как почки регулируют ионы водорода и бикарбоната посредством экскреция и реабсорбция в более неторопливом темпе.
Кислотные ожоги являются результатом обезвоживания тканей, Коррозионные характеристики сильного раствора серной кислоты обусловлены его способностью отдавать ионы водорода, вызывая мощную реакцию окисления. Кожа содержит большое количество воды, и взаимодействие H2SO4 с H20 приводит к образованию положительно заряженных ионов гидрония (H3O +) и отрицательно заряженного сероводорода (HSO4–), что соответствует реакции, описанной в разделе, описывающем дегидратацию плодов. Когда эта реакция происходит, она также генерирует тепло, которое увеличивает любой ущерб.
Приток серной кислоты в кожу связан с немедленной диссоциацией ее ионов водорода; рН пораженной ткани быстро падает. В этой сильно кислой среде окружающие клетки погибают, что приводит к некрозу коагуляции, образованию капилляров и образованию тромба и тромбов в капиллярах и более крупных размерах. кровь сосуды при ожогах второй и третьей степени.
Добавление воды к концентрированному сжиганию серной кислоты или даже раствора, превышающего 20%, не только добавляет дополнительный ингредиент, с которым может реагировать серная кислота, но и последующая реакция генерирует еще больше тепла и, таким образом, больше ущерба. Полоскание под проточной водой должно производиться только сразу после контакта смыть кислоту с кожи но это не лечение или терапия. Прежде чем проводить какое-либо лечение, кислоту необходимо нейтрализовать. Вот почему иногда рекомендуется мыть немедленно с мылом, поскольку большинство мыл являются щелочными. При сжигании серной кислоты время имеет большое значение. Старая информация об упаковке, изображенная ниже, говорит вам, чтобы вы использовали много мыла, а затем покрыли магнезией или пищевой содой. Все эти вещества являются щелочными. Для приема серной кислоты в этих инструкциях рекомендуется пить мел, мыло или даже настенную штукатурку, еще раз щелочи, которые будут принимать диссоциированные протоны. В обоих случаях несчастному человеку рекомендуется обратиться за медицинской помощью.
Структура серной кислоты
Структура серной кислоты состоит из одного атома серы, связанного с двумя атомами кислорода посредством двойных связей, и двух гидроксильные группы (ОН) присоединяется через одинарные связи. Это хорошо видно на изображении ниже.
Факты о серной кислоте
Вот некоторые факты о серной кислоте, которые дадут вам дополнительное представление об этой едкой, опасной, но важной кислоте.
Молярная масса серной кислоты составляет 98,08 г / моль. Это рассчитывается в соответствии с атомными массами его атомов: два атома водорода (2 х 1,008 г / моль), один атом серы (1 х 32,065 г / моль) и четыре атома кислорода (4 х 16 г / моль). Для общего веса одной молекулы серной кислоты расчет такой же, но результаты приведены в аму или единицах атомной массы. Именно когда вы хотите знать молекулярную массу более чем одного моля, результат молекулярной массы отличается от молярной массы. Например, когда у вас есть 2 грамма диоксида серы (SO2 с молярной массой 64,065 г / моль) и вы хотите знать, сколько это молей. Чтобы рассчитать этот результат, сначала нужно разделить 1 (моль) с молярной массой вещества. Затем вы умножаете результат на 2 (граммы), как показано в приведенном ниже уравнении.
Плотность серной кислоты зависит от ее силы (концентрации) и температуры. Например, 13% раствор H2SO4 при комнатной температуре имеет плотность 9,09 г / см3. 96% раствор при той же температуре имеет плотность 15,37 г / см3. Температура кипения серной кислоты составляет 639 ° F, 337 ° C или 610 К; температура замерзания составляет 37 ° F, а температура плавления – 50 ° F.
Серная кислота и автопротолиз
Чистая H2SO4 или безводная H2SO4 является очень полярной жидкостью, что означает, что она содержит молекулы, в которых полярные связи – связи между двумя атомами, которые распределены неравномерно – имеют очень слегка отрицательный и положительный заряд на противоположных концах. Эти заряженные концы могут притягивать или отталкивать противоположно заряженные почти соприкасающиеся молекулы посредством очень слабых диполь-дипольные силы, Серная кислота полностью ионизируется в присутствии воды на ионы гидрония (H30 +) и ионы сероводорода (HSO4–). Однако, без воды серная кислота ионизирует сама с собойгде две молекулы серной кислоты автопротолизуются с образованием одного протонированного иона серной кислоты H3SO4 + и одного иона сероводорода (HSO4–), как видно из уравнения ниже:
2 H2SO4 ⇌ H3SO4 + + HSO4-
Этот высокий уровень ионизации делает серную кислоту превосходной растворитель для широкого спектра реакций и хорошо превосходит свойства растворителя воды.
Серная кислота в нашей среде
Серная кислота является составной частью кислотный дождь и образуется в результате атмосферного окисления газообразного диоксида серы в присутствии влаги. Поскольку диоксид серы образуется, когда ископаемое топливо сжигается либо на производственных предприятиях, для производства электроэнергии и отопления, либо на транспортных средствах, кислотные дожди – это прежде всего антропогенное явление. Сухое осаждение в форме кислых частиц означает, что кислоты могут оседать, а затем вымываться дождевыми осадками, принося кислую воду в пресноводные и морские экосистемы, а также в наземную среду. Это может нанести вред жизни растений и животных.
Серная кислота также является продуктом природного мира путем окисления серосодержащих минералов и руд. Вулканы славятся повышением уровня кислотности близлежащих озер и рек. Говорят, что смерть Плиния Старшего, который в экспедиции, чтобы спасти друзей от извержения Везувия, внезапно упал на землю и умер, была вызвана вдыханием диоксида серы. Предположительно, попав в среду с высокой влажностью легких, этот газ превратился в серную кислоту, подавив и убив его.
Результирующие потоки кислой воды, вызванные кислотными дождями, могут привести к дренажу кислых пород (ARD). ARD на самом деле является результатом образования разбавленной серной кислоты в результате минеральных реакций в породе, которые несут значительный ущерб окружающей среде. Регулирующие органы пытаются ограничить воздействие ОРЗ, не допуская попадания воды в промышленные отходы серы, добавляя щелочи в сточные воды и следя за тем, чтобы сточные воды очищались до того, как они попадут в природные источники воды. Кислая вода растворяет различные металлы, присутствующие в сульфидных рудах, и производит яркие, но очень токсичные потоки.
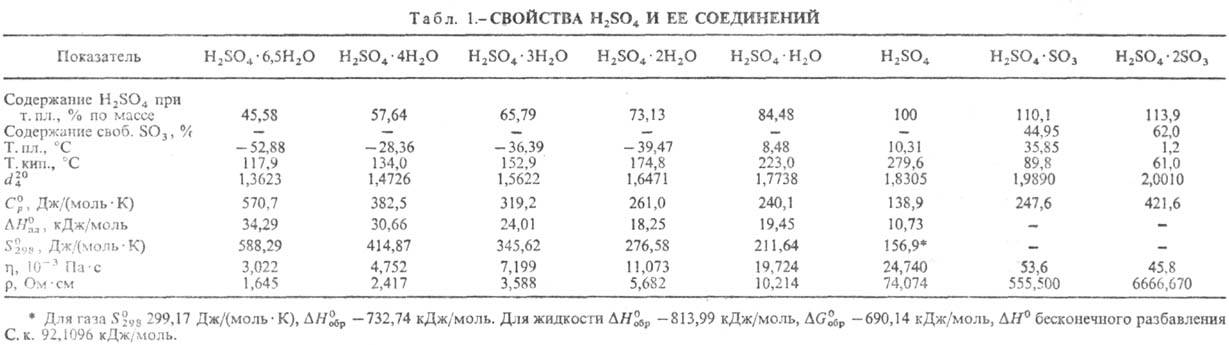
СЕРНАЯ КИСЛОТА H2SO4,
мол. м. 98,082; бесцв. маслянистая жидкость без запаха. Очень сильная двухосновная
к-та, при 18°С pKa1 — 2,8,
K21,2·10-2, pKa2l,92;
длины связей в молекуле S=O 0,143 нм, S—ОН 0,154 нм, угол HOSOH 104°, OSO
119°; кипит с разл., образуя азеотропную смесь (98,3% H2SO4
и 1,7% Н2О с т. кип. 338,8 °С; см. также табл. 1). Серная кислота, отвечающая
100%-ному содержанию H2SO4, имеет состав (%): H2SO4
99,5, 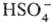
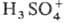
0,09, H2S2O7 0,04, HS2O7
0,05. Смешивается с водой и SO3 во всех соотношениях. В водных р-рах
серная кислота практически полностью диссоциирует на Н+,
и 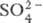
H2SO4·nH2O, где n = 1, 2, 3,
4 и 6,5.
Р-ры SO3 в серной кислоте наз. олеумом, они образуют два соед. H2SO4·SO3
и H2SO4·2SO3. Олеум содержит также пиросерную
к-ту, получающуюся по р-ции: Н2SO4 + + SO3:H2S2O7.
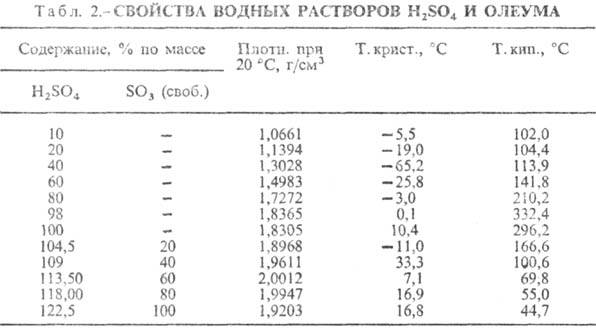
Т-ра кипения водных р-ров
серной кислоты повышается с ростом ее концентрации и достигает максимума при содержании
98,3% H2SO4 (табл. 2). Т-ра кипения олеума с увеличением
содержания SO3 понижается. При увеличении концентрации водных р-ров
серной кислоты общее давление пара над р-рами понижается и при содержании 98,3% H2SO4
достигает минимума. С увеличением концентрации SO3 в олеуме общее
давление пара над ним повышается. Давление пара над водными р-рами серной кислоты и олеума
можно вычислить по ур-нию: lgp(Пa) = А — В/Т+ 2,126, величины
коэф. А и В зависят от концентрации серной кислоты. Пар над водными р-рами
серной кислоты состоит из смеси паров воды, Н2SO4 и SO3,
при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением т-ры усиливается
диссоциация H2SO4
H2О + SO3 — Q, ур-ние температурной зависимости
константы равновесия lnКp = 14,74965 — 6,71464ln(298/T)
— 8, 10161·104T2-9643,04/T-9,4577·10-3Т+2,19062
x 10-6T2. При нормальном давлении степень
диссоциации: 10-5 (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по ур-нию: d= 1,8517 — — 1,1
· 10-3 t + 2·10-6t2 г/см3.
С повышением концентрации р-ров серной кислоты их теплоемкость уменьшается и достигает
минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO3
увеличивается.
При повышении концентрации
и понижении т-ры теплопроводность l уменьшается: l = 0,518 + 0,0016t
— (0,25 + + t/1293)·С/100, где С-концентрация серной кислоты, в %. Макс.
вязкость имеет олеум H2SO4·SO3, с повышением
т-ры h снижается. Электрич. сопротивление серной кислоты минимально при концентрации
30 и 92% H2SO4 и максимально при концентрации 84 и 99,8%
H2SO4. Для олеума миним. r при концентрации 10% SO3.
С повышением т-ры r серной кислоты увеличивается. Диэлектрич. проницаемость 100%-ной
серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопич. постоянная 6,12, эбулиоскопич.
постоянная 5,33; коэф. диффузии пара серной кислоты в воздухе изменяется с изменением
т-ры; D = 1,67· 10-5 T3/2 см2/с.
Серная кислота-довольно сильный
окислитель, особенно при нагр.; окисляет HI и частично НВг до своб. галогенов,
углерод-до СО2, S-до SO2, окисляет мн. металлы (Си, Hg
и др.). При этом серная кислота восстанавливается до SO2, а наиб. сильными
восстановителями-до S и H2S. Конц. H2SO4 частично
восстанавливается Н2, из-за чего не может применяться для его
сушки. Разб. H2SO4 взаимод. со всеми металлами, находящимися
в электрохим. ряду напряжений левее водорода, с выделением Н2. Окислит.
св-ва для разб. H2SO4 нехарактерны. Серная кислота дает два ряда
солей: средние-сульфаты и кислые-гидросульфаты (см. Сульфаты неорганические),
а также эфиры (см. Сульфаты органические). Известны пероксомоносерная
(к-та Каро) H2SO5 и пероксоди-серная H2S2O8
к-ты (см. Сера).
Получение. Сырьем
для получения серной кислоты служат: S, сульфи-ды металлов, H2S, отходящие
газы теплоэлектростанций, сульфаты Fe, Ca и др. Осн. стадии получения серной кислоты:
1) обжиг сырья с получением SO2; 2) окисление SO2 до SO3
(конверсия); 3) абсорбция SO3. В пром-сти применяют два метода получения
серной кислоты, отличающихся способом окисления SO2,-контактный с использованием
твердых катализаторов (контактов) и нитрозный-с оксидами азота. Для получения
серной кислоты контактным способом на совр. заводах применяют ванадиевые катализаторы,
вытеснившие Pt и оксиды Fe. Чистый V2O5 обладает слабой
каталитич. активностью, резко возрастающей в присут. солей щелочных металлов,
причем наиб. влияние оказывают соли К. Промотирующая роль щелочных металлов
обусловлена образованием низкоплавких пиросульфованадатов (3К2S2О7
· V2О5, 2К2S2O7 · V2O5
и K2S2O7·V2O5,
разлагающихся соотв. при 315-330, 365-380 и 400-405 °С). Активный компонент
в условиях катализа находится в расплавленном состоянии.
Схему окисления SO2
в SO3 можно представить след. образом:
На первой стадии достигается
равновесие, вторая стадия медленная и определяет скорость процесса.
Произ-во серной кислоты из серы
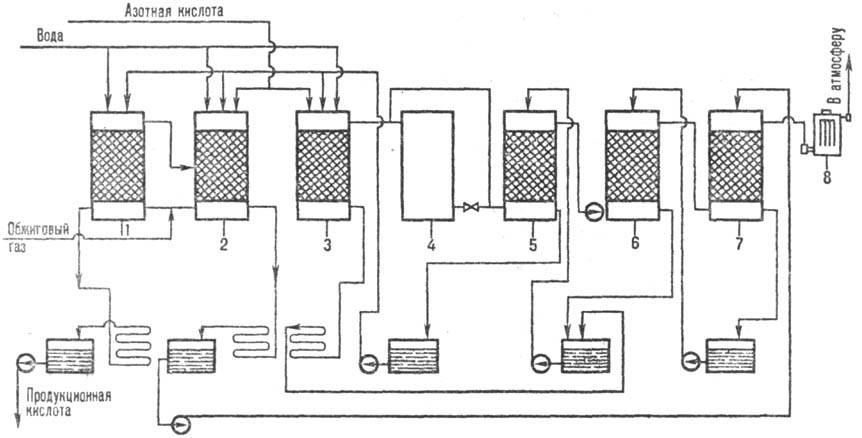
по методу двойного контактирования и двойной абсорбции (рис. 1) состоит из след.
стадий. Воздух после очистки от пыли подается газодувкой в сушильную башню,
где он осушается 93-98%-ной серной кислотой до содержания влаги 0,01% по объему. Осушенный
воздух поступает в серную печь после предварит. подогрева в одном из теплообменников
контактного узла. В печи сжигается сера, подаваемая форсунками: S + О2: SO2 + + 297,028 кДж. Газ, содержащий 10-14% по объему SO2,
охлаждается в котле и после разбавления воздухом до содержания SO2
9-10% по объему при 420 °С поступает в контактный аппарат на первую стадию
конверсии, к-рая протекает на трех слоях катализатора (SO2 + V2O2: : SO3 + 96,296 кДж), после чего газ охлаждается в теплообменниках.
Затем газ, содержащий 8,5-9,5% SO3, при 200 °С поступает на первую
стадию абсорбции в абсорбер, орошаемый олеумом и 98%-ной серной кислотой: SO3
+ Н2 О : Н2 SO4 + + 130,56 кДж. Далее
газ проходит очистку от брызг серной кислоты, нагревается до 420 °С и поступает на
вторую стадию конверсии, протекающую на двух слоях катализатора. Перед второй
стадией абсорбции газ охлаждается в экономайзере и подается в абсорбер второй
ступени, орошаемый 98%-ной серной кислотой, и затем после очистки от брызг выбрасывается
в атмосферу.
Рис. 1. Схема произ-ва
серной к-ты из серы: 1-серная печь; 2-котел-утилизатор; 3 — экономайзер; 4-пусковая
топка; 5, 6-теплообменники пусковой топки; 7-контактный аппарат; 8-теплообменники;
9-олеумный абсорбер; 10-сушильная башня; 11 и 12-соотв. первый и второй моногидратные
абсорберы; 13-сборники к-ты.
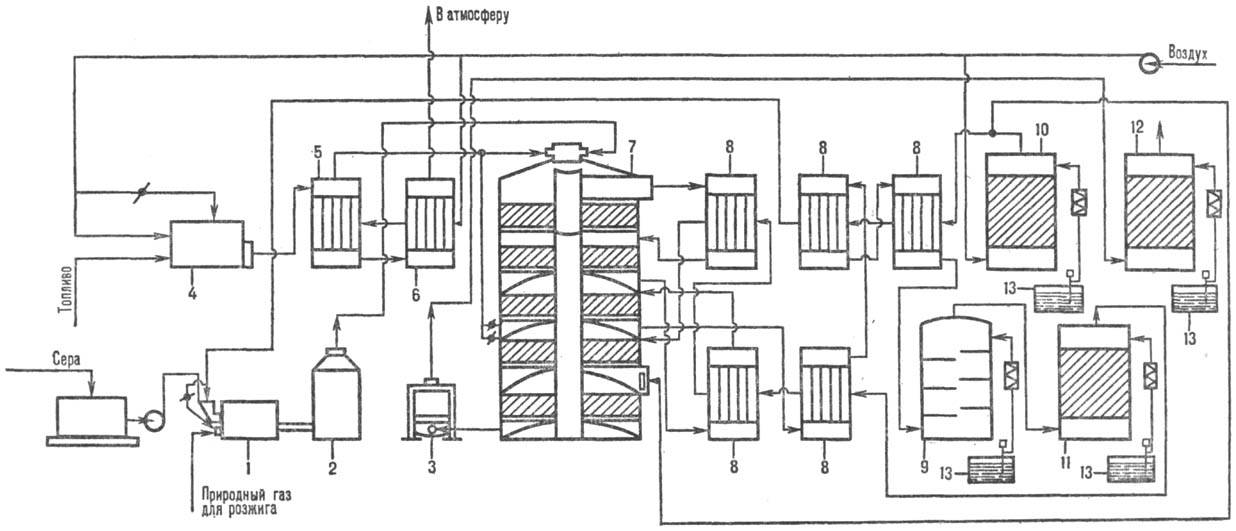
Рис.2. Схема произ-ва серной
к-ты из колчедана: 1-тарельчатый питатель; 2-печь; 3-котел-утилизатор; 4-циклоны;
5-электрофильтры; 6-промывные башни; 7-мокрые электрофильтры; 8-отдувочная башня;
9-сушильная башня; 10-брызгоуловитель; 11-первый моногидратный абсорбер; 12-теплообмен-вики;
13 — контактный аппарат; 14-олеумный абсорбер; 15-второй моногидратный абсорбер;
16-холодильники; 17-сборники.
Рис. 3. Схема произ-ва
серной к-ты нитроз-ным методом: 1 — денитрац. башня; 2, 3-первая и вторая продукц.
башни; 4-окислит. башня; 5, 6, 7-абсорбц. башни; 8 — электрофильтры.
Произ-во серной кислоты из сульфидов
металлов (рис. 2) существенно сложнее и состоит из след. операций. Обжиг FeS2
производят в печи кипящего слоя на воздушном дутье: 4FeS2 +
11О2: 2Fe2 O3 + 8SO2 + 13476
кДж. Обжиговый газ с содержанием SO2 13-14%, имеющий т-ру 900 °С,
поступает в котел, где охлаждается до 450 °С. Очистку от пыли осуществляют
в циклоне и электрофильтре. Далее газ проходит через две промывные башни, орошаемые
40%-ной и 10%-ной серной кислотой. При этом газ окончательно очищается от пыли, фтора и
мышьяка. Для очистки газа от аэрозоля серной кислоты, образующегося в промывных башнях,
предусмотрены две ступени мокрых электрофильтров. После осушки в сушильной башне,
перед к-рой газ разбавляется до содержания 9% SO 2, его газодувкой
подают на первую стадию конверсии (3 слоя катализатора). В теплообменниках газ
подогревается до 420 °С благодаря теплу газа, поступающего с первой стадии
конверсии. SO2, окисленный на 92-95% в SO3, идет на первую
стадию абсорбции в олеумный и моногидратный абсорберы, где освобождается от
SO3. Далее газ с содержанием SO2 ~ 0,5% поступает на вторую
стадию конверсии, к-рая протекает на одном или двух слоях катализатора. Предварительно
газ нагревается в др. группе теплообменников до 420 °С благодаря теплу газов,
идущих со второй стадии катализа. После отделения SO3 на второй стадии
абсорбции газ выбрасывается в атмосферу.
Степень превращения SO2
в SO3 при контактном способе 99,7%, степень абсорбции SO3
99,97%. Произ-во серной кислоты осуществляют и в одну стадию катализа, при этом степень
превращения SO2 в SO3 не превышает 98,5%. Перед выбросом
в атмосферу газ очищают от оставшегося SO2 (см. Газов очистка).
Производительность совр. установок 1500-3100 т/сут.
Сущность нитрозного метода
(рис. 3) состоит в том, что обжиговый газ после охлаждения и очистки от пыли
обрабатывают т. наз. нитрозой-серной кислотой, в к-рой раств. оксиды азота. SO2
поглощается нитрозой, а затем окисляется: SO2 + N2O3
+ Н2О : Н2SO4 + NO. Образующийся NO плохо
раств. в нитрозе и выделяется из нее, а затем частично окисляется кислородом
в газовой фазе до NO2. Смесь NO и NO2 вновь поглощается
серной кислотой и т.д. Оксиды азота не расходуются в нитрозном процессе и возвращаются
в производств. цикл, вследствие неполного поглощения их серной кислотой они частично уносятся
отходящими газами. Достоинства нитрозного метода: простота аппаратурного оформления,
более низкая себестоимость (на 10-15% ниже контактной), возможность 100%-ной
переработки SO2.
Аппаратурное оформление
башенного нитрозного процесса несложно: SO2 перерабатывается в 7-8
футерованных башнях с керамич. насадкой, одна из башен (полая) является регулируемым
окислит. объемом. Башни имеют сборники к-ты, холодильники, насосы, подающие
к-ту в напорные баки над башнями. Перед двумя последними башнями устанавливается
хвостовой вентилятор. Для очистки газа от аэрозоля серной кислоты служит электрофильтр.
Оксиды азота, необходимые для процесса, получают из HNO3. Для сокращения
выброса оксидов азота в атмосферу и 100%-ной переработки SO2 между
продукционной и абсорбционной зонами устанавливается безнитрозный цикл переработки
SO2 в комбинации с водно-кислотным методом глубокого улавливания
оксидов азота. Недостаток нитрозного метода-низкое качество продукции: концентрация
серной кислоты 75%, наличие оксидов азота, Fe и др. примесей.
Для уменьшения возможности
кристаллизации серной кислоты при перевозке и хранении установлены стандарты на товарные
сорта серной кислоты, концентрация к-рых соответствует наиб. низким т-рам кристаллизации.
Содержание серной кислоты в техн. сортах (%): башенная (нитрозная) 75, контактная 92,5-98,0,
олеум 104,5, высокопроцентный олеум 114,6, аккумуляторная 92-94. Серную кислоту хранят
в стальных резервуарах объемом до 5000 м3, их общая емкость на складе
рассчитана на десятисуточньш выпуск продукции. Олеум и серную кислоту перевозят в стальных
железнодорожных цистернах. Конц. и аккумуляторную серную кислоту перевозят в цистернах
из кислотостойкой стали. Цистерны для
перевозки олеума покрывают теплоизоляцией и перед заливкой олеум подогревают.
Определяют серную кислоту колориметрически
и фотометрически, в виде взвеси BaSO4 — фототурбидиметрически, а
также ку-лонометрич. методом.
Применение. Серную кислоту применяют
в произ-ве минер. удобрений, как электролит в свинцовых аккумуляторах, для получения
разл. минер. к-т и солей, хим. волокон, красителей, дымообразующих в-в и ВВ,
в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях пром-сти.
Ее используют в пром. орг. синтезе в р-циях дегидратации (получение диэтилового
эфира, сложных эфиров), гидратации (этанол из этилена), сульфирования (синтетич.
моющие ср-ва и промежут. продукты в произ-ве красителей), алкили-рования (получение
изооктана, полиэтиленгликоля, капро-лактама) и др. Самый крупный потребитель
серной кислоты-произ-во минер. удобрений. На 1 т Р2О5фосфорных
удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH4)2SO4-0,75
т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами
по произ-ву минер. удобрений. Мировое произ-во серной кислоты в 1987 достигло 152 млн.
т.
Серная кислота и олеум — чрезвычайно
агрессивные в-ва, поражают дыхат. пути, кожу, слизистые оболочки, вызывают затруднение
дыхания, кашель, нередко-ларингит, трахеит, бронхит и т. д. ПДК аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м3, в атм. воздухе 0,3 мг/м3
(макс. разовая) и 0,1 мг/м3 (среднесуточная). Поражающая концентрация
паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин).
Класс опасности 2. Аэрозоль серной кислоты может образовываться в атмосфере в результате
выбросов хим. и металлургич. произ-в, содержащих оксиды S, и выпадать в виде
кислотных дождей.
Лит.: Справочник
сернокислотчика, под ред. К. М. Малина, 2 изд., М., 1971; Амелин А. Г., Технология
серной кислоты, 2 изд., М., 1983; Васильев Б. Т., Отвагина М. И., Технология
серной кислоты, М., 1985. Ю.В. Филатов.
Еще по теме:
- Серная кислота — справочник по веществам
- Серная кислота — Токсикологическая химия
СЕ́РНАЯ КИСЛОТА́, тетраоксосульфат(VI) водорода, H2SO4; сильная двухосновная неорганич. кислота; многотоннажный продукт химич. пром-сти.
Свойства
Безводная С. к. – бесцветная, очень вязкая и гигроскопичная жидкость без запаха, tпл 10,4 °С; плотность 1831 кг/м3 (20 °С); при нагревании частично разлагается с выделением серы триоксида SO3; перегоняется в виде азеотропной смеси – массовая доля H2SO4 98,3%, tкип 338,8 °C; при более высоких темп-рах полностью разлагается. Неограниченно смешивается с водой и SO3; в водных растворах практически полностью диссоциирует на Н3О+, и ; даёт два ряда солей – сульфаты и гидросульфаты; образует гидраты H2SO4·nH2O (n= 1, 2, 3, 4), твёрдые гидраты H2SO4·H2O и H2SO4·2H2O имеют ионное строение: (Н3О+)(HSO4-) и (Н3О+)2() соответственно. Безводная H2SO4 – неводный растворитель сульфатов металлов. Технич. смесь концентрир. H2SO4, SO3 и дисерной кислоты H2S2O7 (продукт взаимодействия H2SO4 и SO3) – т. н. олеум.
С. к. вытесняет др. кислоты из их солей, нейтрализуется щелочами. Концентрир. H2SO4 – сильный окислитель (восстанавливается до серы диоксида SO2, S и сероводорода H2S); при нагревании окисляет почти все металлы (кроме Au и платиновых металлов), неметаллы, HBr, HI и др.; на холоду в концентрир. H2SO4 некоторые металлы (напр., Co, Fe) пассивируются. Разбавленная H2SO4 реагирует с металлами, расположенными в электрохимич. ряду напряжений левее водорода, с выделением Н2. Известны пероксопроизводные: H2SO5 (пероксомоносерная, кислота Каро) и H2S2O8 (пероксодисерная кислота).
Получение
Получение «купоросного масла» (концентрир. С. к.) прокаливанием железного или медного купороса описано в трудах алхимиков. Старейший пром. способ получения С. к. (предложен в 1690 Н. Лемери и Н. Лефевром, Франция; реализован в 1736 Дж. Уордом, Англия) включал сжигание смеси серы и селитры и поглощение продукта водой в стеклянном баллоне. В 1746 англ. технолог Дж. Робек предложил заменить стеклянные баллоны камерами из листового свинца (камерный способ произ-ва). Нитрозный способ разработан в 1860 англ. химиком Дж. Гловером. Принцип контактного способа произ-ва С. к. открыт в 1831 англ. химиком П. Филипсом и получил распространение в нач. 20 в.
Осн. стадии совр. произ-ва С. к.: обжиг сырья с получением SO2; окисление SO2 до SO3; абсорбция SO3. В пром-сти применяют два метода получения H2SO4, отличающиеся способом окисления SO2, – контактный, с использованием твёрдых катализаторов V2О5 (до 80% мирового произ-ва), и нитрозный (башенный, устар. – камерный) – с оксидами азота. Сырьём для получения H2SO4 служат в осн. сера (ок. 65% всего SO2) и сульфидные руды, гл. обр. пирит (ок. 35%).
Технология произ-ва С. к. контактным способом из серы включает сжигание распыляемого форсунками расплава S в токе подогретого, очищенного от пыли и осушенного воздуха с получением смеси газов, содержащей 10–14% SO2, которую охлаждают и разбавляют воздухом до содержания SO2 9–10%; технология произ-ва С. к. из пирита включает обжиг FeS2 в печи кипящего слоя на возд. дутье (4FeS2+11О2= 2Fe2O3+ 8SO2), охлаждение и очистку обжигового газа (содержание SO2 13–14%) в циклоне и электрофильтре, промывку, осушку и разбавление воздухом до содержания SO2 9%. Очищенная, осушенная и подогретая до 420 °С газовая смесь, содержащая 9–10% SO2, поступает в контактный аппарат на первую стадию окисления на трёх слоях катализатора. Окисленная газовая смесь в олеумном и моногидратном абсорберах (орошаемых олеумом и концентрир. H2SO4) освобождается от SO3, нагревается до 420 °С и поступает на вторую стадию окисления на одном или двух слоях катализатора. Далее SO3 отделяется в абсорбере, орошаемом 98%-ной H2SO4, а отходящие газы выбрасываются в атмосферу. Суммарная степень превращения SO2 в SO3 при контактном способе достигает 99,7%, степень абсорбции SO3 99,97%.
В нитрозном способе обжиговый газ после охлаждения и очистки от пыли обрабатывают нитрозой – С. к., в которой растворены оксиды азота. SO2 поглощается нитрозой, а затем окисляется (SO2+N2O3+Н2О=Н2SO4+NO). Выделяющийся NO окисляется до NO2. Смесь NO и NO2 растворяют в H2SO4 и возвращают в цикл. Достоинства нитрозного метода: простота аппаратурного оформления, более низкая себестоимость (на 10–15% ниже контактного), возможность 100%-ной переработки SO2. Недостатки: низкая концентрация H2SO4, наличие примесей в продукте.
Мировое произ-во С. к. ок. 145 млн. т/год.
Стандарты на товарные сорта С. к. (в % по массе H2SO4): нитрозная 75%, контактная 92,5–98,0%; олеум 104,5%, высокопроцентный олеум 114,6%, аккумуляторная 92–94%, реактивная (получаемая контактным способом в аппаратуре из кварца или платины) 92–94%.
Применение
С. к. используется для произ-ва минер. удобрений, как электролит в свинцовых аккумуляторах, в гидрометаллургии для вскрытия комплексных руд, для получения кислот (фосфорной, соляной, борной, плавиковой и др.) и солей, в нефтяной пром-сти (очистка нефтепродуктов от сернистых и ненасыщенных органич. соединений), в металлообработке (удаление окалины с проволоки и листов перед лужением и оцинковкой, травление металлич. поверхностей перед нанесением гальванич. покрытий), в пром. органич. синтезе (реакции этерификации, сульфирования, алкилирования и пр.), как водоотнимающее средство (осушка газов, концентрирование азотной кислоты) и др.
С. к. и олеум – химически чрезвычайно агрессивные вещества, поражают дыхат. пути, кожу, слизистые оболочки, вызывают затруднение дыхания, кашель, ларингит, трахеит, бронхит. Обращаться с С. к. в лаборатории и на произ-ве следует с осторожностью, используя средства защиты (очки, резиновые перчатки, фартуки, сапоги). При разбавлении необходимо лить H2SO4 в воду тонкой струёй при перемешивании (приливание воды к концентрир. H2SO4 вызывает разбрызгивание из-за большого тепловыделения).
Аэрозоль H2SO4 может образоваться в атмосфере в результате выбросов теплоэлектростанций, химич. и металлургич. производств, содержащих оксиды S, и выпадать в виде кислотных дождей.
| Серная кислота | |
|---|---|

| |
| Систематическое наименование | серная кислота |
| Хим. формула | H2SO4 |
| Состояние | жидкость |
| Молярная масса | 98,078 ± 0,006 г/моль |
| Плотность | 1,8356 г/см³ |
| Динамическая вязкость | 0,027534 Па·с |
| Кинематическая вязкость | 0,1501 см²/с |
| Т. плав. | 10,38 °C |
| Т. кип. | 337 °C |
| Удельная теплота плавления | 10,73 Дж/кг |
| Давление пара | 0,001 ± 0,001 мм рт.ст. |
| pKa | -3 |
| Растворимость в воде | смешивается |
| Показатель преломления | 1.397 |
| Дипольный момент | 2.72 Д |
| ГОСТ | ГОСТ 2184-77 ГОСТ 667-73 ГОСТ 14262-78 ГОСТ 4204-77 |
| Рег. номер CAS | 7664-93-9 |
| PubChem | 1118 |
| Рег. номер EINECS | 231-639-5 |
| SMILES | OS(O)(=O)=O |
| InChI | 1S/H2O4S/c1-5(2,3)4/h(H2,1,2,3,4) QAOWNCQODCNURD-UHFFFAOYSA-N |
| Рег. номер EC | 231-639-5 |
| Кодекс Алиментариус | E513 |
| RTECS | WS5600000 |
| ChEBI | 26836 и 45693 |
| Номер ООН | 1830 |
| ChemSpider | 1086 |
| ЛД50 | 510 мг/кг |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Серная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум).

Название
В XVIII—XIX веках серу для пороха производили из серного колчедана (пирит) на купоросных заводах. Серную кислоту в то время называли «купоросным маслом», очевидно отсюда происхождение названия её солей (а точнее именно кристаллогидратов) — купоросы.
Получение серной кислоты
Основная статья: Производство серной кислоты
Промышленный (контактный) способ
В промышленности серную кислоту получают окислением диоксида серы (сернистый газ, образующийся в процессе сжигания серы или серного колчедана) до триоксида (серного ангидрида) с последующим взаимодействием SO3 с водой. Получаемую данным способом серную кислоту также называют контактной (концентрация 92-94 %).
-
- 2SO2 + O2 = 2SO3
H2O + SO3 = H2SO4
Нитрозный (башенный) способ
Раньше серную кислоту получали исключительно нитрозным методом в специальных башнях, а кислоту называли башенной (концентрация 75 %). Сущность этого метода заключается в окислении диоксида серы диоксидом азота в присутствии воды. Именно таким способом произошла реакция в воздухе Лондона во время Великого смога.
-
- SO2 + NO2 + H2O = H2SO4 + NO ↑
Другой способ
В тех редких случаях, когда сероводород (H2S) вытесняет сульфат(SO4—) из соли (с металлами Cu,Ag,Pb,Hg) побочным продуктом является серная кислота
-
- H2S + CuSO4 = CuS + H2SO4
Сульфиды данных металлов обладают высочайшей прочностью, а также отличительным чёрным окрасом,
но могут быть окислены до сульфатов, например, азотной кислотой при кипении:
-
- CuS + 8HNO3 → CuSO4 + 8NO2↑ + 4H2O

Физические и физико-химические свойства
Очень сильная кислота, при 18оС pKa (1) = −2,8, pKa (2) = 1,92 (К₂ 1,2 10−2); длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H2SO4 и 1,7 % H2O с температурой кипения 338,8оС). Серная кислота, отвечающая 100%-ному содержанию H2SO4, имеет состав (%): H2SO4 99,5, HSO4− — 0,18, H3SO4+ — 0,14, H3O+ — 0,09, H2S2O7, — 0,04, HS2O7⁻ — 0,05. Смешивается с водой и SO3, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H3O+, HSO3+, и 2HSO₄−. Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
Олеум
Основная статья: Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
-
- H2SO4 + SO3 → H2S2O7 Сульфит
-
- H2SO4 + 2SO3 → H2S3O10
Температура кипения водных растворов серной кислоты повышается с ростом её концентрации и достигает максимума при содержании 98,3 % H2SO4.
| Содержание % по массе | Плотность при 20 ℃, г/см³ | Температура плавления, ℃ | Температура кипения, ℃ | |
|---|---|---|---|---|
| H2SO4 | SO3 (свободный) | |||
| 10 | — | 1,0661 | −5,5 | 102,0 |
| 20 | — | 1,1394 | −19,0 | 104,4 |
| 40 | — | 1,3028 | −65,2 | 113,9 |
| 60 | — | 1,4983 | −25,8 | 141,8 |
| 80 | — | 1,7272 | −3,0 | 210,2 |
| 98 | — | 1,8365 | 0,1 | 332,4 |
| 100 | — | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
-
- lg p = A − B + 2,126 ,
- T
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
-
- H2SO4 ⟷ H2O + SO3 − Q .
При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:
-
- d = 1,851 7 − 1,1 ⋅ 10−3 t + 2 ⋅ 10−6 t2
С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO3 увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:
-
- λ = 0,518 + 0,0016t − ( 0,25 + t/1293 ) ⋅ C/100
где С — концентрация серной кислоты, в %.
Максимальную вязкость имеет олеум H2SO4·SO3, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации SO3 и 92 % H2SO4 и максимально при концентрации 84 и 99,8 % H2SO4. Для олеума минимальное ρ при концентрации 10 % SO3. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T3/2 см²/с.
Химические свойства
Серная кислота в концентрированном виде при нагревании — довольно сильный окислитель.
Окисляет HI и частично HBr до свободных галогенов.
-
- 8HI + H2SO4 = 4I2 ↓ + H2S↑ + 4H2O
-
- 2HBr + H2SO4 = Br2↓ + SO2↑ + 2H2O
Углерод до CO2, серу — до SO2.
-
- C + 2H2SO4 = 2SO2↑ + CO2 ↑ + 2H2O
-
- S + 2H2SO4 = 3SO2↑ + 2H2O
Окисляет многие металлы (исключения: Au, Pt, Ir, Rh, Ta.). При этом концентрированная серная кислота восстанавливается до SO2, например:
-
- Cu + 2H2SO4 = CuSO4 + 2H2O + SO2
На холоде в концентрированной серной кислоте Fe, Al, Cr, Co, Ni, Ba пассивируются и реакции не протекают.
Наиболее сильными восстановителями концентрированная серная кислота восстанавливается до S и H2S. Концентрированная серная кислота поглощает водяные пары, поэтому она применяется для сушки газов, жидкостей и твёрдых тел, например, в эксикаторах. Однако концентрированная H2SO4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Отщепляя воду от органических соединений и оставляя при этом чёрный углерод (уголь), концентрированная серная кислота приводит к обугливанию древесины, сахара и других веществ.
Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением, например:
-
- Fe + H2SO4 = FeSO4 + H2↑
Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
-
- H2SO4 + 2NaOH = Na2SO4 + 2H2O
-
- H2SO4 + 2NaOH = Na2SO4 + 2H2O
Серная кислота реагирует также с основными оксидами, образуя сульфат и воду:
-
- CuO + H2SO4 = CuSO4 + H2O
На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты:
-
- Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Концентрированная H2SO4 превращает некоторые органические вещества в другие соединения углерода:
-
- HCOOH + H2SO4(k) = CO↑ + H2SO4 ⋅ nH2O
Качественной реакцией на серную кислоту и её растворимые соли является их взаимодействие с растворимыми солями бария, при котором образуется белый осадок сульфата бария, нерастворимый в воде и кислотах, например:
-
- H2SO4 + BaCl2 = BaSO4↓ + 2HCl
Применение


Перевозка серной кислоты железнодорожным транспортом осуществляется в специализированных вагонах-цистернах

Контейнеры-цистерны для перевозки серной кислоты погруженные на железнодорожные фитинговые платформы, станция Волковская, Санкт-Петербург
Серную кислоту применяют:
- в обработке руд, особенно при добыче редких элементов, в том числе урана, иридия, циркония, осмия и т. п.;
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513 (эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанол из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.;
- для восстановления смол в фильтрах на производстве дистиллированной воды.
Мировое производство серной кислоты около 200 млн тонн в год. Самый крупный потребитель серной кислоты — производство минеральных удобрений. На P₂O₅ фосфорных удобрений расходуется в 2,2—3,4 раза больше по массе серной кислоты, а на (NH₄)₂SO₄ серной кислоты 75 % от массы расходуемого (NH₄)₂SO₄. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Токсическое действие
Серная кислота и олеум — очень едкие вещества. Они поражают кожу, слизистые оболочки, дыхательные пути (вызывают химические ожоги). При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Предельно допустимая концентрация аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м³, в атмосферном воздухе 0,3 мг/м³ (максимальная разовая) и 0,1 мг/м³ (среднесуточная). Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности II. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей.
В РФ оборот серной кислоты концентрации 45% и более — ограничен.

Исторические сведения
Серная кислота известна с древности, встречаясь в природе в свободном виде, например, в виде озёр вблизи вулканов. Возможно, первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
Схема получения серной кислоты из железного купороса — термическое разложение сульфата железа (II) с последующим охлаждением смеси

Молекула серной кислоты по Дальтону
-
- 2FeSO4 + 7H2O → Fe2O3 + SO2 + H2O + O2
- 2SO2 + 2H2O + O2 ⇄ 2H2SO4
В трудах алхимика Валентина (XIII в) описывается способ получения серной кислоты путём поглощения водой газа (серный ангидрид), выделяющегося при сжигании смеси порошков серы и селитры. Впоследствии этот способ лег в основу т. н. «камерного» способа, осуществляемого в небольших камерах, облицованных свинцом, который не растворяется в серной кислоте. В СССР такой способ просуществовал вплоть до 1955 г.
Алхимикам XV в известен был также способ получения серной кислоты из пирита — серного колчедана, более дешевого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. Впоследствии, в связи с развитием катализа этот метод вытеснил камерный способ синтеза серной кислоты. В настоящее время серную кислоту получают каталитическим окислением (на V2O5) оксида серы (IV) в оксид серы (VI), и последующим растворением оксида серы (VI) в 70 % серной кислоте с образованием олеума.
В России производство серной кислоты впервые было организовано в 1805 году под Москвой в Звенигородском уезде. В 1913 году Россия по производству серной кислоты занимала 13 место в мире.
Дополнительные сведения
Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (Полуостров Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3⋅107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994.
Стандарты
- Кислота серная техническая ГОСТ 2184-77
- Кислота серная аккумуляторная. Технические условия ГОСТ 667-73
- Кислота серная особой чистоты. Технические условия ГОСТ 14262-78
- Реактивы. Кислота серная. Технические условия ГОСТ 4204-77