Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Простое вещество железо (CAS-номер: 7439-89-6) — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
На самом деле железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
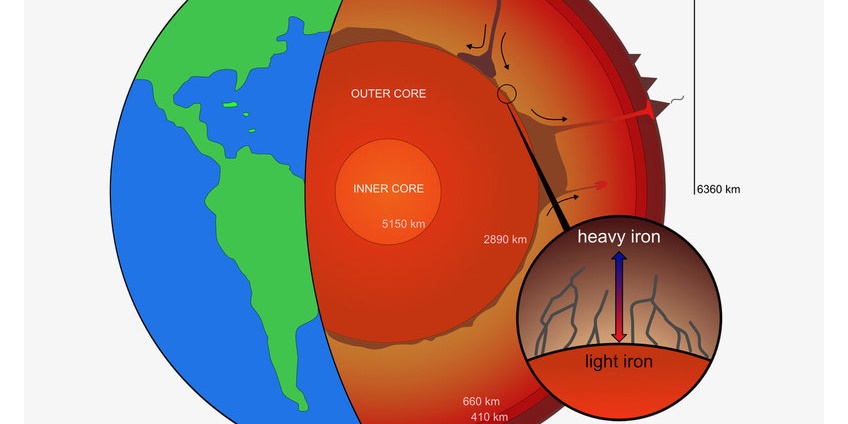
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al). Считается также, что железо составляет бо́льшую часть земного ядра.
Происхождение названия
Имеется несколько версий происхождения славянского слова «железо» (белор. жалеза, укр. залізо, ст.-слав. желѣзо, болг. желязо, сербохорв. жељезо, польск. żelazo, чеш. železo, словен. železo).
Одна из этимологий связывает праслав. *želězo с греческим словом χαλκός, что означало железо и медь, согласно другой версии *želězo родственно словам *žely «черепаха» и *glazъ «скала», с общей семой «камень». Третья версия предполагает древнее заимствование из неизвестного языка.
Романские языки (итал. ferro, фр. fer, исп. hierro, порт. ferro, рум. fier) продолжают лат. ferrum . Латинское ferrum (
Германские языки заимствовали название железа (готск. eisarn,англ. iron, нем. Eisen, нидерл. ijzer,дат. jern, швед. järn) из кельтских.
Пракельтское слово *isarno- (> др.-ирл. iarn, др.-брет. hoiarn), вероятно, восходит к пра-и.е. *h1esh2r-no- «кровавый» с семантическим развитием «кровавый» > «красный» > «железо». Согласно другой гипотезе данное слово восходит к пра-и.е. *(H)ish2ro- «сильный, святой, обладающий сверхъестественной силой».
Древнегреческое слово σίδηρος, возможно, было заимствовано из того же источника, что и славянское, германское и балтийское слова для серебра.
Название природного карбоната железа (сидерита) происходит от лат. sidereus — звёздный; действительно, первое железо, попавшее в руки людям, было метеоритного происхождения. Возможно, это совпадение не случайно. В частности древнегреческое слово сидерос (σίδηρος) для железа и латинское sidus, означающее «звезда», вероятно, имеют общее происхождение.
Получение
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
В печи углерод в виде кокса окисляется до монооксида углерода. Данный оксид образуется при горении в недостатке кислорода. В свою очередь, монооксид углерода восстанавливает железо из руды. Чтобы данная реакция шла быстрее, нагретый угарный газ пропускают через оксид железа(III). Флюс добавляется для избавления от нежелательных примесей (в первую очередь от силикатов; например кварц) в добываемой руде. Типичный флюс содержит известняк (карбонат кальция) и доломит (карбонат магния). Для устранения других примесей используют другие флюсы.
Действие флюса (в данном случае карбонат кальция) заключается в том, что при его нагревании он разлагается до его оксида. Оксид кальция соединяется с диоксидом кремния, образуя шлак — метасиликат кальция. Шлак, в отличие от диоксида кремния, плавится в печи. Более лёгкий, чем железо, шлак плавает на поверхности — это свойство позволяет разделять шлак от металла. Шлак затем может использоваться при строительстве и сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит довольно много углерода (чугун). Кроме таких случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Излишки углерода и другие примеси (сера, фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используются и для выплавки легированных сталей.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах.
Химически чистое железо получается электролизом растворов его солей.
Источник: Википедия
Другие заметки по химии

Основные степени окисления — +2, +3
Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Химические свойства простого вещества — железа:
Ржавление и горение в кислороде
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O2 + 6H2 O → 4Fe(OH)3
Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II, III):
3Fe + 2O2 → Fe3O4
3Fe+2O2→(Fe IIFe2III)O4 (160 °С)
2) При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O –t°→ Fe3O4 + 4H2
3) Железо реагирует с неметаллами при нагревании:
2Fe+3Cl2→2FeCl3 (200 °С)
2Fe + 3Br2 –t°→ 2FeBr3
Fe + S –t°→ FeS (600 °С)
Fe+2S → Fe+2(S2-1) (700°С)
4) В ряду напряжений стоит левее водорода, реагирует с разбавленными кислотами НСl и Н2SO4, при этом образуются соли железа(II) и выделяется водород:
Fe + 2HCl → FeCl2 + H2 (реакции проводятся без доступа воздуха, иначе Fe+2 постепенно переводится кислородом в Fe+3 )
Fe + H2SO4(разб.) → FeSO4 + H2
В концентрированных кислотах–окислителях железо растворяется только при нагревании, оно сразу переходит в катион Fе3+:
2Fe + 6H2SO4(конц.) –t°→ Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3(конц.) –t°→ Fe(NO3)3 + 3NO2 + 3H2O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
Железный гвоздь, погруженный в голубоватый раствор медного купороса, постепенно покрывается налетом красной металлической меди
5) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO4 → FeSO4 + Cu
6)
Амфотерность железа проявляется только в концентрированных щелочах при кипячении:
Fе + 2NaОН (50 %) + 2Н2O= Nа2[Fе(ОН)4]↓+ Н2↑
и образуется осадок тетрагидроксоферрата(II) натрия.
Техническое железо — сплавы железа с углеродом: чугун содержит 2,06-6,67 % С, сталь 0,02-2,06 % С, часто присутствуют другие естественные примеси (S, Р, Si) и вводимые искусственно специальные добавки (Мn, Ni, Сr), что придает сплавам железа технически полезные свойства — твердость, термическую и коррозионную стойкость, ковкость и др.
Доменный процесс производства чугуна
Доменный процесс производства чугуна составляют следующие стадии:
а) подготовка (обжиг) сульфидных и карбонатных руд — перевод в оксидную руду:
FeS2→Fe2O3 (O2,800°С, -SO2) FeCO3→Fe2O3 (O2,500-600°С, -CO2)
б) сжигание кокса при горячем дутье:
С(кокс) + O2 (воздух) →СO2 (600—700°С) СO2 + С(кокс) ⇌ 2СО (700—1000 °С)
в) восстановление оксидной руды угарным газом СО последовательно:
Fe2O3→(CO) (FeIIFe2III)O4→(CO) FeO→(CO) Fe
г) науглероживание железа (до 6,67 % С) и расплавление чугуна:
Fе(т)→(C(кокс) 900—1200°С)Fе(ж) (чугун, t пл 1145°С)
В чугуне всегда в виде зерен присутствуют цементит Fe2С и графит.
Производство стали
Передел чугуна в сталь проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева; температура процесса 1700-2000 °С. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (СО2, SО2), либо связываются в легко отделяемый шлак — смесь Са3(РO4)2 и СаSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Получение чистого железа в промышленности — электролиз раствора солей железа, например:
FеСl2→ Fе↓ + Сl2↑ (90°С) (электролиз)
(существуют и другие специальные методы, в том числе восстановление оксидов железа водородом).
Чистое железо применяется в производстве специальных сплавов, при изготовлении сердечников электромагнитов и трансформаторов, чугун — в производстве литья и стали, сталь — как конструкционный и инструментальный материалы, в том числе износо-, жаро- и коррозионно-стойкие.
Оксид железа(II) FеО. Амфотерный оксид с большим преобладанием основных свойств. Черный, имеет ионное строение Fе2+ O2-. При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций:
4FеО ⇌(FeIIFe2 III) + Fе (560—700 °С , 900—1000°С)
FеО + 2НС1 (разб.) = FеС12 + Н2O
FеО + 4НNO3 (конц.) = Fе(NO3)3 +NO2↑ + 2Н2O
FеО + 4NаОН =2Н2O + Nа4FеO3(красн.) триоксоферрат(II) (400—500 °С)
FеО + Н2 =Н2O + Fе (особо чистое) (350°С)
FеО + С(кокс) = Fе + СО (выше 1000 °С)
FеО + СО = Fе + СO2 (900°С)
4FеО + 2Н2O(влага) + O2(воздух) →4FеО(ОН) (t)
6FеО + O2 = 2(FeIIFe2III )O4 (300—500°С)
Получение в лаборатории: термическое разложение соединений железа (II) без доступа воздуха:
Fе(ОН)2 = FеО + Н2O (150-200 °С)
FеСОз = FеО + СO2 (490-550 °С)
Оксид дижелеза (III) – железа(II) (FeIIFe2III )O4 . Двойной оксид. Черный, имеет ионное строение Fe2+(Fе3+)2(O2-)4. Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок (железный сурик), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий (чернение, воронение). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто-формулы Fe3O4 не рекомендуется. Уравнения важнейших реакций:
2(FeIIFe2 III )O4 = 6FеО + O2 (выше 1538 °С)
(FeIIFe2III )O4 + 8НС1 (разб.) = FеС12 + 2FеС13 + 4Н2O
(FeIIFe2III )O4 +10НNO3 (конц.) =3Fе(NO3)3 + NO2↑+ 5Н2O
(FeIIFe2III )O4 + O2 (воздух) = 6Fе2O3 (450-600°С)
(FeIIFe2III )O4 + 4Н2 = 4Н2O + 3Fе (особо чистое, 1000 °С)
(FeIIFe2III )O4 + СО =ЗFеО + СO2 (500—800°C)
(FeIIFe2 III )O4 + Fе ⇌4FеО (900—1000 °С , 560—700 °С)
Получение: сгорание железа (см.) на воздухе.
В природе — оксидная руда железа магнетит.
Оксид железа(III) Fе2О3. Амфотерный оксид с преобладанием основных свойств. Красно-коричневый, имеет ионное строение (Fе 3+)2(O2-)3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Fе2O3 nН2О. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели (технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла.
Уравнения важнейших реакций:
6Fе2O3 = 4(FeIIFe2III )O4 +O2 (1200—1300 °С)
Fе2O3 + 6НС1 (разб.) →2FеС13 + ЗН2O (t) (600°С,р)
Fе2O3 + 2NaОН (конц.) →Н2O+ 2NаFеO2 (красн.) диоксоферрат(III)
Fе2О3 + МО=(МIIFе2III)O4 (М=Сu, Мn, Fе, Ni, Zn)
Fе2O3 + ЗН2 =ЗН2O+ 2Fе (особо чистое, 1050—1100 °С)
Fе2O3 + Fе = ЗFеО (900 °С)
3Fе2O3 + СО = 2(FeIIFе2III)O4 + СO2 (400—600 °С)
Получение в лаборатории — термическое разложение солей железа (III) на воздухе:
Fе2(SO4)3 = Fе2O3 + 3SO3 (500-700 °С)
4{Fе(NO3)3 9 Н2O} = 2FеaO3 + 12NO2+ 3O2 + 36Н2O (600-700 °С)
В природе — оксидные руды железа гематит Fе2O3 и лимонит Fе2O3 nН2O
Гидроксид железа (II) Fе(ОН)2. Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Fе — ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов.
Уравнения важнейших реакций:
Fе(OН)2 = FеО + Н2O (150-200 °С, в атм.N2)
Fе(ОН)2 + 2НС1 (разб.) =FеС12 + 2Н2O
Fе(ОН)2 + 2NаОН (> 50%) = Nа2[Fе(ОН)4] ↓(сине-зеленый) (кипячение)
4Fе(ОН)2 (суспензия) + O2 (воздух) →4FеО(ОН)↓ + 2Н2O (t)
2Fе(ОН)2 (суспензия) +Н2O2 (разб.) = 2FеО(ОН)↓ + 2Н2O
Fе(ОН)2 + КNO3(конц.) = FеО(ОН)↓ + NO↑+ КОН (60 °С)
Получение: осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере:
Fе2+ + 2OH (разб.) = Fе(ОН)2↓
Fе2+ + 2(NH3Н2O) = Fе(ОН)2↓+ 2NH4
Метагидроксид железа FеО(ОН). Амфотерный гидроксид с преобладанием основных свойств. Светло-коричневый, связи Fе — О и Fе — ОН преимущественно ковалентные. При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Fе2O3 nН2O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в FеО(ОН). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Fе(ОН)2. Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе.
Соединение состава Fе(ОН)3 не известно (не получено).
Уравнения важнейших реакций:
Fе2O3. nН2O→(200-250 °С, —H2O) FеО(ОН)→( 560-700° С на воздухе , -H2O) →Fе2О3
FеО(ОН) + ЗНС1 (разб.) =FеС13 + 2Н2O
FeO(OH)→Fe2O3.nH2O -коллоид (NаОН (конц.))
FеО(ОН)→Nа3[Fе(ОН)6] белый , Nа5[Fе(OН)8желтоватый (75 °С, NаОН( т))
2FеО(ОН) + Fе(ОН)2=( FeIIFe2III )O4 + 2Н2O (600—1000 °С)
2FеО(ОН) + ЗН2 = 4Н2O+ 2Fе (особо чистое, 500—600 °С)
2FеО(ОН) + ЗВr2 + 10КОН = 2К2FеO4 + 6Н2O + 6КВr
Получение: осаждение из раствора солей железа(Ш) гидрата Fе2О3 nН2O и его частичное обезвоживание (см. выше).
В природе — оксидная руда железа лимонит Fе2O3 nН2О и минерал гётит FеО(ОН).
Феррат калия К2FеО4. Оксосоль. Красно-фиолетовый, разлагается при сильном нагревании. Хорошо растворим в концентрированном растворе КОН, реагирует с кипящей водой, неустойчив в кислотной среде. Сильный окислитель.
Качественная реакция — образование красного осадка феррата бария. Применяется в синтезе ферритов — промышленно важных двойных оксидов железа (III) и других металлов.
Уравнения важнейших реакций:
4К2FеO4= 4КFеO2 + 3O2 + 2К2O (700 °С)
4К2FеO4 + 6Н2O (гор.) =4FeО(ОН)↓ + 8КОН + 3O2↑
FеО42- + 2OН+(разб.) =4Fе3+ + 3O2↑+10Н2O
FеО42- + 2(NH3. Н2O) →2FеО(ОН)↓ + N2↑+ 2Н2O+ 4OН—
FеО42- + Ва2+ = ВаFеO4 (красн.)↓ (в конц. КОН)
Получение: образуется при окислении соединений железа, например метагидроксида FеО(ОН), бромной водой, а также при действии сильных окислителей (при спекании) на железо
Fе + 2КОН + 2КNO3 = К2FеO4 + 3КNO2+ H2O (420 °С)
и электролизе в растворе:
электролиз
Fе + 2КОН (конц.) + 2Н2O→ЗН2↑ + К2FеO4 ( электролиз)
(феррат калия образуется на аноде).
Качественные реакции на ионы Fе2+ и Fе3+
Обнаружение ионов Fе2+ и Fе3+в водном растворе проводят с помощью реактивов К3[Fе(СN)6] и К4[Fе(СN)6] соответственно; в обоих случаях выпадает синий продукт одинакового состава и строения, КFеIII[FеII (СN)6]. В лаборатории этот осадок называют берлинская лазурь, или турнбуллева синь:
Fе2+ + К+ + [Fе(СN)6]3- = КFеIII[FеII (СN) 6]↓
Fе3+ + К+ + [Fе(СN)6]4- = КFеIII[FеII (СN) 6]↓
Химические названия исходных реактивов и продукта реакций:
К3FеIII[Fе(СN) 6]- гексацианоферрат (III) калия
К4FеIII[Fе (СN) 6]- гексацианоферрат (II) калия
КFеIII[FеII (СN) 6]- гексацианоферрат (II) железа (Ш) калия
Кроме того, хорошим реактивом на ионы Fе3+ является тиоцианат-ион NСS—, железо (III) соединяется с ним, и появляется ярко-красная («кровавая») окраска:
Fе3+ + 6NСS— = [Fе(NСS)6]3-
Этим реактивом (например, в виде соли КNСS) можно обнаружить даже следы железа (III) в водопроводной воде, если она проходит через железные трубы, покрытые изнутри ржавчиной.
 | ÐÑÐ¾Ð¼Ñ — Lego пÑиÑодÑ. |
Ð Ð°Ð·Ð´ÐµÐ»Ñ ÑÑÑаниÑÑ Ð¾ железе:
- Ðелезо как Ñ
имиÑеÑкий ÑÐ»ÐµÐ¼ÐµÐ½Ñ (железо в Ñизико-Ñ
имиÑеÑкиÑ
пÑоÑеÑÑаÑ
)
- ÐÑом железа (кÑаÑкие ÑведениÑ)
- ФизиÑеÑкие и Ñ Ð¸Ð¼Ð¸ÑеÑкие ÑвойÑÑва железа (как маÑеÑиала и веÑеÑÑва)
- Ðелезо как минеÑал
(железо в геологии)- РаÑпÑоÑÑÑанение железа и ÑÐ¸Ð¿Ñ Ð¶ÐµÐ»ÐµÐ·Ð½ÑÑ ÑÑд
- ÐпÑеделение (обнаÑÑжение) железа
- Ðелезо как маÑеÑиал
(железо в ÑÐµÑ Ð½Ð¾Ð»Ð¾Ð³Ð¸ÑÑ )- ÐÑÑоÑиÑеÑÐºÐ°Ñ ÑпÑавка о добÑÑе и иÑполÑзовании железе
- ÐолÑÑение железа
- ÐÑименение железа
- Ðелезо как оÑганиÑеÑкий микÑоÑÐ»ÐµÐ¼ÐµÐ½Ñ (железо в
оÑганизме и медиÑине)- ÐедоÑÑаÑок и избÑÑок железа в поÑве и ÑаÑÑениÑÑ
- ÐоÑÑебноÑÑÑ Ð² железе в оÑÐ³Ð°Ð½Ð¸Ð·Ð¼Ð°Ñ Ð¶Ð¸Ð²Ð¾ÑнÑÑ Ð¸ Ñеловека
- ÐÑименение железа в медиÑине и ÑаÑмакологии
- СеÑевÑе обзоÑÑ Ð¾ железе
- ÐиблиогÑаÑÐ¸Ñ Ð¿Ð¾ железÑ
Ðелезо как Ñ Ð¸Ð¼Ð¸ÑеÑкий ÑÐ»ÐµÐ¼ÐµÐ½Ñ (железо в Ñизико-Ñ Ð¸Ð¼Ð¸ÑеÑÐºÐ¸Ñ Ð¿ÑоÑеÑÑÐ°Ñ )
ÐÑом железа (кÑаÑкие ÑведениÑ)
Ðелезо (Fe — Ð¾Ñ Ð»Ð°Ñ. Ferrum) — Ñ
имиÑеÑкий ÑÐ»ÐµÐ¼ÐµÐ½Ñ VIII гÑÑÐ¿Ð¿Ñ Ð¿ÐµÑиодиÑеÑкой ÑиÑÑÐµÐ¼Ñ Ðенделеева;
аÑомнÑй Ð½Ð¾Ð¼ÐµÑ 26, аÑÐ¾Ð¼Ð½Ð°Ñ Ð¼Ð°ÑÑа 55,847; блеÑÑÑÑий ÑеÑебÑиÑÑо-белÑй плаÑÑиÑнÑй меÑалл.
ÐÐ»ÐµÐ¼ÐµÐ½Ñ Ð² пÑиÑоде ÑоÑÑÐ¾Ð¸Ñ Ð¸Ð· ÑеÑÑÑÑÑ ÑÑабилÑнÑÑ Ð¸Ð·Ð¾Ñопов: 54Fe (5,84%), 56Fe (91,68%), 57Fe (2,17%) и 58Fe (0,31%).
ФизиÑеÑкие и Ñ Ð¸Ð¼Ð¸ÑеÑкие ÑвойÑÑва железа
ÐнаÑение железа в ÑовÑеменной ÑеÑ
нике опÑеделÑеÑÑÑ Ð½Ðµ ÑолÑко его ÑиÑоким ÑаÑпÑоÑÑÑанением в пÑиÑоде,
но и ÑоÑеÑанием веÑÑма ÑеннÑÑ
ÑвойÑÑв.
Ðно плаÑÑиÑно, легко кÑеÑÑÑ ÐºÐ°Ðº в Ñ
олодном, Ñак и нагÑеÑом ÑоÑÑоÑнии, поддаÑÑÑÑ Ð¿ÑокаÑке, ÑÑамповке и волоÑениÑ.
СпоÑобноÑÑÑ ÑаÑÑвоÑÑÑÑ ÑглеÑод и дÑ. ÑлеменÑÑ ÑлÑÐ¶Ð¸Ñ Ð¾Ñновой Ð´Ð»Ñ Ð¿Ð¾Ð»ÑÑÐµÐ½Ð¸Ñ ÑазнообÑазнÑÑ
железнÑÑ
Ñплавов.
ÐÑомнÑе ÑвойÑÑва железа
- ÐопеÑеÑное ÑеÑение Ð·Ð°Ñ Ð²Ð°Ñа ÑепловÑÑ Ð½ÐµÐ¹ÑÑонов Ð´Ð»Ñ Ð¿ÑиÑодной ÑмеÑи изоÑопов — 2,62.10-28 [?] м2.
- ÐонÑигÑÑаÑÐ¸Ñ Ð²Ð½ÐµÑÐ½Ð¸Ñ ÑлекÑÑоннÑÑ Ð¾Ð±Ð¾Ð»Ð¾Ñек 3d64s2.
- СÑепени окиÑÐ»ÐµÐ½Ð¸Ñ +2 и +3 (наиболее Ñ Ð°ÑакÑеÑнÑ), +1, +4, +6, +8.
- ÐнеÑÐ³Ð¸Ñ Ð¸Ð¾Ð½Ð¸Ð·Ð°Ñии пÑи поÑледоваÑелÑном пеÑÐµÑ Ð¾Ð´Ðµ Ð¾Ñ Fe0 к Fe5+ 7,893, 16,183, 30,65, 57,79 ÑÐ.
- СÑодÑÑво к ÑлекÑÑÐ¾Ð½Ñ 0,58 ÑÐ.
- ÐлекÑÑооÑÑиÑаÑелÑноÑÑÑ Ð¿Ð¾ ÐÐ¾Ð»Ð¸Ð½Ð³Ñ 1,8.
- â ÐÑомнÑй ÑадиÑÑ 1,26 [0,126 нм?].
- ÐоннÑе ÑадиÑÑÑ (в нм, в ÑкобкаÑ
ÑÐºÐ°Ð·Ð°Ð½Ñ ÐºÐ¾Ð¾ÑдинаÑионнÑе ÑиÑла) [ÐоннÑе ÑадиÑÑÑ Fe2+ O,80, Fe3+ O,67 ?]:
- Ð´Ð»Ñ Fe2+ 0,077 (4), 0,092 (6), 0,106 (8);
- Ð´Ð»Ñ Fe3+ 0,063 (4), 0,079 (6), 0,092 (8).
ФизиÑеÑкие ÑвойÑÑва железа как веÑеÑÑва
ФизиÑеÑкие ÑвойÑÑва железа завиÑÑÑ Ð¾Ñ ÐµÐ³Ð¾ ÑиÑÑоÑÑ.
РпÑомÑÑленнÑÑ
ÑеÑÑо-маÑеÑиалаÑ
железÑ, как пÑавило, ÑопÑÑÑÑвÑÑÑ Ð¿ÑимеÑи
ÑглеÑода, азоÑа, киÑлоÑода, водоÑода, ÑеÑÑ, ÑоÑÑоÑа.
Ðаже пÑи оÑÐµÐ½Ñ Ð¼Ð°Ð»ÑÑ
конÑенÑÑаÑиÑÑ
ÑÑи пÑимеÑи ÑилÑно изменÑÑÑ ÑвойÑÑва меÑалла.
Так, ÑеÑа вÑзÑÐ²Ð°ÐµÑ Ñ. н. кÑаÑноломкоÑÑÑ, ÑоÑÑÐ¾Ñ (даже 10-20% Ð ) â Ñ
ладноломкоÑÑÑ;
ÑглеÑод и Ð°Ð·Ð¾Ñ ÑменÑÑаÑÑ Ð¿Ð»Ð°ÑÑиÑноÑÑÑ, а водоÑод ÑвелиÑÐ¸Ð²Ð°ÐµÑ Ñ
ÑÑпкоÑÑÑ Ð¶ÐµÐ»ÐµÐ·Ð° (Ñ.н. водоÑÐ¾Ð´Ð½Ð°Ñ Ñ
ÑÑпкоÑÑÑ).
Снижение ÑодеÑÐ¶Ð°Ð½Ð¸Ñ Ð¿ÑимеÑей до 10-7â10-9% пÑÐ¸Ð²Ð¾Ð´Ð¸Ñ Ðº ÑÑÑеÑÑвеннÑм изменениÑм ÑвойÑÑв меÑалла, в ÑаÑÑноÑÑи к повÑÑÐµÐ½Ð¸Ñ Ð¿Ð»Ð°ÑÑиÑноÑÑи.
Ðиже пÑиводÑÑÑÑ ÑизиÑеÑкие ÑвойÑÑва железа, оÑноÑÑÑиеÑÑ, в оÑновном, к меÑÐ°Ð»Ð»Ñ Ñ Ð¾Ð±Ñим ÑодеÑжанием пÑимеÑей менее 0,01% по маÑÑе:
- ÐлоÑноÑÑÑ (в г/Ñм3):
- a-Fe 7,87 (20â), 7,67 (600°С);
- g-Fe 7,59 (1000°С);
- d-Fe 7,409;
- жидкого железа 7,024 (1538°С), 6,962 (1600°С), 6,76 (1800°С).
УÑавнение ÑемпеÑаÑÑÑной завиÑимоÑÑи плоÑноÑÑи жидкого каÑбонилÑного железа: d = 8,618 — 8,83.10-4T г/Ñм3.
- ТемпеÑаÑÑÑа Ð¿Ð»Ð°Ð²Ð»ÐµÐ½Ð¸Ñ 1539°С [1535°С ?]. DH0 Ð¿Ð»Ð°Ð²Ð»ÐµÐ½Ð¸Ñ 16,6 кÐж/молÑ.
- ТемпеÑаÑÑÑа ÐºÐ¸Ð¿ÐµÐ½Ð¸Ñ Ð¾ÐºÐ¾Ð»Ð¾ 3200°С [2750°С ?]. DH0 иÑпаÑÐµÐ½Ð¸Ñ 354,3 кÐж/молÑ.
- ТемпеÑаÑÑÑнÑй коÑÑÑиÑÐ¸ÐµÐ½Ñ Ð»Ð¸Ð½ÐµÐ¹Ð½Ð¾Ð³Ð¾ ÑаÑÑиÑÐµÐ½Ð¸Ñ (20 °С) 11,7·10-6.
- ТеплопÑоводноÑÑÑ (25°С) 74,04 вÑ/(м·Ð) [0,177 (кал/Ñм·Ñек·гÑад)].
- ТеплоÑмкоÑÑÑ Ð¶ÐµÐ»ÐµÐ·Ð° завиÑÐ¸Ñ Ð¾Ñ ÐµÐ³Ð¾ ÑÑÑÑкÑÑÑÑ Ð¸ ÑложнÑм обÑазом изменÑеÑÑÑ Ñ ÑемпеÑаÑÑÑоq.
ТеплоемкоÑÑÑ Ð¼ÐµÐ´Ð»ÐµÐ½Ð½Ð¾ ÑвелиÑиваеÑÑÑ Ñ ÑоÑÑом ÑемпеÑаÑÑÑÑ Ð´Ð¾ 523 Ð,
заÑем Ñезко возÑаÑÑаеÑ, доÑÑÐ¸Ð³Ð°Ñ Ð¼Ð°ÐºÑимÑма в ÑоÑке ÐÑÑи, поÑле Ñего ÑнижаеÑÑÑ.
С0Ñ 25,14 Ðж/(молÑ.Ð); S0298 27,30 Ðж/(молÑ.Ð) [?].
СÑеднÑÑ ÑделÑÐ½Ð°Ñ ÑеплоÑмкоÑÑÑ (0-1000°С) 640,57 дж/(кг·Ð) [0,153 кал/(г·гÑад)]. - ТеплопÑоводноÑÑÑ [ÐÑ/(м.Ð)]:
- 132 (100 Ð), 80,3 (300 Ð), 69,4 (400 Ð), 32,6 (1000 Ð), 31,8 (1500 Ð);
- Ð´Ð»Ñ Ð°Ñмко-железа 74,7 (273 Ð), 72,8 (298 Ð), 67,6 (373 Ð).
- ÐÐ»Ñ 99,99%-ного железа g в аÑмоÑÑеÑе Ðе 1,72 Ð/м (1535°С);
динамиÑ. вÑзкоÑÑÑ Ð² инÑеÑвале 1535-1700°С изменÑеÑÑÑ Ð¾Ñ 6,8.10-4 до 5,6.10-4 Ðа.Ñ. - ÐÐ»Ñ 99,99%-ного железа r 0,0327 мкÐм.Ñм (4,2 Ð), 9,71 мкÐм.Ñм (293 Ð),
ÑемпеÑаÑÑÑнÑй коÑÑ. r 6,51.10-3 Ð-1 (273-373 Ð); - ÐодÑÐ»Ñ Ð®Ð½Ð³Ð° 190â210·103 Ðн/м.2 (19-21·103 кгÑ/мм2).
- ТемпеÑаÑÑÑнÑй коÑÑÑиÑÐ¸ÐµÐ½Ñ Ð¼Ð¾Ð´ÑÐ»Ñ Ð®Ð½Ð³Ð° 4·10-6.
- ÐодÑÐ»Ñ Ñдвига 84,0·103 Ðн/м2 [8,4·103 кгÑ/мм2].
- ÐÑаÑковÑÐµÐ¼ÐµÐ½Ð½Ð°Ñ Ð¿ÑоÑноÑÑÑ Ð½Ð° ÑазÑÑв 170-210 Ðн/м2 [17-21 кгÑ/мм2].
- ÐÑноÑиÑелÑное Ñдлинение 45â55%.
- ТвÑÑдоÑÑÑ Ð¿Ð¾ ÐÑÐ¸Ð½ÐµÐ»Ð»Ñ 350â450 Ðн/м2 [35â45 кгÑ/мм2].
- ÐÑедел ÑекÑÑеÑÑи 100 Ðн/м2 [10 кгÑ/мм2].
- УдаÑÐ½Ð°Ñ Ð²ÑзкоÑÑÑ 300 Ðн/м2 [30 кгÑ/мм2].
- УделÑное ÑлекÑÑиÑеÑкое ÑопÑоÑивление (20°С) 9,7·10-8 ом·м [9,7·10-6 ом·Ñм].
- ТемпеÑаÑÑÑнÑй коÑÑÑиÑÐ¸ÐµÐ½Ñ ÑлекÑÑиÑеÑкого ÑопÑоÑÐ¸Ð²Ð»ÐµÐ½Ð¸Ñ (0â100°С) 6,51·10-3.
- ТемпеÑаÑÑÑа пеÑÐµÑ Ð¾Ð´Ð° в ÑвеÑÑ Ð¿ÑоводÑÑее ÑоÑÑоÑние 0,1125 Ð.
- ÐагниÑÐ½Ð°Ñ Ð¿ÑониÑаемоÑÑÑ 1,45.106 (Ð´Ð»Ñ Ð¼Ð¾Ð½Ð¾ÐºÑиÑÑалла).
- ÐагниÑÐ½Ð°Ñ Ð¸Ð½Ð´ÑкÑÐ¸Ñ Ð½Ð°ÑÑÑÐµÐ½Ð¸Ñ 2,18 Тл.
- ÐоÑÑÑиÑÐ¸Ð²Ð½Ð°Ñ [?] Ñила 5-6 Ð/м (Ð´Ð»Ñ ÐºÐ°ÑбонилÑного железа).
- ÑÑ-ние ÑемпеÑаÑÑÑной завиÑимоÑÑи Ð´Ð°Ð²Ð»ÐµÐ½Ð¸Ñ Ð¿Ð°Ñа: lgp (в мм ÑÑ.ÑÑ.) = — 19710/T — l,271gT + 13,27 (1808-3023 Ð);
- ÑемпеÑаÑÑÑнÑй коÑÑ. линейного ÑаÑÑиÑÐµÐ½Ð¸Ñ 12.10-6 Ð-1 (298 Ð),
- ÑÑ-ние его ÑемпеÑаÑÑÑной завиÑимоÑÑи: a = 11,3.10-6 + 17,6.10-8t — 1,68.10-11t2 oС-1 (0-800°С).
- ÐÐ»Ñ Ð¾Ñобо ÑиÑÑого железа (
- Ñ-Ñа пеÑÐµÑ Ð¾Ð´Ð° в Ñ ÑÑпкое ÑоÑÑоÑние -85°С; Ð´Ð»Ñ ÑовеÑÑеннÑÑ ÐºÑиÑÑаллов («ÑÑов») s ÑаÑÑ [?] 13,4 ÐÐа.
- ТвеÑдоÑÑÑ Ð¿Ð¾ ÐооÑÑ 4-5.
- ÐÐ»Ñ Ð¾Ñожженного обÑазÑа оÑноÑиÑ. Ñдлинение 40-50%,
- модÑÐ»Ñ Ñдвига 76,4-78,4 ÐÐа,
- ÑвеÑдоÑÑÑ Ð¿Ð¾ ÐÑÐ¸Ð½ÐµÐ»Ð»Ñ 588-686 ÐÐа.
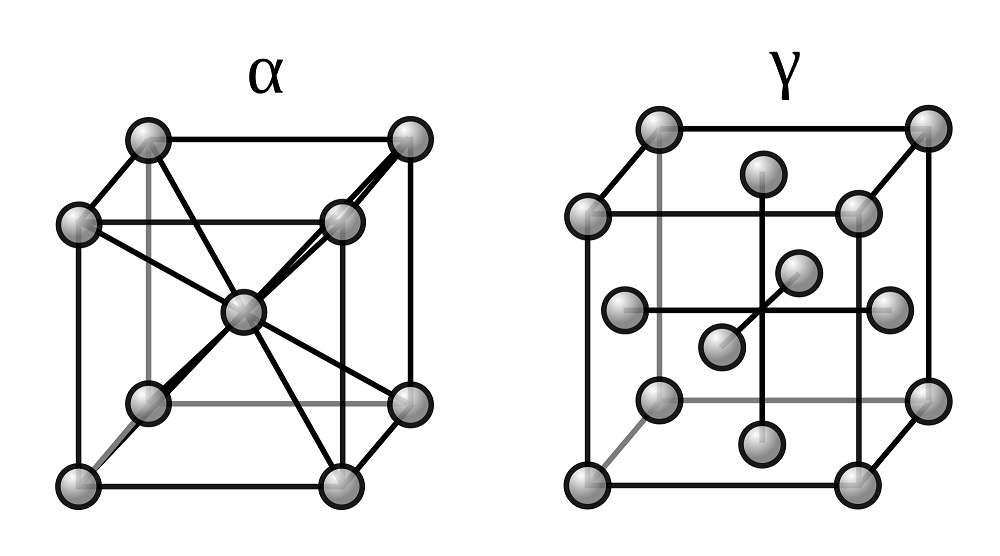
ÐÑиÑÑаллиÑеÑкие модиÑикаÑии железа
Ðелезо Ð¼Ð¾Ð¶ÐµÑ ÑÑÑеÑÑвоваÑÑ Ð² виде 2 кÑиÑÑаллиÑеÑкиÑ
ÑеÑÑÑок:
обÑÑмноÑенÑÑиÑованной кÑбиÑеÑкой (ÐЦÐ) и гÑанеÑенÑÑиÑованной кÑбиÑеÑкой (ÐЦÐ).
ÐÑего же, железо Ð¸Ð¼ÐµÐµÑ 5 кÑиÑÑаллиÑеÑкиÑ
модиÑикаÑий.
ÐÑи обÑÑном давлении железо ÑÑÑеÑÑвÑÐµÑ Ð² 4 кÑиÑÑаллиÑеÑÐºÐ¸Ñ Ð¼Ð¾Ð´Ð¸ÑикаÑиÑÑ :
- Ðо 769°С ÑÑÑеÑÑвÑÐµÑ ÑеÑÑомагниÑное a-Fe Ñ ÐЦР(а = 0,286645 нм пÑи 20°С, z = 2, пÑоÑÑÑанÑÑÐ²ÐµÐ½Ð½Ð°Ñ Ð³ÑÑппа Im3m).
- ÐÑи 769°С (ÑоÑка ÐÑÑи) a-Fe пеÑеÑ
Ð¾Ð´Ð¸Ñ Ð² паÑамагниÑное ÑоÑÑоÑние b-Fe
без Ð¸Ð·Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ñингонии и дÑ. ÑвойÑÑв, кÑоме магниÑнÑÑ .
DH0 пеÑÐµÑ Ð¾Ð´Ð° a:b 1,72 кÐж/молÑ.
ÐаÑамагниÑное железо b-Fe ÑÑÑойÑиво в инÑеÑвале 769-917°С. - РинÑеÑвале 917-1394°С ÑÑÑеÑÑвÑÐµÑ Ð¿Ð°ÑамагниÑное g-Fe Ñ ÐЦÐ
(пÑи 950°С а = 0,3656 нм, z = 4, пÑоÑÑÑанÑÑÐ²ÐµÐ½Ð½Ð°Ñ Ð³ÑÑппа Fm3m).
DH0 пеÑÐµÑ Ð¾Ð´Ð° b:g 0,91 кÐж/молÑ. - ÐÑÑе 1394°С ÑÑÑеÑÑвÑÐµÑ Ð¿Ð°ÑамагниÑное d-Fe Ñ ÐЦÐ
(пÑи 1425°С а = 0,293 нм, z = 2, пÑоÑÑÑанÑÑÐ²ÐµÐ½Ð½Ð°Ñ Ð³ÑÑппа Im3m).
DH0 пеÑÐµÑ Ð¾Ð´Ð° g:d 0,63 кÐж/молÑ.
ÐÑи вÑÑокиÑ
давлениÑÑ
ÑÑÑеÑÑвÑÐµÑ e-Fe Ñ Ð³ÐµÐºÑагониÑеÑкой плоÑноÑпакованной ÑеÑеÑкой,
коÑоÑое Ñакже обÑазÑеÑÑÑ Ð¸ пÑи ноÑмалÑном давлении пÑи легиÑовании железа ÑÑдом ÑлеменÑов.
ÐолимоÑÑнÑе пÑевÑаÑÐµÐ½Ð¸Ñ Ð¶ÐµÐ»ÐµÐ·Ð° и ÑÑали пÑи нагÑевании и Ð¾Ñ Ð»Ð°Ð¶Ð´ÐµÐ½Ð¸Ð¸ оÑкÑÑл в 1868 Ð. Ð. ЧеÑнов.
ХимиÑеÑкие ÑвойÑÑва и ÑÐ¾ÐµÐ´Ð¸Ð½ÐµÐ½Ð¸Ñ Ð¶ÐµÐ»ÐµÐ·Ð°

Ðелезо пÑоÑвлÑÐµÑ Ð¿ÐµÑеменнÑÑ Ð²Ð°Ð»ÐµÐ½ÑноÑÑÑ (наиболее ÑÑÑойÑÐ¸Ð²Ñ ÑÐ¾ÐµÐ´Ð¸Ð½ÐµÐ½Ð¸Ñ 2- и 3-валенÑного железа).
С киÑлоÑодом железо обÑазÑÐµÑ Ð·Ð°ÐºÐ¸ÑÑ FeO, окиÑÑ Fe2O3 и закиÑÑ-окиÑÑ Fe3O4 (Ñоединение FeO Ñ Fe2O3, имеÑÑее ÑÑÑÑкÑÑÑÑ Ñпинели).
Ðо влажном воздÑÑ
е пÑи обÑÑной ÑемпеÑаÑÑÑе железо покÑÑваеÑÑÑ ÑÑÑ
лой ÑжавÑиной (Fe2O3·nH2O).
ÐÑледÑÑвие Ñвоей поÑиÑÑоÑÑи ÑжавÑина не пÑепÑÑÑÑвÑÐµÑ Ð´Ð¾ÑÑÑÐ¿Ñ ÐºÐ¸ÑлоÑода и влаги к меÑаллÑ
и поÑÑÐ¾Ð¼Ñ Ð½Ðµ пÑедоÑ
ÑанÑÐµÑ ÐµÐ³Ð¾ Ð¾Ñ Ð´Ð°Ð»ÑнейÑего окиÑлениÑ.
Ð ÑезÑлÑÑаÑе ÑазлиÑнÑÑ
видов коÑÑозии ежегодно ÑеÑÑÑÑÑÑ Ð¼Ð¸Ð»Ð»Ð¸Ð¾Ð½Ñ Ñонн железа.
ÐÑи нагÑевании железа в ÑÑÑ
ом воздÑÑ
е вÑÑе 200°С оно покÑÑваеÑÑÑ ÑонÑайÑей окиÑной плÑнкой,
коÑоÑÐ°Ñ Ð·Ð°ÑиÑÐ°ÐµÑ Ð¼ÐµÑалл Ð¾Ñ ÐºÐ¾ÑÑозии пÑи обÑÑнÑÑ
ÑемпеÑаÑÑÑаÑ
; ÑÑо Ð»ÐµÐ¶Ð¸Ñ Ð² оÑнове ÑеÑ
ниÑеÑкого меÑода заÑиÑÑ Ð¶ÐµÐ»ÐµÐ·Ð° â воÑонениÑ.
ÐÑи нагÑевании в водÑном паÑе железо окиÑлÑеÑÑÑ Ñ Ð¾Ð±Ñазованием Fe3O4 (ниже 570°С) или FeO (вÑÑе 570°С) и вÑделением водоÑода.
Ð ÑÑÑ
ом воздÑÑ
е пÑи Ñ-ÑаÑ
до 200 °С на повеÑÑ
ноÑÑи компакÑного железа обÑазÑеÑÑÑ ÑонÑайÑÐ°Ñ Ð¾ÐºÑÐ¸Ð´Ð½Ð°Ñ Ð¿Ð»ÐµÐ½ÐºÐ°,
заÑиÑаÑÑÐ°Ñ Ð¼ÐµÑалл Ð¾Ñ Ð´Ð°Ð»ÑнейÑего окиÑлениÑ.
ÐÑÑе 200 °С ÑкоÑоÑÑÑ ÐºÐ¾ÑÑозии железа ÑвелиÑиваеÑÑÑ, обÑазÑеÑÑÑ Ñлой окалинÑ;
внÑÑÑ. зона ее ÑоÑÑÐ¾Ð¸Ñ Ð¸Ð· вÑÑÑиÑа FеxÐ (Ñ
= 0,89-0,95), повеÑÑ
него Ð»ÐµÐ¶Ð¸Ñ Ñлой Fe3O4, заÑем Fe2O3.
Ржавление железа (аÑмоÑÑеÑÐ½Ð°Ñ ÐºÐ¾ÑÑозиÑ) во влажном воздÑÑ
е, оÑобенно ÑодеÑжаÑем капли моÑÑкой водÑ, Ð¸Ð´ÐµÑ Ð±ÑÑÑÑее;
ÑжавÑина ÑодеÑÐ¶Ð¸Ñ Ñакже и гидÑокÑÐ¸Ð´Ñ Ð¶ÐµÐ»ÐµÐ·Ð°, в оÑновном FeO(OH).
ÐидÑоокиÑÑ Fe (OH)2 обÑазÑеÑÑÑ Ð² виде белого оÑадка пÑи дейÑÑвии едкиÑ
ÑелоÑей или аммиака
на воднÑе ÑаÑÑвоÑÑ Ñолей Fe2+ в аÑмоÑÑеÑе водоÑода или азоÑа.
ÐÑи ÑопÑикоÑновении Ñ Ð²Ð¾Ð·Ð´ÑÑ
ом Fe (OH)2 ÑпеÑва зеленееÑ, заÑем ÑеÑÐ½ÐµÐµÑ Ð¸ Ð½Ð°ÐºÐ¾Ð½ÐµÑ Ð±ÑÑÑÑо пеÑеÑ
Ð¾Ð´Ð¸Ñ Ð² кÑаÑно-бÑÑÑÑ Ð³Ð¸Ð´ÑоокиÑÑ Fe (OH)3.
ÐакиÑÑ FeO пÑоÑвлÑÐµÑ Ð¾ÑновнÑе ÑвойÑÑва.
ÐкиÑÑ Fe2O3 амÑоÑеÑна и Ð¾Ð±Ð»Ð°Ð´Ð°ÐµÑ Ñлабо вÑÑаженной киÑлоÑной ÑÑнкÑией; ÑеагиÑÑÑ Ñ Ð±Ð¾Ð»ÐµÐµ оÑновнÑми окиÑлами (напÑимеÑ, Ñ MgO),
она обÑазÑÐµÑ ÑеÑÑиÑÑ â ÑÐ¾ÐµÐ´Ð¸Ð½ÐµÐ½Ð¸Ñ Ñипа Fe2O3·nMeO, имеÑÑие ÑеÑÑомагниÑнÑе ÑвойÑÑва и ÑиÑоко пÑименÑÑÑиеÑÑ Ð² ÑадиоÑлекÑÑонике.
ÐиÑлоÑнÑе ÑвойÑÑва вÑÑÐ°Ð¶ÐµÐ½Ñ Ð¸ Ñ 6-валенÑного железа, ÑÑÑеÑÑвÑÑÑего в виде ÑеÑÑаÑов, напÑÐ¸Ð¼ÐµÑ K2FeO4,
Ñолей не вÑделенной в Ñвободном ÑоÑÑоÑнии железной киÑлоÑÑ.
Ðелезо легко ÑеагиÑÑÐµÑ Ñ Ð³Ð°Ð»Ð¾Ð³ÐµÐ½Ð°Ð¼Ð¸ и галогеноводоÑодами, Ð´Ð°Ð²Ð°Ñ Ñоли, напÑÐ¸Ð¼ÐµÑ Ñ
лоÑÐ¸Ð´Ñ FeCl2 и FeCl3.
ÐÑи нагÑевании железо оÑобенно легко ÑеагиÑÑÐµÑ Ñ Ð¡l2, Ñ. к. обÑазÑÑÑийÑÑ FeCl3 леÑÑÑ
и не ÑÐ¾Ð·Ð´Ð°ÐµÑ Ð½Ð° повеÑÑ
ноÑÑи меÑалла заÑиÑной пленки.
ÐапÑоÑив, FeF3 нелеÑÑÑ, поÑÑÐ¾Ð¼Ñ ÐºÐ¾Ð¼Ð¿Ð°ÐºÑное железо ÑÑÑойÑиво к дейÑÑÐ²Ð¸Ñ F2 до 250-300 °С.
ÐÑи нагÑевании железа Ñ ÑеÑой обÑазÑÑÑÑÑ ÑÑлÑÑÐ¸Ð´Ñ FeS и FeS2.
Ð -ÑÐ¸Ñ Ð¶ÐµÐ»ÐµÐ·Ð° Ñ S ÑкзоÑеÑмиÑна, наÑинаеÑÑÑ Ð¿Ñи Ñлабом нагÑевании, пÑи ÑÑом обÑазÑеÑÑÑ
неÑÑеÑ
иомеÑÑиÑеÑкий ÑÑлÑÑид, близкий по ÑоÑÑÐ°Ð²Ñ Ðº FeS.
РпÑиÑоде ÑаÑпÑоÑÑÑанен минеÑал пиÑÐ¸Ñ FeS2.
ÐзоÑ, подобно ÑглеÑодÑ, даÑÑ Ñ Ð¶ÐµÐ»ÐµÐ·Ð¾Ð¼ ÑвÑÑдÑе ÑаÑÑвоÑÑ Ð²Ð½ÐµÐ´ÑениÑ; из Ð½Ð¸Ñ Ð²ÑделÑÑÑÑÑ Ð½Ð¸ÑÑÐ¸Ð´Ñ Fe4N и Fe2N.
С водоÑодом железо даÑÑ Ð»Ð¸ÑÑ Ð¼Ð°Ð»Ð¾ÑÑÑойÑивÑе гидÑидÑ, ÑоÑÑав коÑоÑÑÑ ÑоÑно не ÑÑÑановлен.
ÐÑи нагÑевании железо ÑнеÑгиÑно ÑеагиÑÑÐµÑ Ñ ÐºÑемнием и ÑоÑÑоÑом, обÑазÑÑ ÑилиÑÐ¸Ð´Ñ (напÑимеÑ, Fe3Si) и ÑоÑÑÐ¸Ð´Ñ (напÑимеÑ, Fe3P).
Ð¡Ð¾ÐµÐ´Ð¸Ð½ÐµÐ½Ð¸Ñ Ð¶ÐµÐ»ÐµÐ·Ð° Ñ Ð¼Ð½Ð¾Ð³Ð¸Ð¼Ð¸ ÑлеменÑами (Ð, S и дÑ.), обÑазÑÑÑие кÑиÑÑаллиÑеÑкÑÑ ÑÑÑÑкÑÑÑÑ,
имеÑÑ Ð¿ÐµÑеменнÑй ÑоÑÑав (Ñак, ÑодеÑжание ÑеÑÑ Ð² моноÑÑлÑÑиде Ð¼Ð¾Ð¶ÐµÑ ÐºÐ¾Ð»ÐµÐ±Ð°ÑÑÑÑ Ð¾Ñ 50 до 53,3 аÑ.%).
ÐÑо обÑÑловлено деÑекÑами кÑиÑÑаллиÑеÑкой ÑÑÑÑкÑÑÑÑ.
ÐапÑимеÑ, в закиÑи железа ÑаÑÑÑ Ð¸Ð¾Ð½Ð¾Ð² Fe2+ в ÑзлаÑ
ÑеÑÑÑки замеÑена ионами Fe3+;
Ð´Ð»Ñ ÑоÑ
ÑÐ°Ð½ÐµÐ½Ð¸Ñ ÑлекÑÑонейÑÑалÑноÑÑи некоÑоÑÑе ÑÐ·Ð»Ñ ÑеÑÑÑки, пÑинадлежавÑие ионам Fe2+,
оÑÑаÑÑÑÑ Ð¿ÑÑÑÑми и Ñаза (вÑÑÑиÑ) [?] в обÑÑнÑÑ
ÑÑловиÑÑ
Ð¸Ð¼ÐµÐµÑ ÑоÑмÑÐ»Ñ Fe0,947O.
СвоеобÑазно взаимодейÑÑвие железо Ñ Ð°Ð·Ð¾Ñной киÑлоÑой.
ÐонÑенÑÑиÑÐ¾Ð²Ð°Ð½Ð½Ð°Ñ HNO3 (плоÑноÑÑÑ 1,45 г/Ñм3) паÑÑивиÑÑÐµÑ Ð¶ÐµÐ»ÐµÐ·Ð¾
вÑледÑÑвие Ð²Ð¾Ð·Ð½Ð¸ÐºÐ½Ð¾Ð²ÐµÐ½Ð¸Ñ Ð½Ð° его повеÑÑ
ноÑÑи заÑиÑной окиÑной плÑнки;
более ÑÐ°Ð·Ð±Ð°Ð²Ð»ÐµÐ½Ð½Ð°Ñ HNO3 ÑаÑÑвоÑÑÐµÑ Ð¶ÐµÐ»ÐµÐ·Ð¾ Ñ Ð¾Ð±Ñазованием ионов Fe2+ или Fe3+, воÑÑÑанавливаÑÑÑ Ð´Ð¾ MH3 или N2O и N2.
Ðелезо обÑазÑÐµÑ Ð´Ð²Ð° ÑÑда Ñолей — Ñоед. Fe(II) и Fe(III).
Соли Fe(II) гидÑолизÑÑÑÑÑ, в ÑиÑле пÑодÑкÑов гидÑолиза обÑазÑÑÑÑÑ Ñазл. полиÑдеÑнÑе комплекÑÑ; на воздÑÑ
е окиÑлÑÑÑÑÑ Ð´Ð¾ Fe(III).
Ðолее ÑÑÑойÑÐ¸Ð²Ñ Ð´Ð²Ð¾Ð¹Ð½Ñе Ñоли, напÑ., ÑÐ¾Ð»Ñ ÐоÑа FeSO4.(NH4)2SO4.6H2O, и комплекÑнÑе.
Рводном Ñ-Ñе Fe2+ обÑазÑÐµÑ Ð°ÐºÐ²Ð°ÐºÐ¾Ð¼Ð¿Ð»ÐµÐºÑÑ, напÑ., ÑоÑÑава [Fe(H2O)6]2+ , ÑаÑÑо ÑоÑ
ÑанÑÑÑиеÑÑ Ð¸ в вÑÑÑиÑ
кÑиÑÑаллогидÑаÑаÑ
Ñолей.
Ð -ÑÑ Ñолей Fe2+ пÑакÑиÑеÑки беÑÑвеÑнÑ, Ñ. к. окÑаÑка [Fe(H2O)6]2+ оÑÐµÐ½Ñ ÑÐ»Ð°Ð±Ð°Ñ (зеленоваÑаÑ).
ÐÑи дейÑÑвии Na2CO3 на Ñ-ÑÑ Fe2+ оÑаждаеÑÑÑ ÐºÐ°ÑÐ±Ð¾Ð½Ð°Ñ FeCO3, коÑоÑÑй пÑи дейÑÑвии избÑÑка СÐ2 пеÑеÑ
Ð¾Ð´Ð¸Ñ Ð² Ñ-Ñ Ð² виде Fe(HCO3)2.
Ðаиб. пÑоÑнÑе комплекÑÑ Fe(II) — ÑианиÑÑÑе, напÑ. K4[Fe(CN)6].
Соли Fe(II) — воÑÑÑановиÑели в воднÑÑ
Ñ-ÑаÑ
.
Соли Fe(III) обÑазÑÑÑÑÑ Ð¿Ñи окиÑлении Ñолей Fe(II) и дÑ. ÑпоÑобами;
гидÑолизÑÑÑÑÑ (Ñ Ð¾Ð±Ñазованием Ñазл. полиÑдеÑнÑÑ
комплекÑов) ÑилÑнее, Ñем Ñоли Fe(II).
ÐидÑаÑиÑ. ион Fe3+ поÑÑи беÑÑвеÑен, но Ñ-ÑÑ Ñолей Fe3+ обÑÑно имеÑÑ Ð±ÑÑÑÑ Ð¾ÐºÑаÑÐºÑ Ð¸Ð·-за обÑÐ°Ð·Ð¾Ð²Ð°Ð½Ð¸Ñ Ð³Ð¸Ð´ÑокÑоÑоединений.
Ð -ÑÑ Fe3+ Ñ MNCS даÑÑ ÐºÑоваво-кÑаÑнÑй Ñ-Ñ ÑиоÑианаÑа Fe(NCS)3, Ñ K4[Fe(CN)6] —
ÑÑко-Ñиний оÑадок беÑлинÑкой лазÑÑи (ÑÑÑнбÑлевой Ñини) пÑиблизиÑелÑного ÑоÑÑава KFeIII[FeII(CN)6].
ÐÑи взаимод. Ñ-Ñов Ñолей Fe(III) Ñ (NH4)2C2O4 обÑазÑеÑÑÑ Ð¾ÐºÑÐ°Ð»Ð°Ñ Fe2(C2O4)3 (Ñ. Ñазл. 100°С),
пÑименÑемÑй Ð´Ð»Ñ Ð¿Ð¾Ð»ÑÑÐµÐ½Ð¸Ñ ÑвеÑокопиÑовалÑной бÑмаги.
СÑлÑÑÐ°Ñ Fe(III) обÑазÑÐµÑ Ð´Ð²Ð¾Ð¹Ð½Ñе ÑÑлÑÑаÑÑ.
ÐмминокомплекÑÑ Fe(II) и Fe(III) обÑазÑÑÑÑÑ Ð¿Ñи дейÑÑвии NH3 на безводнÑе Ñоли; водой ÑазлагаÑÑÑÑ.
СÑÐµÐ¿ÐµÐ½Ñ Ð¾ÐºÐ¸ÑÐ»ÐµÐ½Ð¸Ñ +6 железо пÑоÑвлÑÐµÑ Ð² ÑеÑÑаÑаÑ
(VI), напÑ. BaFeO4, K2FeO4, +4 — в ÑеÑÑаниÑÑозиле Fe(NO)4,
коÑоÑÑй обÑазÑеÑÑÑ Ð¿Ñи дейÑÑвии NO на железо пÑи повÑÑенном давлении, и ÑеÑÑаÑаÑ
(IV) ÑоÑÑавов MIIFeO3, MI2FeO3, MI4FeO4,
легко обÑазÑÑÑиÑ
ÑÑ Ð² воднÑÑ
ÑелоÑнÑÑ
ÑÑедаÑ
пÑи окиÑлении Ð2.
ÐÑи анодном ÑаÑÑвоÑении железа пÑи вÑÑÐ¾ÐºÐ¸Ñ Ð¿Ð»Ð¾ÑноÑÑÑÑ Ñока обÑазÑеÑÑÑ ÑеÑÑаÑ(VШ) неопÑеделенного ÑоÑÑава.
РаÑÑвоÑÑ Ð¶ÐµÐ»ÐµÐ·Ð°
Ðелезо — меÑалл ÑмеÑенной Ñ Ð¸Ð¼Ð¸ÑеÑкой акÑивноÑÑи.
СÑандаÑÑнÑй ÑлекÑÑоднÑй поÑенÑиал Fe2+/Fe0 -0,447 Ð, Fe3+/Fe0 -0,037 Ð, Fе3+/Fе2+ +0,771 Ð.
ÐоÑмалÑнÑй ÑлекÑÑоднÑй поÑенÑиал железа в воднÑÑ
ÑаÑÑвоÑаÑ
его Ñолей Ð´Ð»Ñ ÑеакÑии ÑоÑÑавлÑÐµÑ â 0,44 в,
а Ð´Ð»Ñ ÑеакÑии Ñавен â 0,036 в. Т. о., в ÑÑÐ´Ñ Ð°ÐºÑивноÑÑей железо ÑÑÐ¾Ð¸Ñ Ð»ÐµÐ²ÐµÐµ водоÑода.
Ðно легко ÑаÑÑвоÑÑеÑÑÑ Ð² ÑазбавленнÑÑ ÐºÐ¸ÑлоÑÐ°Ñ Ñ Ð²Ñделением H2 и обÑазованием ионов Fe2+.
Ðелезо не ÑаÑÑв. в воде и Ñ-ÑаÑ
Ñ
олоднÑÑ
ÑелоÑей, ÑеагиÑÑÐµÑ Ñ ÑазбавленнÑми киÑлоÑами, обÑазÑÑ Ñоли Fe(II), и гоÑÑÑими конÑ. Ñ-Ñами ÑелоÑей.
ÐонÑ. HNO3 и H2SO4 паÑÑивиÑÑÑÑ Ð¶ÐµÐ»ÐµÐ·Ð¾ благодаÑÑ Ð¾Ð±ÑÐ°Ð·Ð¾Ð²Ð°Ð½Ð¸Ñ Ð½ÐµÑаÑÑвоÑимой в киÑлоÑаÑ
окÑидной пленки.
РаÑÑвоÑÑ Ñолей 2-валенÑного железа на воздÑÑ
е неÑÑÑойÑÐ¸Ð²Ñ â Fe2+ поÑÑепенно окиÑлÑеÑÑÑ Ð´Ð¾ Fe3+.
ÐоднÑе ÑаÑÑвоÑÑ Ñолей железа вÑледÑÑвие гидÑолиза имеÑÑ ÐºÐ¸ÑлÑÑ ÑеакÑиÑ.
Ðобавление к ÑаÑÑвоÑам Ñолей Fe3+ ÑиоÑианаÑ-ионов SCN- даÑÑ ÑÑкÑÑ ÐºÑоваво-кÑаÑнÑÑ Ð¾ÐºÑаÑкÑ
вÑледÑÑвие Ð²Ð¾Ð·Ð½Ð¸ÐºÐ½Ð¾Ð²ÐµÐ½Ð¸Ñ Fe (SCN)3, ÑÑо позволÑÐµÑ Ð¾ÑкÑÑваÑÑ Ð¿ÑиÑÑÑÑÑвие 1 ÑаÑÑи Fe3+ пÑимеÑно в 106 ÑаÑÑÑÑ
водÑ.
ÐÐ»Ñ Ð¶ÐµÐ»ÐµÐ·Ð° Ñ Ð°ÑакÑеÑно обÑазование комплекÑнÑÑ Ñоединений.
Ðидкое железо неогÑаниÑенно ÑаÑÑвоÑÑÐµÑ Al, Cu, Mn, Ni, Co, Si, Ti,
Ñ
оÑоÑо ÑаÑÑвоÑÑÐµÑ V, Сr и Pt,
огÑаниÑенно — Mo, Sn, С, S, P, As, H2, N2, Ð2, не ÑаÑÑвоÑÑÐµÑ Pb, Ag, Bi.
ÐÐ·Ð¾Ñ Ð² малÑÑ
конÑенÑÑаÑиÑÑ
обÑазÑÐµÑ Ñ Ð¶ÐµÐ»ÐµÐ·Ð¾Ð¼ ÑвеÑдÑе Ñ-ÑÑ Ð²Ð½ÐµÐ´ÑениÑ, в болÑÑиÑ
— ниÑÑÐ¸Ð´Ñ Fe2N и дÑ.
ÐÑи ноÑмалÑном давлении ок. 917°С Ñ-ÑимоÑÑÑ N2 в a-Fe до 0,01 аÑ. %, в g-Fe ок. 0,1 аÑ. %.
Ðелезо ÑпоÑобно поглоÑаÑÑ Ð2 пÑи ÑÑавлении киÑлоÑами и в пÑоÑеÑÑе каÑодного вÑÐ´ÐµÐ»ÐµÐ½Ð¸Ñ Ð¶ÐµÐ»ÐµÐ·Ð° пÑи ÑлекÑÑолизе.
ÐдÑоÑбиÑÑÑÑÑ Ð½Ð° деÑекÑаÑ
ÑÑÑÑкÑÑÑÑ, водоÑод Ñезко ÑÐ½Ð¸Ð¶Ð°ÐµÑ Ð¿ÑоÑноÑÑÑ Ð¸ плаÑÑиÑноÑÑÑ Ð¶ÐµÐ»ÐµÐ·Ð° (Ñ. наз. водоÑÐ¾Ð´Ð½Ð°Ñ Ñ
ÑÑпкоÑÑÑ).
ТвеÑдое железо поглоÑÐ°ÐµÑ Ð2 Ñ Ð¾Ð±Ñазованием ÑвеÑдÑÑ
Ñ-Ñов внедÑениÑ.
Ð -ÑимоÑÑÑ Ð2 в железе пÑи комнаÑной Ñ-Ñе менее 0,005%, в ÑаÑплавленном железе — поÑÑи в 25 Ñаз болÑÑе.
ÐидÑÐ¸Ð´Ñ Ð¶ÐµÐ»ÐµÐ·Ð° ÑÑÑеÑÑвÑÑÑ ÑолÑко пÑи вÑÑокиÑ
давлениÑÑ
Ð2; извеÑÑÐ½Ñ Ð³Ð¸Ð´ÑÐ¸Ð´Ñ Ð¸Ð½ÑеÑмеÑаллидов железа, напÑ. TiFeH2.
С СРжелезо обÑазÑÐµÑ Ð¶ÐµÐ»ÐµÐ·Ð° каÑбонилÑ, в коÑоÑÑÑ
железо ÑоÑмалÑно пÑоÑвлÑÐµÑ Ð½ÑлевÑÑ ÑÑÐµÐ¿ÐµÐ½Ñ Ð¾ÐºÐ¸ÑлениÑ.
ФоÑÑÐ¾Ñ Ð¿Ñи малÑÑ
конÑенÑÑаÑиÑÑ
Ð´Ð°ÐµÑ Ñ Ð¶ÐµÐ»ÐµÐ·Ð¾Ð¼ огÑаниÑеннÑе ÑвеÑдÑе ÑаÑÑвоÑÑ,
пÑи болÑÑиÑ
конÑенÑÑаÑиÑÑ
— ÑоÑÑидÑ, из коÑоÑÑÑ
наиб. ÑÑÑойÑÐ¸Ð²Ñ Fe3P, Fe2P, FeP и FeP2.
ТвÑÑдÑе ÑаÑÑвоÑÑ Ð²Ð½ÐµÐ´ÑÐµÐ½Ð¸Ñ Ð¶ÐµÐ»ÐµÐ·Ð° Ñ ÑглеÑодом
УглеÑод обÑазÑÐµÑ Ñ Ð¶ÐµÐ»ÐµÐ·Ð¾Ð¼ ÑвеÑдÑе ÑаÑÑвоÑÑ Ð²Ð½ÐµÐ´ÑÐµÐ½Ð¸Ñ — ÑеÑÑÐ¸Ñ Ð¸ маÑÑенÑÐ¸Ñ Ñ a-Fe, аÑÑÑÐµÐ½Ð¸Ñ Ñ g-Fe.
РниÑ
аÑÐ¾Ð¼Ñ Ð¡, имеÑÑие неболÑÑой аÑомнÑй ÑадиÑÑ (0,77), ÑазмеÑаÑÑÑÑ Ð² междоÑзлиÑÑ
кÑиÑÑаллиÑеÑкой ÑеÑÑÑки меÑалла,
ÑоÑÑоÑÑей из более кÑÑпнÑÑ
аÑомов (аÑомнÑй ÑадиÑÑ Fe 1,26).
ТвÑÑдÑй ÑаÑÑÐ²Ð¾Ñ ÑглеÑода в g-Fe назÑваеÑÑÑ Ð°ÑÑÑениÑом, а в a-Fe â ÑеÑÑиÑом.
ÐаÑÑÑеннÑй ÑвÑÑдÑй ÑаÑÑÐ²Ð¾Ñ ÑглеÑода в g-Fe ÑодеÑÐ¶Ð¸Ñ 2,0% С по маÑÑе пÑи 1130°С;
a-Fe ÑаÑÑвоÑÑÐµÑ Ð²Ñего 0,02â 0,04%С пÑи 723°С, и менее 0,01% пÑи комнаÑной ÑемпеÑаÑÑÑе.
ÐоÑÑÐ¾Ð¼Ñ Ð¿Ñи закалке аÑÑÑениÑа обÑазÑеÑÑÑ Ð¼Ð°ÑÑенÑÐ¸Ñ â пеÑеÑÑÑеннÑй ÑвÑÑдÑй ÑаÑÑÐ²Ð¾Ñ ÑглеÑода в a-Fe, оÑÐµÐ½Ñ ÑвÑÑдÑй и Ñ
ÑÑпкий.
Ð ÑÐ¿Ð»Ð°Ð²Ð°Ñ Ð¶ÐµÐ»ÐµÐ·Ð° ÑглеÑод пÑиÑÑÑÑÑвÑÐµÑ Ñакже в виде гÑаÑиÑа и ÑеменÑиÑа Fe3C.
РзавиÑимоÑÑи Ð¾Ñ ÑодеÑÐ¶Ð°Ð½Ð¸Ñ Ð¡ в железе ÑазлиÑаÑÑ:
мÑгкое железо (ÑÑÐ°Ð»Ñ (0,2-1,7% С)
и ÑÑгÑн (1,7-5% С).
СоÑеÑание закалки Ñ Ð¾ÑпÑÑком (нагÑевом до оÑноÑиÑелÑно низкиÑ
ÑемпеÑаÑÑÑ Ð´Ð»Ñ ÑменÑÑÐµÐ½Ð¸Ñ Ð²Ð½ÑÑÑенниÑ
напÑÑжений)
позволÑÐµÑ Ð¿ÑидаÑÑ ÑÑали ÑÑебÑемое ÑоÑеÑание ÑвÑÑдоÑÑи и плаÑÑиÑноÑÑи
.
ÐаÑÐ±Ð¸Ð´Ñ Ð¶ÐµÐ»ÐµÐ·Ð° â Fe3C (ÑеменÑиÑ) и Fe2C (e-каÑбид) â вÑпадаÑÑ Ð¸Ð· ÑвÑÑдÑÑ
ÑаÑÑвоÑов ÑглеÑода в железе пÑи оÑ
лаждении.
Fe3C вÑделÑеÑÑÑ Ñакже из ÑаÑÑвоÑов ÑглеÑода в жидком железе пÑи вÑÑокиÑ
конÑенÑÑаÑиÑÑ
С.
Ðелезо как минеÑал (железо в геологии)
РаÑпÑоÑÑÑанение железа
Ðо ÑодеÑÐ¶Ð°Ð½Ð¸Ñ Ð² лиÑоÑÑеÑе (4,65% по маÑÑе) железо Ð·Ð°Ð½Ð¸Ð¼Ð°ÐµÑ Ð²ÑоÑое меÑÑо ÑÑеди меÑаллов (на пеÑвом — алÑминий).
ÐÑо один из ÑамÑÑ
ÑаÑпÑоÑÑÑаненнÑÑ
ÑлеменÑов в пÑиÑоде.
Ðно пÑÐ¸Ð½Ð¸Ð¼Ð°ÐµÑ Ð°ÐºÑивное ÑÑаÑÑие в магмаÑиÑеÑкиÑ
, гидÑоÑеÑмалÑнÑÑ
и гипеÑгеннÑÑ
пÑоÑеÑÑаÑ
,
Ñ ÐºÐ¾ÑоÑÑми ÑвÑзано обÑазование ÑазлиÑнÑÑ
Ñипов его меÑÑоÑождений железнÑÑ
ÑÑд.
ÐнеÑгиÑно мигÑиÑÑÑ Ð² земной коÑе, железо обÑазÑÐµÑ ÑвÑÑе 300 минеÑалов
(окиÑлÑ, ÑÑлÑÑидÑ, ÑиликаÑÑ, каÑбонаÑÑ, ÑиÑанаÑÑ, ÑоÑÑаÑÑ Ð¸ Ñ. д.).
ÐажнÑÑ ÑÐ¾Ð»Ñ Ð² Ð³ÐµÐ¾Ñ Ð¸Ð¼Ð¸Ð¸ железа игÑаÑÑ Ð¾ÐºÐ¸ÑлиÑелÑно-воÑÑÑановиÑелÑнÑе ÑеакÑии â пеÑÐµÑ Ð¾Ð´ 2-валенÑного железа в 3-валенÑное и обÑаÑно.
РбиоÑÑеÑе пÑи налиÑии оÑганиÑеÑкиÑ
веÑеÑÑв Fe3+ воÑÑÑанавливаеÑÑÑ Ð´Ð¾ Fe2+ и легко мигÑиÑÑеÑ,
а пÑи вÑÑÑеÑе Ñ ÐºÐ¸ÑлоÑодом воздÑÑ
а Fe2+ окиÑлÑеÑÑÑ, обÑазÑÑ ÑÐºÐ¾Ð¿Ð»ÐµÐ½Ð¸Ñ Ð³Ð¸Ð´ÑоокиÑей 3-валенÑного железа.
ШиÑоко ÑаÑпÑоÑÑÑанÑннÑе ÑÐ¾ÐµÐ´Ð¸Ð½ÐµÐ½Ð¸Ñ 3-валенÑного железа имеÑÑ ÐºÑаÑнÑй, жÑлÑÑй, бÑÑÑй ÑвеÑа.
ÐÑим опÑеделÑеÑÑÑ Ð¾ÐºÑаÑка многиÑ
оÑадоÑнÑÑ
гоÑнÑÑ
поÑод и иÑ
наименование â
«ÐºÑаÑно-ÑвеÑÐ½Ð°Ñ ÑоÑмаÑиѻ (кÑаÑнÑе и бÑÑÑе ÑÑглинки и глинÑ, жÑлÑÑе пеÑки и Ñ. д.).
Ðелезо â меÑалл земнÑÑ
глÑбин, оно накапливаеÑÑÑ Ð½Ð° ÑанниÑ
ÑÑапаÑ
кÑиÑÑаллизаÑии магмÑ,
в ÑлÑÑÑаоÑновнÑÑ
(9,85%) и оÑновнÑÑ
(8,56%) поÑодаÑ
(в гÑаниÑаÑ
его вÑего 2,7%).
РбиоÑÑеÑе железо накапливаеÑÑÑ Ð²Ð¾ Ð¼Ð½Ð¾Ð³Ð¸Ñ Ð¼Ð¾ÑÑÐºÐ¸Ñ Ð¸ конÑиненÑалÑнÑÑ Ð¾ÑÐ°Ð´ÐºÐ°Ñ , обÑазÑÑ Ð¾ÑадоÑнÑе ÑÑдÑ.
Ðелезо Ð²Ñ Ð¾Ð´Ð¸Ñ Ð² ÑоÑÑав гемоглобина.
Ð¢Ð¸Ð¿Ñ Ð¶ÐµÐ»ÐµÐ·Ð½ÑÑ ÑÑд
ÐÑомÑÑленное знаÑение имеÑÑ ÑÑÐ´Ñ Ñ ÑодеÑжанием Fe ÑвÑÑе 16%.
ÐоÑÑÐ¾Ð¼Ñ Ð²Ð°Ð¶Ð½ÐµÐ¹Ñими ÑÑднÑми минеÑалами железа ÑвлÑÑÑÑÑ:
- магнеÑÐ¸Ñ (магниÑнÑй железнÑк) Fe3O4 (ÑодеÑÐ¶Ð¸Ñ 72,4% Fe),
- гемаÑÐ¸Ñ (железнÑй блеÑк, кÑаÑнÑй железнÑк) Fe2O3 (70% Fe),
- гÑÑÐ¸Ñ a-FeO(OH), или Fe2O3.H2O,
- лепидокÑÐ¾ÐºÐ¸Ñ g-FeO(OH) и гидÑогÑÑÐ¸Ñ (лимониÑ) Fe2O3.xH2O (ок. 62% Fe),
- ÑидеÑÐ¸Ñ FeCO3 (48,2% Fe),
- илÑÐ¼ÐµÐ½Ð¸Ñ FeTiO3 (36,8% Fe).
ÐаÑÑÐ´Ñ Ñ Ð¿Ð¾Ð»ÐµÐ·Ð½Ñми пÑимеÑÑми — Mn, Cr, Ni, Ti, V, Co — железнÑе ÑÑÐ´Ñ ÑодеÑÐ¶Ð°Ñ Ð¸ вÑеднÑе пÑимеÑи — S, P и дÑ.
Ðелезо вÑ
Ð¾Ð´Ð¸Ñ Ð² ÑоÑÑав пÑиÑ. ÑиликаÑов, знаÑиÑелÑнÑе ÑÐºÐ¾Ð¿Ð»ÐµÐ½Ð¸Ñ ÐºÐ¾ÑоÑÑÑ
могÑÑ Ð¸Ð¼ÐµÑÑ Ð¿Ñом. знаÑение Ð´Ð»Ñ Ð¿Ñоиз-ва железа или его Ñоед.
РазлиÑаÑÑ Ñлед. оÑн. ÑÐ¸Ð¿Ñ Ð¶ÐµÐ»ÐµÐ·Ð½ÑÑ ÑÑд.
- ÐÑÑÑе железнÑки — ÑÑÐ´Ñ Ð³Ð¸Ð´ÑокÑидов Fe(III) (главнÑй минеÑал — гÑÑиÑ); ÑодеÑÐ¶Ð°Ñ Ð´Ð¾ 66,1% Fe (ÑаÑе 30-55%);
имеÑÑ Ð¾ÑадоÑное пÑоиÑÑ Ð¾Ð¶Ð´ÐµÐ½Ð¸Ðµ. ÐÑÑпнейÑие меÑÑоÑÐ¾Ð¶Ð´ÐµÐ½Ð¸Ñ Ð² СССР, во ФÑанÑии, в Ðвинее. - ÐемаÑиÑовÑе ÑÑдÑ, или кÑаÑнÑе железнÑки (главнÑй минеÑал — гемаÑиÑ); ÑодеÑÐ¶Ð°Ñ Ð¾Ð±ÑÑно 50-65% Fe.
ÐÐ»Ñ Ð½Ð¸Ñ Ñ Ð°ÑакÑеÑно залегание богаÑÑÑ ÑÑд повеÑÑ Ð¼Ð¾ÑнÑÑ ÑÐ¾Ð»Ñ Ð±ÐµÐ´Ð½ÑÑ (30-40% Fe) магнеÑиÑовÑÑ ÐºÐ²Ð°ÑÑиÑов.
ÐÑÑпнейÑие меÑÑоÑÐ¾Ð¶Ð´ÐµÐ½Ð¸Ñ Ð² СССР, СШÐ, Ðанаде, ÐÑазилии, ÐенеÑÑÑле. - ÐагнеÑиÑовÑе ÑÑдÑ, или магниÑнÑе железнÑки (главнÑй минеÑал -магнеÑиÑ); ÑодеÑÐ¶Ð°Ñ ÑаÑе вÑего до 45-60% Fe.
ÐеÑÑ . гоÑизонÑÑ Ð¼Ð°Ð³Ð½ÐµÑиÑовÑÑ ÑÑднÑÑ Ñел обÑÑно ÑаÑÑиÑно окиÑÐ»ÐµÐ½Ñ Ð´Ð¾ гемаÑиÑа (полÑмаÑÑиÑÑ Ð¸ маÑÑиÑÑ).
ÐÑÑпнейÑие меÑÑоÑÐ¾Ð¶Ð´ÐµÐ½Ð¸Ñ Ð² СССРи ШвеÑии. - СиликаÑнÑе ÑÑÐ´Ñ (25-40% Fe) оÑадоÑного пÑоиÑÑ
ождениÑ, иÑполÑзÑемÑе Ð´Ð»Ñ Ð²Ñплавки ÑÑгÑна.
Ð ÐеÑмании,
ЮгоÑлавии, Ð§ÐµÑ Ð¸Ð¸ и ÑÑде дÑ. ÑÑÑан ÐвÑопÑ, оÑноÑÑÑÑÑ Ðº гÑÑппе зеленÑÑ ÑлÑд-Ñ Ð»Ð¾ÑиÑов.
ÐлавнÑе минеÑÐ°Ð»Ñ — ÑÐ°Ð¼Ð¾Ð·Ð¸Ñ Fe4(Fe, Al)2[Al2Si2O10](OH)8
и ÑÑÑÐ¸Ð½Ð³Ð¸Ñ (Mg, Fe)3,5Al1,5[Si2,5Al1,5O10](ÐÐ)6.nÐ2Ð — ÑодеÑÐ¶Ð°Ñ Ð´Ð¾ 42% Fe.
ÐажнейÑие меÑÑоÑÐ¾Ð¶Ð´ÐµÐ½Ð¸Ñ Ð² ÐÐÐ , ÐвÑÑÑии и дÑ.
ÐиÑовÑе ÑазведаннÑе запаÑÑ Ð¶ÐµÐ»ÐµÐ·Ð½ÑÑ
ÑÑд ÑоÑÑавлÑÑÑ 231,9 млÑд. Ñ, или 93 млÑд. Ñ Ð² пеÑеÑÑеÑе на железо (1980).
Ðо запаÑам железнÑÑ
ÑÑд (баланÑовÑм — Ñв. 100 млÑд. Ñ) Ð¡Ð¡Ð¡Ð Ð·Ð°Ð½Ð¸Ð¼Ð°ÐµÑ Ð¿ÐµÑвое меÑÑо в миÑе.
Ðаиб. запаÑÑ Ð¶ÐµÐ»ÐµÐ·Ð½ÑÑ
ÑÑд (в млÑд. Ñ), кÑоме СССР,
ÑоÑÑедоÑоÑÐµÐ½Ñ Ð² ÐÑазилии (34), Ðанаде (26), ÐвÑÑÑии (21), СШР(17), Ðндии (13), ЮÐÐ (9), ШвеÑии (4,5) и во ФÑанÑии (4).
ÐеÑÑпекÑивно иÑполÑзование беднÑÑ
железом гоÑнÑÑ
поÑод и железомаÑганÑевÑÑ
конкÑеÑий.
ÐиÑовÑе запаÑÑ Ð¿Ð¾ÑледниÑ
оÑениваÑÑÑÑ Ð² 3000 млÑд. Ñ (1984).
ТеллÑÑиÑ. железо обÑазÑеÑÑÑ Ð² ÑезÑлÑÑаÑе воÑÑÑÐ°Ð½Ð¾Ð²Ð»ÐµÐ½Ð¸Ñ Ð¾ÐºÑидов и ÑÑлÑÑидов железа ÑглеÑодом из железиÑÑой магмÑ
и пÑи подземнÑÑ
пожаÑаÑ
ÑглÑ, конÑакÑиÑÑÑÑего Ñ Ð¿Ð»Ð°ÑÑами ÑÑдÑ.
Ð ÑÑезвÑÑайно ÑедкиÑ
ÑлÑÑаÑÑ
железо вÑÑÑеÑаеÑÑÑ Ð² земной коÑе в ÑоÑÑаве минеÑала иоÑиÑа FeO (аналог коÑоÑого в ÑеÑ
нике назÑваÑÑ Ð²ÑÑÑиÑом),
а Ñакже в виде ÑамоÑодного железа — меÑеоÑного и ÑеллÑÑиÑеÑкого (земного пÑоиÑÑ
ождениÑ).
Ðелезо как маÑеÑиал (железо в ÑÐµÑ Ð½Ð¾Ð»Ð¾Ð³Ð¸ÑÑ )
ÐÑÑоÑиÑеÑÐºÐ°Ñ ÑпÑавка о железе
Ðелезо бÑло извеÑÑно еÑÑ Ð² доиÑÑоÑиÑеÑкие вÑемена, однако ÑиÑокое пÑименение наÑло знаÑиÑелÑно позже,
Ñ. к. в Ñвободном ÑоÑÑоÑнии вÑÑÑеÑаеÑÑÑ Ð² пÑиÑоде кÑайне Ñедко, а полÑÑение его из ÑÑд
ÑÑало возможнÑм лиÑÑ Ð½Ð° опÑеделÑнном ÑÑовне ÑазвиÑÐ¸Ñ ÑеÑ
ники.
ÐеÑоÑÑно, впеÑвÑе Ñеловек познакомилÑÑ Ñ Ð¼ÐµÑеоÑиÑнÑм железом, о ÑÑм ÑвидеÑелÑÑÑвÑÑÑ ÐµÐ³Ð¾ Ð½Ð°Ð·Ð²Ð°Ð½Ð¸Ñ Ð½Ð° ÑзÑÐºÐ°Ñ Ð´ÑÐµÐ²Ð½Ð¸Ñ Ð½Ð°Ñодов:
- дÑевнеегипеÑÑкое «Ð±ÐµÐ½Ð¸-пеѻ ознаÑÐ°ÐµÑ «Ð½ÐµÐ±ÐµÑное железо»;
- дÑевнегÑеÑеÑкое sideros ÑвÑзÑваÑÑ Ñ Ð»Ð°ÑинÑким sidus (ÑодиÑелÑнÑй падеж sideris) â звезда, небеÑное Ñело.
- Ð ÑоманÑÐºÐ¸Ñ ÑзÑÐºÐ°Ñ ÑÐ¾Ñ ÑанилÑÑ ÐºÐ¾ÑÐµÐ½Ñ Ð½Ð°Ð·Ð²Ð°Ð½Ð¸Ñ, данного ÑимлÑнами (напÑимеÑ, ÑÑанÑÑзÑкое fer, иÑалÑÑнÑкое ferro).
Ð Ñ ÐµÑÑÑÐºÐ¸Ñ ÑекÑÑÐ°Ñ 14 в. до н. Ñ. ÑпоминаеÑÑÑ Ð¾ железе. как о меÑалле, ÑпавÑем Ñ Ð½ÐµÐ±Ð°.
СпоÑоб полÑÑÐµÐ½Ð¸Ñ Ð¶ÐµÐ»ÐµÐ·Ð° из ÑÑд бÑл изобÑеÑÑн в западной ÑаÑÑи Ðзии
[ÐакавказÑе?] во II ÑÑÑÑÑелеÑии до н.Ñ..
ÐаÑем пÑименение железа ÑаÑпÑоÑÑÑанилоÑÑ Ð² Ðавилоне,
ÐгипÑе,
ÐÑеÑии.
Так на ÑÐ¼ÐµÐ½Ñ Ð±ÑÐ¾Ð½Ð·Ð¾Ð²Ð¾Ð¼Ñ Ð²ÐµÐºÑ Ð¿ÑиÑÑл железнÑй век
[поÑле оконÑÐ°Ð½Ð¸Ñ Ð¢ÑоÑнÑкой Ð²Ð¾Ð¹Ð½Ñ Ð² 12-м веке до н.Ñ.,
когда ÑекÑÐµÑ Ð¿ÑоизводÑÑва железа Ñзнали Ð¾Ñ Ñ
еÑÑов].
ÐÐ¾Ð¼ÐµÑ (в 23-й пеÑне «Ðлиадѻ) ÑаÑÑказÑваеÑ, ÑÑо ÐÑ
илл
нагÑадил диÑком из железной кÑиÑÑ Ð¿Ð¾Ð±ÐµÐ´Ð¸ÑÐµÐ»Ñ Ð² ÑоÑевновании по меÑÐ°Ð½Ð¸Ñ Ð´Ð¸Ñка.
Ð ÐвÑопе и ÐÑевней Ð ÑÑи в ÑеÑение многиÑ
веков железо полÑÑали по ÑÑÑодÑÑÐ½Ð¾Ð¼Ñ Ð¿ÑоÑеÑÑÑ.
ÐелезнÑÑ ÑÑÐ´Ñ Ð²Ð¾ÑÑÑанавливали дÑевеÑнÑм ÑглÑм в гоÑне (воÑÑÑановление меÑаллов), ÑÑÑÑоенном в Ñме.
ÐаÑем в гоÑн меÑ
ами нагнеÑали воздÑÑ
, а пÑодÑÐºÑ Ð²Ð¾ÑÑÑÐ°Ð½Ð¾Ð²Ð»ÐµÐ½Ð¸Ñ â кÑиÑÑ
ÑдаÑами молоÑа оÑделÑли Ð¾Ñ Ñлака и из Ð½ÐµÑ Ð²ÑковÑвали ÑазлиÑнÑе изделиÑ.
Ðо меÑе ÑÑовеÑÑенÑÑÐ²Ð¾Ð²Ð°Ð½Ð¸Ñ ÑпоÑобов дÑÑÑÑ Ð¸ ÑвелиÑÐµÐ½Ð¸Ñ Ð²ÑÑоÑÑ Ð³Ð¾Ñна
ÑемпеÑаÑÑÑа пÑоÑеÑÑа повÑÑалаÑÑ Ð¸ ÑаÑÑÑ Ð¶ÐµÐ»ÐµÐ·Ð° наÑглеÑоживалаÑÑ,
Ñ. е. полÑÑалÑÑ ÑÑгÑн; ÑÑÐ¾Ñ ÑÑавниÑелÑно Ñ
ÑÑпкий пÑодÑÐºÑ ÑÑиÑали оÑÑ
одом пÑоизводÑÑва.
ÐÑÑÑда название ÑÑгÑна «ÑÑÑка», «ÑвинÑкое железо» â английÑкое pig iron.
Ðозже бÑло замеÑено, ÑÑо пÑи загÑÑзке в гоÑн не железной ÑÑдÑ, а ÑÑгÑна Ñакже полÑÑаеÑÑÑ Ð½Ð¸Ð·ÐºÐ¾ÑглеÑодиÑÑÐ°Ñ Ð¶ÐµÐ»ÐµÐ·Ð½Ð°Ñ ÐºÑиÑа,
пÑиÑÑм Ñакой двÑÑ
ÑÑадийнÑй пÑоÑеÑÑ (кÑиÑнÑй пеÑедел) оказалÑÑ Ð±Ð¾Ð»ÐµÐµ вÑгоднÑм, Ñем ÑÑÑодÑÑнÑй.
Ð 12â13 вв. кÑиÑнÑй ÑпоÑоб бÑл Ñже ÑиÑоко ÑаÑпÑоÑÑÑанÑн.
Ð 14 в. ÑÑгÑн наÑали вÑплавлÑÑÑ Ð½Ðµ ÑолÑко как полÑпÑодÑÐºÑ Ð´Ð»Ñ Ð´Ð°Ð»ÑнейÑего пеÑедела, но и как маÑеÑиал Ð´Ð»Ñ Ð¾Ñливки ÑазлиÑнÑÑ
изделий.
Ð ÑÐ¾Ð¼Ñ Ð¶Ðµ вÑемени оÑноÑиÑÑÑ Ð¸ ÑеконÑÑÑÑкÑÐ¸Ñ Ð³Ð¾Ñна в ÑаÑ
ÑнÑÑ Ð¿ÐµÑÑ («Ð´Ð¾Ð¼Ð½Ð¸ÑÑ»), а заÑем и в доменнÑÑ Ð¿ÐµÑÑ.
Ð ÑеÑедине 18 в. в ÐвÑопе наÑал пÑименÑÑÑÑÑ ÑигелÑнÑй пÑоÑеÑÑ Ð¿Ð¾Ð»ÑÑÐµÐ½Ð¸Ñ ÑÑали,
коÑоÑÑй бÑл извеÑÑен на ÑеÑÑиÑоÑии СиÑии еÑÑ Ð² Ñанний пеÑиод ÑÑедневековÑÑ, но в далÑнейÑем оказалÑÑ Ð·Ð°Ð±ÑÑÑм.
ÐÑи ÑÑом ÑпоÑобе ÑÑÐ°Ð»Ñ Ð¿Ð¾Ð»ÑÑали ÑаÑплавлением меÑаллиÑеÑкие ÑиÑ
ÑÑ Ð² неболÑÑиÑ
ÑоÑÑдаÑ
(ÑиглÑÑ
) из вÑÑокоогнеÑпоÑной маÑÑÑ.
РпоÑледней ÑеÑвеÑÑи 18 в. ÑÑал ÑазвиваÑÑÑÑ Ð¿ÑдлинговÑй пÑоÑеÑÑ Ð¿ÐµÑедела ÑÑгÑна в железо
на Ð¿Ð¾Ð´Ñ Ð¿Ð»Ð°Ð¼ÐµÐ½Ð½Ð¾Ð¹ оÑÑажаÑелÑной пеÑи (пÑдлингование).
ÐÑомÑÑленнÑй пеÑевоÑÐ¾Ñ 18 â наÑала 19 вв., изобÑеÑение паÑовой маÑинÑ, ÑÑÑоиÑелÑÑÑво железнÑÑ
доÑог,
кÑÑпнÑÑ
моÑÑов и паÑового ÑлоÑа вÑзвали гÑомаднÑÑ Ð¿Ð¾ÑÑебноÑÑÑ Ð² железе и его ÑплаваÑ
.
Ðднако вÑе ÑÑÑеÑÑвовавÑие ÑпоÑÐ¾Ð±Ñ Ð¿ÑоизводÑÑва железа не могли ÑдовлеÑвоÑиÑÑ Ð¿Ð¾ÑÑебноÑÑи ÑÑнка.
ÐаÑÑовое пÑоизводÑÑво ÑÑали наÑалоÑÑ Ð»Ð¸ÑÑ Ð² ÑеÑедине 19 в., когда бÑли ÑазÑабоÑанÑ
беÑÑемеÑовÑкий, ÑомаÑовÑкий и маÑÑеновÑкий пÑоÑеÑÑÑ.
Ð 20 в. возник и полÑÑил ÑиÑокое ÑаÑпÑоÑÑÑанение ÑлекÑÑоÑÑалеплавилÑнÑй пÑоÑеÑÑ, даÑÑий ÑÑÐ°Ð»Ñ Ð²ÑÑокого каÑеÑÑва.
ÐпÑеделение (обнаÑÑжение) железа
ÐаÑеÑÑвенно Fe(II) обнаÑÑживаÑÑ Ð¿Ð¾ обÑÐ°Ð·Ð¾Ð²Ð°Ð½Ð¸Ñ Ð±ÐµÑлинÑкой лазÑÑи Ñ K3[Fe(CN)6],
Fe(III) — пo обÑÐ°Ð·Ð¾Ð²Ð°Ð½Ð¸Ñ ÐµÐµ же Ñ K2[Fe(CN)6] или Fe(CNS)3 Ñ ÑиоÑианаÑом Ð°Ð¼Ð¼Ð¾Ð½Ð¸Ñ Ð¸Ð»Ð¸ Ð.
ÐолиÑеÑÑвенно Fe(II) опÑеделÑÑÑ Ñ Ð¿Ð¾Ð¼Ð¾ÑÑÑ Ð´Ð¸Ñ
ÑомаÑомеÑÑии или пеÑманганаÑомеÑÑии,
Fе(Ш) — иодомеÑÑиÑ. или комплекÑономеÑÑиÑ. ÑиÑÑованием Ñ ÑÑилоном Ри индикаÑоÑом (ÑÑлÑÑоÑалиÑÐ¸Ð»Ð¾Ð²Ð°Ñ ÐºÐ¸ÑлоÑа),
Fe(II) и Fe(III) — колоÑимеÑÑиÑеÑки Ñ ÑÑлÑÑоÑалиÑиловой киÑлоÑой.
ÐÐ»Ñ Ð¾Ð¿ÑÐµÐ´ÐµÐ»ÐµÐ½Ð¸Ñ Ð¶ÐµÐ»ÐµÐ·Ð° иÑполÑзÑÑÑ Ñакже ÑпекÑÑалÑнÑй, ÑенÑгеноÑлÑоÑеÑÑенÑнÑй и ÑеÑмомеÑÑиÑ. меÑодÑ, мÑÑÑбаÑÑÑовÑкÑÑ ÑпекÑÑоÑÐºÐ¾Ð¿Ð¸Ñ Ð¸ дÑ.
ÐÑимеÑи в железе опÑеделÑÑÑ Ð¼ÐµÑодами газового анализа, маÑÑ-ÑпекÑÑомеÑÑиÑеÑким, акÑиваÑионнÑм, кондÑкÑомеÑÑиÑеÑким, ÑпекÑÑалÑнÑм и дÑ.
ÐолÑÑение железа
СÑ
ема меÑаллÑÑгиÑ. пеÑедела железнÑÑ
ÑÑд вклÑÑÐ°ÐµÑ Ð´Ñобление, измелÑÑение,
обогаÑение магниÑной ÑепаÑаÑией (до ÑодеÑÐ¶Ð°Ð½Ð¸Ñ Fe 64-68%),
полÑÑение конÑенÑÑаÑа (74-83% Fe), плавкÑ; оÑн. маÑÑÑ Ð¶ÐµÐ»ÐµÐ·Ð° вÑплавлÑÑÑ Ð² виде ÑÑгÑна и ÑÑали.
ТеÑ
ниÑеÑки ÑиÑÑое железо, или аÑмко-железо (0,02% С, 0,035% Ðn, 0,14% Сr, 0,02% S, 0,015% Ð ),
вÑплавлÑÑÑ Ð¸Ð· ÑÑгÑна в ÑÑалеплавилÑнÑÑ
пеÑаÑ
или киÑлоÑоднÑÑ
конвеÑÑеÑаÑ
.
ЧиÑÑое железо полÑÑаÑÑ: воÑÑÑановлением окÑидов железа ÑвеÑдÑм (кокÑик, кам.-Ñг. пÑлÑ),
газообÑазнÑм (Ð2, СÐ, иÑ
ÑмеÑÑ, пÑиÑ. конвеÑÑиÑованнÑй газ) или комбиниÑ. воÑÑÑановиÑелем;
ÑлекÑÑолизом воднÑÑ
Ñ-Ñов или ÑаÑплавов Ñолей железа; Ñазложением пенÑакаÑбонила Fe(CO)5 (каÑбонилÑное железо).
СваÑоÑное, или кÑиÑное, железо пÑоизводÑÑ Ð¾ÐºÐ¸Ñлением пÑимеÑей малоÑглеÑодиÑÑой ÑÑали железиÑÑÑм Ñлаком пÑи 1350°С
или воÑÑÑановлением из ÑÑд ÑвеÑдÑм ÑглеÑодом.
ÐоÑÑÑановлением окÑидов железа пÑи 750-1200°С полÑÑаÑÑ Ð³ÑбÑаÑое железо (97-99% Fe) —
поÑиÑÑÑй агломеÑÐ°Ñ ÑаÑÑÐ¸Ñ Ð¶ÐµÐ»ÐµÐ·Ð°; пиÑоÑоÑно; в гоÑÑÑем ÑоÑÑоÑнии поддаеÑÑÑ Ð¾Ð±ÑабоÑке давлением.
ÐаÑбонилÑное железо (до 0,00016% С) полÑÑаÑÑ Ñазложением Fe(CO)5 пÑи 300 °С в ÑÑеде NH3
Ñ Ð¿Ð¾Ñлед. воÑÑÑановиÑ. оÑжигом в ÑÑеде Ð2 пÑи 500-600 °С; поÑоÑок Ñ ÑазмеÑом ÑаÑÑÐ¸Ñ 1-15 мкм;
пеÑеÑабаÑÑваеÑÑÑ Ð¼ÐµÑодами поÑоÑковой меÑаллÑÑгии.
ÐÑобо ÑиÑÑое железо полÑÑаÑÑ Ð·Ð¾Ð½Ð½Ð¾Ð¹ плавкой и дÑ. меÑодами.
ЧиÑÑое железо полÑÑаÑÑ Ð² оÑноÑиÑелÑно неболÑÑиÑ
колиÑеÑÑваÑ
ÑлекÑÑолизом воднÑÑ
ÑаÑÑвоÑов его Ñолей
или воÑÑÑановлением водоÑодом его окиÑлов.
РазÑабаÑÑваеÑÑÑ ÑпоÑоб непоÑÑедÑÑвенного полÑÑÐµÐ½Ð¸Ñ Ð¶ÐµÐ»ÐµÐ·Ð° из ÑÑд ÑлекÑÑолизом ÑаÑплавов.
ÐоÑÑепенно ÑвелиÑиваеÑÑÑ Ð¿ÑоизводÑÑво доÑÑаÑоÑно ÑиÑÑого железа пÑÑÑм его пÑÑмого воÑÑÑÐ°Ð½Ð¾Ð²Ð»ÐµÐ½Ð¸Ñ Ð¸Ð· ÑÑднÑÑ
конÑенÑÑаÑов водоÑодом,
пÑиÑоднÑм газом или ÑглÑм пÑи оÑноÑиÑелÑно низкиÑ
ÑемпеÑаÑÑÑаÑ
.
ÐÑименение железа
Ð¢ÐµÑ Ð½Ð¸ÑеÑки ÑиÑÑое железо — маÑеÑиал Ð´Ð»Ñ ÑеÑдеÑников ÑлекÑÑомагниÑов и ÑкоÑей ÑлекÑÑомаÑин, плаÑÑин аккÑмÑлÑÑоÑов.
ÐаÑбонилÑное железо иÑполÑзÑÑÑ Ð´Ð»Ñ Ð½Ð°Ð½ÐµÑÐµÐ½Ð¸Ñ ÑонÑайÑиÑ
пленок и Ñлоев на магниÑоÑоннÑе ленÑÑ,
как каÑализаÑоÑ, анÑианемиÑеÑкое ÑÑедÑÑво и дÑ.
Ðз гÑбÑаÑого железа вÑплавлÑÑÑ Ð²ÑÑококаÑеÑÑвеннÑе ÑÑали.
ÐелезнÑй поÑоÑок иÑполÑзÑÑÑ Ð´Ð»Ñ ÑваÑки, а Ñакже Ð´Ð»Ñ ÑеменÑаÑии меди.
ÐÑкÑÑÑÑвеннÑе ÑадиоакÑивнÑе изоÑÐ¾Ð¿Ñ 55Fe (T1/2 2,6 Ñ) и 59Fe (Tl/2 45,6 ÑÑÑ) — изоÑопнÑе индикаÑоÑÑ.
Ðелезо â важнейÑий меÑалл ÑовÑеменной ÑеÑ
ники.
Ð ÑиÑÑом виде железо из-за его низкой пÑоÑноÑÑи пÑакÑиÑеÑки не иÑполÑзÑеÑÑÑ,
Ñ
оÑÑ Ð² бÑÑÑ «Ð¶ÐµÐ»ÐµÐ·Ð½Ñми» ÑаÑÑо назÑваÑÑ ÑÑалÑнÑе или ÑÑгÑннÑе изделиÑ.
ÐÑÐ½Ð¾Ð²Ð½Ð°Ñ Ð¼Ð°ÑÑа железа пÑименÑеÑÑÑ Ð² виде веÑÑма ÑазлиÑнÑÑ
по ÑоÑÑÐ°Ð²Ñ Ð¸ ÑвойÑÑвам Ñплавов.
Ðа Ð´Ð¾Ð»Ñ Ñплавов железа пÑиÑ
одиÑÑÑ Ð¿ÑимеÑно 95% вÑей меÑаллиÑеÑкой пÑодÑкÑии.
ÐогаÑÑе ÑглеÑодом ÑÐ¿Ð»Ð°Ð²Ñ (ÑвÑÑе 2% по маÑÑе) â ÑÑгÑнÑ,
вÑплавлÑÑÑ Ð² доменнÑÑ
пеÑаÑ
из обогаÑеннÑÑ
железнÑÑ
ÑÑд.
СÑÐ°Ð»Ñ ÑазлиÑнÑÑ
маÑок (ÑодеÑжание ÑглеÑода менее 2% по маÑÑе) вÑплавлÑÑÑ Ð¸Ð· ÑÑгÑна
в маÑÑеновÑкиÑ
и ÑлекÑÑиÑеÑкиÑ
пеÑаÑ
и конвеÑÑеÑаÑ
пÑÑÑм окиÑÐ»ÐµÐ½Ð¸Ñ (вÑжиганиÑ) излиÑнего ÑглеÑода,
ÑÐ´Ð°Ð»ÐµÐ½Ð¸Ñ Ð²ÑеднÑÑ
пÑимеÑей (главнÑм обÑазом S, Ð , Ð)
и Ð´Ð¾Ð±Ð°Ð²Ð»ÐµÐ½Ð¸Ñ Ð»ÐµÐ³Ð¸ÑÑÑÑиÑ
ÑлеменÑов.
ÐÑÑоколегиÑованнÑе ÑÑали (Ñ Ð±Ð¾Ð»ÑÑим ÑодеÑжанием никелÑ, Ñ
Ñома, волÑÑÑама и дÑ. ÑлеменÑов)
вÑплавлÑÑÑ Ð² ÑлекÑÑиÑеÑкиÑ
дÑговÑÑ
и индÑкÑионнÑÑ
пеÑаÑ
.
ÐÐ»Ñ Ð¿ÑоизводÑÑва ÑÑалей и Ñплавов железа оÑобо оÑвеÑÑÑвенного назнаÑÐµÐ½Ð¸Ñ ÑлÑÐ¶Ð°Ñ Ð½Ð¾Ð²Ñе пÑоÑеÑÑÑ â
вакÑÑмнÑй, ÑлекÑÑоÑлаковÑй пеÑеплав, Ð¿Ð»Ð°Ð·Ð¼ÐµÐ½Ð½Ð°Ñ Ð¸ ÑлекÑÑонно-лÑÑÐµÐ²Ð°Ñ Ð¿Ð»Ð°Ð²ÐºÐ° и дÑ.
РазÑабаÑÑваÑÑÑÑ ÑпоÑÐ¾Ð±Ñ Ð²Ñплавки ÑÑали в непÑеÑÑвно дейÑÑвÑÑÑиÑ
агÑегаÑаÑ
,
обеÑпеÑиваÑÑиÑ
вÑÑокое каÑеÑÑво меÑалла и авÑомаÑизаÑÐ¸Ñ Ð¿ÑоÑеÑÑа.
Ðа оÑнове желеÑ
а ÑоздаÑÑÑÑ Ð¼Ð°ÑеÑиалÑ, ÑпоÑобнÑе вÑдеÑживаÑÑ Ð²Ð¾Ð·Ð´ÐµÐ¹ÑÑвие вÑÑокиÑ
и низкиÑ
ÑемпеÑаÑÑÑ,
вакÑÑма и вÑÑокиÑ
давлений, агÑеÑÑивнÑÑ
ÑÑед, болÑÑиÑ
пеÑеменнÑÑ
напÑÑжений, ÑдеÑнÑÑ
излÑÑений и Ñ.п.
ÐÑполÑзование железа как Ñ ÑдожеÑÑвенного маÑеÑиала
Ðелезо как Ñ
ÑдожеÑÑвеннÑй маÑеÑиал иÑполÑзовалоÑÑ Ñ Ð´ÑевноÑÑи в
ÐгипÑе
(подÑÑавка Ð´Ð»Ñ Ð³Ð¾Ð»Ð¾Ð²Ñ Ð¸Ð· гÑобниÑÑ Ð¢ÑÑанÑ
амона около Фив, ÑеÑедина 14 в. до н. Ñ., ÐÑзей ÐÑмола, ÐкÑÑоÑд),
ÐеÑопоÑамии
(кинжалÑ, найденнÑе около ÐаÑÑ
емиÑа, 500 до н.Ñ., ÐÑиÑанÑкий мÑзей, Ðондон),
Ðндии (Ð¶ÐµÐ»ÐµÐ·Ð½Ð°Ñ ÐºÐ¾Ð»Ð¾Ð½Ð½Ð° в Ðели, 415).
Со вÑемÑн ÑÑедневековÑÑ ÑоÑ
ÑанилиÑÑ Ð¼Ð½Ð¾Ð³Ð¾ÑиÑленнÑе вÑÑокоÑ
ÑдожеÑÑвеннÑе Ð¸Ð·Ð´ÐµÐ»Ð¸Ñ Ð¸Ð· железа
в ÑÑÑанаÑ
ÐвÑÐ¾Ð¿Ñ (Ðнглии, ФÑанÑии, ÐÑалии, РоÑÑии и дÑ.) â
кованÑе огÑадÑ, двеÑнÑе пеÑли, наÑÑеннÑе кÑонÑÑейнÑ, ÑлÑгеÑа, оковки ÑÑндÑков, ÑвеÑÑÑ.
ÐованÑе ÑквознÑе Ð¸Ð·Ð´ÐµÐ»Ð¸Ñ Ð¸Ð· пÑÑÑÑев и Ð¸Ð·Ð´ÐµÐ»Ð¸Ñ Ð¸Ð· пÑоÑеÑного лиÑÑового железа (ÑаÑÑо Ñо ÑлÑдÑной подкладкой)
оÑлиÑаÑÑÑÑ Ð¿Ð»Ð¾ÑкоÑÑнÑми ÑоÑмами, ÑÑÑким линейно-гÑаÑиÑеÑким ÑилÑÑÑом и ÑÑÑекÑно пÑоÑмаÑÑиваÑÑÑÑ Ð½Ð° ÑвеÑо-воздÑÑном Ñоне.
Ð 20 веке железо иÑполÑзÑеÑÑÑ Ð´Ð»Ñ Ð¸Ð·Ð³Ð¾ÑÐ¾Ð²Ð»ÐµÐ½Ð¸Ñ ÑеÑÑÑок, огÑад, ажÑÑнÑÑ Ð¸Ð½ÑеÑÑеÑнÑÑ Ð¿ÐµÑегоÑодок, подÑвеÑников, монÑменÑов.
Ðелезо в оÑганизме и медиÑине
Ðелезо пÑиÑÑÑÑÑвÑÐµÑ Ð² оÑганизмаÑ
вÑеÑ
живоÑнÑÑ
и в ÑаÑÑениÑÑ
(в ÑÑеднем, около 0,02%);
оно необÑ
одимо, главнÑм обÑазом, Ð´Ð»Ñ ÐºÐ¸ÑлоÑодного обмена и окиÑлиÑелÑнÑÑ
пÑоÑеÑÑов.
ÐоÑÑи вÑÑ Ð¶ÐµÐ»ÐµÐ·Ð¾ в оÑганизмаÑ
живоÑнÑÑ
и ÑаÑÑений ÑвÑзано Ñ Ð±ÐµÐ»ÐºÐ°Ð¼Ð¸.
СÑÑеÑÑвÑÑÑ Ð¾ÑÐ³Ð°Ð½Ð¸Ð·Ð¼Ñ (Ñ.н. конÑенÑÑаÑоÑÑ), ÑпоÑобнÑе накапливаÑÑ ÐµÐ³Ð¾ в болÑÑиÑ
колиÑеÑÑваÑ
,
напÑимеÑ, железобакÑеÑии â до 17â20% железа
[видимо, из иÑ
оÑложений и возникло заÑем болÑÑинÑÑво железнÑÑ
ÑÑд].
ÐедоÑÑаÑок и избÑÑок железа в поÑве и ÑаÑÑениÑÑ
Рземной коÑе железа ÑÑавниÑелÑно много â в ÑÑеднем 4,2%.
Ð ÑазнÑÑ
поÑваÑ
колиÑеÑÑво его ÑилÑно колеблеÑÑÑ, пÑиблизиÑелÑно в пÑеделаÑ
1â5%.
ÐÑобенно много железа в ÑжнÑÑ
ÑÑбÑÑопиÑеÑкиÑ
поÑваÑ
(в западной ÑаÑÑи ÐÑÑзии и Ñжной ÑаÑÑи ÐзеÑбайджана),
где окиÑи железа неÑедко накоплÑеÑÑÑ Ð´Ð¾ 20 и более пÑоÑенÑов.
[ÐедаÑом в ÑÑиÑ
меÑÑаÑ
Ð¿Ð»ÐµÐ¼Ñ Ñ
алибов впеÑвÑе наÑÑилоÑÑ Ð´Ð¾Ð±ÑваÑÑ Ð¶ÐµÐ»ÐµÐ·Ð¾]
СÑеднее ÑодеÑжание железа в ÑаÑÑениÑÑ
пÑиблизиÑелÑно 0,02%.
ÐбÑее колиÑеÑÑво ÑÑого ÑлеменÑа в ÑÑожаÑÑ
ÑазнÑÑ
кÑлÑÑÑÑ ÐºÐ¾Ð»ÐµÐ±Ð»ÐµÑÑÑ Ð¾Ñ 1 до 10 кг на гекÑаÑ.
Ð ÑелоÑнÑÑ
поÑваÑ
обÑазÑÑÑÑÑ Ð½ÐµÐ´Ð¾ÑÑÑпнÑе Ð´Ð»Ñ ÑÑÐ²Ð¾ÐµÐ½Ð¸Ñ ÐºÐ¾ÑнÑми ÑаÑÑений ÑÐ¾ÐµÐ´Ð¸Ð½ÐµÐ½Ð¸Ñ Ð¶ÐµÐ»ÐµÐ·Ð°,
и ÑаÑÑÐµÐ½Ð¸Ñ Ð½Ðµ полÑÑаÑÑ ÐµÐ³Ð¾ в доÑÑаÑоÑном колиÑеÑÑве [а знаÑиÑ, и живоÑнÑе, и лÑди].
РкиÑлÑÑ Ð¿Ð¾ÑÐ²Ð°Ñ Ð¶ÐµÐ»ÐµÐ·Ð¾ пеÑÐµÑ Ð¾Ð´Ð¸Ñ Ð² ÑаÑÑвоÑимÑе ÑÐ¾ÐµÐ´Ð¸Ð½ÐµÐ½Ð¸Ñ Ð² избÑÑоÑном колиÑеÑÑве.
ÐÑи недоÑÑаÑке или избÑÑке в поÑваÑ
ÑÑвоÑемÑÑ
Ñоединений железа, Ð·Ð°Ð±Ð¾Ð»ÐµÐ²Ð°Ð½Ð¸Ñ ÑаÑÑений могÑÑ Ð½Ð°Ð±Ð»ÑдаÑÑÑÑ
на знаÑиÑелÑнÑÑ
ÑеÑÑиÑоÑиÑÑ
(в некоÑоÑÑÑ
биогеоÑ
имиÑеÑкиÑ
пÑовинÑиÑÑ
).
ÐедоÑÑаÑок железа вÑзÑÐ²Ð°ÐµÑ Ð·Ð°Ð´ÐµÑÐ¶ÐºÑ ÑоÑÑа и Ñвление Ñ Ð»Ð¾Ñоза ÑаÑÑений, ÑвÑзанное Ñ Ð¿Ð¾Ð½Ð¸Ð¶ÐµÐ½Ð½Ñм обÑазованием Ñ Ð»Ð¾ÑоÑилла.
ÐÑи Ñ Ð»Ð¾Ñозе лиÑÑовÑе плаÑÑинки ÑавномеÑно внаÑале бледнеÑÑ, а заÑем пÑиобÑеÑаÑÑ Ð¶ÐµÐ»ÑоваÑÑÑ Ð¾ÐºÑаÑкÑ.
ÐÑобÑÑ ÑÑвÑÑвиÑелÑноÑÑÑ Ðº недоÑÑаÑÐºÑ Ð¶ÐµÐ»ÐµÐ·Ð° обнаÑÑживаÑÑ Ð¿Ð¾ÑÑи вÑе плодовÑе деÑевÑÑ, Ñгодники и виногÑад.
СÑÑадаÑÑ Ñакже, но в менÑÑей ÑÑепени, некоÑоÑÑе полевÑе и овоÑнÑе кÑлÑÑÑÑÑ (овеÑ, кÑкÑÑÑза, каÑÑоÑелÑ, ÑомаÑÑ Ð¸ дÑ.).
ÐÑедное влиÑние на ÑазвиÑие ÑаÑÑений оказÑÐ²Ð°ÐµÑ Ð¸ избÑÑок железа, вÑзÑваÑ, напÑимеÑ, ÑÑеÑилÑноÑÑÑ ÑвеÑков ÑиÑа и Ñ Ð»Ð¾Ñоз.
ÐоÑÑебноÑÑÑ Ð² железе в оÑÐ³Ð°Ð½Ð¸Ð·Ð¼Ð°Ñ Ð¶Ð¸Ð²Ð¾ÑнÑÑ Ð¸ Ñеловека
РживоÑнÑÑ
оÑганизмаÑ
железо вÑ
Ð¾Ð´Ð¸Ñ Ð² ÑоÑÑав окиÑлиÑелÑнÑÑ
ÑеÑменÑов и кÑаÑÑÑего веÑеÑÑва кÑови (гемоглобин),
в коÑоÑом его колиÑеÑÑво доÑ
Ð¾Ð´Ð¸Ñ Ð´Ð¾ 0,47%. ÐÑÐµÐ½Ñ Ð²Ð°Ð¶Ð½Ð° ÑÐ¾Ð»Ñ Ð¶ÐµÐ»ÐµÐ·Ð° в пÑоÑеÑÑаÑ
Ñканевого дÑÑ
аниÑ,
наÑÑÑение коÑоÑÑÑ
пÑÐ¸Ð²Ð¾Ð´Ð¸Ñ Ðº бÑÑÑÑой гибели живоÑнÑÑ
и Ñеловека.
РоÑганизм живоÑнÑÑ
и Ñеловека железо поÑÑÑÐ¿Ð°ÐµÑ Ñ Ð¿Ð¸Ñей
(наиболее богаÑÑ Ð¸Ð¼ пеÑенÑ, мÑÑо, ÑйÑа, бобовÑе, Ñ
леб, кÑÑпÑ, ÑпинаÑ, ÑвÑкла).
РноÑме Ñеловек полÑÑÐ°ÐµÑ Ñ ÑаÑионом 60â110 мг железа, ÑÑо знаÑиÑелÑно пÑевÑÑÐ°ÐµÑ ÐµÐ³Ð¾ ÑÑÑоÑнÑÑ Ð¿Ð¾ÑÑебноÑÑÑ.
ÐÑаÑÑвание поÑÑÑпивÑего Ñ Ð¿Ð¸Ñей железа пÑоиÑÑ
Ð¾Ð´Ð¸Ñ Ð² веÑÑ
нем оÑделе ÑонкиÑ
киÑок,
оÑкÑда оно в ÑвÑзанной Ñ Ð±ÐµÐ»ÐºÐ°Ð¼Ð¸ ÑоÑме поÑÑÑÐ¿Ð°ÐµÑ Ð² кÑÐ¾Ð²Ñ Ð¸ ÑазноÑиÑÑÑ Ðº оÑганам и ÑканÑм,
где депониÑÑеÑÑÑ Ð² виде железо-белкового комплекÑа â ÑеÑÑиÑина.
ÐÑновное депо железа в оÑганизме â пеÑÐµÐ½Ñ Ð¸ ÑелезÑнка.
Ðа ÑÑÑÑ Ð¶ÐµÐ»ÐµÐ·Ð° ÑеÑÑиÑина пÑоиÑÑ
Ð¾Ð´Ð¸Ñ ÑинÑез вÑеÑ
железоÑодеÑжаÑиÑ
Ñоединений оÑганизма:
в коÑÑном мозге ÑинÑезиÑÑеÑÑÑ Ð´ÑÑ
аÑелÑнÑй Ð¿Ð¸Ð³Ð¼ÐµÐ½Ñ Ð³ÐµÐ¼Ð¾Ð³Ð»Ð¾Ð±Ð¸Ð½, в мÑÑÑаÑ
â миоглобин,
в ÑазлиÑнÑÑ
ÑканÑÑ
— ÑиÑоÑ
ÑÐ¾Ð¼Ñ Ð¸ дÑ. железоÑодеÑжаÑие ÑеÑменÑÑ.
ÐÑделÑеÑÑÑ Ð¶ÐµÐ»ÐµÐ·Ð¾ из оÑганизма, главнÑм обÑазом, ÑеÑез ÑÑÐµÐ½ÐºÑ ÑолÑÑÑÑ
киÑок
(Ñ Ñеловека около 6â10 мг в ÑÑÑки) и в незнаÑиÑелÑной ÑÑепени поÑками.
ÐоÑÑебноÑÑÑ Ð¾Ñганизма в железе менÑеÑÑÑ Ñ Ð²Ð¾Ð·ÑаÑÑом и ÑизиÑеÑким ÑоÑÑоÑнием.
Ðа 1 кг веÑа необÑ
одимо деÑÑм â 0,6, взÑоÑлÑм â 0,1 и беÑеменнÑм â 0,3 мг железа в ÑÑÑки.
У живоÑнÑÑ
поÑÑебноÑÑÑ Ð² железе оÑиенÑиÑовоÑно ÑоÑÑавлÑÐµÑ (на 1 кг ÑÑÑ
ого веÑеÑÑва ÑаÑиона):
Ð´Ð»Ñ Ð´Ð¾Ð¹Ð½ÑÑ
коÑов â не менее 50 мг, Ð´Ð»Ñ Ð¼Ð¾Ð»Ð¾Ð´Ð½Ñка â 30â50 мг, Ð´Ð»Ñ Ð¿Ð¾ÑоÑÑÑ â до 200 мг, Ð´Ð»Ñ ÑÑпоÑоÑнÑÑ
Ñвиней â 60 мг.
ÐÑименение железа в медиÑине и ÑаÑмакологии
РмедиÑине лекаÑÑÑвеннÑе пÑепаÑаÑÑ Ð¶ÐµÐ»ÐµÐ·Ð°
(воÑÑÑановленное железо, лакÑÐ°Ñ Ð¶ÐµÐ»ÐµÐ·Ð°, глиÑеÑоÑоÑÑÐ°Ñ Ð¶ÐµÐ»ÐµÐ·Ð°, ÑÑлÑÑÐ°Ñ 2-валенÑного железа,
ÑаблеÑки Ðло, ÑаÑÑÐ²Ð¾Ñ ÑблоÑнокиÑлого железа, ÑеÑамид, гемоÑÑимÑлин и дÑ.)
иÑполÑзÑÑÑ Ð¿Ñи леÑении заболеваний, ÑопÑовождаÑÑиÑ
ÑÑ Ð½ÐµÐ´Ð¾ÑÑаÑком железа в оÑганизме (железодеÑиÑиÑÐ½Ð°Ñ Ð°Ð½ÐµÐ¼Ð¸Ñ),
а Ñакже как обÑеÑкÑеплÑÑÑие ÑÑедÑÑва (поÑле пеÑенеÑÑннÑÑ
инÑекÑионнÑÑ
заболеваний и дÑ.).
ÐзоÑÐ¾Ð¿Ñ Ð¶ÐµÐ»ÐµÐ·Ð° (52Fe, 55Fe и 59Fe) пÑименÑÑÑ ÐºÐ°Ðº индикаÑоÑÑ
пÑи медико-биологиÑеÑкиÑ
иÑÑледованиÑÑ
и диагноÑÑике заболеваний кÑови
(анемии, лейкозÑ, полиÑиÑÐµÐ¼Ð¸Ñ Ð¸ дÑ.).
СеÑевÑе ÑеÑÑÑÑÑ Ð¾ железе
СеÑевÑе обзоÑÑ Ð¾ железе
ÐовоÑÑи ÑеÑи о железе
- Ð ÑдÑе Ðемли в ÑеÑение миллиаÑдов Ð»ÐµÑ Ð¿ÑоиÑÑ
одила «ÑÑеÑка» железа.
более ÑÑжелÑе изоÑÐ¾Ð¿Ñ Ð¶ÐµÐ»ÐµÐ·Ð° мигÑиÑÑÑÑ Ðº более низким ÑемпеÑаÑÑÑам (в манÑиÑ), в Ñо вÑÐµÐ¼Ñ ÐºÐ°Ðº более легкие изоÑÐ¾Ð¿Ñ Ð²Ð¾Ð·Ð²ÑаÑаÑÑÑÑ Ð¾Ð±ÑаÑно в ÑдÑо.
ÐиблиогÑаÑÐ¸Ñ Ð¿Ð¾ железÑ
- ÐбÑÐ°Ñ Ð¼ÐµÑаллÑÑгиÑ, Ð., 1967.
- ÐекÑаÑов Ð. Ð., ÐÑÐ½Ð¾Ð²Ñ Ð¾Ð±Ñей Ñ Ð¸Ð¼Ð¸Ð¸, Ñ. 3, Ð., 1970.
- Реми Ð., ÐÑÑÑ Ð½ÐµÐ¾ÑганиÑеÑкой Ñ Ð¸Ð¼Ð¸Ð¸, пеÑ. Ñ Ð½ÐµÐ¼., Ñ. 2, Ð., 1966.
- ÐÑаÑÐºÐ°Ñ Ñ Ð¸Ð¼Ð¸ÑеÑÐºÐ°Ñ ÑнÑиклопедиÑ, Ñ. 2, Ð., 1963.
- ÐевинÑон Ð. Ð ., ÐÐ·Ð´ÐµÐ»Ð¸Ñ Ð¸Ð· ÑвеÑного и ÑÑÑного меÑалла,
в кн.: Ð ÑÑÑкое декоÑаÑивное иÑкÑÑÑÑво, Ñ. 1â3, Ð., 1962â65. - ÐеÑнадÑкий Ð. Ð., ÐÐ¸Ð¾Ð³ÐµÐ¾Ñ Ð¸Ð¼Ð¸ÑеÑкие оÑеÑки. 1922â1932, Ð. â Ð., 1940.
- ÐÑаник С., Ðбмен железа Ñ Ð¶Ð¸Ð²Ð¾ÑнÑÑ
и ÑаÑÑений,
в ÑбоÑнике: ÐикÑоÑлеменÑÑ, пеÑ. Ñ Ð°Ð½Ð³Ð»., Ð., 1962. - ÐикÑон Ð., УÑбб Ф., ÑеÑменÑÑ, пеÑ. Ñ Ð°Ð½Ð³Ð»., Ð., 1966.
- ФедоÑов Ð. Ð., ÐовÑе меÑÐ¾Ð´Ñ Ð°Ð½Ð°Ð»Ð¸Ð·Ð° меÑаллиÑеÑÐºÐ¸Ñ Ð¿Ð¾ÑоÑков и Ñлаков, Ð., 1971, Ñ. 62-109. 226-36.
- ÐаменеÑÐºÐ°Ñ Ð. С., ÐилеÑÐºÐ°Ñ Ð. Ð., ШиÑÑев Ð. Ð., Ðелезо вÑÑокой ÑÑепени ÑиÑÑоÑÑ. Ð., 1978.
- ÐаÑпаÑова Ð. Ð. и дÑ., ÐаÑиÑа меÑаллов. 1985, Ñ. 21. â 3. Ñ. 339-45.
- ÐеÑÑилÑев Ю. Ð. и дÑ.. Ðоклад ÐРСССР. 1987. Ñ. 296, â 6, Ñ. 1406-09.
- Neogi P., Iron in ancient India, Calcutta, 1914.
- Friend J. N., Iron in antiquity, L.,1926.
- Frank E. B., Old French ironwork, Camb. (Mass.), 1950.
- Lister R., Decorative wrought ironwork in Great Britain, L., 1960.
|
Ðа ÑÑÑÑком ÑзÑке: железо, аÑом железа, вÑплавка ÑÑали, ÑÑгÑн, аÑÑÑениÑ, ÑеÑÑиÑ, маÑÑенÑиÑ,
Ðа английÑком ÑзÑке: ferrum, Fe.
|
СÑÑаниÑа обновлена 02.05.2020
| | |
|
Чистое железо (99,97%), очищенное методом электролиза
Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
СТРУКТУРА
Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С —а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА
Железная руда
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.
Железо
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде — 1·10−5-1·10−8 %
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
ПРОИСХОЖДЕНИЕ
Самородное железо
Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
ПРИМЕНЕНИЕ
Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) — Fe
| Молекулярный вес | 55.85 г/моль |
| Происхождение названия | возможно англо-саксонского происхождения |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.57
| Strunz (8-ое издание) | 1/A.07-10 |
| Nickel-Strunz (10-ое издание) | 1.AE.05 |
| Dana (7-ое издание) | 1.1.17.1 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | железно-черный |
| Цвет черты | серый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | несовершенная по {001} |
| Твердость (шкала Мооса) | 4,5 |
| Излом | в зазубринах |
| Прочность | ковкий |
| Плотность (измеренная) | 7.3 — 7.87 г/см3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | ферромагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | изотропный |
| Цвет в отраженном свете | белый |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | m3m (4/m 3 2/m) — изометрический — гексаоктаэдральный |
| Пространственная группа | Im3m (I4/m 3 2/m) |
| Сингония | кубическая |
| Параметры ячейки | a = 2.8664Å |
| Двойникование | (111) также в пластинчатых массах {112} |
| Морфология | в маленьких пузырьках |
mineralpro.ru
13.07.2016
В периодической системе Менделеева железо входит в группу VIIIВ. В четвертом периоде, к которому принадлежит и железо, в эту группу входят также кобальт и никель. Эти три элемента образуют триаду и обладают сходными свойствами.
Радиус нейтрального атома железа 0, 126 нм, радиус иона Fe2+ — 0, 080 нм, иона Fe3+ — 0, 067 нм. Энергии последовательной ионизации атома железа 7, 893, 16, 18, 30, 65, 57, 79 эВ. Сродство к электрону 0, 58 эв. По шкале Полинга электроотрицательность железа около 1, 8.
Железо высокой чистоты — это блестящий серебристо-серый, пластичный металл, хорошо поддающийся различным способам механической обработки.
В земной коре железо распространено достаточно широко — на его долю приходится около 4, 1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красные железняки (руда гематит, Fe2O3; содержит до 70% Fe), магнитные железняки (руда магнетит, Fe3О4; содержит 72, 4% Fe), бурые железняки (руда гидрогетит НFeO2·nH2O), а также шпатовые железняки (руда сидерит, карбонат железа, FeСО3; содержит около 48% Fe). В природе встречаются также большие месторождения пирита FeS2 (другие названия — серный колчедан, железный колчедан, дисульфид железа и другие), но руды с высоким содержанием серы пока практического значения не имеют. По запасам железных руд Россия занимает первое место в мире. В морской воде 1·10-5—1·10-8% железа.
Железо играло и играет исключительную роль в материальной истории человечества. Первое металлическое железо, попавшее в руки человека, имело, вероятно, метеоритное происхождение. Руды железа широко распространены и часто встречаются даже на поверхности Земли, но самородное железо на поверхности крайне редко. Вероятно, еще несколько тысяч лет назад человек заметил, что после горения костра в некоторых случаях наблюдается образование железа из тех кусков руды, которые случайно оказались в костре. При горении костра восстановление железа из руды происходит за счет реакции руды как непосредственно с углем, так и с образующимся при горении оксидом углерода (II) СО. Возможность получения железа из руд существенно облегчило обнаружение того факта, что при нагревании руды с углем возникает металл, который далее можно дополнительно очистить при ковке. Получение железа из руды с помощью сыродутного процесса было изобретено в Западной Азии во 2-м тыс. до н. э. Период с 9 по 7 в. до н. э., когда у многих племен Европы и Азии развилась металлургия железа, получил название железного века, пришедшего на смену бронзовому веку. Усовершенствование способов дутья (естественную тягу сменили меха) и увеличение высоты горна (появились низкошахтные печи — домницы) привело к получению чугуна, который стали широко выплавлять в Западной Европе с 14 века. Полученный чугун переделывали в сталь. С середины 18 века в доменном процессе вместо древесного угля начали использовать каменно-угольный кокс. В дальнейшем способы получения железа из руд были значительно усовершенствованы, и в настоящее время для этого используют специальные устройства — домны, кислородные конвертеры, электродуговые печи.
При температурах от комнатной и до 917 °C, а также в интервале температур 1394-1535 °C существует α-Fe с кубической объемно центрированной решеткой, при комнатной температуре параметр решетки а = 0, 286645 нм. При температурах 917-1394 °C устойчиво β-Fe с кубической гранецентрированной решеткой Т (а = 0, 36468 нм). При температурах от комнатной до 769 °C (так называемая точка Кюри) железо обладает сильными магнитными свойствами (оно, как говорят, ферромагнитно), при более высоких температурах железо ведет себя как парамагнетик. Иногда парамагнитное α-Fe с кубической объемно центрированной решеткой, устойчивое при температурах от 769 до 917 °C, рассматривают как γ-модификацию железа, а β-Fe, устойчивое при высоких температурах (1394-1535 °C), называют по традиции δ-Fe (представления о существовании четырех модификаций железа — α, β, γи δ— возникли тогда, когда еще не существовал рентгеноструктурный анализ и не было объективной информации о внутреннем строении железа). Температура плавления 1535 °C, температура кипения 2750 °C, плотность 7, 87 г/см3. Стандартный потенциал пары Fe2+/Fe0 –0, 447В, пары Fe3+/Fe2+ +0, 771В.
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной пленкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближенно ее химическую формулу можно записать как Fe2О3·хН2О.
С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe2О3, при сгорании в чистом кислороде — оксид Fe3О4. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeО. При нагревании порошка серы и железа образуется сульфид, приближенную формулу которого можно записать как FeS.
Железо при нагревании реагирует с галогенами. Так как FeF3 нелетуч, железо устойчиво к действию фтора до температуры 200-300°C. При хлорировании железа (при температуре около 200°C) образуется летучий FeСl3. Если взаимодействие железа и брома протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется FeBr3. При нагревании FeСl3 и, особенно, FeBr3 отщепляют галоген и превращаются в галогениды железа (II). При взаимодействии железа и иода образуется иодид Fe3I8.
При нагревании железо реагирует с азотом, образуя нитрид железа Fe3N, с фосфором, образуя фосфиды FeP, Fe2P и Fe3P, с углеродом, образуя карбид Fe3C, с кремнием, образуя несколько силицидов, например, FeSi.
При повышенном давлении металлическое железо реагирует с монооксидом углерода СО, причем образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава [Fe(-C5H5)2].
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. В концентрированной серной и азотной кислотах железо не растворяется, так как прочная оксидная пленка пассивирует его поверхность.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа (II):
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа (III):
2Fe + 4H2SO4 = Fe2(SO4)3 + SO2 + 4H2O
Оксид железа (II) FeО обладает основными свойствами, ему отвечает основание Fe(ОН)2. Оксид железа (III) Fe2O3 слабо амфотерен, ему отвечает еще более слабое, чем Fe(ОН)2, основание Fe(ОН)3, которое реагирует с кислотами:
2Fe(ОН)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Гидроксид железа (III) Fe(ОН)3 проявляет слабо амфотерные свойства; он способен реагировать только с концентрированными растворами щелочей:
Fe(ОН)3 + КОН = К[Fe(ОН)4]
Образующиеся при этом гидроксокомплексы железа (III) устойчивы в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причем в осадок выпадает гидроксид железа (III) Fe(OH)3.
Соединения железа (III) в растворах восстанавливаются металлическим железом:
Fe + 2FeCl3 = 3FeCl2
При хранении водных растворов солей железа (II) наблюдается окисление железа (II) до железа (III):
4FeCl2 + O2 + 2H2O = 4Fe(OH)Cl2Из солей железа (II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа (II) (NH4)2Fe(SO4)2·6Н2О.
Железо (III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д.
При действии газообразного хлора или озона на щелочные растворы соединений железа (III) образуются соединения железа (VI) — ферраты, например, феррат (VI) калия K2FeO4. Имеются сообщения о получении под действием сильных окислителей соединений железа (VIII).
Для обнаружения в растворе соединений железа (III) используют качественную реакцию ионов Fe3+ с тиоцианат-ионами CNS—. При взаимодействии ионов Fe3+ с анионами CNS— образуется ярко-красный роданид железа Fe(CNS)3. Другим реактивом на ионы Fe3+ служит гексацианоферрат (II) калия K4[Fe(CN)6] (ранее это вещество называли желтой кровяной солью). При взаимодействии ионов Fe3+ и [Fe(CN)6]4- выпадает ярко-синий осадок.
Реактивом на ионы Fe2+ в растворе может служить раствор гексацианоферрат (III) калия K3[Fe(CN)6], ранее называвшийся красной кровяной солью. При взаимодействии ионов Fe3+ и [Fe(CN)6]3- выпадает ярко-синий осадок такого же состава, как и в случае взаимодействия ионов Fe3+ и [Fe(CN)6]4-.
Железо используется главным образом в сплавах, прежде всего в сплавах с углеродом — различных чугунах и сталях. В чугуне содержание углерода выше 2, 14 % по массе (обычно — на уровне 3, 5-4%), в сталях содержание углерода более низкое (обычно на уровне 0, 8-1 %).
Чугун получают в домнах. Домна представляет собой гигантский (высотой до 30-40 м) усеченный конус, полый внутри. Стенки домны изнутри выложены огнеупорным кирпичом, толщина кладки составляет несколько метров. Сверху в домну вагонетками загружают обогащенную (освобожденную от пустой породы) железную руду, восстановитель кокс (каменный уголь специальных сортов, подвергнутый коксованию — нагреванию при температуре около 1000 °C без доступа воздуха), а также плавильные материалы (известняк и другие), способствующие отделению от выплавляемого металла примесей — шлака. Снизу в домну подают дутье (чистый кислород или воздух, обогащенный кислородом). По мере того, как загруженные в домну материалы опускаются, их температура поднимается до 1200-1300 °C. В результате реакций восстановления, протекающих главным образом с участием кокса С и СО:
Fe2O3 + 3C = 2Fe + 3CO;
Fe2O3 + 3CО = 2Fe + 3CO2
возникает металлическое железо, которое насыщается углеродом и стекает вниз.
Этот расплав периодически выпускают из домны через специальное отверстие — летку — и дают расплаву застыть в специальных формах. Чугун бывает белый, так называемый передельный (его используют для получения стали) и серый, или литьевой. Белый чугун — это твердый раствор углерода в железе. В микроструктуре серого чугуна можно различить микрокристаллики графита. Из-за наличия графита серый чугун оставляет след на белой бумаге.
Чугун хрупок, при ударе он колется, поэтому из него нельзя изготавливать пружины, рессоры, любые изделия, которые должны работать на изгиб.
Твердый чугун легче расплавленного, так что при его затвердевании происходит не сжатие (как обычно при затвердевании металлов и сплавов), а расширение. Эта особенность позволяет изготавливать из чугуна различные отливки, в том числе использовать его как материал для художественного литья.
Если содержание углерода в чугуне снизить до 1, 0-1, 5%, то образуется сталь. Стали бывают углеродистыми (в таких сталях нет других компонентов, кроме Fe и C) и легированными (такие стали содержат добавки хрома, никеля, молибдена, кобальта и других металлов, улучшающие механические и иные свойства стали).
Стали получают, перерабатывая чугун и металлический лом в кислородном конвертере, в электродуговой или мартеновской печах. При такой переработке снижается содержание углерода в сплаве до требуемого уровня, как говорят, избыточный углерод выгорает.
Физические свойства стали существенно отличаются от свойств чугуна: сталь упруга, ее можно ковать, прокатывать. Так как сталь, в отличие от чугуна, при затвердевании сжимается, то полученные стальные отливки подвергают обжатию на прокатных станах. После прокатки в объеме металла исчезают пустоты и раковины, появившиеся при затвердевании расплавов.
Производство сталей имеет в России давние глубокие традиции, и полученные нашими металлургами стали отличаются высоким качеством.
Чистое железо имеет довольно ограниченное применение. Его используют при изготовлении сердечников электромагнитов, как катализатор химических процессов, для некоторых других целей. Но сплавы железа — чугун и сталь — составляют основу современной техники. Находят широкое применение и многие соединения железа. Так, сульфат железа (III) используют при водоподготовке, оксиды и цианид железа служат пигментами при изготовлении красителей и так далее.
Железо присутствует в организмах всех растений и животных как микроэлемент, то есть в очень малых количествах (в среднем около 0, 02%). Однако железобактерии, использующие энергию окисления железа (II) в железо (III) для хемосинтеза, могут накапливать в своих клетках до 17-20% железа. Основная биологическая функция железа — участие в транспорте кислорода и окислительных процессах. Эту функцию железо выполняет в составе сложных белков — гемопротеидов, простетической группой которых является железопорфириновый комплекс — гем. Среди важнейших гемопротеидов дыхательные пигменты гемоглобин и миоглобин, универсальные переносчики электронов в реакциях клеточного дыхания, окисления и фотосинеза цитохромы, ферменты каталоза и пероксида, и других. У некоторых беспозвоночных железосодержащие дыхательные пигменты гелоэритрин и хлорокруорин имеют отличное от гемоглобинов строение. При биосинтезе гемопротеидов железо переходит к ним от белка ферритина, осуществляющего запасание и транспорт железа. Этот белок, одна молекула которого включает около 4 500 атомов железа, концентрируется в печени, селезенке, костном мозге и слизистой кишечника млекопитающих и человека. Суточная потребность человека в железе (6-20 мг) с избытком покрывается пищей (железом богаты мясо, печень, яйца, хлеб, шпинат, свекла и другие). В организме среднего человека (масса тела 70 кг) содержится 4, 2 г железа, в 1 л крови — около 450 мг. При недостатке железа в организме развивается железистая анемия, которую лечат с помощью препаратов, содержащих железо. Препараты железа применяются и как общеукрепляющие средства. Избыточная доза железа (200 мг и выше) может оказывать токсичное действие. Железо также необходимо для нормального развития растений, поэтому существуют микроудобрения на основе препаратов железа.
- Конецкая Д. С. и др. Железо высокой степени чистоты. М., 1978.
- Путешествие в страну элементов: Сборник. М.: Молодая гвардия. 1963.
- Каменецкая Д. С., Пилецкая И. Б., Ширяев В. И. Железо высокой степени чистоты. М., 1978.
- Пикеринг Ф. Физическое металловедение и разработка сталей. М., 1982.